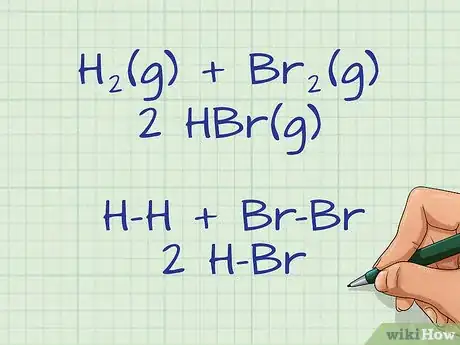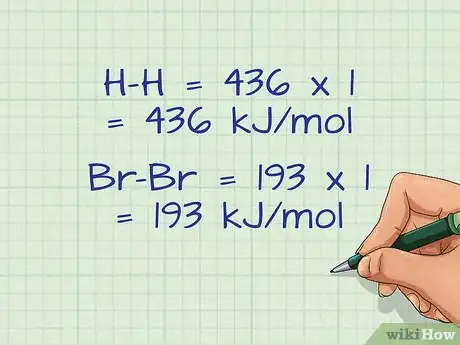Cet article a été coécrit par Bess Ruff, MA. Bess Ruff est doctorante en géographie à l'université d'État de Floride. Elle a obtenu un master en sciences et gestion de l'environnement à l'université de Californie, Santa Barbara, en 2016. Elle a aussi mené des enquêtes pour des projets de planification des espaces marins dans les Caraïbes et a contribué à la recherche en tant que boursière d'études supérieures pour Sustainable Fisheries Group.
Il y a 8 références citées dans cet article, elles se trouvent au bas de la page.
Cet article a été consulté 38 014 fois.
L'énergie de liaison est une notion très importante en chimie, qui définit la quantité d'énergie nécessaire pour briser les liaisons au sein d'un gaz lié par covalence [1] . Ce type d'énergie ne s'applique pas aux liaisons ioniques [2] . Lorsque deux atomes s'associent pour former une nouvelle molécule, il est possible de déterminer quelle est la force qui les lie en mesurant la quantité d'énergie qui serait nécessaire pour les séparer. Notez bien qu'un atome seul ne peut pas posséder d'énergie de liaison, cette notion n'existe qu'entre deux atomes différents. Pour calculer l'énergie de liaison d'une réaction chimique, il vous suffira de déterminer quel est le nombre total de liens rompus et de lui soustraire le nombre total de liens formés.
Étapes
Partie 1
Partie 1 sur 2:Déterminer le nombre de liaisons formées et de liaisons rompues
-
1Souvenez-vous de l'équation correspondante. Par définition, l'énergie de liaison est la différence entre le nombre de liaisons formées et le nombre de liaisons rompues : ΔH = ∑H(liaisons rompues) - ∑H(liaisons formées). ΔH est la variation de l'énergie de liaison, qu'on appelle également l'enthalpie de liaison et ∑H est la somme des énergies de liaison de chaque côté de la réaction [3] .
- Cette équation fait partie de la loi de Hess.
- L'énergie de liaison se mesure en kilojoules par mole ou kJ/mol [4] .
-
2Représentez l'équation chimique. Elle prendra en compte toutes les liaisons entre les molécules. Lorsqu'on est confronté à une équation qui ne contient que des chiffres et des symboles, il peut être utile d'en tirer l'équation chimique afin de mieux voir les liens entre les différents éléments et molécules. Grâce à cette représentation visuelle, vous pourrez dénombrer plus facilement les liaisons rompues et celles qui se sont formées du côté des réactifs et du côté des produits.
- N'oubliez pas que tous les éléments qui se trouvent à gauche de l'équation chimique en sont les réactifs, tandis que tous ceux qui se trouvent à droite en sont les produits.
- Les liaisons simples, doubles et triples ont des énergies différentes, vous devez en tenir compte [5] .
- Vous pouvez par exemple rédiger l'équation chimique suivante : H2(g) + Br2(g) ---> 2 HBr(g). H-H + Br-Br ---> 2 H-Br.
-
3Apprenez les règles de comptage. En général, lorsqu'on fait des calculs, on utilise en fait des énergies de liaison basées sur des moyennes [6] . En fonction de la molécule au sein de laquelle elles se trouvent, il se peut que des liaisons identiques aient des énergies de liaisons très légèrement différentes. Cependant, on néglige la plupart du temps ce phénomène et on se base sur une moyenne [7] .
- Qu'elle soit simple, double ou triple, une liaison rompue est comptée une fois. Dans chaque cas, elle possède une énergie de liaison qui lui est propre, et cependant, on la considère toujours comme une seule et unique rupture.
- Cette règle vaut aussi pour la formation d'une liaison simple, double ou triple. Elle comptera systématiquement comme la formation d'une seule et unique liaison.
- Dans notre exemple, toutes les liaisons sont des liaisons simples.
-
4Identifiez les liaisons rompues. Elles sont à gauche de l'équation, du côté où se trouvent les réactifs. Elles servent à représenter toutes les liaisons qui seront brisées au cours de la réaction chimique. Cette dissolution est un processus endothermique qui nécessite une absorption d'énergie [8] .
- Dans notre exemple, du côté gauche, il y a une liaison H-H et une liaison Br-Br.
-
5Comptez les liaisons formées. Elles sont à droite de l'équation, du côté où se trouvent les produits. Elles servent à représenter toutes liaisons qui se formeront au cours de la réaction chimique. Il s'agit d'un processus exothermique qui libère de l'énergie, en général sous forme de chaleur [9] .
- Dans notre exemple, du côté droit, il y a deux liaisons H-Br.
Publicité
Partie 2
Partie 2 sur 2:Calculer l'énergie de liaison
-
1Cherchez l'énergie de liaison des liaisons concernées. Il existe de nombreux tableaux récapitulatifs permettant de connaitre l'énergie moyenne propre à chaque sorte de liaison. Vous les trouverez dans des livres de chimie ou bien sur internet. Notez bien que ces informations sont toujours données pour des molécules qui se trouvent à l'état gazeux [10] .
- Pour notre exemple, vous devez chercher l'énergie de liaison pour H-H, pour Br-BR et pour H-Br.
- H-H = 436 kJ/mol ; Br-Br = 193 kJ/mol ; H-Br = 366 kJ/mol [11] .
- Si vous souhaitez calculer l'énergie de liaison de molécules qui se trouvent à l'état liquide, vous devrez également tenir compte du changement d'enthalpie de la molécule dû à la vaporisation. Il s'agit de la quantité d'énergie nécessaire pour passer de son état liquide à son état gazeux [12]
. Ce nombre doit ensuite être ajouté à l'énergie de liaison totale.
- Par exemple, si elle comporte de l'eau liquide, il faudra que vous ajoutiez à votre équation le changement d'enthalpie dû à la vaporisation de l'eau, c'est-à-dire +41 kJ [13] .
-
2Multipliez l'énergie de liaison par le nombre de liaisons rompues. Dans certaines réactions chimiques, il peut arriver qu'une même liaison soit rompue plusieurs fois [14] . Si par exemple vous avez 4 atomes d'hydrogène dans votre molécule, il faut que l'énergie de liaison de l'hydrogène soit comptée quatre fois, donc qu'elle soit multipliée par 4.
- Il se trouve que notre exemple ne comporte qu'une seule liaison pour chaque molécule, la multiplication se fait donc simplement par 1.
- H-H = 436 x 1 = 436 kJ/mol
- Br-Br = 193 x 1 = 193 kJ/mol
-
3Additionnez toutes les énergies des liaisons rompues. Une fois que vous avez multiplié le nombre de liaisons par leur énergie, vous n'avez plus qu'à toutes les ajouter du côté des réactifs [15] .
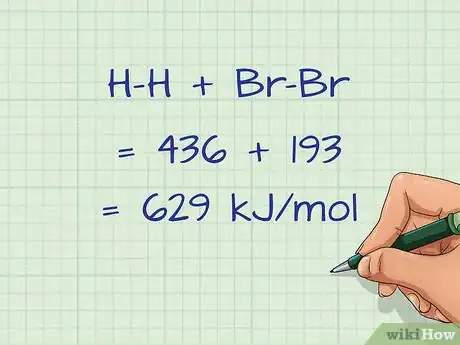
- Dans notre exemple, la somme des liaisons rompues sera de H-H + Br-Br = 436 + 193 = 629 kJ/mol.
-
4Multipliez les énergies de liaison par le nombre de liaisons formées. Exactement comme vous l'avez fait pour les liaisons brisées du côté des réactifs, vous devez maintenant multiplier le nombre de liaisons nouvellement formées par leurs énergies de liaison respectives [16] . Si 4 liaisons hydrogène sont apparues, vous allez multiplier l'énergie correspondante par 4.
- Nous assistons dans notre exemple à la formation de deux liaisons H-Br, l'énergie est donc multipliée par 2 : 366 x 2 = 732 kJ/mol.
-
5Ajoutez toutes les énergies des liaisons formées. Une fois encore, comme pour celles qui ont été rompues, il faut que vous additionniez toutes les liaisons qui sont apparues du côté des produits [17] . Parfois, il arrive qu'un seul produit se forme au cours de la réaction, vous pouvez alors sauter cette étape.
- C'est le cas dans notre exemple, où nous n'avons qu'un seul produit, l'énergie des liaisons formées correspond donc tout simplement à celle de 2 liaisons H-Br, soit 732 kJ/mol.
-
6Faites la soustraction. Soustrayez dès lors les liaisons formées aux liaisons rompues. Une fois que vous avez fait vos additions pour chacun des côtés de la réaction, il ne vous reste plus qu'à faire la différence entre les liaisons formées et celles qui se sont brisées. Souvenez-vous que l'équation de départ était : ΔH = ∑H(liaisons rompues) - ∑H(liaisons formées). Intégrez vos valeurs à la place des variables et faites le calcul.
- Reprenons notre exemple : ΔH = ∑H(liaisons rompues) - ∑H(liaisons formées) = 629 kJ/mol - 732 kJ/mol = -103 kJ/mol.
-
7Tirez-en des conclusions. Déterminez si la réaction chimique était endothermique ou exothermique. Si le calcul de l'énergie de liaison est intéressant, c'est parce qu'il permet au bout du compte de savoir si la réaction en question va libérer de l'énergie ou bien en consommer. Si l'énergie de liaison que vous avez trouvée est positive, cela signifie que vous êtes face à une réaction endothermique (qui va consommer de l'énergie), alors que si elle est négative, vous êtes en présence d'une réaction exothermique (qui va au contraire en produire [18] ).
- L'équation dont nous nous sommes servis pour notre exemple a une énergie de liaison négative, elle est donc exothermique.
Publicité
Références
- ↑ http://chemwiki.ucdavis.edu/Core/Theoretical_Chemistry/Chemical_Bonding/General_Principles_of_Chemical_Bonding/Bond_Energies
- ↑ http://www.science.uwaterloo.ca/~cchieh/cact/c120/bondel.html
- ↑ http://www.kentchemistry.com/links/Kinetics/BondEnergy.htm
- ↑ http://chemwiki.ucdavis.edu/Core/Theoretical_Chemistry/Chemical_Bonding/General_Principles_of_Chemical_Bonding/Bond_Energies
- ↑ http://chemwiki.ucdavis.edu/Core/Theoretical_Chemistry/Chemical_Bonding/General_Principles_of_Chemical_Bonding/Bond_Energies
- ↑ http://www.chemguide.co.uk/physical/energetics/bondenthalpies.html
- ↑ http://chemwiki.ucdavis.edu/Core/Theoretical_Chemistry/Chemical_Bonding/General_Principles_of_Chemical_Bonding/Bond_Energies
- ↑ http://www.chemteam.info/Thermochem/HessLawIntro3.html
- ↑ http://www.chemteam.info/Thermochem/HessLawIntro3.html
- ↑ http://www.chemguide.co.uk/physical/energetics/bondenthalpies.html
- ↑ http://www.science.uwaterloo.ca/~cchieh/cact/c120/bondel.html
- ↑ http://www.chemguide.co.uk/physical/energetics/bondenthalpies.html
- ↑ http://www.chemguide.co.uk/physical/energetics/bondenthalpies.html
- ↑ http://www.chemteam.info/Thermochem/HessLawIntro3.html
- ↑ http://www.chemteam.info/Thermochem/HessLawIntro3.html
- ↑ http://www.chemteam.info/Thermochem/HessLawIntro3.html
- ↑ http://www.chemteam.info/Thermochem/HessLawIntro3.html
- ↑ http://chemwiki.ucdavis.edu/Core/Physical_Chemistry/Equilibria/Le_Chatelier's_Principle/Effect_Of_Temperature_On_Equilibrium_Composition/Exothermic_Versus_Endothermic_And_K