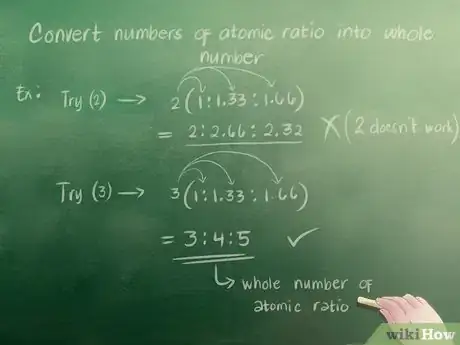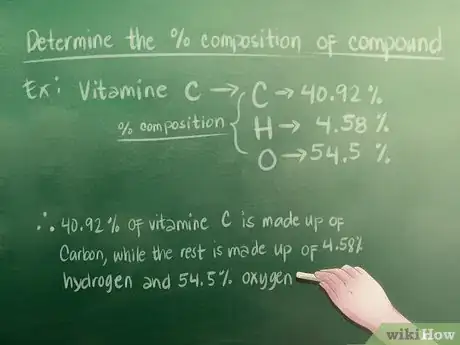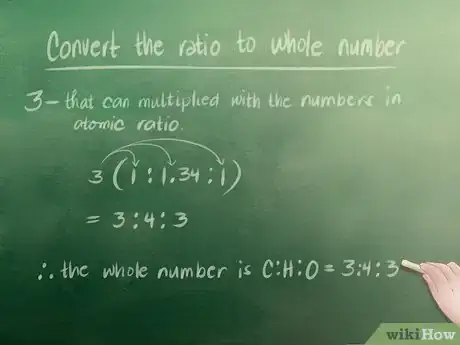X
wikiHow est un wiki, ce qui veut dire que de nombreux articles sont rédigés par plusieurs auteurs(es). Pour créer cet article, des auteur.e.s volontaires ont participé à l'édition et à l'amélioration.
Cet article a été consulté 44 971 fois.
Si on vous a donné un devoir dans lequel vous devez calculer la formule empirique d'un composant, mais que vous ne savez pas comment vous y prendre, n'ayez pas peur. Passez à la 1re partie pour apprendre les techniques de base nécessaires pour trouver la formule empirique puis mettez-les en pratique avec un exemple dans la 2e partie.
Étapes
Partie 1
Partie 1 sur 2:Comprendre les bases
Partie 1
-
1Définissez le terme « formule empirique ». En chimie, la formule empirique (FE) est le moyen le plus simple de décrire un composant. Il s'agit de la liste des éléments qui le composent, organisés en pourcentage. Il est important de noter que cette formule ne prend pas en compte l'arrangement et la disposition des atomes du composant. Elle décrit simplement les éléments qui composent le complexe chimique [1] . Par exemple :
- Une molécule composée de 40,92 % de carbone, 4,58 % d'hydrogène et 54,5 % d'oxygène (il s'agit de pourcentages massiques) aura une formule empirique de C3H4O3 (nous prendrons cet élément comme exemple dans la partie 2).
-
2Comprenez le terme « composition en pourcentages ». Ce terme se réfère au pourcentage massique individuel de chaque type d'atome par rapport à la masse totale du composé chimique étudié. Pour trouver la formule empirique d'un composé, vous devez connaitre sa composition en pourcentage. Si vous cherchez une formule empirique dans le cadre d'un devoir, on vous donnera sans doute ces pourcentages.
- Dans un laboratoire de chimie, vous devrez examiner le composé pour trouver sa composition. Pour cela, il faut mener quelques expériences et analyses quantitatives. À moins que vous ne vous trouviez dans un laboratoire, vous n'avez pas besoin de mener ces expériences.
-
3Notez que l'on utilisera la masse atomique. Il s'agit de la masse d'un élément chimique, exprimée en tant que multiple d'une masse élémentaire (u.m.a.). On cherchera ensuite la fraction massique de chaque élément dans le composé en utilisant la formule suivante : le pourcentage d'un élément dans le composé (en masse) divisé par la masse atomique de celui-ci [2] .
- Par exemple, disons que notre composé est constitué à 40,92 % de carbone. La masse atomique du carbone est de 12 u.m.a. (unité de masse atomique) donc notre résultat sera : 40,92 / 12 = 3,41.
-
4Apprenez à trouver le ratio atomique. Lorsque vous travaillez sur un composé, vous devrez trouver la fraction massique de plusieurs atomes différents. Une fois que vous avez trouvé ces valeurs pour chaque élément de votre composé, regardez-les tous ensemble. Pour trouver le ratio atomique, vous devez considérer d'abord l'élément avec la plus petite fraction, parmi les éléments du composé. Vous diviserez toutes les fractions par la fraction de cet élément.
- Disons que nous travaillons sur un composé présentant 3 éléments : l'un avec une fraction de 1,5, le second avec une fraction de 2 et le troisième étant à 2,5. La plus petite fraction est de 1,5. Pour trouver le ratio atomique, vous devez diviser tous les chiffres précédents par 1,5 et les présenter avec le symbole du ratio : .
- 1,5 / 1,5 = 1 ; 2 / 1,5 = 1,33 ; 2,5 / 1,5 = 1,66. Votre ratio atomique est donc de 1 : 1,33 : 1,66.
-
5Convertissez les nombres obtenus en nombres entiers. Lorsque vous écrivez une formule empirique, vous devez travailler avec des nombres entiers. Vous ne pouvez donc pas utiliser des nombres tels que 1,33. Une fois que vous avez écrit votre ratio atomique, vous devez convertir les parties non entières (comme 1,33) en nombres entiers (comme 3). Pour ce faire, vous devez trouver le nombre entier par lequel multiplier chaque nombre de votre ratio atomique pour obtenir uniquement des nombres entiers.
- Essayez avec 2. Multipliez les nombres du ratio atomique calculé précédemment (1 ; 1,33 et 1,66) par 2. Vous obtenez 2 ; 2,66 et 3,32. Ces nombres ne sont pas entiers donc 2 ne fonctionne pas.
- Essayez avec 3. Vous obtenez 3 ; 4 et 5 lorsque vous multipliez 1 ; 1,33 et 1,66 par 3. Ainsi, votre ratio atomique, écrit en nombres entiers, donne 3 : 4 : 5.
-
6Comprenez bien ce que ces nombres entiers signifient dans la formule empirique. Le ratio entier que vous venez de calculer s'intègre dans la formule empirique. Ces trois nombres entiers sont les petits nombres en indices que l'on trouve au pied des lettres symbolisant les éléments, lorsqu'on décrit un composé chimique. Par exemple, la formule empirique du composé des exemples précédents serait :
- X3Y4Z5
Publicité
Partie 2
Partie 2 sur 2:Trouver la formule empirique
Partie 2
-
1Déterminez le pourcentage de composition de votre composé chimique. Si vous essayez de trouver une formule empirique dans le cadre d'un devoir, on vous donnera certainement la composition en pourcentage. Vous avez juste à regarder au bon endroit.
- Disons que vous devez étudier un échantillon de vitamine C. La composition qui vous est donnée indique 40,92 % de Carbone, 4,58 % d'hydrogène et 54,5 % d'oxygène.
- 40,92 % de la vitamine C (en masse) est composée de carbone. 4,58 % sont de l'hydrogène et 54,5 % de l'oxygène.
-
2Trouvez les fractions massiques des éléments du composé. Comme il a été vu dans la partie 1, l'équation pour déterminer les fractions pour chaque atome est : le pourcentage massique de chaque élément divisé par sa masse atomique. Dans notre exemple, la masse atomique du carbone est de 12 u.ma., celle de l'hydrogène est de 1 u.m.a. et celle de l'oxygène est de 16 u.m.a.
- Fraction molaire du carbone = 40,92 / 12 = 3,41
- Fraction molaire de l'oxygène = 04,58 / 01 = 4,58
- Fraction molaire de l'hydrogène = 54,50 / 16 = 3,41
-
3Déterminez le ratio atomique. Trouvez la fraction massique la plus faible. Dans cet exemple, il s'agit de 3,41 (pour le carbone comme pour l'oxygène). Vous devez diviser toutes les fractions par celle-ci. Vous écrirez donc le ratio ainsi : valeur Carbone : valeur Hydrogène : valeur Oxygène.
- Carbone : 3,41 / 3,41 = 1
- Hydrogène : 4,58 / 3,41 = 1,34
- Oxygène : 3,41 / 3,41 = 1
- Le ratio atomique est 1 : 1,34 : 1.
-
4Convertissez le ratio en nombres entiers. Si votre ratio atomique présente déjà des nombres entiers, vous pouvez sauter cette étape. Dans notre exemple, cependant, on doit convertir 1,34 en nombre entier. Le plus petit nombre entier par lequel multiplier 1,34 pour obtenir un nombre entier est 3.
- 1 x 3 = 3 (cela fonctionne, car 3 est entier).
- 1,34 x 3 = 4 (4 est également un entier).
- 1 x 3 = 3 (entier aussi).
- Le ratio écrit en nombre entier est donc Carbone (C) : Hydrogène (H) : Oxygène (O) = 3 : 4 : 3
-
5Écrivez la formule empirique. Pour faire cela, vous avez juste à écrire les lettres correspondant aux atomes du composé. Dans notre cas, il s'agit de C pour le carbone, le H pour l'hydrogène et l'O pour l'oxygène. Ajoutez ensuite les nombres entiers du ratio en indice pour chaque élément. La formule empirique de l'exemple est donc :
- C3H4O3
Publicité
Conseils
- La formule moléculaire représente le nombre total d'éléments dans une molécule alors que la formule empirique représente le plus petit ratio entier pour les atomes présents.
- Si vous devez déterminer la composition en pourcentage massique en laboratoire, vous réaliserez des expériences de spectrométrie sur un échantillon de composé.
Publicité
Références
À propos de ce wikiHow
Publicité