Cet article a été rédigé avec la collaboration de nos éditeurs(trices) et chercheurs(euses) qualifiés(es) pour garantir l'exactitude et l'exhaustivité du contenu.
L'équipe de gestion du contenu de wikiHow examine soigneusement le travail de l'équipe éditoriale afin de s'assurer que chaque article est en conformité avec nos standards de haute qualité.
Cet article a été consulté 29 251 fois.
Le rendement théorique est une notion de chimie sous laquelle se cache la quantité maximale d’un produit issu d’une réaction chimique. Pour calculer ce rendement, il faut partir d’une équation bilan équilibrée afin de déterminer le réactif limitant. Une fois celui-ci connu, vous pourrez déterminer la quantité de produits obtenus sur le papier : c’est le rendement théorique de l’expérience. En fait, lors d’une expérience, parce que les conditions ne sont jamais idéales, on obtient toujours moins de quantités de produits.
Étapes
Partie 1
Partie 1 sur 2:Identifier le réactif limitant d’une réaction
-
1Partez d’une équation équilibrée. En chimie, une équation relève quelque part de la recette de cuisine. Vous partez de réactifs (vos ingrédients) et après réaction, vous obtenez des produits (objet de votre recette). Les réactifs sont placés à gauche de l’équation et les produits le sont à droite. Une équation n’est pas toujours équilibrée au départ, mais elle doit l’être à la fin, c’est-à-dire que vous devez avoir autant d’atomes de chaque élément dans les deux parties de l’équation [1] .
- Partons de l’équation bien connue : → . Comme vous le voyez, vous avez bien deux atomes d’hydrogène de chaque côté (), mais s’il y a deux atomes d’oxygène à gauche (), il n’y en a qu’un à droite ().
- Pour équilibrer cette équation, il faut avoir 2 molécules d’eau : → .
- Voyez si l’équation est équilibrée. Désormais, les atomes d’oxygène sont équilibrés, deux de chaque côté, mais vous avez deux atomes d’hydrogène à gauche et quatre atomes d’hydrogène à droite. Il faut équilibrer à nouveau.
- Doublez à gauche le nombre d’atomes d’hydrogène. Vous obtenez alors : → . Comptez et vous verrez que vous avez 4 atomes d’hydrogène et deux atomes d’oxygène de chaque côté de l’équation : cette dernière est équilibrée.
- Prenons un exemple plus difficile. L’oxygène et le glucose réagissent entre eux pour donner du dioxyde de carbone et de l’eau :
→ .
Vous avez de chaque côté : 6 atomes de carbone (), 12 d’hydrogène () et 18 d’oxygène () : l’équation est équilibrée. - Jetez un coup d’œil à cet article pour savoir comment on équilibre une équation bilan.
-
2Calculez la masse molaire de chaque réactif. À l’aide du tableau périodique des éléments ou d’un livre de chimie, recherchez la masse molaire de chacun des atomes de votre composé. Additionnez-les afin de trouver la masse molaire de ce composé. Il s’agit de trouver la masse d’une seule molécule. Reprenons l’équation bilan de la réaction entre l’oxygène et le glucose, les produits étant le dioxyde de carbone et l’eau : → [2] .
- Dans cet exemple, la molécule d’oxygène () contient deux atomes d’oxygène (elle est bivalente).
- La masse molaire de l’oxygène est d’environ 16 g/mol. Si vous avez besoin d’une valeur plus précise, utilisez le tableau périodique des éléments.
- Vous avez donc : 2 atomes d’oxygène x 16 g/mol = 32 g/mol de .
- L’autre réactif, le glucose (), a une masse molaire de : 6 atomes de carbone x 12 g/mol) + (12 atomes d’hydrogène x 1 g/mol) + (6 atomes d’oxygène x 16 g/mol) = 72 g/mol+ 12 g/mol + 96 g/mol= 180 g/mol.
- Si vous voulez revoir ce qu’est une masse molaire, nous en saurions trop vous conseiller cet article.
-
3Convertissez la masse de chaque réactif en moles. Quand vous faites une expérience, vous pesez chacun des réactifs pour que la réaction se fasse : vous avez donc des grammes. Pour obtenir des moles, vous devez diviser la masse de chaque réactif par sa masse molaire [3] .
- Prenons une expérience dans laquelle vous auriez 40 g d’oxygène et 25 g de glucose.
- Vous avez d’un côté : 40 g / (32 g/mol) = 1,25 mole d’oxygène.
- Vous avez aussi : 25 g / (180 g/mol) ≈ 0,139 mole de glucose.
-
4Déterminez le rapport molaire de votre réaction. Les chimistes préfèrent utiliser les moles plutôt que les molécules (1 mole ≈ 6 x 1023 molécules). Vous avez le nombre de moles de chacun des réactifs. Pour déterminer le nombre de moles d’oxygène et de glucose, vous devez partir du nombre de molécules de chacun d’eux. Pour trouver le rapport molaire de la réaction, divisez le nombre de moles d’un des réactifs par celui de l’autre réactif pour connaitre leur rapport [4] .
- Dans notre exemple, nous avions 1,25 mole d’oxygène et 0,139 mole de glucose. Le rapport molaire s’établit comme suit : 1,25 / 0,139 = 9,0. Ce résultat signifie que, dans cette réaction, 9 molécules d’oxygène se combinent avec 1 molécule de glucose.
-
5Calculez le rapport molaire idéal de la réaction. Reprenez votre équation de départ équilibrée, sinon cela ne marche pas. À partir des nombres des molécules respectives, vous pouvez calculer le rapport molaire idéal de la réaction. Cela signifie qu’avec un tel rapport les deux réactifs auront disparu en même temps et que la réaction s’arrêtera [5] .
- Reprenons notre équation bilan de l’oxygène et du glucose. Pour rappel, les réactifs sont . Pour que la réaction soit parfaite, les coefficients montrent qu’il faut 6 molécules d’oxygène pour 1 molécule de glucose. Le rapport idéal pour cette réaction est donc de 6,0 (6 : 1).
-
6Comparez les deux rapports molaires. Cela servira à déterminer le réactif limitant. En effet, dans toute réaction chimique réelle, il y a toujours un réactif qui disparait totalement en premier, ce qui entraine l’arrêt de la réaction chimique : c’est le réactif limitant. Dans ce contexte, c’est lui qui détermine aussi la durée de l’expérience et le rendement théorique qu’on peut en attendre. Comparez les deux rapports molaires, celui que vous avez trouvé et l’idéal, pour savoir quel réactif limitant [6] .
- Lors de l’expérience, nous avions trouvé qu’il fallait 9 fois plus de moles d’oxygène que de moles de glucose. L’équation bilan établissait, elle, que le rapport était de 6 à 1. Cette simple constatation montre qu’en laboratoire, il faut plus d’oxygène que prévu. Il est facile alors de conclure que dans cette réaction, le réactif limitant est le glucose.
Publicité
Partie 2
Partie 2 sur 2:Déterminer le rendement théorique d’une réaction
-
1Repérez le produit qui vous intéresse. La partie droite de l’équation bilan montre la liste des produits créés lors de la réaction chimique. Lorsque l’équation est équilibrée, vous pouvez prévoir le nombre de molécules de produits obtenus en lisant les coefficients. Chacun de ces produits a un rendement théorique, c’est-à-dire la quantité de produits qu’on obtiendrait si la réaction se déroulait dans des conditions parfaites [7] .
- Reprenons notre exemple. Nous avions l’équation : → . Les deux produits obtenus sont donc du dioxyde de carbone et de l’eau.
- Le rendement théorique se calcule en partant de n’importe quel produit, simplement il sera différent si vous changez de produit. Choisissez celui qui vous intéresse afin de pouvoir commencer.
-
2Inscrivez le nombre de moles du réactif limitant. Le rendement théorique se compare avec les moles, non avec les masses correspondantes. Si vous partez des masses, vous aurez un résultat faux [8] .
- Dans notre exemple, le réactif limitant est le glucose. La masse molaire des 25 g de départ correspondait, cela a été calculé plus haut dans l’article, à 0,139 mole.
-
3Déterminez le rapport entre votre produit et le réactif limitant. Revenez à l’équation bilan, équilibrée bien sûr. Divisez le nombre de molécules du produit que vous avez choisi par le nombre de molécules de votre réactif limitant.
- Dans notre exemple du glucose, l’équation équilibrée était : → . Vous voyez qu’en théorie vous obtenez 6 molécules de dioxyde de carbone () à partir d’une seule molécule de glucose ().
- Le rapport molaire du dioxyde de carbone au glucose est donc de 6 pour 1. Dans une expérience qui impliquerait une seule mole de glucose, vous obtiendriez 6 moles de dioxyde de carbone.
-
4Multipliez ce rapport par le nombre de moles du réactif. Le résultat sera le rendement théorique (en moles) du produit que vous aurez choisi.
- Dans notre exemple, 25 g de glucose équivalaient à 0,139 mole. Dans cette réaction, le rapport dioxyde de carbone/glucose est de 6/1. Autrement dit, à partir d’une mole de glucose, vous devriez obtenir 6 fois plus de moles de dioxyde de carbone.
- Le rendement théorique du dioxyde de carbone est donc le suivant : (0,139 mole de glucose) x (6 moles de dioxyde de carbone / mole glucose) = 0,834 mole de dioxyde de carbone.
-
5Convertissez votre résultat en grammes. Vous aviez transformé les grammes en moles : il faut à présent faire l’inverse. À partir des moles, il suffit de récupérer la masse molaire, de multiplier les deux et vous obtiendrez le rendement théorique en grammes [9] .
- Dans notre exemple, la masse molaire de est d’environ 44 g/mol, celle du carbone est d’environ 12 g/mol et celle de l’oxygène d’environ 16 g/mol, d’où cette somme de 44 g/mol (12 + (2 x 16) = 12 + 32 = 44).
- Faites les calculs. Vous avez 0,834 mole de pour une masse molaire de 44 g/mol, ce qui vous donne environ 36,7 g. Le rendement théorique de cette expérience est donc de 36,7 g de CO2.
-
6Faites les mêmes calculs avec les autres produits. Ne les faites que si vous en avez besoin. Le plus souvent, on ne cherche le rendement que d’un seul produit, mais il peut arriver que vous ayez à chercher les rendements de tous les produits de la réaction. Si c’est le cas, procédez exactement de la même façon pour chacun des produits.
- Dans notre exemple, le second produit était l’eau (). Si l’on regarde l’équation bilan (et théorique) équilibrée, avec 6 molécules de glucose, on obtient 6 molécules d’eau. Le rapport est donc de 6 : 6, soit 1 : 1. En conséquence, si vous partez avec 0,139 mole de glucose vous obtiendrez 0,139 mole d’eau.
- Calculez la masse d’eau obtenue. Multipliez le nombre de moles d’eau par la masse molaire de l’eau. La masse molaire est de : 2 + 16 = 18 g/mol. La masse d’eau se calcule ainsi : 0,139 mole H2O x 18 g/mol H2O ≈ 2,50 g. Le rendement théorique de l’eau dans cette réaction est de 2,50 g.
Publicité
Références
- ↑ http://www.chemteam.info/Equations/Balance-Equation.html
- ↑ https://www.boundless.com/chemistry/textbooks/boundless-chemistry-textbook/mass-relationships-and-chemical-equations-3/molar-mass-41/molar-mass-of-compounds-223-7524/
- ↑ http://www.chemteam.info/Stoichiometry/Limiting-Reagent.html
- ↑ http://www.chemteam.info/Equations/Balance-Equation.html
- ↑ http://www.chemteam.info/Equations/Balance-Equation.html
- ↑ https://www.khanacademy.org/science/chemistry/chemical-reactions-stoichiome/limiting-reagent-stoichiometry/a/limiting-reagents-and-percent-yield
- ↑ http://www.chemteam.info/Equations/Balance-Equation.html
- ↑ http://www.chemteam.info/Equations/Balance-Equation.html
- ↑ https://www.boundless.com/chemistry/textbooks/boundless-chemistry-textbook/mass-relationships-and-chemical-equations-3/molar-mass-41/molar-mass-of-compounds-223-7524/
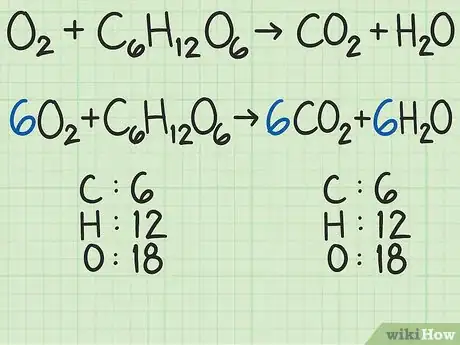













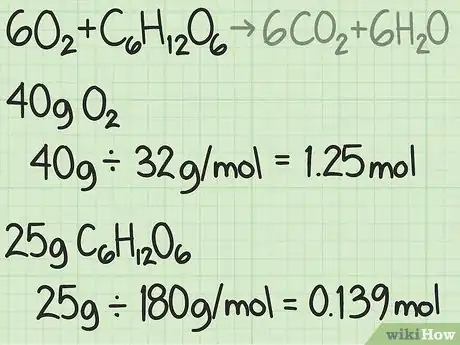

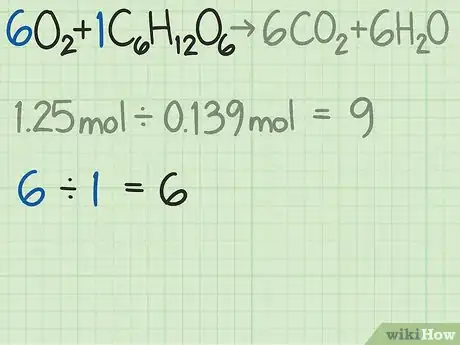
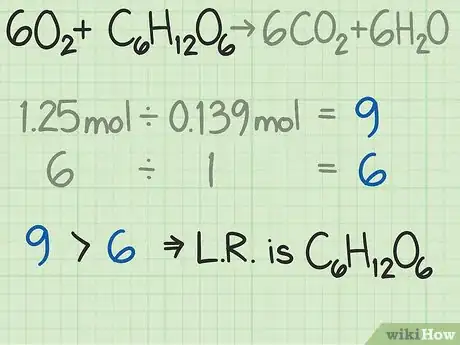
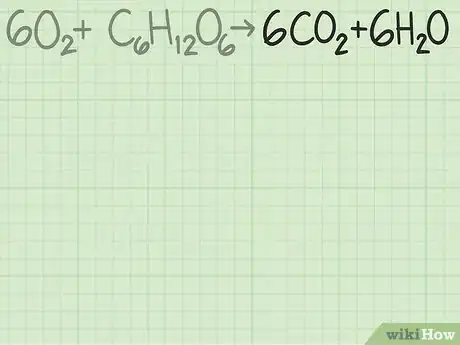

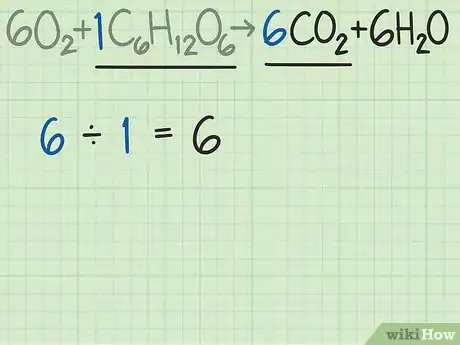






















L'équipe de gestion du contenu de wikiHow examine soigneusement le travail de l'équipe éditoriale afin de s'assurer que chaque article est en conformité avec nos standards de haute qualité. Cet article a été consulté 29 251 fois.