X
wikiHow est un wiki, ce qui veut dire que de nombreux articles sont rédigés par plusieurs auteurs(es). Pour créer cet article, des auteur.e.s volontaires ont participé à l'édition et à l'amélioration.
Il y a 7 références citées dans cet article, elles se trouvent au bas de la page.
Cet article a été consulté 32 686 fois.
Le numéro atomique d'un élément représente le nombre de protons contenus dans le noyau d'un atome de cet élément. Le numéro atomique d'un élément ou d'un isotope est invariable, ce qui permet de déterminer d'autres caractéristiques telles que le nombre de neutrons.
Étapes
Partie 1
Partie 1 sur 2:Déterminer le numéro atomique
Partie 1
-
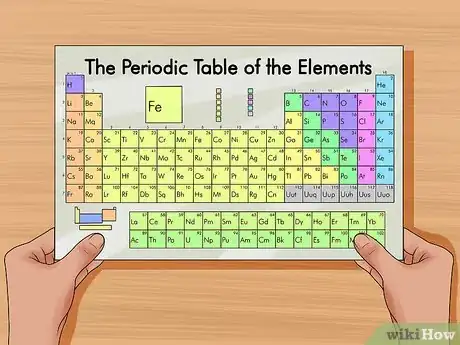
1Recherchez un tableau périodique. En voici un, si vous n'en avez aucun sous la main. Chaque élément possède un numéro atomique unique, il n'existe aucune règle générale permettant de les retenir. Il vaut mieux avoir un tableau périodique sur soi ou en mémoriser un.
- La plupart des livres de chimie comportent un tableau périodique sur la couverture d'intérieur.
-
2Trouvez l'élément que vous recherchez. La plupart des tableaux périodiques affichent les noms complets des éléments, de même que le symbole chimique y correspondant (tel qu’Hg pour Mercure). Si vous avez des difficultés à trouver l'élément dans le tableau, recherchez son symbole chimique en ligne.
-
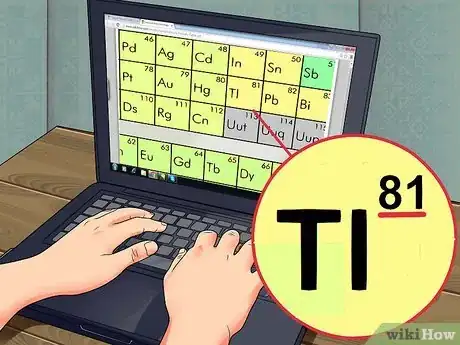
3Recherchez le numéro atomique. Le numéro atomique se situe généralement dans le coin supérieur gauche ou droit de la case de l'élément, mais peut être placé à un autre endroit. Le numéro atomique est toujours un nombre entier.
- Si le nombre comprend une virgule, il s'agit probablement de la masse atomique.
-
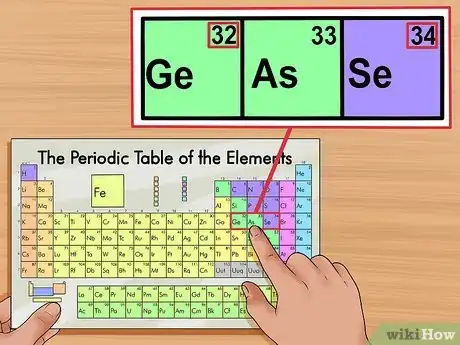
4Faites une vérification en fonction des éléments voisins. Les éléments du tableau périodique sont disposés selon l'ordre croissant de leurs numéros atomiques. Autrement dit, si le numéro atomique de votre élément est 33, le numéro atomique de l'élément à gauche devrait être 32 et le numéro atomique de l'élément à droite serait 34. Si c'est exactement cela, donc il s'agit bel et bien du numéro atomique.
- Il existe un espace après les éléments Barium (56) et Radium (88). Ces éléments sont situés dans deux rangées en dessous du reste du tableau. Ils ont été séparés comme tels afin de pouvoir ajuster le tableau périodique d'une manière plus étroite.
-
5Comprenez ce que c'est qu'un numéro atomique. Le numéro atomique d'un élément est défini comme le nombre de protons dans un atome de cet élément [1] . Il s'agit de la définition fondamentale d'un élément. Le nombre de protons détermine la charge électrique totale du noyau, qui détermine le nombre d'électrons que l'atome peut supporter. Parce que les électrons sont responsables de la plupart des interactions chimiques, le numéro atomique définit indirectement la plupart des propriétés physiques et chimiques des éléments.
- Autrement dit, chaque atome avec 8 protons est un atome d'oxygène. Deux atomes d'oxygène devraient avoir différents nombres de neutrons ou, si l'un est un ion, différents nombres d'électrons, mais ils auront toujours huit protons chacun.
Publicité
Partie 2
Partie 2 sur 2:Trouver des informations relatives
Partie 2
-
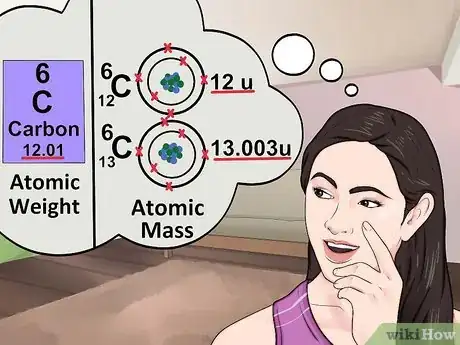
1Trouvez le poids atomique (ou masse atomique relative). Le poids atomique est généralement affiché en dessous du nom de l'élément dans le tableau périodique. Il s'agit généralement d'un nombre décimal à deux ou trois chiffres après la virgule. C'est la masse moyenne d'un atome de cet élément au prorata de sa présence dans la nature. Ce nombre est en unités de masse atomique.
- Certains scientifiques préfèrent le terme masse atomique relative plutôt que poids atomique [2] .
-
2Comprenez le concept de masse atomique. Le concept de masse atomique est étroitement lié à celui de poids atomique ou de masse atomique relative. La seule différence est que vous calculez un atome spécifique plutôt que la moyenne d'un échantillon [3] . Un gramme de fer comporte plusieurs atomes avec différentes masses, donc la masse relative permet de déterminer la masse moyenne. Si vous prenez un seul atome de fer, dans ce cas, vous n'avez pas besoin de trouver la moyenne, car vous recherchez juste la masse exacte de cet atome spécifique.
- Dans la pratique, les problèmes de chimie ne traitent que des atomes uniques, vous fournissant ainsi la masse atomique et non la masse atomique relative. Comprenez cela afin d'éviter les confusions entre masse atomique et masse atomique relative.
-
3Arrondissez au nombre de masse. Le nombre de masse est le nombre total de protons et de neutrons dans un atome d'un élément. Cela est facile à déterminer : prenez le poids atomique dans le tableau et arrondissez-le au nombre entier le plus proche [4] .
- Cela est calculé de cette manière, car les neutrons et protons sont tous les deux très proches d'une unité de masse atomique et les électrons sont très proches de 0 unité de masse atomique. Le poids atomique utilise des mesures précises pour obtenir la valeur décimale, mais nous sommes seulement intéressés par les nombres entiers qui nous informent du nombre de protons et de neutrons contenus dans l'atome.
- Souvenez-vous que si vous utilisez la masse atomique relative, vous obtiendrez la moyenne pour un échantillon donné. Un échantillon de brome a un nombre de masse moyen de 80, mais il se trouve qu'un seul atome de brome a presque toujours un nombre de masse de 79 ou 81 [5] .
-
4Calculez le nombre de neutrons. Maintenant, vous savez que le numéro atomique est égal au nombre de protons et que le nombre de masse est égal au nombre de protons et de neutrons. Pour trouver le nombre de neutrons dans un élément, soustrayez le numéro atomique du nombre de masse. Voici quelques exemples.
- Le nombre de masse d'un seul atome d'hélium (He) est égal à 4 et son numéro atomique est 2. Le nombre de neutrons serait égal à 2 (4 - 2 = 2 neutrons).
- Le nombre de masse moyen d'un échantillon d'argent est 108 (selon le tableau périodique) et son numéro atomique est 47. En moyenne, chaque atome d'argent dans l'échantillon a 61 neutrons (108 - 47 = 61 neutrons).
-
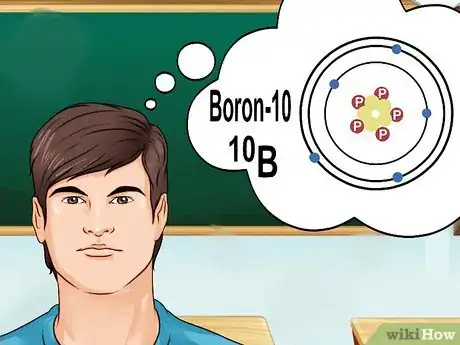
5Comprenez ce que c'est que les isotopes. Un isotope est une forme spécifique d'un élément, avec un certain nombre d'électrons. Si un problème de chimie mentionne bore-10 ou 10B, il s'agit des éléments de bore avec un nombre de masse de 10 [6] . Utilisez ce nombre de masse au lieu des valeurs du bore typique.
- Le numéro atomique des isotopes ne varie pas. Chaque isotope d'un élément comporte le même nombre de protons.
Publicité
Conseils
- Certains éléments plus pesants ont leurs poids atomique notés entre parenthèses ou crochets. Cela veut dire que le poids atomique est la masse exacte de l'isotope le plus stable, au lieu de la moyenne de plusieurs isotopes [7] . Cela n'a pas d'effet sur le numéro atomique de l'élément.
Publicité
Références
- ↑ https://fr.wikipedia.org/wiki/Numero_atomique
- ↑ http://lesdefinitions.fr/masse-atomique
- ↑ http://courschimie.chez.com/masseatomique.htm
- ↑ http://fr.wikihow.com/calculer-le-nombre-de-neutrons-d'un-atome
- ↑ http://gwenaelm.free.fr/Physique/Physchim/util/atomes/Br.htm
- ↑ https://fr.wikipedia.org/wiki/Isotopes_du_bore
- ↑ https://fr.wikipedia.org/wiki/%C3%89l%C3%A9ment_chimique
À propos de ce wikiHow
Publicité