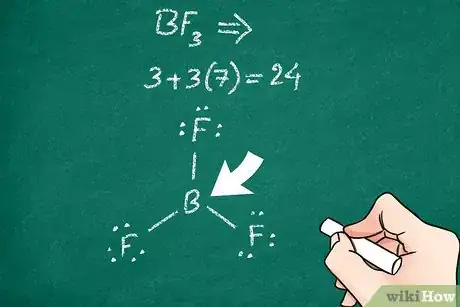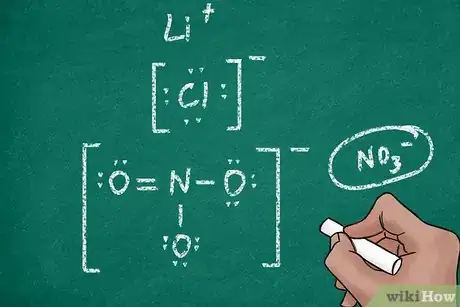Cet article a été coécrit par Meredith Juncker, PhD. Meredith Juncker est doctorante en biochimie et biologie moléculaire au centre des sciences de la santé de l'université d'État de Louisiane. Ses études portent sur les protéines et les maladies neurodégénératives.
Cet article a été consulté 30 177 fois.
Quelqu’un qui débute en chimie et qui rencontre pour la première fois une structure par points de Lewis (ou diagrammes de Lewis) est souvent désarçonné par une telle représentation. En fait, il s’agit d’une représentation des électrons de valence et des liaisons qui peuvent, ou pourraient, exister entre atomes au sein de molécules plus ou moins complexes. Un tel diagramme ne représente que les couches électroniques externes. Vous vous doutez bien que plus une molécule est complexe, moins son diagramme est explicite à la première lecture. Si les atomes ou les molécules stables peuvent être représentés, les ions peuvent l’être également.
Étapes
Méthode 1
Méthode 1 sur 3:Dessiner la liaison covalente entre deux atomes
-
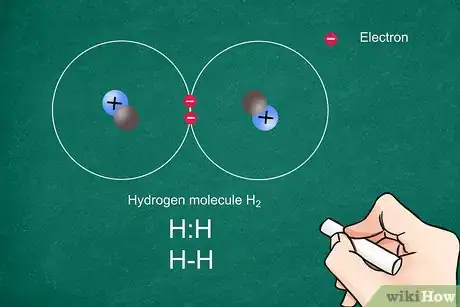
1Inscrivez les symboles chimiques des atomes en jeu. Notez-les sur la même ligne et veillez à ce qu’il y ait assez de place entre les deux pour pouvoir tracer lisiblement et les liaisons covalentes et les électrons célibataires (ou non appariés [1] ).
- Une liaison covalente est une liaison chimique dans laquelle deux atomes se partagent deux électrons, cela arrive plutôt entre deux éléments du groupe des non-métaux.
-
2Déterminez le degré de liaison entre 2 atomes. Des atomes peuvent avoir entre eux une liaison simple, double ou triple. La nature de la liaison est donnée par la règle du duet et de l’octet, à savoir qu’un atome, sauf exceptions, cherche à compléter sa couche électronique externe avec 8 électrons. Pour calculer le nombre d’électrons d’un atome, vous devez trouver le nombre d’électrons de valence de la molécule que vous multipliez par 2 (chaque liaison implique 2 électrons), puis vous ajoutez le nombre d’électrons non communs [2] .
- À titre d’exemple, un atome d’oxygène (O2) a 6 électrons de valence. Multipliez 6 par 2, ce qui nous donne 12.
- Pour vérifier le respect de la règle de l'octet, utilisez des points pour représenter les électrons célibataires. La molécule d’oxygène de formule O2 se compose de deux atomes d’oxygène qui ont chacun 6 atomes sur la seconde couche, ce qui donne 6 doublets Or, la règle de l’octet veut que cette couche en contienne 8. En conséquence, chaque atome d'oxygène doit réaliser deux liaisons covalentes pour respecter la règle de l’octet, une seule ne serait pas suffisante. Ces liaisons établies, la règle de l'octet est alors respectée pour les deux.
-
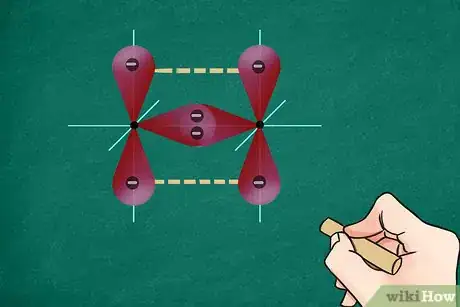
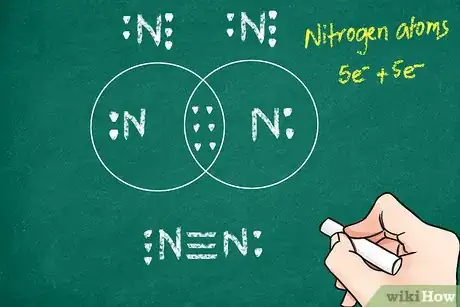
3Tracez les liaisons sur votre représentation. Chaque liaison est figurée par un trait entre les deux atomes. Une liaison simple est représentée par un simple trait qui unit, sans les toucher, les symboles des deux atomes. Une liaison double ou triple sera figurée par respectivement deux ou trois traits [3] .
- Ainsi, les deux atomes d’azote (N2) sont unis par une triple liaison. Sur l'illustration ci-dessus, vous voyez très nettement les trois traits reliant les deux atomes d'azote (N).
-
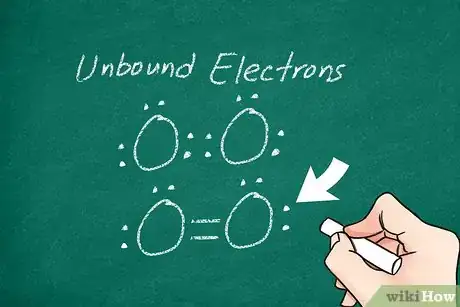
4Indiquez les électrons non liés. Certains des électrons de valence de l’un ou des deux atomes peuvent ne pas être liés. En ce cas, il convient de représenter chacun par un point autour de son atome respectif. Quoi qu’il en soit, la couche externe des atomes ne doit pas avoir plus de 8 électrons. Pour vérifier votre représentation, vous devez compter chaque point comme un électron et chaque trait comme deux électrons [4] .
- Par exemple, les deux atomes d’oxygène (O2) ont entre eux une liaison double (deux traits), à laquelle viennent s’ajouter 2 paires de points que vous répartirez géométriquement autour du symbole.
Publicité
Méthode 2
Méthode 2 sur 3:Établir la structure de Lewis d’une molécule polyatomique
-
1Déterminez quel atome est l’atome central. Le plus souvent, il s’agit d’un atome électronégatif, c’est-à-dire qui possède un ou plusieurs électrons capables de se lier à d’autres atomes. L’appellation de « central » se voit bien sur la représentation : c’est l’atome qui est le plus relié aux autres, sans que ceux-ci soient nécessairement liés entre eux [5] .
- Certains atomes, comme le phosphore ou le carbone, ont tendance à être souvent l’atome central.
- Dans certaines molécules complexes, il est possible qu’il y ait plusieurs atomes centraux.
- Notez que dans le tableau périodique des éléments, l’électronégativité augmente de la gauche vers la droite, mais baisse du haut du tableau vers le bas.
-
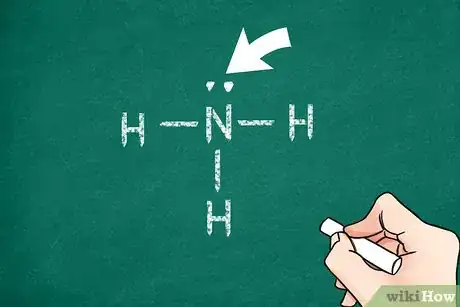
2Observez les électrons de valence de l'atome central. En règle générale, même s’il y a des exceptions, les atomes cherchent à compléter leur couche de valence, ici avec 8 électrons (c’est ce que pose la règle de l'octet). Quand l'atome central se lie à d'autres atomes, les électrons se placent le plus souvent sur des niveaux les plus bas possible en énergie (principe de Pauli), ce qui fait que la règle de l’octet est satisfaite. Cela va vous aider à trouver le nombre de liaisons entre cet atome central et les autres atomes de la molécule, chaque liaison représentant 2 électrons [6] .
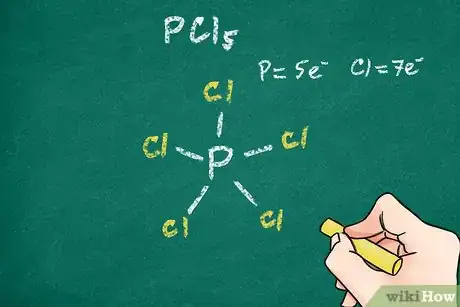
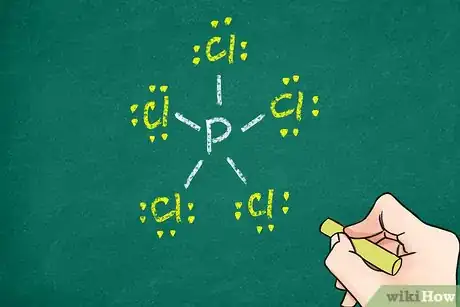
- Certains gros atomes, c’est le cas du phosphore, ne satisfont pas la règle de l'octet.
- Ainsi, dans une molécule de dioxyde de carbone (CO2), il y a deux atomes d’oxygène qui ont chacun une double liaison covalente avec l'atome central, le carbone. La règle de l'octet est alors respectée pour les trois atomes.
- Le pentachlorure de phosphore (PCl5), molécule pourtant stable, ne satisfait pas entièrement la règle de l’octet. En effet, la molécule se compose de 5 atomes de chlore, chacun en liaison covalente simple avec l'atome central, celui du phosphore. La règle de l’octet est satisfaite pour chacun des cinq atomes de chlore, elle ne l’est pas pour l’atome de phosphore.
-
3Inscrivez le symbole de votre atome central. Pour représenter une molécule covalente complexe, il est préférable de commencer par indiquer l’atome central. La tentation est souvent grande de mettre tous les symboles au départ, mais dans ces cas-là, il faut commencer par l’atome principal. Veillez à ce que le symbole central soit entouré de suffisamment de place pour indiquer les autres atomes et les liaisons qui viendront en leur temps [7] .
-
4Préparez la disposition des atomes autour de l'atome central. Pour chaque doublet d’électrons célibataires, indiquez deux points rapprochés dans une des quatre directions (nord, sud, est, ouest) de l'atome central. Chaque liaison simple sera représentée par un trait partant du même atome. Si la liaison est double, voire triple, ce sera respectivement un trait double, voire triple. Ainsi, tout est prêt pour compléter le diagramme [8] .
-
5Ajoutez les autres atomes. Chacun des autres atomes de la molécule est donc rattaché à l’atome central par une liaison (simple, double ou triple). Les symboles de ces éléments seront donc placés à l’autre extrémité des traits partant de l'atome central. Tout chimiste comprendra alors la nature des liaisons entre ces atomes et l'atome central [9] .
-
6Indiquez les électrons restants. Chaque liaison simple compte pour 2 électrons, la double pour 4 et enfin la triple liaison, pour 6 électrons. Faites le décompte des électrons déjà engagés, puis ajoutez autour de chacun des atomes les paires d’électrons en sorte que la règle de l'octet soit satisfaite pour chacun des atomes. Confirmation vous sera donnée si vous comptez un électron pour chacun point et deux, pour chaque trait. La somme des électrons de la dernière couche doit être de 8 [10] .
- Cette règle de l'octet connait avec certains atomes des exceptions qu’il serait trop long d’évoquer ici, il n’est que de mentionner l’hydrogène ou l’hélium, les premiers éléments du tableau périodique qui ont une structure atomique bien particulière.
- Si une molécule d’ hydrogène avait une liaison covalente avec un autre atome, par définition, elle ne pourrait pas en avoir une autre avec un autre atome : elle n’a plus aucun électron célibataire.
Publicité
Méthode 3
Méthode 3 sur 3:Représenter un ion avec la formule de Lewis
-
1Inscrivez le symbole chimique de l’atome. Un ion a pour symbole le même symbole de l’élément dont il est issu symbole chimique (par exemple, l’atome Cl et l’ion Cl-). Veillez à ce qu’il y ait suffisamment de place autour du symbole pour pouvoir placer les électrons et les crochets. Certains ions sont en fait des molécules polyatomiques (composées de plusieurs atomes) : en ce cas, les symboles utilisés seront ceux de tous les éléments de la molécule [11] .
- Pour obtenir le symbole d’un ion polyatomique (comme NO3- ou SO4- -), relisez ce qui a été dit plus haut dans la deuxième méthode (Établir la structure de Lewis d’une molécule polyatomique) de cet article.
-
2Figurez les électrons. Les atomes sont par définition électriquement neutres : ils ne sont ni négatifs ni positifs. Si lors d’une réaction chimique quelconque, un tel atome venait à perdre ou à gagner un ou plusieurs électrons, l’atome serait chargé positivement ou négativement : il deviendrait un ion. Sur votre diagramme, vous devrez donc, selon le cas, ajouter ou enlever ces électrons migrants [12] .
- Au moment de faire figurer les électrons, gardez toujours dans un coin de votre mémoire la règle de l’octet.
- Un atome qui perd des électrons devient un ion positif (cation). Ainsi, si le lithium perd dans une réaction le seul électron de sa dernière couche, sa formule de Lewis sera juste Li sans point autour.
- Quand des électrons sont captés par un atome, celui-ci devient un ion négatif (anion). Le chlore, avec ses sept électrons de valence, gagne durant une ionisation un électron pour compléter sa dernière couche (8 électrons). Le diagramme de Lewis de l’ion chlorure (Cl-) montre donc un atome avec quatre paires d’électrons dans chacune des directions.
-
3Indiquez la charge de l'ion. Il serait fastidieux pour les ions complexes et peu courants de déterminer la charge de l’ion en comptant les points des électrons. Aussi, il a été décidé de faire figurer conventionnellement la charge de façon plus explicite. L’ion est alors encadré par deux crochets, et en haut et à droite de celui de droite, sera mentionnée la charge électrique [13] .
- Ainsi, il manque à l’ion magnésium deux électrons sur sa couche externe, son écriture sera comme suit : [Mg]+ + ou [Mg]2+.
Publicité
Conseils
- Les structures de Lewis des éléments appartenant à la même famille sont similaires, même s’il y a quelques exceptions à cette règle.
Références
- ↑ http://www.chem.ucalgary.ca/courses/351/Carey5th/Ch01/ch1-3depth.html
- ↑ http://web.chem.ucla.edu/~harding/lewisdots.html
- ↑ http://web.chem.ucla.edu/~harding/lewisdots.html
- ↑ http://chemed.chem.purdue.edu/genchem/topicreview/bp/ch8/lewis.html
- ↑ http://web.chem.ucla.edu/~harding/lewisdots.html
- ↑ http://www.chem.ucalgary.ca/courses/351/Carey5th/Ch01/ch1-3depth.html
- ↑ http://chemed.chem.purdue.edu/genchem/topicreview/bp/ch8/lewis.html
- ↑ http://web.chem.ucla.edu/~harding/lewisdots.html
- ↑ http://www.chem.ucalgary.ca/courses/351/Carey5th/Ch01/ch1-3depth.html