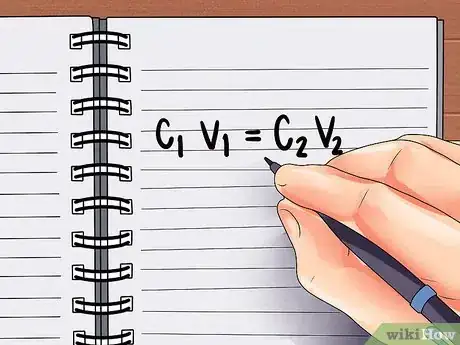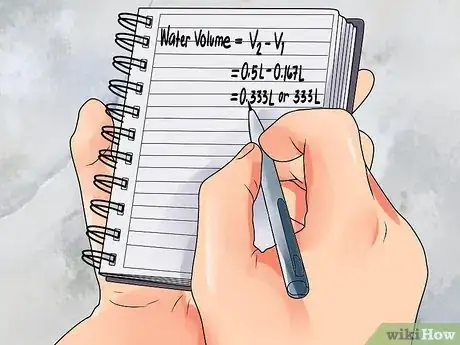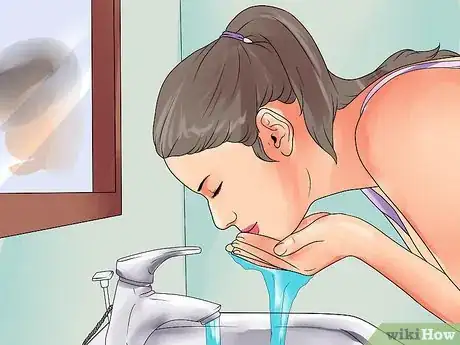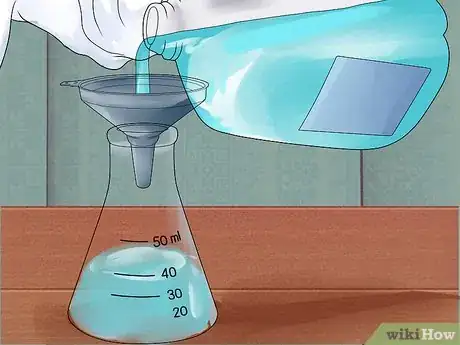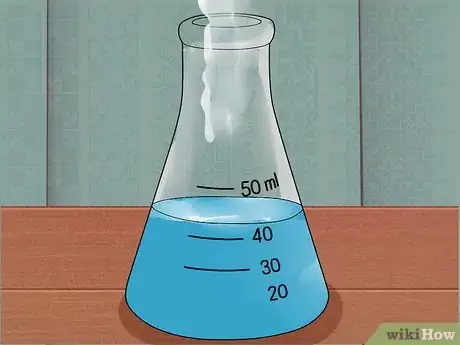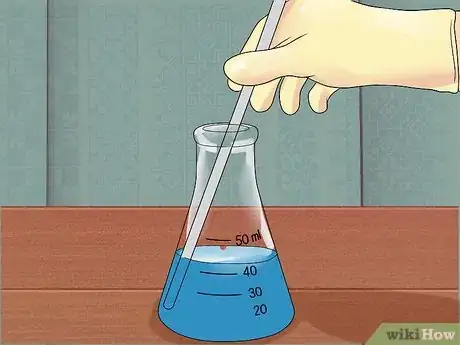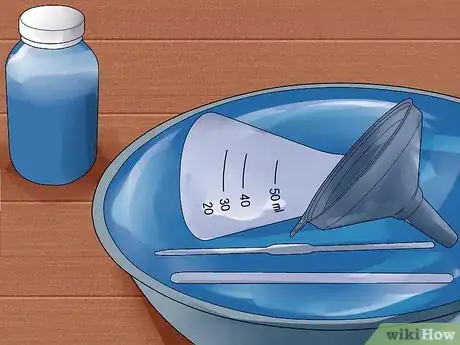wikiHow est un wiki, ce qui veut dire que de nombreux articles sont rédigés par plusieurs auteurs(es). Pour créer cet article, 23 personnes, certaines anonymes, ont participé à son édition et à son amélioration au fil du temps.
Cet article a été consulté 32 575 fois.
Lorsque vous avez besoin d'utiliser de l'acide, il est conseillé d'acheter l'acide le plus dilué possible par simplicité d'utilisation et par mesure de sécurité. Parfois, il vous faudra le diluer encore plus une fois à la maison. Ne lésinez pas sur les équipements de sécurité, car l'acide concentré peut causer des brulures chimiques sérieuses. Lorsque vous calculerez la quantité d'acide et d'eau que vous aurez besoin de mélanger, vous devrez connaitre la concentration molaire (M) initiale de votre acide et la concentration molaire que vous désirerez obtenir après dilution.
Étapes
Partie 1
Partie 1 sur 3:Calculer la formule de dilution
-
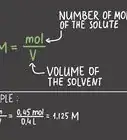
1Vérifiez les informations dont vous disposez déjà. Cherchez la concentration de la solution d'acide sur l'étiquette ou dans l'énoncé du problème sur lequel vous travaillez. Ce nombre est souvent écrit en unité de molarité ou unité de concentration molaire, abrégée en M. Par exemple, une solution d'acide à « 6M » contient six moles de molécules d'acide par litre. Appelons cette concentration initiale C1.
- La formule ci-dessous comprend aussi le terme V1. Il s'agit du volume de l'acide que nous ajouterons dans l'eau. Cependant, nous n'utiliserons probablement pas la totalité de la bouteille d'acide, c'est pourquoi nous ne savons pas encore quelle sera la valeur de ce nombre.
-
2Décidez du résultat final. La concentration et le volume d'acide désirés sont typiquement déterminés dans l'énoncé d'un problème scolaire ou par les besoins du laboratoire dans lequel vous travaillez. Par exemple, nous voudrons peut-être diluer notre acide pour obtenir une concentration d'acide à 2M. Nous aurons alors besoin de 0,5 L. Appelons cette concentration désirée C2 et le volume désiré V2.
- Si vous utilisez des unités inhabituelles, convertissez-les toutes en unités de concentration molaire (moles par litres) et en litres avant de continuer.
- Si vous n'êtes pas certain(e) de quelle concentration ou de quel volume d'acide vous avez besoin, demandez à votre professeur, à un chimiste ou à un spécialiste de la tâche pour laquelle vous avez besoin d'utiliser de l'acide.
-
3Écrivez la formule pour calculer la dilution. À chaque fois que vous vous préparez à diluer une solution, vous pouvez utiliser la formule C1V1 = C2V2 [1] , qui signifie « la concentration initiale de la solution x son volume = la concentration de la solution diluée x son volume. » Nous savons que cela est vrai, car la concentration x le volume = la quantité totale d'acide et la quantité totale d'acide restera la même lorsqu'elle sera ajoutée à l'eau.
- Dans notre exemple, nous pouvons écrire cette formule (6M)(V1)=(2M)(0,5L).
-
4Résolvez l'équation pour trouver V1. Ce terme, V1, nous dira quelle quantité de la solution d'acide initiale nous devrons ajouter à l'eau pour obtenir la concentration et le volume désirés. Réarrangez la formule pour obtenir V1=(C2V2)/(C1), puis introduisez les valeurs que vous connaissez.
- Dans notre exemple, nous obtiendrions V1=((2M)(0,5L))/(6M)=1/6L. Cela équivaut approximativement à 0,167 L ou 167 millilitres.
-
5Calculez la quantité d'eau dont vous avez besoin. Maintenant que vous avez V1, soit la quantité d'acide que vous utiliserez et V2, soit la quantité de solution que vous obtiendrez à la fin, vous pouvez facilement calculer la quantité d'eau dont vous aurez besoin pour faire la différence. V2 - V1 = le volume d'eau nécessaire.
- Dans notre cas, nous voulons obtenir 0,5 L et nous utiliserons 0,167 L d'acide. La quantité d'eau nécessaire est de 0,5 L - 0,167 L = 0,333 L, soit 333 millilitres.
Publicité
Partie 2
Partie 2 sur 3:Préparer un espace de travail sécurisé
-
1Lisez en ligne les Fiches Internationales de Sécurité Chimique. Les Fiches Internationales de Sécurité Chimique fournissent des informations de sécurité détaillées, mais succinctes. Cherchez le nom exact de l'acide que vous allez utiliser, par exemple « acide chlorhydrique » dans cette base de données en ligne. Certains acides peuvent nécessiter des précautions de sureté supplémentaires en plus de celles décrites ci-dessous.
- Parfois, plusieurs fiches sont éditées selon la concentration et les additions faites à l'acide. Choisissez celle qui ressemble le plus à votre solution d'acide initiale.
- Si vous préférez les lire dans une autre langue, choisissez celle qui vous intéresse sur cette page.
-
2Portez des lunettes de protection, des gants et une blouse de laboratoire. Des lunettes de protection qui recouvrent tous les côtés de vos yeux sont nécessaires lorsque vous manipulez de l'acide [2] . Protégez votre peau et vos vêtements en portant des gants et une blouse de laboratoire ou un tablier.
- Si vous avez les cheveux longs, attachez-les avant de manipuler de l'acide.
- L'acide peut mettre plusieurs heures à former des trous dans les vêtements. Même si vous ne remarquez pas tout de suite une tache, quelques gouttes peuvent abimer vos vêtements si vous ne les protégez pas avec une blouse de laboratoire [3] .
-
3Travaillez sous une hotte ou dans une zone ventilée. Lorsque c'est possible, gardez la solution d'acide sous une hotte allumée lorsque vous travaillez. Cela limite l'exposition aux vapeurs de gaz produits par l'acide, celles-ci pouvant être corrosives ou toxiques [4] . Si vous ne disposez pas de hotte, ouvrez toutes les fenêtres et toutes les portes et allumez un ventilateur pour aérer la zone.
-
4Identifiez les points d'eau courante. Si de l'acide est projeté dans vos yeux ou sur votre peau, vous devrez rincer la zone avec de l'eau courante et fraiche pendant 15 à 20 minutes. Ne commencez pas la dilution avant d'avoir trouvé le poste de lavage d'urgence des yeux ou l'évier fonctionnel le plus proche.
- Lorsque vous vous laverez les yeux, gardez les paupières bien ouvertes. Faites tourner vos yeux et regardez vers le haut, vers la droite, vers le bas et vers la gauche pour vous assurer de bien rincer tous les côtés de vos globes oculaires.
-
5Vous devez disposer d'un plan d'intervention propre à l'acide que vous utilisez. Vous pouvez acheter une trousse d'urgence en cas de déversement d'acide. Celle-ci doit contenir tout le matériel nécessaire. Vous pouvez aussi faire l'acquisition de neutraliseurs et d'absorbeurs séparément. La procédure décrite ici peut être utilisée pour l'acide chlorhydrique, sulfurique, nitrique ou phosphorique, mais les autres acides peuvent nécessiter plus de recherches pour être utilisés de façon appropriée.
- Aérez la zone en ouvrant les fenêtres et les portes et allumez les hottes et ventilateurs.
- Appliquez une base faible telle que du carbonate de sodium (ou soude ménagère), du bicarbonate de sodium ou du carbonate de calcium aux limites externes de la tache pour éviter qu'elle ne s'étende encore.
- Continuez à appliquer lentement, en travaillant vers l'intérieur jusqu'à ce que l'éclaboussure soit totalement recouverte.
- Mélangez bien avec un objet en plastique. Vérifiez le pH de l'éclaboussure avec du papier de tournesol. Si c'est nécessaire, ajoutez plus de base pour obtenir un pH compris entre 6 et 8, puis débarrassez-vous du contenu de l'éclaboussure dans un tuyau d'évacuation avec beaucoup d'eau.
Publicité
Partie 3
Partie 3 sur 3:Diluer l'acide
-
1Lorsque vous utilisez de l'acide concentré, refroidissez l'eau dans un bain de glace. Cette étape n'est nécessaire que si vous manipulez des solutions acides extrêmement concentrées, comme de l'acide sulfurique à 18M ou de l'acide chlorhydrique à 12M [5] . Refroidissez l'eau que vous utiliserez en la maintenant dans un récipient pendant au moins 20 minutes avant de commencer la dilution.
- Pour la plupart des dilutions, l'eau peut être à température ambiante.
-
2Versez de l'eau distillée dans un grand flacon. Pour les projets nécessitant des mesures précises (comme les titrages) utilisez une fiole jaugée. Dans la plupart des situations pratiques, vous pouvez utiliser une fiole Erlenmeyer. Dans tous les cas, choisissez un récipient qui pourra contenir facilement le volume total désiré, tout en faisant en sorte qu'il vous reste beaucoup d'espace encore pour minimiser les risques d'éclaboussure au-delà de la bordure.
- Ce n'est pas nécessaire de mesurer précisément ce volume d'eau, tant que celui-ci provient d'un récipient qui a été soigneusement mesuré pour contenir la quantité d'eau totale requise.
-
3Ajoutez une toute petite quantité d'acide. Si vous utilisez un petit volume d'acide, servez-vous d'une pipette graduée (ou burette de Mohr) ou d'une pipette volumétrique surmontée d'une poire en caoutchouc. Pour les volumes plus larges, placez un entonnoir dans le goulot du flacon et versez doucement une petite quantité d'acide à l'aide d'un cylindre gradué.
- Ne pipettez jamais à la bouche dans un laboratoire de chimie.
-
4Laissez la solution refroidir. Les acides forts peuvent générer beaucoup de chaleur lorsqu'ils sont ajoutés à de l'eau. Si l'acide était hautement concentré, la solution peut faire des éclaboussures ou générer des vapeurs corrosives. Si cela se produit, vous devrez effectuer la totalité de la dilution par toutes petites doses ou refroidir l'eau dans un bac à glace avant de continuer.
-
5Ajoutez l'acide restant par petites doses. Laissez à la solution le temps de refroidir entre chaque ajout, surtout si vous remarquez de la chaleur, des vapeurs ou des éclaboussures. Continuez jusqu'à ce que la quantité nécessaire d'acide ait été ajoutée.
- Cette quantité est représentée par le volume V1 ci-dessus.
-
6Mélangez la solution. Pour obtenir de meilleurs résultats, vous pouvez mélanger la solution avec un agitateur en verre après chaque ajout d'acide. Si la taille du flacon vous empêche de le faire, mélangez la solution après avoir terminé la dilution et après avoir ôté l'entonnoir.
-
7Rangez l'acide et rincez les instruments. Versez la solution d'acide que vous avez créée dans un récipient clairement étiqueté, de préférence une bouteille en verre recouverte d'une couche de PVC et conservez dans un endroit sûr. Rincez le flacon, l'entonnoir, l'agitateur en verre, la pipette et/ou le cylindre gradué avec de l'eau afin d'éliminer toute trace d'acide.Publicité
Conseils
- Ajoutez toujours l'acide dans l'eau, jamais l'inverse. La rencontre de ces deux substances génère une grande quantité de chaleur. Plus il y aura d'eau, plus votre « puits de chaleur » sera important et plus la chaleur sera absorbée. Vous limiterez ainsi les risques de brulure et d'éclaboussure.
- Voici un moyen mnémotechnique pour retenir l'ordre de l'ajout : « Eau dans acide : suicide, acide dans eau : bravo ! ». Voici un autre moyen mnémotechnique : « Pour nettoyer des toilettes avec de l'acide, il faut mettre l'acide dans l'eau » (l'inverse étant tout simplement impossible).
- Lorsque vous mélangerez deux acides, ajoutez toujours l'acide le plus fort au plus faible, pour les mêmes raisons que celles expliquées ci-dessus.
- Il est possible d'ajouter la moitié de la quantité nécessaire d'eau, de la diluer complètement, puis de mélanger lentement l'eau restante [6] [7] . Ce n'est pas recommandé pour les solutions concentrées.
- Pour un maximum de sécurité et pour faciliter le stockage, achetez l'acide le plus dilué qui correspond à vos besoins.
Avertissements
- Même lorsque l'effet de l'acide est faible, il existe des risques d'intoxication. C'est le cas par exemple du cyanure d'hydrogène (il n'est pas très fort, mais est très toxique).
- Ne dissolvez pas des matériaux pour vous amuser ou pour une raison quelconque, sauf si vous savez exactement ce que vous êtes en train de faire. Vous risquez de créer des produits extrêmement dangereux comme des gaz explosifs ou toxiques ou des explosifs qui risquent de s'enflammer spontanément.
- Si vous renversez de l'acide, n'essayez jamais d'en contrer les effets avec une base forte comme du KOH ou du NaOH. Utilisez de l'eau ou une base faible telle que du bicarbonate de sodium (NaHCO3) dilué à la place.
- Ces acides faibles peuvent aussi produire beaucoup de chaleur et s'avérer très dangereux. La distinction entre acide faible et acide fort n'est que purement chimique.
Éléments nécessaires
- Des lunettes de protection
- Des gants
- Une blouse de laboratoire ou un tablier
- Une solution de rinçage oculaire (un accès à de l'eau courante et froide sous laquelle vous pourrez facilement placer votre œil)
- Une fiole jaugée (pour plus de précision) ou une fiole Erlenmeyer
- Une pipette (pour les petites quantités) ou un cylindre gradué (pour les quantités plus importantes)
- De l'eau
- De l'acide
- Une trousse d'urgence en cas de déversement d'acide, ou du bicarbonate de soude et un outil en plastique
- Un agitateur en verre
Références
- ↑ https://www.youtube.com/watch?v=xeA7DRarq6IIn
- ↑ http://www.flinnsci.com/media/396140/acidsafety.pdf
- ↑ http://www.flinnsci.com/media/396140/acidsafety.pdf
- ↑ https://www.youtube.com/watch?v=xeA7DRarq6I
- ↑ https://www.youtube.com/watch?v=xeA7DRarq6I
- ↑ https://www.youtube.com/watch?v=xeA7DRarq6I
- ↑ http://www.lagoonsonline.com/laboratory-articles/normal-solutions.htm