Cet article a été rédigé avec la collaboration de nos éditeurs(trices) et chercheurs(euses) qualifiés(es) pour garantir l'exactitude et l'exhaustivité du contenu.
L'équipe de gestion du contenu de wikiHow examine soigneusement le travail de l'équipe éditoriale afin de s'assurer que chaque article est en conformité avec nos standards de haute qualité.
Cet article a été consulté 5 726 fois.
La spectrophotométrie est une méthode expérimentale qui sert à mesurer la concentration en soluté d’une solution en calculant la quantité de lumière absorbée par ce soluté [1] . Cette technique s’appuie sur la propriété qu’ont certains composés chimiques d’absorber différentes longueurs d’onde lumineuses de diverses intensités. Vous pouvez connaitre les substances contenues dans une solution ainsi que leurs concentrations simplement en faisant passer de la lumière à travers celle-ci. Pour cela, les laboratoires de recherche utilisent un appareil appelé spectrophotomètre.
Étapes
Partie 1
Partie 1 sur 3:Préparer les échantillons
-
1Allumez le spectrophotomètre. La plupart des appareils doivent rester un petit moment en fonctionnement avant de pouvoir donner des mesures précises. Mettez en route la machine et laissez-la chauffer au moins 15 minutes avant d’analyser votre première solution [2] .
- Profitez de ce laps de temps pour préparer vos échantillons.
-
2Nettoyez les cuvettes. Si vous êtes en train de faire des travaux pratiques dans un cadre scolaire, il est possible que l’on vous fournisse des tubes à essai jetables que vous n’aurez pas besoin de nettoyer. Si vous vous servez de contenants réutilisables, vérifiez qu’ils sont parfaitement propres avant de vous en servir. Rincez-les abondamment avec de l’eau distillée.
- Prenez soin des cuvettes, il s’agit de matériel assez cher.
- Lorsque vous manipulez une cuvette, vous devez veiller à ne pas mettre les doigts sur les côtés au travers desquels la lumière va passer. En général, ce sont les faces transparentes [3] .
-
3Versez le bon volume dans la cuvette. Certaines cuvettes ont une contenance maximum de 1 mL, alors que les tubes à essai peuvent aller jusqu’à 5 mL. Pour que votre mesure soit pertinente, il faut surtout faire attention à ce que le rayon laser qui sert de source lumineuse traverse bien le liquide et non la partie vide du récipient.
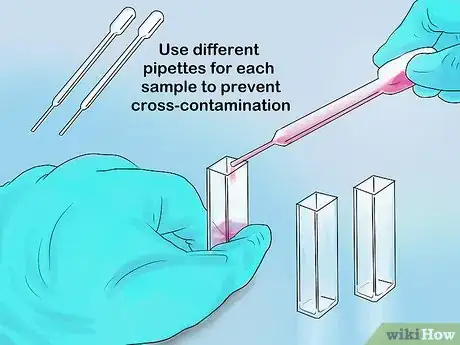
- Si vous remplissez vos échantillons à l’aide d’une pipette, changez-la à chaque fois pour éviter les contaminations croisées [4] .
-
4Préparez un « blanc ». On désigne sous ce terme la solution de contrôle qui ne contient rien d’autre que le solvant dans lequel le soluté à analyser sera dissout. Par exemple, si vous menez votre expérience sur de l’eau salée, votre « blanc » sera composé uniquement d’eau. Si vous avez teinté votre eau salée en rouge, le « blanc » contiendra de l’eau et du colorant rouge. Cette solution de contrôle doit avoir le même volume et être placée dans le même contenant que la solution à étudier [5] .
-
5Essuyez la cuvette. Avant de la mettre dans le spectrophotomètre, il faut vérifier qu’elle est aussi propre que possible afin d’éviter que de la poussière ou une saleté ne fausse le résultat. Servez-vous d’un chiffon qui ne peluche pas pour enlever la poussière et sécher les gouttes d’eau qui peuvent se trouver sur les parois externes [6] .Publicité
Partie 2
Partie 2 sur 3:Réaliser l’expérience
-
1Réglez la longueur d’onde. Vous allez maintenant choisir la longueur d’onde de la lumière qui traversera l’échantillon. Il faut qu’il n’y ait qu’une seule longueur d’onde (cela signifie que la couleur doit impérativement être monochrome) pour que le résultat soit fiable. Optez pour une lumière dont vous savez que la couleur sera absorbée par l’un des composés chimiques contenus dans la solution. Reportez-vous à la notice d’utilisation du spectrophotomètre pour décider quel est le réglage le plus pertinent [7] .
- Si vous faites des travaux pratiques à l’école, la longueur d’onde vous sera probablement donnée.
- La longueur d’onde choisie pour réaliser l’expérience sera toujours différente de la couleur de l’échantillon. En effet, vous savez d’ores et déjà que la solution va renvoyer toute la lumière de la longueur d’onde correspondant à sa couleur visible.
- Les objets ont une couleur pour l’œil humain parce qu’ils réfléchissent certaines longueurs d’onde alors qu’ils en absorbent d’autres. Par exemple, l’herbe est verte, car la chlorophylle renvoie la lumière verte tout en absorbant les autres teintes [8] .
-
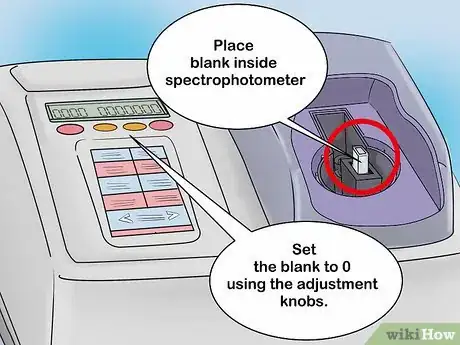
2Calibrez la machine avec le blanc. Placez la solution de contrôle dans le porte-cuvette et fermez le couvercle. Si vous possédez un spectrophotomètre analogique, vous allez voir un cadran avec une aiguille qui oscille en fonction de l’intensité lumineuse détectée. Normalement, quand vous analysez le blanc, cette aiguille devrait pointer vers la droite. Notez la valeur obtenue, vous en aurez peut-être besoin ultérieurement. Avant de sortir la cuvette, tournez le bouton de la tare jusqu’au zéro.
- Le principe qui régit le calibrage d’un spectrophotomètre électronique est le même, sauf que les mesures se lisent sur un écran. Tarez l’appareil pour qu’il soit sur zéro à l’aide du bouton prévu à cet effet.
- Le calibrage de la machine restera en mémoire après le retrait de la solution de contrôle. Lorsque vous allez ensuite réaliser des mesures avec vos échantillons, l’absorbance du blanc sera automatiquement soustraite.
- N'oubliez pas d'utiliser une nouvelle solution de contrôle pour chaque session afin que chaque échantillon soit calibré à partir d'une solution identique. Si par exemple vous mettez de la solution puis analysez quelques échantillons avant de changer la solution, les résultats seront faussés et vous devrez recommencer.
-
3Enlevez le blanc. Vérifiez que l’aiguille ou l’écran restent sur zéro. Pour être certain que le calibrage a été correctement enregistré, essayez de remettre la solution de contrôle dans la machine. La mesure doit toujours demeurer égale à zéro.
- Si le cadran de la machine affiche un autre résultat, recommencez le réglage de la tare depuis le début.
- Si cela ne suffit pas à résoudre le problème, demandez de l’aide à quelqu’un ou faites réparer la machine.
-
4Mesurez l’absorbance de vos échantillons. Patientez environ 10 secondes, le temps que l’aiguille se stabilise ou que l’affichage digital ne varie plus. Notez la valeur de l’absorbance et (ou) de la transmittance.
- L'absorbance est aussi appelée la densité optique.
- La part de lumière transmise à travers l’échantillon est inversement proportionnelle à la part de lumière absorbée. En général, on note plutôt la valeur de l’absorbance qui est normalement exprimée sous forme décimale. On pourra par exemple avoir un résultat de 0,43.
- Si le résultat montre une différence importante, par exemple 0,900 alors que les autres sont autour de 0,400, diluez l'échantillon et effectuez une nouvelle mesure d'absorbance.
- Pour chaque échantillon, réalisez au moins trois mesures et faites ensuite la moyenne des trois résultats. C’est le meilleur moyen d’obtenir un chiffre aussi précis que possible.
-
5Répétez l’opération avec différentes couleurs [9] . Il n’est pas exclu que votre échantillon contienne de nombreux composés chimiques inconnus dont l’absorbance variera en fonction de la longueur d’onde choisie. Pour réduire la marge d’erreur, refaites des mesures en choisissant des couleurs distantes de 25 nm sur le spectre lumineux. Vous serez ainsi capable de détecter les substances parasites qui peuvent se trouver dans votre solution.Publicité
Partie 3
Partie 3 sur 3:Analyser les résultats de l’absorbance
-
1Calculez la transmittance et l’absorbance. La transmittance représente la proportion de lumière qui est parvenue à traverser l’échantillon et à atteindre le capteur du spectrophotomètre. À l’inverse, l’absorbance caractérise la part de lumière qui a été absorbée par l’une des substances chimiques de la solution. La plupart des appareils modernes affichent directement les valeurs de l’absorbance et de la transmittance, mais si votre spectrophotomètre ne vous donne que le résultat de la mesure de l’intensité lumineuse, vous pouvez les calculer vous-même.
- Pour trouver la transmittance (T), divisez l’intensité lumineuse qui a traversé l’échantillon par l’intensité lumineuse qui avait traversé le blanc. Exprimez votre résultat sous forme de pourcentage ou sous forme décimale. T = I/I0, avec I l’intensité mesurée pour la solution et I0 l’intensité mesurée pour le blanc.
- L’absorbance (A) correspond au négatif du logarithme de base 10 de la valeur de la transmittance : A = -log10T. Pour une valeur de T égale à 0,1, A vaudra 1 (0,1 équivaut à 10 puissance -1), ce qui signifie que 10 % de la lumière est transmise et que 90 % sont absorbées. Avec une valeur de T égale à 0,01, A vaudra 2 (car 0,01 équivaut à 10 puissance -2), ce qui signifie que 1 % de la lumière est transmise.
-
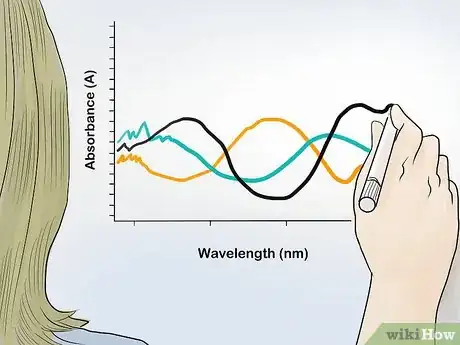
2Placez vos résultats sur un graphique. La valeur de l’absorbance sera sur l’axe vertical x, tandis que la longueur d’onde sera sur l’axe horizontal y. Le fait de disposer sur un repère orthonormé les valeurs maximums de l’absorbance pour chacune des longueurs d’onde lumineuses testées permet de réaliser le spectre d’absorption de l’échantillon [10] , d’identifier les composés présents et de connaitre leurs proportions.
- En général, le spectre d’absorption présente des pics au niveau de certaines longueurs d’onde, ce qui permet d’identifier des composés spécifiques.
-
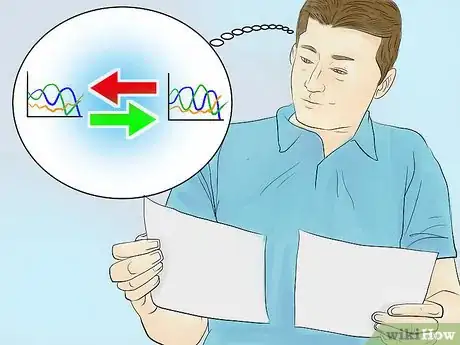
3Comparez. Mettez en relation votre spectre avec ceux qui sont connus pour divers composés chimiques. Chaque substance possède un spectre d’absorption qui lui est propre et présentera toujours le même pic à la même longueur d’onde lors des mesures. Vous pouvez donc identifier les composés inconnus qui forment votre solution en comparant son spectre avec les graphiques de composés connus.
- Cette méthode peut également vous être utile pour identifier des substances qui auraient contaminé l’échantillon. En effet, si le résultat attendu doit être un pic à une longueur d’onde donnée et que vous vous retrouvez avec deux pics à deux longueurs d’onde distinctes, c’est qu’il y a quelque chose qui ne va pas dans votre solution.
Publicité
Éléments nécessaires
- Un spectrophotomètre
- Un soluté à analyser au sein d’une solution
- Un peu de solvant seul (pour le blanc)
- Un contenant dans lequel verser les échantillons et le blanc (cuvettes, tubes à essai, etc.)
Références
- ↑ http://www2.bren.ucsb.edu/~keller/courses/esm223/Spectrometer_analysis.pdf
- ↑ http://www.oneonta.edu/faculty/kotzjc/LAB/Spec_intro.pdf
- ↑ http://www2.bren.ucsb.edu/~keller/courses/esm223/Spectrometer_analysis.pdf
- ↑ http://www2.bren.ucsb.edu/~keller/courses/esm223/Spectrometer_analysis.pdf
- ↑ http://www.oneonta.edu/faculty/kotzjc/LAB/Spec_intro.pdf
- ↑ http://www2.bren.ucsb.edu/~keller/courses/esm223/Spectrometer_analysis.pdf
- ↑ http://www.oneonta.edu/faculty/kotzjc/LAB/Spec_intro.pdf
- ↑ http://www.oneonta.edu/faculty/kotzjc/LAB/Spec_intro.pdf
- ↑ http://www.oneonta.edu/faculty/kotzjc/LAB/Spec_intro.pdf



























L'équipe de gestion du contenu de wikiHow examine soigneusement le travail de l'équipe éditoriale afin de s'assurer que chaque article est en conformité avec nos standards de haute qualité. Cet article a été consulté 5 726 fois.