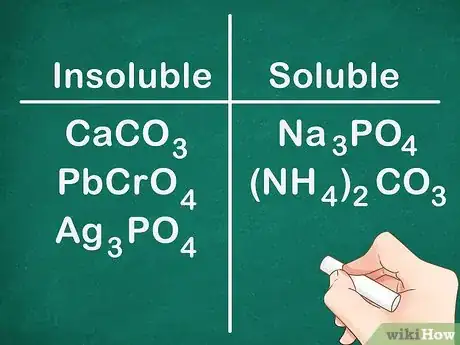Cet article a été coécrit par Meredith Juncker, PhD. Meredith Juncker est doctorante en biochimie et biologie moléculaire au centre des sciences de la santé de l'université d'État de Louisiane. Ses études portent sur les protéines et les maladies neurodégénératives.
Cet article a été consulté 9 334 fois.
La solubilité d'un composé est sa capacité à se dissoudre dans l'eau. Un composé insoluble va former un précipité en solution. Un composé partiellement soluble est également dit chimiquement insoluble [1] . Si vous vous rappelez des règles de solubilité, cela vous facilitera la vie lorsque vous devrez travailler avec des équations chimiques. Avec un peu de temps, de travail et quelques astuces mnémotechniques, vous retiendrez toutes les formules.
Étapes
Méthode 1
Méthode 1 sur 3:Apprendre les règles de solubilité
-
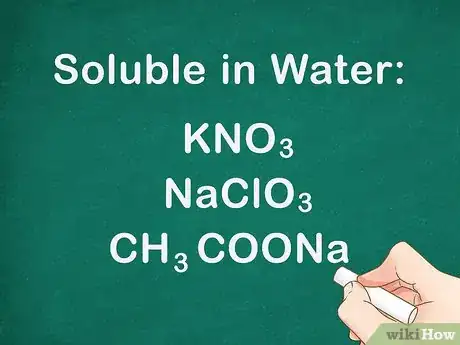
1Les sels du groupe 1A sont solubles. Le tableau périodique des éléments est organisé en lignes et colonnes appelées respectivement « périodes » et « groupes ». La première colonne du tableau contient les éléments du groupe 1A. Il s'agit des métaux alcalins. Ceux-ci incluent les éléments Li, Na, K, Cs et Rb [2] .
- Exemple : KCl et LiOH sont solubles dans l'eau [3] .
-
2
-
3Tous les sels d'ammonium sont solubles. L'ion ammonium (de formule NH4+) forme des sels qui se dissocient complètement dans l'eau. Il n'existe aucune exception à cette règle [6] .
- Exemple : NH4OH est soluble même s'il contient un ion hydroxyde.
-
4La plupart des composés hydroxylés sont insolubles. Certains sels d'hydroxydes sont légèrement solubles. C'est le cas des hydroxydes formés avec les éléments du groupe 2 (Ca, Sr et Ba). Les sels hydroxydes formés avec les éléments du groupe 1 sont une exception, car ces éléments sont toujours solubles [7] .
- Exemple : Fe(OH)3, Al(OH)3 et Co(OH)2 sont insolubles, mais LiOH et NaOH sont solubles.
-
5Les sels de non-métaux du groupe 17 sont généralement solubles. Les non-métaux du groupe 17 incluent le chlore (Cl-), le bromure (Br-) et l'iode (I-). L'argent, le plomb et le mercure font exception à cette règle. Les composés constitués de ces non-métaux et de ces ions ne sont pas solubles [8] .
- Exemple : AgCl et Hg2Cl2 sont tous deux insolubles.
- PbCl2, PbBr2 et PbI2 sont soluble dans l'eau TRÈS CHAUDE [9] .
-
6La plupart des carbonates, des chromates et des phosphates sont insolubles. Les formules chimiques de ces éléments sont les suivantes : CO3 (carbonates), CrO4 (chromates) et PO4 (phosphates). Les métaux du groupe 1A et ainsi que les composés de NH4+ font exception et sont solubles.
- Exemple : les composés tels que CaCO3, PbCrO4 et Ag3PO4 sont tous insolubles tandis que les composés comme Na3PO4 et (NH4)2CO3 sont solubles.
-
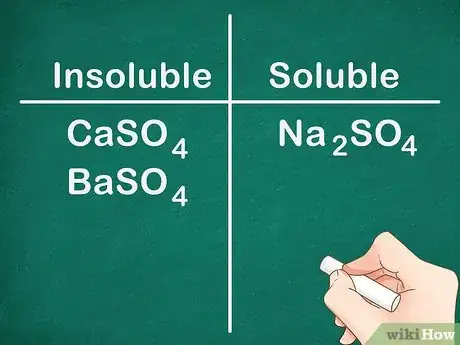
7La plupart des sels de sulfate sont solubles. La plupart des sels comprenant un ion SO4 est soluble dans l'eau. Les ions Ca+2, Ba+2, Pb+2, Ag+, Sr+2 et Hg+2 font exception à cette règle. Les sels de sulfate contenant ces ions ne sont pas solubles [10] .
- Exemple : Na2SO4 est complètement soluble tandis que CaSO4 et BaSO4 ne sont pas solubles [11] .
-
8La majorité des composés sulfurés est insoluble dans l'eau. Les éléments baryum, calcium, magnésium, sodium, potassium et ammonium font exception à cette règle. Seuls les composés faits de ces éléments et de sulfure sont solubles dans l'eau [12] .
- Exemple : CdS, FeS et ZnS sont tous insolubles [13] .
- Cependant, les sulfides de métaux en transition sont insolubles.
Publicité
Méthode 2
Méthode 2 sur 3:Utiliser un moyen mnémotechnique : NAG SAG
-
1Utilisez l'astuce mnémotechnique NAG SAG. L'acronyme NAG SAG est une astuce facile pour se rappeler des composés solubles et des exceptions. Écrivez l'acronyme NAG SAG et mémorisez la signification de chaque lettre [14] . Cette technique n'inclut pas toutes les règles de solubilité, mais en couvre une bonne partie. Toutes les lettres représentent des molécules solubles.
- N : Nitrates (NO3-)
- A : Acetates (CH3COO-)
- G : métaux alcalins du Groupe 1 (Li+, Na+, etc.)
- S : Sulfates (SO4-2)
- A : ions Ammonium (NH4+)
- G : non-métaux du Groupe 17 (F-, Cl-, Br-, I-, etc.)
-
2Retenez l'acronyme PMA pour la première exception. P représente le Pb+2 (plomb). M représente le Mercure (Hg2+2). A représente l'Argent (Ag+). Ces trois ions ne sont jamais solubles avec le groupe sulfate ou les non-métaux du groupe 17 [15] .
- Lorsque vous notez l'astuce mnémotechnique, dessinez une étoile près du sigle PMA et une étoile similaire près du S et du G de SAG pour vous rappeler qu'il s'agit d'exceptions.
-
3Rappelez-vous des mots « Castro » et « bar » pour la seconde exception. Cela peut sembler stupide, mais ces mots vous aideront à vous souvenir des ions calcium (Ca+2, strontium (Sr+2) et baryum (Ba+2). Ces trois ions ne sont jamais solubles avec des sulfates [16] .
- Faites une croix à côté de ces mots et une autre croix près du S de SAG pour vous souvenir que ces ions sont les exceptions pour la solubilité du sulfate.
Publicité
Méthode 3
Méthode 3 sur 3:Les bases de l'apprentissage
-
1Révisez fréquemment. Mémoriser des informations demande toujours du temps et du travail. Plus vous lirez souvent vos cours, plus vous vous en souviendrez à long terme. Relisez souvent les règles et testez-vous quotidiennement sur le sujet.
- Demandez à des amis ou à votre famille de vous poser des questions sur ce sujet au déjeuner ou au cours du diner.
- Gardez une copie des règles sous la main pour les réviser lorsque vous aurez un peu de temps libre.
-
2Faites des fiches de résumés et utilisez-les. Les fiches sont un excellent support pour réviser rapidement une matière et la mémoriser [17] . Notez les règles de solubilité sur des fiches avec quelques exemples. Repassez les fiches en revue jusqu'à ce que vous connaissiez bien les règles et les noms des composés qui sont solubles et insolubles.
- Emportez vos fiches avec vous et sortez-les pour réviser dans la voiture ou lorsque vous attendez vos amis.
- Toutes les occasions sont bonnes pour réviser vos fiches.
-
3Utilisez des moyens mnémotechniques. Les outils mnémotechniques sont des astuces pour vous aider à mémoriser des informations rapidement et facilement [18] . Lorsque vous apprenez un terme mnémotechnique, il peut être utile de l'écrire plusieurs fois pour vous en souvenir. Les astuces mnémotechniques ne sont utiles que si vous savez ce que chaque lettre signifie !
- Entrainez-vous souvent à écrire les sigles et ce que chaque lettre signifie.
- Lorsque vous êtes en examen, notez d'abord les astuces mnémotechniques afin de pouvoir y faire référence par la suite.
Publicité
Références
- ↑ http://www.chem.sc.edu/faculty/morgan/resources/solubility/
- ↑ http://chemwiki.ucdavis.edu/Core/Physical_Chemistry/Equilibria/Solubilty/Solubility_Rules
- ↑ http://www.chem.sc.edu/faculty/morgan/resources/solubility/
- ↑ http://www.chem.sc.edu/faculty/morgan/resources/solubility/
- ↑ http://www.chem.sc.edu/faculty/morgan/resources/solubility/
- ↑ http://www.chem.sc.edu/faculty/morgan/resources/solubility/
- ↑ http://chemwiki.ucdavis.edu/Core/Physical_Chemistry/Equilibria/Solubilty/Solubility_Rules
- ↑ http://chemwiki.ucdavis.edu/Core/Physical_Chemistry/Equilibria/Solubilty/Solubility_Rules
- ↑ https://www.chem.tamu.edu/rgroup/hughbanks/courses/462/handouts/The_Solubility_Rules.pdf
- ↑ http://chemwiki.ucdavis.edu/Core/Physical_Chemistry/Equilibria/Solubilty/Solubility_Rules
- ↑ http://www.chem.sc.edu/faculty/morgan/resources/solubility/
- ↑ https://www.chem.tamu.edu/rgroup/hughbanks/courses/462/handouts/The_Solubility_Rules.pdf
- ↑ http://chemwiki.ucdavis.edu/Core/Physical_Chemistry/Equilibria/Solubilty/Solubility_Rules
- ↑ https://www.youtube.com/watch?v=AsCLuLS-yZY
- ↑ https://www.youtube.com/watch?v=AsCLuLS-yZY
- ↑ https://www.youtube.com/watch?v=AsCLuLS-yZY
- ↑ https://www.examtime.com/flashcards/study-flashcards/
- ↑ http://www.back2college.com/memorize.htm