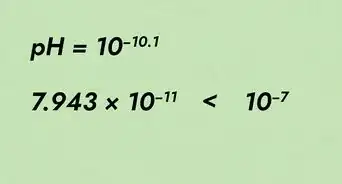wikiHow est un wiki, ce qui veut dire que de nombreux articles sont rédigés par plusieurs auteurs(es). Pour créer cet article, 16 personnes, certaines anonymes, ont participé à son édition et à son amélioration au fil du temps.
Il y a 7 références citées dans cet article, elles se trouvent au bas de la page.
Cet article a été consulté 63 133 fois.
Il est important d'analyser le pH de l'eau (c'est-à-dire son niveau d'acidité ou d'alcalinité). L'eau est en effet consommée par les plantes et les animaux dont nous dépendons et nous la consommons directement tous les jours. Le pH de l'eau peut fournir des indices sur une potentielle contamination. Par conséquent, l'analyse du pH de l'eau est une mesure de santé publique importante.
Étapes
Méthode 1
Méthode 1 sur 3:Utiliser un pH-mètre
-
1Calibrez la sonde et le compteur en suivant les instructions du fabricant. Pour le calibrer, vous aurez peut-être besoin de tester le compteur avec une substance dont le pH est connu. Vous pourrez ensuite le régler en fonction de ces mesures. Si vous allez analyser de l'eau en dehors d'un laboratoire, vous devriez réaliser le calibrage avant d'amener l'appareil sur le terrain [1] .
- Rincez la sonde avec de l'eau propre avant de l'utiliser. Séchez-la avec un chiffon propre.
-
2Collectez un échantillon d'eau dans un récipient propre.
- L'échantillon d'eau devrait être assez profond pour que le bout de l'électrode soit recouvert.
- Laissez l'échantillon reposer un moment pour que la température ait le temps de se stabiliser.
- Mesurez la température de l'échantillon avec un thermomètre.
-
3Réglez le compteur en fonction de la température de l'échantillon. La sensibilité de la sonde est affectée par la température de l'eau et la mesure indiquée pourrait ne pas être bonne si vous n'entrez pas les données de température [2] .
-
4Placez la sonde dans l'échantillon. Attendez que le compteur s'équilibre. On atteint ce dernier lorsque la mesure reste stable.
-
5Lisez la mesure du pH de l'échantillon. Votre pH-mètre devrait vous donner une mesure sur une échelle de 0 à 14. Si l'eau est pure, la mesure devrait être proche de 7. Notez vos relevés.Publicité
Méthode 2
Méthode 2 sur 3:Utiliser du papier de tournesol
-
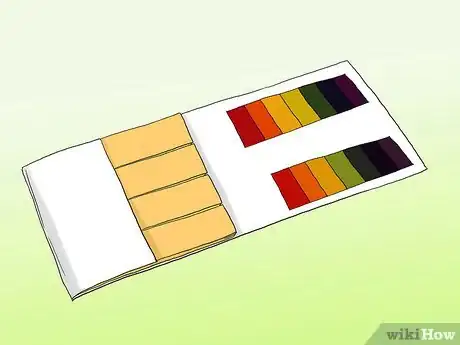
1Apprenez la différence entre le papier pH et le papier de tournesol. Pour obtenir une mesure correcte d'une solution, vous pouvez utiliser du papier pH. Il ne faut pas confondre avec le papier de tournesol courant. Les deux peuvent être utilisés pour analyser les acides et les bases, mais ils sont radicalement différents [3] .
- Les bandes de pH contiennent une série de colonnes indicatrices qui changent de couleur après avoir été exposées à une solution. L'intensité des acides et des bases de chaque colonne diffère. Une fois qu'elles ont changé, les couleurs peuvent être comparées aux exemples fournis dans le kit.
- Le papier de tournesol consiste en des bandes de papier qui contiennent un acide ou une base (alcalin). Ils sont rouges la plupart du temps (s'ils contiennent un acide qui réagit avec les bases) ou bleus (s'ils contiennent une base qui réagit avec des acides). Les bandes rouges deviennent bleues si la substance est alcaline, les bandes bleues deviennent rouges si elles sont en contact avec un acide. Les papiers de tournesol peuvent être utilisés pour réaliser une mesure rapide et facile, cependant les moins chers d'entre eux ne permettent pas forcément une mesure précise du pH d'une solution.
-
2Collectez un échantillon d'eau dans un récipient propre. L'échantillon doit être assez profond pour que la bande soit recouverte.
-
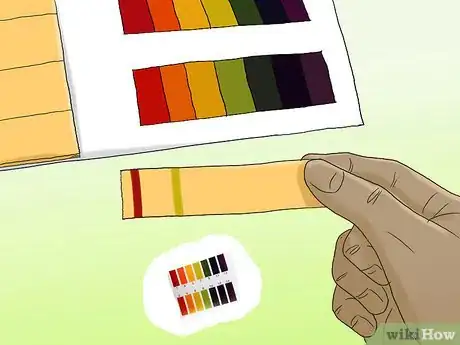
3Trempez une bande de papier dans votre échantillon. Quelques secondes d'exposition devraient suffirent. Les différentes colonnes du papier commenceront à changer de couleur dans quelques instants.
-
4Comparez le bout de la bande d'analyse avec le graphique coloré fourni avec le papier. Les couleurs du graphique devraient correspondre à celles qui se trouvent sur votre bande. Chaque couleur devrait être associée à une mesure de pH.Publicité
Méthode 3
Méthode 3 sur 3:Comprendre le pH
-
1Découvrez comment les acides et les bases se définissent. L'acidité et l'alcalinité (le terme utilisé pour décrire les bases) sont toutes deux définies par les ions d'hydrogène qu'elles perdent ou qu'elles acceptent. Un acide est une substance qui perd (ou selon certains, qui donne) des ions hydrogènes [4] .
-
2Comprenez l'échelle du pH. Le nombre du pH est utilisé pour évaluer le niveau d'acidité ou d'alcalinité des substances solubles dans l'eau. L'eau contient normalement un nombre équivalent d'ions hydroxydes (OH-) et d'ions hydroniums (H30+). Lorsqu'une substance acide ou alcaline est ajoutée dans de l'eau, elle modifie la proportion d'ions hydroxydes et d'ions hydroniums [5] .
- Ce nombre se situe typiquement sur une échelle de 0 à 14 (bien que certaines substances puissent en réalité aller au-delà de cette gamme). Les substances neutres ont un pH proche de 7, les substances acides au-dessous de 7 et les substances alcalines au-dessus de 7.
- L'échelle du pH est logarithmique, ce qui signifie qu'une différence d'une unité représente en fait une différence 10 fois supérieure en acidité ou alcalinité. Par exemple, une substance dont le pH est de 2 est en réalité 10 fois plus acide qu'une substance dont le pH est de 3 et 100 fois plus acide qu'une substance avec un pH de 4. L'échelle fonctionne de la même façon pour les substances alcalines, une unité de mesure correspondant à une différence décuplée.
-
3Sachez pourquoi on veut mesurer le pH de l'eau. L'eau pure devrait avoir un pH de 7, mais l'eau du robinet a généralement un pH entre 5,5 et 6. L'eau très acide (avec un faible pH) est plus susceptible de dissoudre les produits toxiques. Ceux-ci peuvent contaminer l'eau et la rendre impropre à la consommation humaine [6] .
- On préfère généralement mesurer le pH sur place. Si vous collectez un échantillon d'eau pour l'étudier dans un laboratoire, le dioxyde de carbone présent dans l'eau peut se dissoudre dans l'eau. Ce dioxyde de carbone dissout réagit avec les ions présents dans l'eau et augmente l'acidité des solutions basiques ou neutres. Pour éviter la contamination au dioxyde de carbone, vous devriez mesurer votre eau moins de 2 heures après l'avoir collectée [7] .
Publicité
Références
- ↑ http://chemed.chem.purdue.edu/genchem/lab/equipment/phmeter/use.html
- ↑ https://www.labdepotinc.com/articles/pH-temperature-compensation.html
- ↑ http://classroom.synonym.com/differences-between-litmus-paper-ph-strips-13673.html
- ↑ http://www.sciencebuddies.org/science-fair-projects/project_ideas/Chem_AcidsBasespHScale.shtml/
- ↑ http://chemwiki.ucdavis.edu/Physical_Chemistry/Acids_and_Bases/Aqueous_Solutions/The_pH_Scale
- ↑ http://www.lenntech.com/carbon-dioxide.htm
- ↑ http://water.epa.gov/type/rsl/monitoring/vms54.cfm