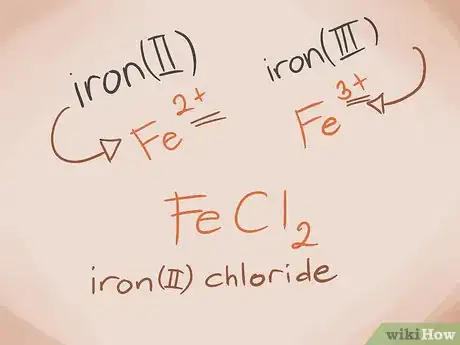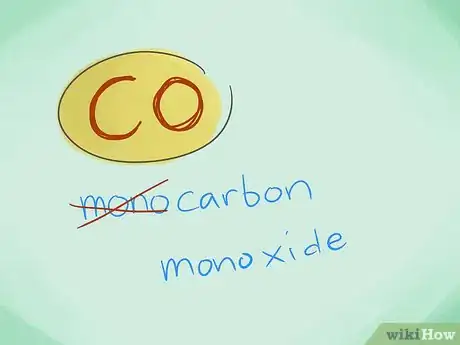X
wikiHow est un wiki, ce qui veut dire que de nombreux articles sont rédigés par plusieurs auteurs(es). Pour créer cet article, 11 personnes, certaines anonymes, ont participé à son édition et à son amélioration au fil du temps.
Cet article a été consulté 15 066 fois.
Réussir dans le domaine de la chimie exige de savoir nommer les composés chimiques de base. Ce guide vous fournit ainsi, des règles de base sur le procédé de dénomination des composés chimiques et sur comment attribuer des noms à des composés qui ne vous sont pas familiers.
Étapes
Méthode 1
Méthode 1 sur 3:Nomenclature des composés ioniques
Méthode 1
-
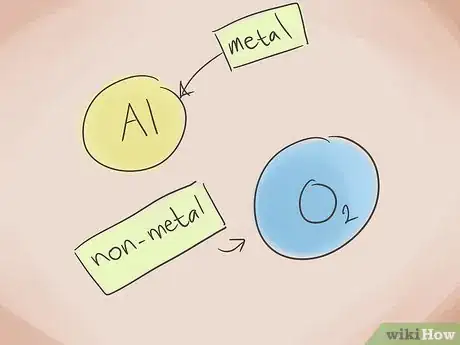
1De quoi est constitué un composé ionique ? Les composés ioniques sont constitués d'un métal et d'un non-métal. Référez-vous alors au tableau périodique des éléments pour savoir à quelles catégories appartiennent les éléments présents dans le composé.
-
2Formez le nom. Rien de plus simple que nommer un composé ionique de deux éléments. En effet, la première partie du nom du composé correspond au nom de l'élément non métallique portant le suffixe « ure » alors que la deuxième correspond au nom de l'élément métallique. Il existe des exceptions : oxyde, phosphure, nitrure, sulfure.
- Exemple : Al2O3. Al2 = Aluminium ; O3 = Oxygène. Donc le nom du composé sera « oxyde d'aluminium ».
-
3Sachez reconnaître les métaux de transition .Les métaux de transition sont ceux que l'on retrouve dans les blocs D et F du tableau périodique. Dans le nom du composé, la charge sur ces métaux est écrite en chiffre romain. Ceci est dû au fait que les métaux de transition peuvent porter plus d'une charge et former plus d'un composé.
- Exemple : FeCl2 et FeCl3. Fe = Fer ; Cl2 = Chlorure -2 ; Cl3 = Chlorure -3. Comme noms, on aura le chlorure ferreux(II) et le chlorure ferrique(III).
Publicité
Méthode 2
Méthode 2 sur 3:Nomenclature des composés polyatomiques
Méthode 2
-
1Il vous faut comprendre ce que c'est qu'un composé polyatomique. Les composés polyatomiques sont des composés formés par un groupe d'atomes associés entre eux ; le groupe entier portant une charge soit positive soit négative. Il y a alors trois actions fondamentales que vous pouvez exercer sur des composés polyatomiques :
- Vous pouvez ajouter un hydrogène à la première partie du composé. Le mot « hydrogène » est, en effet ajouté au début du nom du composé. Ce qui aura pour effet de réduire, par un, la valeur de la charge négative. Par exemple, le « carbonate » CO32- devient le « carbonate d'hydrogène » HCO3-.
- Vous pouvez aussi enlever un oxygène au composé. La charge ne subit pas de modification, mais le suffixe « -ate » du composé se transforme en « –ique ». Par exemple la transformation de : NO3 en NO2 on passe de « nitrate » à « nitrique. »
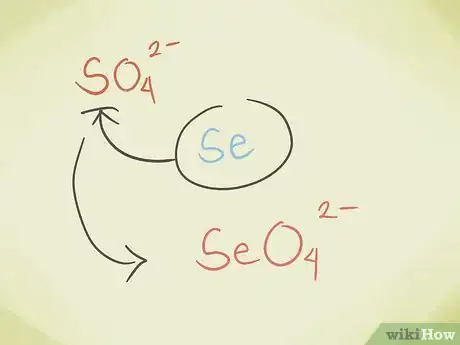
- Vous pouvez remplacer l'atome central du composé par un autre atome appartenant au même groupe périodique. Par exemple, le sulfate SO42- peut être remplacé par le séléniate SeO42-.
-
2Mémorisez les groupes d'ions les plus courants. Les groupes ci-dessous sont utilisés pour former la plupart des composés polyatomiques. Suivant l'ordre croissant de leur charge négative, on a :
- des ions hydroxides : OH-
- des ions nitrates : NO3-
- des ions hydrogéncarbonates : HCO3-
- des ions permanganates : MnO4-
- des ions carbonates : CO32-
- des ions chromates : CrO42-
- des ions dichromates : Cr2O72-
- des ions sulfates : SO42-
- des ions sulfites : SO32-
- des ions thiosulfates : S2O32-
- des ions phosphates : PO43-
- des ions ammonium : NH4+
-
3Formez des noms de composés à partir de la liste ci-dessus. Formez une association ion nom avec n'importe le(s)quel(s) des éléments liés au groupe. Si l'élément est placé avant le groupe ionique, alors le nom de l'élément sera tout simplement ajouté au début du nom du composé.
- Exemple : KMnO4. Vous devez pouvoir savoir que l'ion MnO4- correspond à l'ion permanganate. Le K renvoie au potassium. Ainsi, votre composé aura pour nom, Permanganate de potassium .
- Exemple : NaOH. Vous aurez sans doute compris ici que l'ion OH- c'est l'hoxyde . Na c'est, le sodium, donc le composé portera le nom d'hydroxyde de sodium.
Publicité
Méthode 3
Méthode 3 sur 3:Nomenclature des Composés Covalents
Méthode 3
-
1Qu'est-ce qu'un composé covalent ? Les composés covalents résultent de l'association d'au moins deux éléments non métalliques. Le nom du composé est déterminé par le nombre d'atomes qui le constituent. Le préfixe grec accolé à ce nom indique le nombre de molécules présentes dans le composé.
-
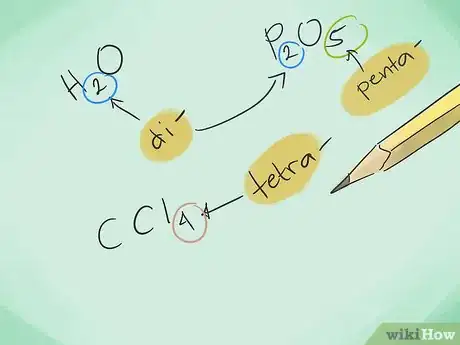
2Familiarisez-vous avec les préfixes. Mémorisez les préfixes suivants pour désigner des composés formés de 1 à 8 atomes :
- 1 atome – « Mono- »
- 2 atomes – « Di- »
- 3 atomes – « Tri- »
- 4 atomes – « Tetra- »
- 5 atomes – « Penta- »
- 6 atomes – « Hexa- »
- 7 atomes – « Hepta- »
- 8 atomes – « Octa- »
-
3Nommez en suite les composés. Nommez le composé obtenu en vous servant des préfixes appropriés. Les préfixes sont à greffer sur chacun des éléments constituant un composé à plusieurs atomes.
- Exemple : CO renverra au monoxyde de carbone tandis que CO2 va désigner le dioxyde de carbone.
- Exemple : N2S3 correspondrait au trisulfure de diazote.
- Dans la plupart des cas, l'on peut omettre le préfixe « mono » ; ce d'autant plus que l'absence de préfixe induit que c'est ce dernier qui devrait être employé. Ce préfixe continue d'être employé dans le cas du monoxyde de carbone compte tenu du fait que cet usage remonte aux premières lueurs de la chimie.
Publicité
Conseils
- Bien évidemment, vous vous doutez que plusieurs exceptions s'appliquent à toutes ces règles ; tenez par exemple, cette formule, CaCl2.Vous vous attendez à la voir porter le nom de « dichlorure de calcium », que NON. Votre composé gardera tout simplement le nom de chlorure de calcium.
- Aussi faudrait-il bien noter, par ailleurs que, tout ceci ne s'applique pas à la chimie organique.
- Les règles détaillées ici sont destinées à un public de débutants en chimie et en science. Des règles bien distinctes s'appliquent lorsque vous franchissez le palier de la chimie de pointe, à l'instar des règles sur la valence variable.
Publicité
À propos de ce wikiHow
Publicité