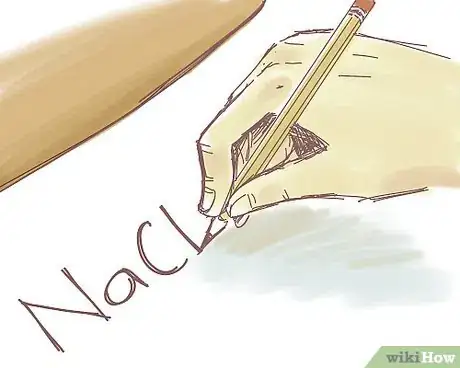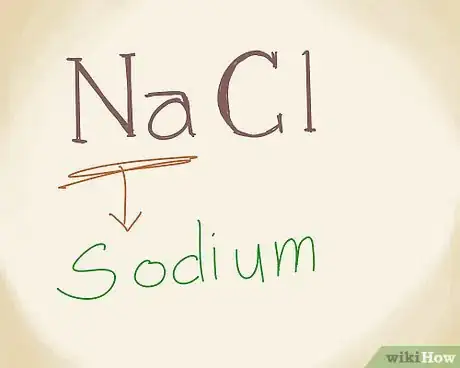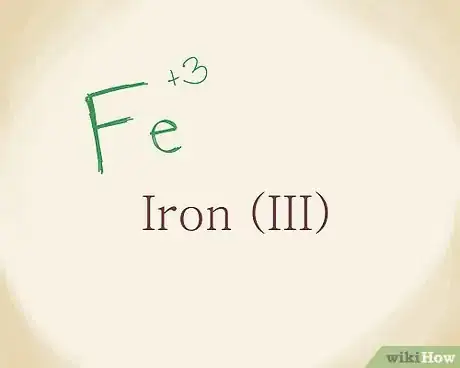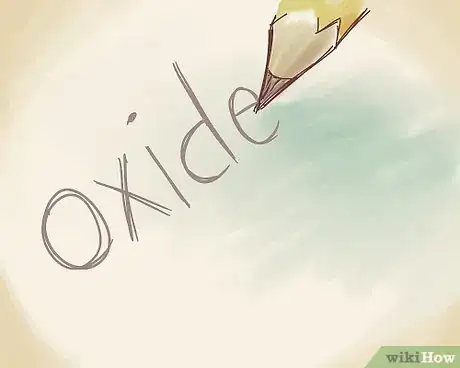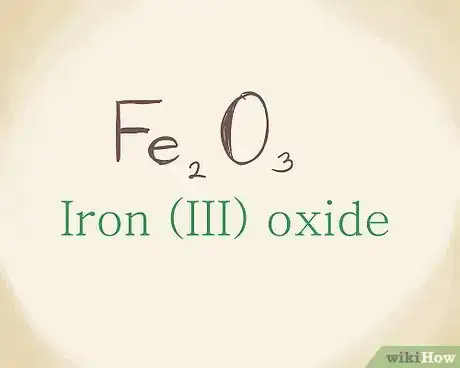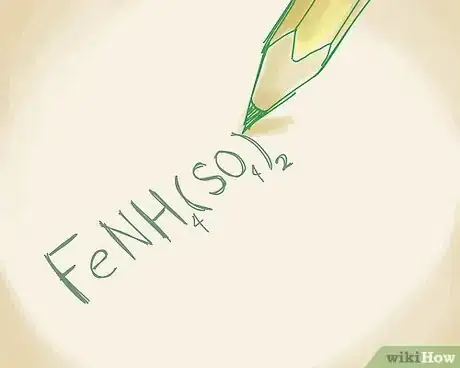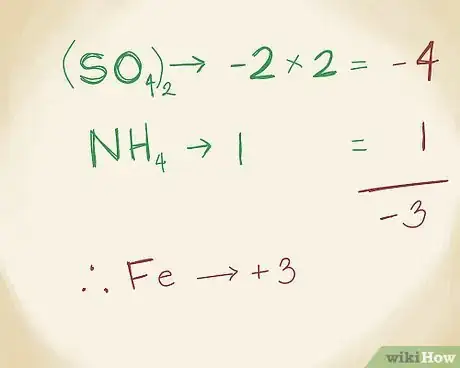Cet article a été coécrit par Bess Ruff, MA. Bess Ruff est doctorante en géographie à l'université d'État de Floride. Elle a obtenu un master en sciences et gestion de l'environnement à l'université de Californie, Santa Barbara, en 2016. Elle a aussi mené des enquêtes pour des projets de planification des espaces marins dans les Caraïbes et a contribué à la recherche en tant que boursière d'études supérieures pour Sustainable Fisheries Group.
Il y a 8 références citées dans cet article, elles se trouvent au bas de la page.
Cet article a été consulté 12 421 fois.
Les composés ioniques sont constitués d'ions métalliques positifs (cations) et d'ions non métalliques négatifs (anions). Pour trouver le nom d'un composé ionique, vous devez d’abord trouver le nom du non-métal (élément de droite) avec le bon suffixe (-ure, ate…), puis celui du métal combiné (élément de gauche), mais sans suffixe. Quant aux composés avec des métaux de transition, la règle reste la même, avec cependant quelques petites variantes.
Étapes
Méthode 1
Méthode 1 sur 3:Nommer les composés ioniques binaires
-
1Consultez le tableau périodique des éléments. Tous les éléments chimiques connus sont dans un tableau périodique. Un composé ionique binaire est fait d'un métal (cation) et d'un non-métal (anion). Ce n'est pas une généralité, mais les éléments capables de gagner des électrons (anions) sont plutôt sur la droite du tableau, les cations, plutôt à gauche. Les métaux sont plutôt à gauche et au centre du tableau [1] .
-
2Inscrivez la formule du composé ionique au nom inconnu. Admettons que l'on vous demande de donner le nom du composé ionique de formule NaCl. Selon les circonstances, en cours, vous l'écrirez sur votre cahier ou au tableau.
- Cet exemple est bien connu, mais il permet de bien comprendre le principe de la nomenclature : NaCl n'a que deux ions et ne contient pas de métal de transition.
-
3Inscrivez le nom du métal. La seconde partie du nom du composé est en fait le nom du métal, l'élément qui arrive en tête dans la formule, l'élément chargé positivement (cation). Ce métal est précédé du mot de (chlorure de sodium). Sur le tableau périodique des éléments, vous trouverez que le symbole Na est celui du sodium, à inscrire donc en deuxième place [3] .
- La règle est immuable : le nom du métal est toujours en seconde position, alors que son symbole l'est en première dans la formule.
-
4inscrivez le nom du non-métal avec un suffixe. Dans le cas d'un anion simple, vous devez ajouter -ure à la racine de l'élément. Dans notre exemple, on a l'anion Cl+, le composé est un chlorure, car Cl est du chlore. Parfois, c'est un peu plus complexe : ainsi, lorsque l'azote est en jeu, on ne parle pas d'azoture, mais de nitrure [4] .
- Le principe de dénomination pour nombre d'anions reste inchangé. Ainsi, dans un composé ionique quelconque contenant du phosphore, vous aurez un phosphure de… et s'il y a de l'iode, un iodure de…
-
5Assemblez dans le bon ordre les noms de l'anion et du cation. Une fois les noms des deux parties du composé ionique trouvés, vous n'êtes plus loin du but. Il faut les assembler dans l'ordre anion-cation, ce qui pour NaCl donnera le chlorure de sodium [5] .
-
6Entrainez-vous avec d'autres composés ioniques simples. Nous venons de voir le cas bien connu du chlorure de sodium, mais il existe nombre d'autres composés de ce type. Certains doivent être retenus pour servir de modèles à des composés rencontrés moins souvent. Avec ces composés, il n'est nul besoin de tenir compte du nombre d'ions mis en jeu. À titre d'exercices, essayez de trouver les noms des composés suivants (la réponse est visible si vous sélectionnez l'espace vide après le signe « = ») :
- Li2S = sulfure de lithium
- Ag2S = sulfure d'argent
- MgCl2 = chlorure de magnésium
Publicité
Méthode 2
Méthode 2 sur 3:Nommer les composés contenant un métal de transition
-
1Inscrivez la formule du composé ionique. Prenons comme exemple le composé ayant pour formule : Fe2O3. Les métaux de transition sont dans la partie centrale du tableau périodique et sur les quatre lignes, vous y trouverez, par exemple, le platine, l'or, le zirconium… Pour trouver le nom du composé, vous allez devoir tenir compte de sa charge, signalée par un chiffre romain [6] .
- Les composés avec un métal de transition sont toujours un peu plus délicats à nommer, car le nombre d'oxydation (charge) de ce dernier peut varier en fonction de la réaction.
-
2Déterminez la charge de l'ion métallique. Si le métal en jeu appartient au minimum au groupe 3 du tableau périodique, vous devez vous préoccuper de son nombre d'oxydation. L'indice de l'anion avec lequel le métal est associé indique la charge du métal de transition [7] . Les métaux auront une charge positive et dans notre cas, l'oxygène ayant toujours une charge de -2, les trois atomes de O3 supposent qu'il y a 6 électrons à équilibrer. Étant donné qu'il y a deux atomes de fer dans Fe, on en conclut donc que la charge du fer est ici de +3.
- Vous pouvez aussi faire l'inverse en écrivant que l'ion oxygène a une charge de -2.
- En général, dans les exercices scolaires, les charges des deux éléments sont mentionnées soit dans la formule soit dans l'énoncé.
-
3Trouvez le nom du métal. Vous y ajouterez sa charge en chiffre romain. Si besoin était, recherchez le nom du cation (métal) dans le tableau périodique. Fe est le symbole du fer et a une charge positive de +3, vous devrez alors écrire …de fer(III) [8] .
- Les chiffres romains ne sont utilisés que dans la dénomination. En aucun cas, ils n'apparaissent dans les formules ou les réactions.
-
4Trouvez la bonne formulation du non-métal. Un suffixe doit être trouvé. Si besoin était, recherchez le nom de l'anion dans le tableau périodique. C'est ainsi que l'oxygène (O) est un cas particulier : il perd sa désinence -gène au profit de -de, ce qui donne oxyde [9] .
- Par contre, tous les autres anions prennent une terminaison en –ure. En clair, quel que soit le métal associé, les anions sont toujours désignés de la même façon.
-
5Combinez les noms des deux éléments. Cette opération n'est en rien différente de ce que l'on a vu avec les composés simples. Assemblez les deux éléments de nomenclature définis précédemment, sans oublier le chiffre romain. C'est ainsi que Fe2O3 est de l'oxyde de fer (III) [10] .
-
6Connaissez les anciennes dénominations. Autrefois, les chiffres romains n'étaient pas utilisés pour les métaux de transition, ils avaient des désinences en -eux ou en -ique. Observez de près les deux parties du composé ionique. Si l'ion métal a une charge inférieure à celle de l'ion non métallique, alors vous utiliserez la terminaison en -eux. Si c'est l'inverse, vous utiliserez la terminaison en -ique [11] .
- Fe2+ a une charge inférieure à celle de l'oxygène (Fe3+ a une charge supérieure), si bien que le fer donne ici l'adjectif ferreux. Ainsi, Fe2+O est de l'oxyde ferreux.
- Les dénominations ferrique et ferreux ont donc la même racine étant donné qu'elles font toutes deux références à l'élément Fe.
-
7N'utilisez pas de chiffres romains avec certains composés. C'est le cas de ceux qui contiennent du zinc ou de l'argent. Ces deux métaux ont toujours, quelle que soit la réaction chimique, le même nombre d'oxydation, si bien qu'il n'y a qu'une seule dénomination : le zinc a toujours une charge de +2, tandis que l'argent a toujours une charge de +1 [12] .
- Cela signifie que les composés contenant ces éléments sont toujours du type « … de zinc » ou « … d'argent ». Jamais vous ne verrez de chiffres romains accolés.
Publicité
Méthode 3
Méthode 3 sur 3:Nommer les composés contenant un ion polyatomique
-
1Inscrivez la formule de votre ion polyatomique. Par définition, un tel composé ionique renferme plusieurs ions combinés de façon différente. En général, il y a un cation unique (le métal) et un anion (le non-métal) qui, lui, est fait de plusieurs atomes. Si vous ne connaissez pas les noms des ions, reportez-vous au tableau périodique. Prenons un exemple classique, le composé de formule FeNH4(SO4)2 [13] .
-
2Déterminez la charge de l'ion métal. En premier lieu, l'ion SO4 a une charge de -2. Le 2 en indice de SO4 indique qu'il y a deux ions de ce type dans le composé. Cet ion porte le nom de sulfate, car c'est une combinaison d'oxygène et de soufre. Sa charge est donc de : 2 x -2 = -4. De son côté, l'ion ammonium NH4 (avec 1 atome d'azote et de 4 d'hydrogène) a une charge de +1. Le gaz ammoniac de formule NH3 est stable et a une charge neutre, mais si un atome d'hydrogène lui est adjoint, il devient NH4 avec une charge de +1. Le sulfate d'ammonium (NH4(SO4)2 a donc une charge de : -4 + 1, soit -3. Cela signifie que l'ion fer (Fe) doit avoir une charge de +3 pour que le composé soit stable [14] .
- Les composés ioniques ont une charge neutre, sans quoi ils ne seraient pas stables. C'est grâce à cette propriété que vous pouvez trouver la charge de l'ion métallique.
- L'ion SO4 a une charge de -2 et quand il est combiné avec deux atomes d'hydrogène, chacun portant une charge de -1, il devient un composé stable : l'acide sulfurique de formule H2SO4 [15] .
-
3Dénommez un ion métallique. Il y a deux façons de faire : l'ancienne méthode et la nouvelle, même si cette dernière commence à dater. Dans le cas de Fe2O3, vous pouvez dire que c'est de l'oxyde ferrique (ancienne dénomination) ou de l'oxyde de fer(III) (nouvelle dénomination).
-
4Inscrivez le nom global des ions non métalliques. En lisant le tableau périodique, vous découvrirez que le symbole S correspond au soufre et combiné à l'oxygène sous la forme SO4, il devient un sulfate. De même, quand un atome d'azote est combiné avec 4 atomes d'hydrogène (NH4), le tout est l'ion ammonium. Finalement, en combinant les deux, vous aurez du sulfate d'ammonium.
- Le gaz ammoniac, ayant une charge neutre, devient l'ion ammonium si un ion positif lui est adjoint.
-
5Associez les noms du métal avec ceux des non-métaux. C'est ainsi donc que FeNH4(SO4)2 est du sulfate d'ammonium et de fer(III) [16] .
- Avec l'ancienne dénomination, ce composé porte le nom de sulfate d'ammonium ferrique.
Publicité
Conseils
- Lors d'un contrôle ou d'un exercice en classe, il vous sera précisé, en cas de double appellation, comment il faudra nommer les composés ioniques. En l'absence d'instructions, toute dénomination sera acceptée.
Références
- ↑ https://medium.com/countdown-education/4-steps-to-naming-compounds-in-chemistry-nomenclature-7525ed57bd13
- ↑ https://sciencing.com/how-to-name-ionic-compounds-13712152.html
- ↑ https://sciencing.com/how-to-name-ionic-compounds-13712152.html
- ↑ https://sciencing.com/how-to-name-ionic-compounds-13712152.html
- ↑ https://youtu.be/7Lfc6jjp1WQ?t=40s
- ↑ https://medium.com/countdown-education/4-steps-to-naming-compounds-in-chemistry-nomenclature-7525ed57bd13
- ↑ https://sciencing.com/how-to-name-ionic-compounds-13712152.html
- ↑ https://medium.com/countdown-education/4-steps-to-naming-compounds-in-chemistry-nomenclature-7525ed57bd13
- ↑ https://www.dummies.com/education/science/chemistry/how-ionic-compounds-are-named/
- ↑ https://youtu.be/7Lfc6jjp1WQ?t=2m41s
- ↑ https://www.dummies.com/education/science/chemistry/how-ionic-compounds-are-named/
- ↑ https://youtu.be/7Lfc6jjp1WQ?t=3m32s
- ↑ http://www.dummies.com/how-to/content/how-ionic-compounds-are-named.html
- ↑ https://www.dummies.com/education/science/chemistry/how-ionic-compounds-are-named/
- ↑ http://www.essentialchemicalindustry.org/chemicals/sulfuric-acid.html
- ↑ https://www.dummies.com/education/science/chemistry/how-ionic-compounds-are-named/