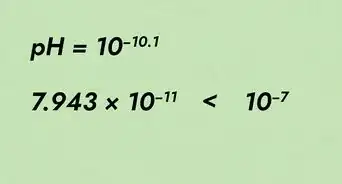wikiHow est un wiki, ce qui veut dire que de nombreux articles sont rédigés par plusieurs auteurs(es). Pour créer cet article, des auteur.e.s volontaires ont participé à l'édition et à l'amélioration.
Il y a 8 références citées dans cet article, elles se trouvent au bas de la page.
Cet article a été consulté 37 789 fois.
La formule chimique du dioxyde de carbone est CO2. C'est un gaz qu'on utilise fréquemment dans l'industrie, par exemple, pour rendre les sodas et certaines boissons alcoolisées pétillants, mais aussi comme gaz de propulsion dans les aérosols. C'est lui qui fait lever une pâte à pain et qui, dans certains extincteurs, permet d'étouffer les flammes. On le voit, c'est un gaz aux multiples usages. Ce CO2 peut être produit de façon volontaire, tout comme il peut être un produit secondaire, issu d'une réaction chimique particulière.
Étapes
Partie 1
Partie 1 sur 2:Faire du CO2 chez soi
-
1Récupérez une bouteille en plastique de 2 litres. Comme on a affaire à un gaz qui peut faire exploser la bouteille, il est préférable de prendre du plastique plutôt que du verre. Il y a moins de risques !
- Si vous avez prévu d'utiliser ce CO2 pour la croissance de vos plantes d'aquarium, sachez que l'expérience qu'on vous propose, avec les quantités que nous avons choisies, permet d'alimenter un bac de 100 litres environ.
-
2Mettez 400 g de sucre en poudre dans votre bouteille. Prenez plutôt du sucre complet, composé de différents sucres, plutôt que du sucre raffiné. Deux avantages : il est moins cher et la production de gaz (via la levure) est plus longue et donc plus importante en volume (les réactions sont plus complexes).
-
3Complétez la bouteille avec de l'eau chaude jusqu'à la base du col. L'eau chaude du robinet est parfaite, une eau bouillante tuerait la levure.
-
4Ajoutez une demi-cuillère à café de bicarbonate de sodium. Ce bicarbonate est le composant principal, voire exclusif, du bicarbonate de soude. On peut en acheter un peu partout (grands magasins, épiceries, pharmacies…).
-
5Ajoutez une demi-cuillère à café d'extrait de levure. Cela permet de prolonger la réaction.
- Vous trouverez de l'extrait de levure dans certains produits typiques. C'est ainsi qu'on en trouve dans cet extrait de bœuf qu'est le Bovril. Si vous pouvez vous en procurer, sachez que la « terrible » Marmite britannique en contient aussi [1] .
-
6Ajoutez un tiers de cuillère à café de levure. La levure de bière agira plus longtemps que la levure de boulanger, même si cette dernière agira suffisamment. De plus, elle est moins couteuse que la levure de bière.
-
7Fermez bien la bouteille.
-
8Secouez-la pour bien mélanger la levure et le sucre. Vous devriez voir se former une légère mousse à la surface du liquide.
-
9Enlevez le bouchon.
-
10Attendez de 2 à12 heures. Votre eau va se mettre à bouillonner, preuve que du gaz carbonique se forme et s'échappe. Si plus rien ne se passe au bout de 12 heures, c'est que l'eau était trop chaude ou que votre levure n'agit plus.
- La solution doit libérer environ 2 bulles à la seconde. S'il y en a plus, vous allez finir par modifier le pH de l'eau [2] .
Publicité
Partie 2
Partie 2 sur 2:D'autres façons de faire du CO2
-
1Expirez. Pour pouvoir fonctionner, votre corps a besoin d'oxygène pour interagir avec les protéines, les acides gras et autres hydrates de carbone que vous ingérez. Il en résulte des réactions chimiques, dont certaines dégagent du dioxyde de carbone, lequel est évacué, entre autres, par la bouche ou le nez.
- Par opposition, nombre de plantes vertes et certaines bactéries « raffolent » du dioxyde de carbone. Elles l'absorbent et, moyennant le phénomène de photosynthèse dans le cas des plantes, fabriquent des sucres simples (les hydrates de carbone) qui permettent leur croissance.
-
2Pour obtenir du CO₂, on peut faire bruler quelque chose qui contient du carbone. La vie sur Terre repose en grande partie sur le carbone qui se compose et se décompose sans interruption au fil du temps. Pour faire bruler un élément carboné (du bois, par exemple), il vous faut une source de chaleur et de l'oxygène (O₂). Lors de la combustion, le carbone (C) de votre élément se combinera avec l'oxygène (O₂) de l'air pour donner du… CO₂.
- L'oxyde de calcium (CaO), connu également sous le nom de « chaux vive », est obtenu par calcination du calcaire à 825 °C, ce dernier contenant du carbonate de calcium (CaCO3). Lors de la réaction, du CO2 se dégage et il reste l'oxyde de calcium. En sortie de four, cet oxyde est appelé « chaux vive [3] [4] ».
-
3Faites réagir entre eux des produits naturels ou chimiques qui contiennent du carbone. Le carbone et l'oxygène nécessaires à la production de CO2 sont présents dans de nombreux produits naturels ou chimiques, comme les carbonates et s'ils sont de plus composés d'hydrogène, on parle alors de bicarbonates. On peut obtenir du CO2 avec d'autres produits, que la réaction se produise à l'air libre ou avec de l'eau. Dans ce dernier cas, on obtient par exemple de l'acide carbonique (H2CO3). Parmi les mélanges qui libèrent du CO₂, on notera...
- L'acide chlorhydrique et le carbonate de calcium : l'acide chlorhydrique (de formule HCl) est en vente libre dans les magasins de bricolage, mais se trouve aussi dans l'estomac humain pour décomposer les aliments. Le carbonate de calcium (de formule CaCO3) est présent dans les calcaires, la craie, les coquilles d'œufs, les perles, les coraux, ainsi que dans tous les médicaments contre les brulures gastriques (Gaviscon, Alka-Seltzer… [5] ). Quand ces deux composants sont mélangés, il se forme de l'acide carbonique et du chlorure de calcium. L'acide se décompose instantanément en eau et en dioxyde de carbone.
- Le vinaigre et le bicarbonate de soude : le vinaigre n'est rien d'autre qu'une solution d'acide acétique (C2H4O2 [6] ), alors que le bicarbonate de soude est composé de bicarbonate de sodium (NaHCO3). La réaction entre les deux donne de l'eau, de l'acétate de sodium (CH3COONa) et un dégagement de CO2 (sous forme de mousse).
- Le méthane et la vapeur d'eau : ce procédé est utilisé dans l'industrie pour produire de l'hydrogène avec de la vapeur d'eau à haute température. La réaction méthane (CH4) - vapeur d'eau (H2O) produit essentiellement de l'hydrogène (H2) et du monoxyde de carbone (CO), gaz mortel et difficile à détecter, car inodore. Ce monoxyde est alors dirigé dans une atmosphère de vapeur d'eau, à température plus basse que précédemment, pour produire à nouveau de l'hydrogène et du dioxyde de carbone, beaucoup moins dangereux [7] .
- Enfin, la levure et le sucre. Quand on mélange les deux, comme on l'a fait dans la première partie de cet article, le sucre est décomposé et libère du CO2. On obtient également de l'éthanol (de formule C2H5OH), une forme d'alcool que l'on trouve majoritairement dans les boissons… alcoolisées. Cette réaction porte le nom de fermentation.
Publicité
Conseils
- Si vous comptez récupérer le CO2 produit dans votre bouteille pour l'injecter dans votre aquarium, il vous faudra percer un petit trou dans le bouchon. Vous y glisserez un petit tube en caoutchouc, le tout devant être hermétiquement collé. Dans l'idéal, il faudra installer une vanne à air pour empêcher l'eau de remonter dans le tuyau et prévoir une soupape de sécurité pour éviter que la bouteille n'explose. Si ! Si ! Cela existe : un compteur à bulles de CO2 ! Cet appareil vous permettra de savoir exactement la quantité de dioxyde de carbone produite pendant la réaction [8] .
Avertissements
- Le plus souvent, le CO2 est produit en petites quantités lors des millions de réactions qui se produisent chaque jour (ne serait-ce que la respiration de chacun de nous !) Si l'on additionne tout ce CO2 produit en permanence, lequel se retrouve le plus souvent dans l'atmosphère, on comprend mieux une des causes probables du réchauffement climatique. En effet, ce gaz a tendance à emprisonner les rayons solaires, d'où l'élévation de température de la planète.
Éléments nécessaires
- Une bouteille en plastique de 2 litres, avec son bouchon
- De l'eau
- Du sucre
- Du bicarbonate de soude
- De la levure (de bière ou de boulanger)
- Des produits contenant de l'extrait de levure (facultatif)
Références
- ↑ http://www.toutsurlalevure.fr/la-levure-de-a-a-z
- ↑ http://aquariuminfo.org/diyco2.html
- ↑ http://fr.wikipedia.org/wiki/Oxyde_de_calcium
- ↑ http://fr.wikipedia.org/wiki/Chaux_(matière)#La_chaux_vive
- ↑ http://fr.wikipedia.org/wiki/Carbonate_de_calcium
- ↑ http://www.csst.qc.ca/prevention/reptox/Pages/fiche-complete.aspx?no_produit=521
- ↑ http://fr.wikipedia.org/wiki/Production_d%27hydrogène
- ↑ http://www.aquavipare.fr/chimie_eau/injection_production_CO2_aquarium.php