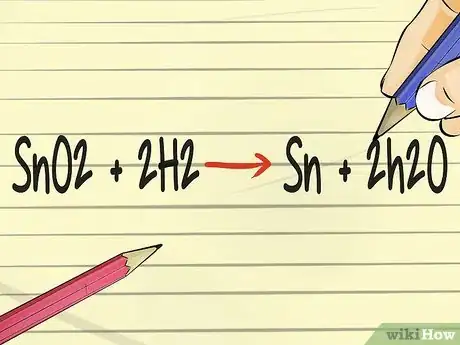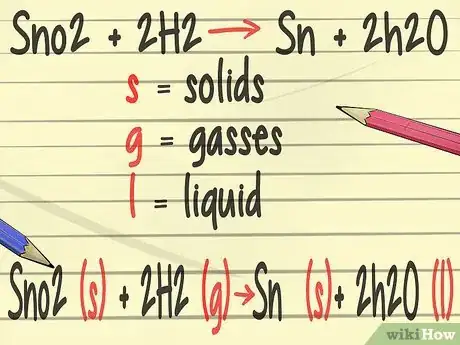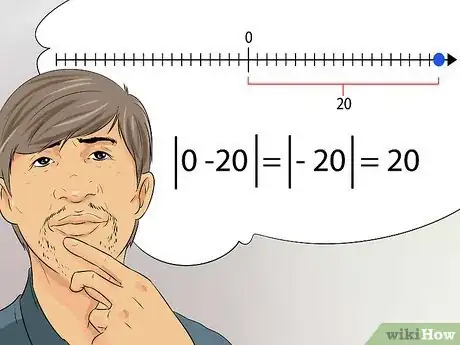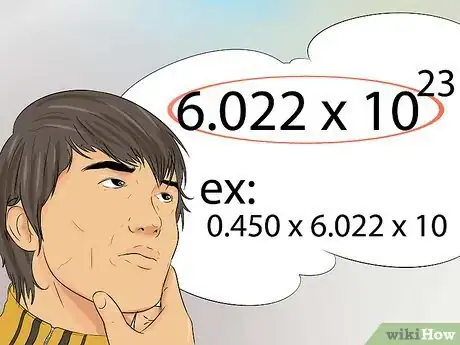wikiHow est un wiki, ce qui veut dire que de nombreux articles sont rédigés par plusieurs auteurs(es). Pour créer cet article, 41 personnes, certaines anonymes, ont participé à son édition et à son amélioration au fil du temps.
Il y a 8 références citées dans cet article, elles se trouvent au bas de la page.
Cet article a été consulté 8 811 fois.
Pour réussir en cours de chimie générale, vous devez bien comprendre les principes fondamentaux de cette matière, être capable de faire des calculs simples, savoir utiliser une calculatrice pour effectuer des opérations plus complexes et être prêt à apprendre quelque chose de vraiment différent. La chimie est une science qui étudie la matière et ses propriétés. Tout ce qui nous entoure est lié à la chimie, même les choses les plus élémentaires qui vous semblent tout à fait naturelles, telles que l'eau que vous buvez et les propriétés de l'air que vous respirez. Restez ouvert aux nouvelles connaissances quand il s'agit de comprendre le monde qui vous entoure, même à l'échelle atomique. Votre premier contact avec la chimie peut être stimulant et passionnant.
Étapes
Partie 1
Partie 1 sur 5:Développer de bonnes habitudes d'étude
-
1Apprenez à connaitre votre professeur. Pour réussir en cours de chimie et avoir de meilleures notes en classe, prenez le temps de rencontrer votre professeur et lui faire part des notions que vous ne comprenez pas.
- Beaucoup d'enseignants disposent de guides d'étude et sont disposés à recevoir les apprenants en dehors des heures de cours en cas de besoin.
-
2Formez ou rejoignez un groupe d'étude. N'ayez pas honte si vous trouvez les cours de chimie assez complexes. C'est une matière difficile pour presque tout le monde.
- Si vous rejoignez un groupe, certains membres pourraient trouver des parties du cours plus faciles que d'autres et pourraient partager leurs méthodes d'apprentissage avec tout le monde. Répartissez-vous les tâches.
-
3Lisez les chapitres. Les manuels de chimie ne sont pas toujours les livres les plus passionnants à lire. Néanmoins, vous devez prendre le temps de lire les textes qui vous ont été donnés en classe et mettez en évidence les parties que vous ne comprenez pas. Essayez de dresser une liste de questions ou de notions que vous ne comprenez pas.
- Essayez plus tard de relire ces parties difficiles à comprendre. Si vous ne les comprenez toujours pas, discutez-en avec votre groupe d'étude, votre professeur ou votre professeur adjoint.
-
4Répondez aux questions d'étude. Même si vous avez l'impression d'être submergé par tous les documents que vous étudiez, sachez que vous avez peut-être mémorisé plus de notions que vous ne le pensez. Répondez aux questions à la fin des chapitres.
- La plupart des manuels fournissent d'autres renseignements expliquant la démarche à suivre pour trouver les bonnes réponses. Cela vous permettra de voir ce que vous avez raté dans votre raisonnement.
-
5Examinez les diagrammes, les images et les tableaux. Vous verrez souvent dans les manuels scolaires des supports visuels qui vous aideront à mieux comprendre les éléments clés à retenir.
- Regardez bien les images et les légendes qui les accompagnent. Cela peut vous aider à comprendre certaines notions.
-
6Demandez la permission d'enregistrer le cours. Il est difficile de prendre des notes dans son cahier et de regarder en même temps ce qui est écrit au tableau, surtout à un cours compliqué comme la chimie.
-
7Essayez d'avoir les anciennes épreuves et les anciens manuels. La plupart des écoles permettent aux apprenants d'avoir en toute légitimité les anciennes épreuves afin de les aider à bien se préparer aux examens.
- Évitez de simplement mémoriser les réponses. En chimie, si vous voulez pouvoir répondre à la même question formulée en des termes différents, vous devez bien comprendre les notions.
-
8Consultez les ressources d'aide en ligne. Consultez tous les liens ou toutes les ressources en ligne fournis par le département de chimie de votre établissement.Publicité
Partie 2
Partie 2 sur 5:Comprendre les structures atomiques
-
1Commencez par les structures les plus basiques. Pour réussir un examen de chimie, vous devez bien comprendre les éléments de base qui composent tout ce qui a une substance ou une masse.
- Comprendre la structure de l'élément le plus fondamental en chimie, c'est-à-dire l'atome, est la première étape pour comprendre cette discipline. Tous les sujets qui seront abordés en classe seront une extension de cette information de base. Prenez tout le temps nécessaire pour comprendre la chimie à l'échelle atomique.
-
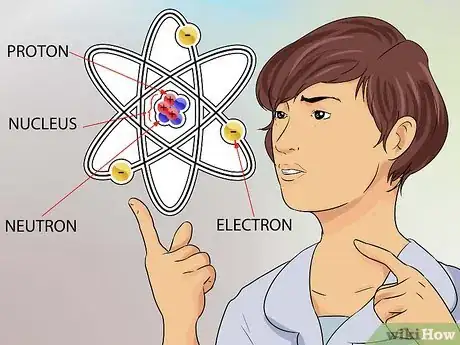
2Comprenez la notion d'atome. On considère que l'atome est le plus petit élément constitutif de toute matière, y compris les choses que nous ne pouvons pas toujours voir, comme les gaz. Toutefois, même un petit atome est composé de particules encore plus petites qui composent sa structure [1] .
- L'atome est composé de neutrons, de protons et d'électrons. Le centre de l'atome est appelé le noyau, et celui-ci est composé de neutrons et de protons. Les électrons sont les particules qui gravitent tout autour de l'atome, tout comme les planètes tournent autour du soleil [2] .
- La taille d'un atome est incroyablement petite, mais pour vous donner une comparaison, essayez de penser au plus grand stade que vous connaissez. Si vous considérez ce stade comme un atome, le noyau serait aussi gros qu'un pois placé au centre du terrain [3] .
-
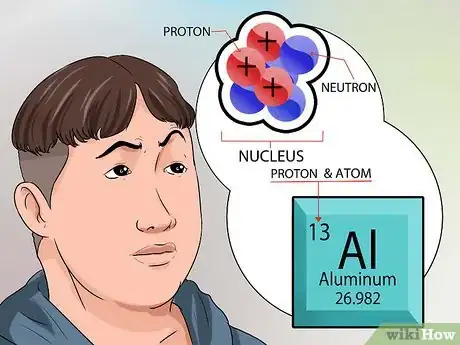
3Comprenez la structure atomique d'un élément. Le terme élément est défini comme une substance à l'état naturel qui ne peut être décomposé en d'autres éléments de base et qui se présente sous sa forme la plus simple. Les éléments sont constitués d'atomes [4] .
- Les atomes présents dans un élément sont tous les mêmes. Cela signifie que chaque élément, dans sa structure atomique, a un nombre connu et unique de neutrons et de protons [5] .
-
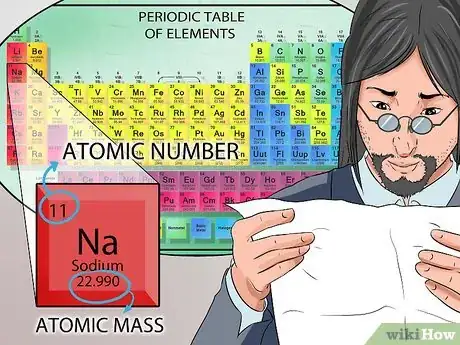
4Apprenez-en plus sur le noyau. Les neutrons, qui se trouvent dans le noyau, ont une charge électrique neutre. Les protons, par contre, ont une charge positive. Le numéro atomique d'un élément correspond exactement au nombre de protons présent dans son noyau [6] .
- Vous n'avez pas besoin de faire un calcul mathématique pour connaitre le nombre de protons d'un élément. Cette valeur est indiquée en haut de chaque case de chaque élément du tableau périodique.
-
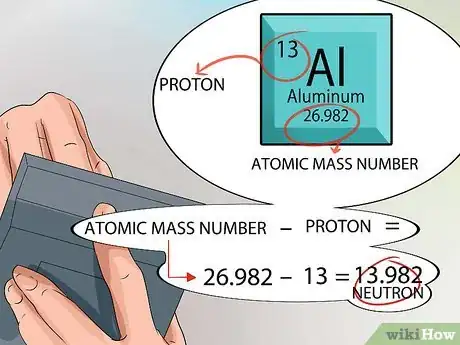
5Calculez le nombre de neutrons dans le noyau. Vous pouvez vous servir des informations fournies dans le tableau périodique à cette fin. Le numéro atomique de chaque élément est égal au nombre de protons dans le noyau.
- La masse atomique est indiquée dans chaque case du tableau périodique et se trouve en bas, juste sous le nom de l'élément.
- Souvenez-vous que seuls les protons et les neutrons se trouvent dans le noyau. Avec le tableau périodique, vous pouvez connaitre le nombre de protons et la masse atomique d'un élément chimique.
- À ce stade, le calcul est assez simple. Soustrayez simplement le nombre de protons de la masse atomique pour trouver le nombre de neutrons se trouvant dans le noyau de l'atome de cet élément [7] .
-
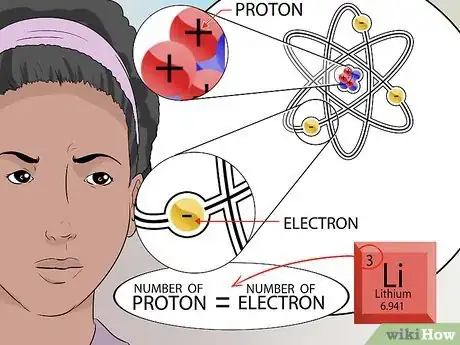
6Déterminez le nombre d'électrons. Souvenez-vous que les éléments opposés s'attirent. Les électrons sont des particules chargées négativement qui gravitent autour du noyau, tout comme les planètes gravitent autour du soleil. Le nombre d'électrons (avec une charge négative) attirés par le noyau dépend du nombre de protons (avec une charge positive) présents dans ce dernier.
- Étant donné que l'atome a une charge totale nulle, toutes les charges positives et négatives doivent être équilibrées. Pour cette raison, le nombre d'électrons est égal au nombre de protons [8] .
-
7Observez le tableau périodique. Si vous avez du mal à comprendre les propriétés des éléments chimiques, prenez le temps de passer en revue toutes les informations disponibles sur le tableau périodique. Plus important encore, étudiez attentivement le tableau.
- Comprendre ce tableau est essentiel pour réussir la première partie de votre cours de chimie.
- Le tableau périodique se compose uniquement d'éléments. Chacun d'eux est représenté par un ou deux symboles. Le symbole identifie l'élément de façon univoque. Par exemple, le symbole Na désigne toujours l'atome de sodium. Le nom complet de l'élément chimique est généralement écrit sous le symbole [9] .
- Le numéro atomique d'un symbole est représenté par le nombre imprimé au-dessus de celui-ci. Le nombre atomique est égal au nombre de protons dans le noyau [10] .
- Le nombre inscrit sous le symbole correspond à la masse atomique. N'oubliez pas ceci : le nombre de masse d'un atome est égal à la somme des protons et des neutrons contenus dans le noyau [11] .
-
8Interprétez le tableau périodique. Il y a beaucoup d'informations dans le tableau périodique, notamment les couleurs de chaque colonne et l'emplacement des éléments de gauche à droite et de haut en bas.Publicité
Partie 3
Partie 3 sur 5:Prédire les réactions chimiques
-
1Équilibrez une équation chimique. En chimie, vous devrez prédire comment les éléments réagissent les uns aux autres. En d'autres termes, vous devez être capable d'équilibrer une réaction chimique [12] .
- Dans une équation chimique, les réactifs sont situés à gauche, suivis d'une flèche pointant vers la droite indiquant les produits de réaction. Et les éléments de chaque côté de l'équation doivent être équilibrés [13] .
- Par exemple, Réactif 1 + Réactif 2 → Produit 1 + Produit 2.
- Voici un exemple avec les symboles de l'étain, dont le symbole est Sn. Associons le dioxyde d'étain (SnO2) à l'hydrogène sous forme gazeuse (H2). L'équation est SnO2 + H2 → Sn + H2O.
- Cependant, cette équation n'est pas équilibrée, étant donné que la quantité de réactifs n'est pas égale à celle des produits. Il y a un atome d'oxygène de plus sur le côté gauche que sur le côté droit de la réaction [14] .
- En utilisant des calculs mathématiques simples, vous pouvez équilibrer l'équation en plaçant deux unités d'hydrogène à gauche et deux molécules d'eau à droite. La réaction une fois équilibrée sera : SnO2 + 2 H2 → Sn + 2 H2O [15] .
-
2Pensez aux équations différemment. Si vous avez du mal à équilibrer les réactions chimiques, imaginez qu'elles font partie d'une recette, mais que vous devez faire des ajustements de sorte à obtenir plus ou moins le produit final de la recette.
- L'équation vous fournit les ingrédients du côté gauche de l'équation, mais ne vous donne pas des informations sur les doses. Cependant, l'équation vous permet de savoir ce que vous allez obtenir en tant que produit, en omettant toujours les quantités. Et vous devrez les trouver.
- En utilisant toujours l'exemple ci-dessus (celui de SnO2 + H2 → Sn + H2O), examinez pourquoi cette réaction (ou la formule de la recette) ne fonctionne pas. Les quantités d'étain (Sn) des deux côtés de l'équation sont égales, tout comme les quantités de dihydrogène (H2). Cependant, à gauche nous avons 2 atomes d'oxygène et à droite 1 seul.
- Changez le côté droit de l'équation pour indiquer qu'il y a deux molécules de H2O (2 H2O). Le chiffre 2 devant H2O signifie que tous les atomes de cette molécule sont maintenant doublés. À présent, les quantités d'oxygène sont équilibrées, mais pas celles de l'hydrogène, car à droite il y a plus d'hydrogène que sur la gauche. Pour cette raison, il faut donc revenir au côté gauche de l'équation. Modifiez les quantités de l'ingrédient H2 et doublez-les en plaçant un coefficient 2 devant H2.
- Et voilà, vous venez d'équilibrer toutes les doses d'ingrédients des deux côtés de l'équation. Les ingrédients de votre recette sont les mêmes (donc équilibrés) que les produits obtenus.
-
3Ajoutez plus de détails aux équations équilibrées. En chimie, vous apprendrez à ajouter des symboles représentant l'état physique des éléments. La lettre s symbolise les matières solides, la lettre g est utilisée pour les gaz et la lettre l représente les liquides [16] .
-
4Identifiez les changements qui se produisent lors d'une réaction. Les réactions chimiques affectent d'abord les éléments de base ou les éléments déjà combinés appelés réactifs. La combinaison de deux ou plusieurs réactifs, conduit à un ou plusieurs produits.
- Pour réussir un examen de chimie, vous devez être capable de résoudre des équations qui impliquent des réactifs, des produits et de prendre en compte d'autres facteurs qui influencent leur comportement [17] .
-
5Étudiez les différents types de réactions. Les réactions chimiques se produisent à cause d'un certain nombre de facteurs qui vont au-delà de la simple combinaison d'ingrédients.
- Les réactions typiques qui sont étudiées en chimie et que vous devez connaitre sont les suivantes : les réactions de synthèse, de substitution, les réactions acidobasiques, d'oxydoréduction, de combustion, d'hydrolyse, de décomposition, de métathèse et d'isomérisation [18] .
- Pendant le cours de chimie, votre professeur pourrait aussi présenter d'autres types de réactions selon le programme. Évidemment, le programme de chimie au lycée ne sera pas aussi détaillé que le programme enseigné à l'université.
-
6Utilisez toutes les ressources mises à votre disposition. Vous devez être capable de reconnaitre les différences dans chaque type de réactions qui ont été abordées en classe. Utilisez toutes les ressources d'étude dont vous disposez pour comprendre ces concepts et n'hésitez pas à poser des questions en classe.
- Les différences entre les réactions peuvent parfois créer une certaine confusion chez l'apprenant et comprendre les divers mécanismes se produisant lors d'une réaction chimique pourrait être la partie la plus complexe de tout le cours.
-
7Comprenez les réactions chimiques de façon logique. Ne rendez pas le processus plus compliqué qu'il ne l'est déjà en vous laissant embrouiller par les termes généraux. Dans toutes les réactions que vous étudierez, vous devez juste transformer quelque chose en quelque chose d'autre.
- Par exemple, vous savez déjà qu'en combinant deux molécules d'hydrogène avec une molécule d'oxygène, vous obtenez de l'eau. Par conséquent, si vous versez de l'eau dans une casserole et que vous la mettez sur le feu, quelque chose changera. Vous avez créé en fait une réaction chimique. Si vous mettez de l'eau dans le congélateur, quelque chose va aussi se produire. Pour faire court, vous avez introduit un facteur qui modifie l'état du réactif initial et dans notre cas il s'agit de l'eau.
- Réécrivez chaque catégorie de réaction un à une jusqu'à ce que vous la maitrisiez, puis passez à la suivante. Mettez l'accent sur la source d'énergie qui déclenche la réaction et les principaux changements qui se produisent.
- Si vous n'arrivez pas à comprendre ces concepts, dressez une liste de tout ce que vous ne comprenez pas et discutez-en avec votre professeur, avec votre groupe d'étude ou avec une personne qui est plutôt douée en chimie.
Publicité
Partie 4
Partie 4 sur 5:Appliquer la mathématique en chimie
-
1Apprenez la séquence des calculs de base. En chimie, des calculs parfois très détaillés sont nécessaires, mais d'autres fois, des opérations élémentaires sont suffisantes. Cependant, il est essentiel de connaitre la séquence exacte des opérations afin de compléter et résoudre les équations [19] .
- Mémorisez un acronyme tout à fait simple. Les élèves utilisent des phrases différentes pour mémoriser certains concepts et l'ordre des opérations mathématiques ne fait pas exception. Avec l'acronyme PEMDAS (qui dérive de la phrase Peut-Etre Mon Dernier AS), vous pourrez facilement vous rappeler dans quel ordre effectuer les opérations mathématiques. La première lettre de chaque mot indique l'ordre de chaque opération. Tout d'abord, faites tout ce qui se trouve dans les Parenthèses, puis les Exposants, les Multiplications, les Divisions, les Additions et enfin les Soustractions.
- Effectuez les calculs de cette expression 3 + 2 x 2 x 6 = ___, en suivant l'ordre des opérations indiqué par l'acronyme PEMDAS. La solution est 15.
-
2Apprenez à arrondir de très grandes valeurs. Bien que le fait d'arrondir des chiffres ne soit pas très courant en chimie, parfois la solution à certaines équations mathématiques complexes est trop longue à écrire. Lisez attentivement les instructions des exercices que vous traitez pour savoir si vous devez arrondir vos réponses ou non [20] .
- Apprenez quand vous devez arrondir au chiffre supérieur ou au chiffre inférieur. Dans une séquence numérique, si le chiffre suivant est inférieur ou égal à 4, arrondissez au chiffre inférieur. Et s'il est supérieur ou égal à 5, arrondissez au chiffre supérieur. Prenons l'exemple de ce nombre 6,66 666 666 666 666. Supposons que vous devez l'arrondir à la deuxième décimale. La réponse sera 6,67 [21] .
-
3Comprenez la notion de valeur absolue. En chimie, certains nombres sont désignés comme étant des valeurs absolues et non des valeurs mathématiques réelles. La valeur absolue d'un réel x est la distance entre ce nombre x et zéro.
- En d'autres termes, vous ne devez plus tenir compte du signe du nombre (positif ou négatif), mais plutôt de sa distance à zéro. À titre d'exemple, la valeur absolue de -20 est égale à 20 [22] .
-
4Familiarisez-vous avec les unités de mesure acceptées. En voici quelques exemples.
- La quantité de matière est exprimée en moles (mol).
- La température est exprimée en degrés Celsius (°C), Fahrenheit (°F) ou en Kelvin (°K).
- La masse s'exprime en grammes (g), kilogrammes (kg) ou milligrammes (mg).
- Le volume et les liquides sont exprimés en litres (l) ou millilitres (ml).
-
5Apprenez à convertir des valeurs d'une échelle de mesure à une autre. Pour réussir votre examen de chimie, vous devrez être capable de faire quelques conversions d'une échelle acceptée à une autre. Par exemple, vous devrez pouvoir passer d'une mesure de température à une autre, convertir des kilogrammes en livres ou des litres en onces liquides.
- Parfois, on vous demandera d'exprimer la solution d'un problème dans une unité de mesure différente de l'unité initiale. Par exemple, supposons que vous devez résoudre une équation de température dont les valeurs sont en Celsius, mais que votre réponse finale doit être en Kelvin.
- Le Kelvin est la norme internationale pour les mesures de température fréquemment utilisées dans les réactions chimiques. Entrainez-vous à passer des degrés Celsius aux degrés Kelvin ou aux degrés Fahrenheit.
-
6Consacrez du temps à faire des exercices. Au fur et à mesure que vous étudiez plusieurs notions en classe, prenez le temps d'apprendre à convertir les unités de mesure d'un système à un autre.
-
7Apprenez à calculer les concentrations. Approfondissez vos connaissances de base en calcul sur les pourcentages, les proportions et les ratios.
-
8Entrainez-vous avec les étiquettes nutritionnelles. Pour réussir votre examen de chimie, vous devriez pouvoir faire facilement les calculs de ratios, de pourcentages, de proportions ainsi que leurs opérations inverses. Si vous ne comprenez pas bien ces concepts, vous devez alors vous entrainer avec d'autres unités de mesure qui sont assez courantes, comme celles qui figurent sur les étiquettes nutritionnelles.
- Consultez l'étiquette nutritionnelle de tout produit alimentaire. Vous y trouverez les calories par portion, le pourcentage des apports journaliers recommandés, la teneur en matière grasse totale, le pourcentage de calories en gras, la teneur en glucides totale et la répartition des différents types de glucides. Apprenez à calculer différents pourcentages à partir des valeurs de différentes catégories comme dénominateurs.
- Par exemple, calculez la quantité de gras mono-insaturé par rapport à la quantité totale de gras d'un produit. Convertissez la valeur en pourcentage. Calculez le nombre de calories que renferme le produit en utilisant le nombre de calories par portion et la quantité de portions contenues dans l'emballage. Calculez la quantité de sodium présente dans la moitié du produit emballé.
- En vous entrainant avec de telles conversions, quelle que soit l'unité de mesure utilisée, vous pourrez facilement convertir des unités de mesure en grandeurs chimiques comme la mole par litre, le gramme par mole et ainsi de suite.
-
9Apprenez à utiliser le nombre d'Avogadro. Cette constante représente le nombre de molécules, d'atomes ou de particules contenu dans une mole. Le nombre d'Avogadro est égal à 6 022 x 1023.
- Par exemple, combien d'atomes y a-t-il dans 0,450 mole de Fe ? La réponse est 0,450 x 6 022 x 1 023.
-
10Pensez aux carottes. Si vous avez du mal à appliquer le nombre d'Avogadro dans les problèmes de chimie, pensez à des carottes plutôt qu'à des atomes, des molécules ou des particules. Combien de carottes y a-t-il dans une douzaine ? Une douzaine comprend 12 éléments, donc forcément, il y a 12 carottes dans une douzaine.
- Maintenant, essayez de répondre à cette question : combien y a-t-il de carottes dans une mole ? Au lieu de faire une multiplication par 12, utilisez le nombre d'Avogadro. Il y a donc 6 022 x 1 023 carottes dans une mole.
- Le nombre d'Avogadro est utilisé pour convertir la quantité chimique (le nombre de moles) en nombre d'objets (un atome, une molécule, une particule ou une carotte).
- Si vous connaissez le nombre de moles d'un élément, vous pouvez connaitre le nombre de molécules, d'atomes ou de particules présents dans cette quantité de matière en multipliant la constante d'Avogadro par le nombre de moles en question.
- Il est important de comprendre à convertir les particules en mole pour réussir votre examen en chimie. Pour pouvoir calculer des ratios et des pourcentages, vous devez faire des conversions molaires. En d'autres termes, vous devez connaitre la quantité d'un élément exprimée en mole par rapport à une autre unité.
-
11Efforcez-vous de comprendre la notion de molarité. Considérez le nombre de moles d'une substance dissoute dans un milieu liquide. Il s'agit d'un exemple très important à comprendre, car il s'agit de la molarité, c'est-à-dire la proportion d'une espèce chimique exprimée en moles par litre.
- En chimie, la molarité est utilisée pour exprimer la quantité d'une substance contenue dans un milieu liquide ou la quantité de soluté contenue dans une solution liquide. Vous pouvez calculer la molarité en divisant le nombre de moles d'un soluté par le volume de la solution en litres. Son unité de mesure est la mole par litre (mol/l) [23] .
- Calculez la densité. La densité est également une mesure couramment utilisée en chimie. Elle exprime la masse par unité de volume d'une substance chimique. L'unité de mesure la plus courante ici est le gramme par litre (g/l) ou le gramme par centimètre cube (g/cm3) [24] .
-
12Réduisez les équations à leur formule empirique. Autrement dit, les solutions finales de vos équations seront considérées comme erronées si vous ne les réduisiez pas à leur forme la plus simple [25] .
- Ceci ne s'applique pas aux formules moléculaires puisque ce type de descriptions indique les proportions exactes entre les éléments chimiques qui constituent la molécule [26] .
-
13Comprenez la notion de formule moléculaire. Vous n'avez pas besoin de réduire une formule moléculaire à sa forme la plus simple ou empirique, car elle exprime exactement la composition de la molécule.
- Écrire la formule moléculaire d'un corps revient à utiliser les abréviations des éléments chimiques ainsi que le nombre d'atomes de chaque élément dans la molécule.
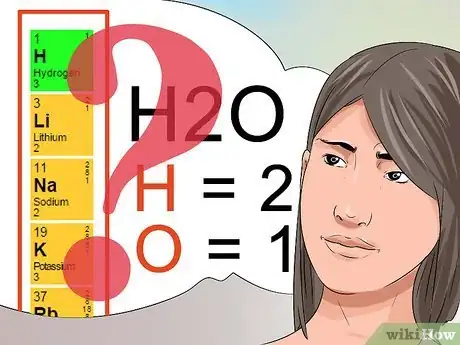
- Supposons la formule moléculaire de l'eau, H2O. Chaque molécule d'eau est formée de deux atomes d'hydrogène et d'un atome d'oxygène. Essayez de faire la même chose avec la formule moléculaire du paracétamol, C8H9NO2. En fait, tous les composés chimiques sont représentés par leurs formules moléculaires.
-
14Apprenez-en plus sur la stœchiométrie. Vous allez sans doute rencontrer ce terme. La stœchiométrie est l'étude des proportions quantitatives des réactions chimiques à l'aide de formules mathématiques. En stœchiométrie (mathématiques appliquées à la chimie), les valeurs des éléments et des composés chimiques sont habituellement représentées en moles, en pourcentages molaires, en moles par litre ou en moles par kilogramme [27] .
- L'une des opérations mathématiques les plus courantes que vous ferez est de convertir les grammes en moles. L'unité de masse atomique d'un élément, habituellement exprimée en grammes, correspond à une mole de cette substance. Par exemple, la masse de l'atome de calcium est de 40 unités de masse atomique. Ainsi, 40 g de calcium équivaut à une mole de calcium [28] .
-
15Demandez des exercices supplémentaires au professeur. Si les équations mathématiques et les conversions vous posent problème, parlez-en au professeur. Demandez-lui de vous donner plus d'exercices à faire vous-même, jusqu'à ce que vous compreniez clairement tous les concepts utilisés.Publicité
Partie 5
Partie 5 sur 5:Utiliser le langage de la chimie
-
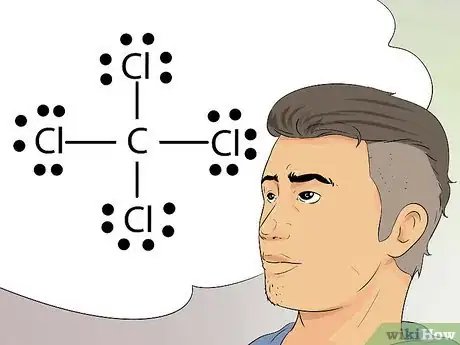
1Reconnaissez les structures de Lewis. Ces structures, aussi appelées formules de Lewis, sont des représentations graphiques qui consistent à utiliser des points pour représenter les électrons groupés et les électrons célibataires dans la couche externe d'un atome [29] .
- Ces structures sont très utiles pour dessiner des diagrammes simples et identifier les liaisons, comme les liaisons covalentes, que partagent plusieurs éléments dans un atome ou dans une molécule [30] .
-
2Apprenez la règle de l'octet. Les structures de Lewis sont basées sur cette règle, qui stipule que les atomes sont stables lorsque leur couche externe contient exactement 8 électrons. Faisant exception à cette règle, l'hydrogène est considéré comme stable avec 2 électrons sur sa couche externe [31] .
-
3Dessinez une structure de Lewis. Cette structure est représentée par le symbole d'un élément entouré d'une série de points. Imaginez qu'il s'agit d'une image fixe capturée d'un film. Au lieu que les électrons gravitent autour du noyau, on représente leur position à un moment donné dans le temps [32] .
- La structure de Lewis permet de visualiser la disposition la plus stable des électrons, les emplacements de leur connexion à un autre élément chimique. Elle fournit également des informations sur la résistance des liaisons (par exemple, si elles sont covalentes ou doubles).
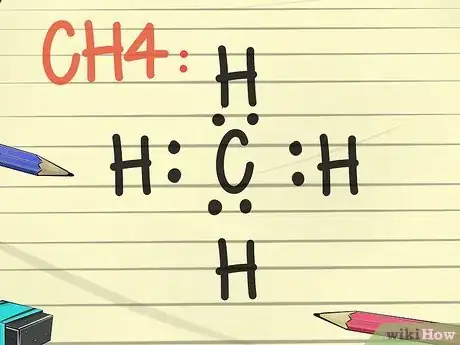
- Essayez de dessiner la structure de Lewis du carbone (C) en tenant compte de la règle des octets. Placez maintenant 2 points de chaque côté de l'atome (en haut, en bas, à gauche et à droite). Écrivez maintenant un H, symbole de l'atome d'hydrogène, de l'autre côté de chaque pair de points. Cette structure de Lewis représente un atome de carbone entouré de quatre atomes d'hydrogène. Lorsque des électrons sont reliés par une liaison covalente, cela signifie que le carbone partage un électron avec chaque atome d'hydrogène et cela s'applique également à l'hydrogène [33] .
- La formule moléculaire de cet exemple est CH4, celle du méthane.
-
4Apprenez à disposer les électrons en fonction de leur liaison. Les structures de Lewis sont une représentation visuelle simpliste des liaisons chimiques.
- Si vous ne comprenez pas bien certains concepts à propos des liaisons chimiques et des formules de Lewis, discutez-en avec votre professeur ou votre groupe d'étude.
-
5Apprenez à nommer les composés. La chimie a ses propres règles en matière de nomenclature. Les types de réactions qui se produisent avec un composé, la perte ou l'ajout d'électrons sur la couche externe et la stabilité ou l'instabilité d'un composé sont des facteurs qui permettent de nommer un composé chimique.
-
6Ne sous-estimez pas la nomenclature en chimie. Dans la plupart des cas, les premiers chapitres en chimie portent principalement sur la nomenclature. Souvent, les erreurs d'identification des composés chimiques peuvent vous faire échouer à l'examen.
- Si possible, apprenez à nommer les composés chimiques avant de commencer votre cours. Vous pouvez acheter un guide ou consultez des ressources en ligne.
-
7Comprenez la signification des nombres en exposant et en indice. Il est important de comprendre ce que ces nombres signifient si vous voulez réussir votre examen [34] .
- Les nombres placés en exposant suivent un schéma qui figure dans le tableau périodique et indiquent la charge totale de l'élément chimique ou du composé chimique. Reprenez le tableau périodique et vous verrez que les éléments disposés le long de la même colonne verticale (groupe) partagent les mêmes nombres en exposant.
- Les nombres placés en indices sont utilisés pour déterminer la quantité de chaque élément identifié comme faisant partie d'un composé chimique. Comme mentionné plus haut, l'indice 2 de la molécule H2O indique qu'il y a deux atomes d'hydrogène.
-
8Découvrez comment les atomes réagissent entre eux. Une partie de la nomenclature utilisée en chimie comprend des règles spécifiques sur la dénomination des produits issus de certains types de réactions [35] .
- L'une de ces réactions est la réaction d'oxydoréduction. Il s'agit d'une réaction au cours de laquelle des électrons sont acquis ou perdus.
- Pour vous souvenir du mécanisme qui a lieu pendant une réaction d'oxydoréduction, mémorisez l'acronyme RROO. C'est un moyen simple de retenir que le Réducteur Rend des électrons alors que l'Oxydant en Obtient [36] .
-
9Utilisez les nombres en indices pour obtenir une molécule neutre. Les scientifiques utilisent des indices pour identifier la formule moléculaire définitive d'un composé, et cela indique également qu'un composé est stable avec une charge neutre.
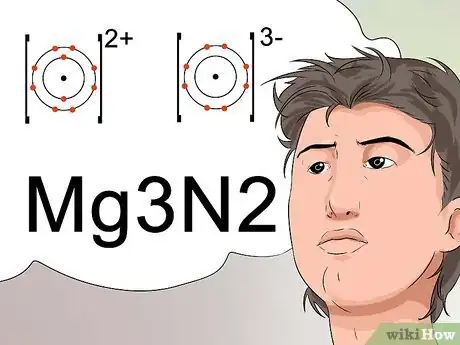
- Pour arriver à une configuration électronique stable, l'ion positif (cation) doit être compensé par un ion négatif (anion) d'intensité égale. Les exposants représentent les charges [37] .
- Par exemple, l'ion magnésium porte une charge positive de +2 et l'ion azote a une charge négative de -3. Les chiffres +2 et -3 devraient être placés en exposants. Pour combiner les deux éléments de façon appropriée afin d'obtenir une molécule neutre, il faudra utiliser 3 atomes de magnésium pour les 2 atomes d'azote [38] .
- La molécule obtenue est donc Mg3N2 [39] .
-
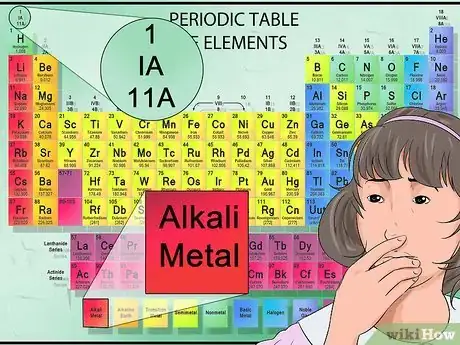
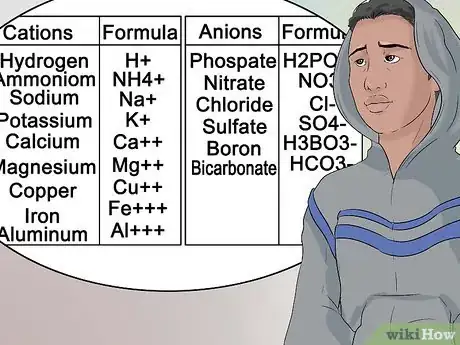
10Identifiez les anions et cations à partir de leur position. Dans le tableau périodique, les éléments appartenant au premier groupe sont considérés comme des métaux alcalins et ont une charge positive de +1. Le sodium (Na+) et le lithium (Li+) en sont des exemples [40] .
- Les métaux alcalinoterreux font partie du deuxième groupe et forment des cations 2+, tels que le magnésium (Mg2+) et le baryum (Ba2+) [41] .
- Les éléments chimiques appartenant à la septième colonne de la classification périodique constituent la famille des halogènes et forment des anions avec une charge négative -1 comme le chlore (Cl-) et l'iode (I-) [42] .
-
11Reconnaissez les cations et anions les plus courants. Pour réussir votre examen de chimie, vous devrez connaitre le mieux possible la nomenclature des groupes d'éléments pour lesquels les nombres en exposant ne changent pas [43] .
- En d'autres termes, le magnésium est toujours représenté par Mg et a toujours une charge positive +2 [44] .
-
12Essayez de ne pas vous submerger d'informations. Il n'est pas facile de comprendre et de se souvenir de toutes les informations détaillées sur les différentes réactions chimiques, les échanges d'électrons et le changement de charge électrique d'un élément ou d'un composé.
- Exprimez les sujets que vous ne comprenez pas avec des termes descriptifs. Par exemple, si vous ne comprenez pas les réactions d'oxydation ou la façon dont les éléments se combinent avec des charges négatives et positives, dites-le. En exprimant clairement les concepts et les notions qui vous posent problème, vous pourriez remarquer que vous maitrisez beaucoup de choses.
-
13Rencontrez régulièrement votre professeur. Créez une liste de sujets que vous ne comprenez pas et demandez de l'aide à votre professeur. C'est une occasion d'assimiler des concepts complexes avant que vous n'abordiez en classe des notions encore plus compliquées et difficiles à comprendre.
-
14Dites-vous que vous apprenez une nouvelle langue. Comprenez que les formules écrites pour indiquer les charges, le nombre d'atomes dans une molécule et les liaisons formées entre les molécules font partie du langage de la chimie. C'est une façon de représenter graphiquement et par écrit les différentes transformations ayant lieu lors d'une réaction chimique, que nous ne pouvons pas voir.
- Il serait beaucoup plus facile de comprendre la chimie si tous les mécanismes pouvaient être observés à l'œil nu. Cependant, vous devez vous efforcer de comprendre la terminologie utilisée en chimie pour décrire les phénomènes, ainsi que les mécanismes des réactions.
- Si vous avez de la difficulté à comprendre le cours de chimie, sachez que vous n'êtes pas seul. Toutefois, ne vous laissez pas abattre. Discutez avec votre professeur, étudiez en groupe, contactez l'assistant de votre enseignant ou demandez de l'aide à une personne qui est vraiment douée en chimie. Vous pouvez apprendre tout le cours, mais il serait bien de demander de l'aide pour que l'on puisse vous l'expliquer afin de mieux comprendre certains chapitres.
Publicité
Conseils
- Assurez-vous de vous reposer suffisamment et de vous distraire. Le fait de penser à autre chose que vos cours de chimie peut vous permettre d'avoir les idées plus claires lorsque vous reprenez vos cahiers.
- Dormez bien la veille de l'examen. Si vous vous reposez bien, vos capacités de mémorisation et de résoudre des problèmes fonctionneront mieux.
- Passez en revue les sujets que vous maitrisez. Les différents concepts en chimie sont interdépendants et vous devez bien maitriser les notions élémentaires avant de passer aux notions suivantes. Cependant, vous devez bien mémoriser ce que vous avez appris si vous ne voulez pas être surpris par une question pendant l'examen.
- Préparez-vous bien avec les cours. Lisez tout le matériel et faites vos devoirs. Vous serez à la traine si vous ne comprenez pas ce qui est expliqué en classe et que votre professeur passe à des sujets de plus en plus complexes.
- Organisez votre temps selon vos priorités. Si vous avez vraiment du mal à comprendre le cours de chimie, consacrez-y plus de temps pendant vos heures de révisions, mais ne vous laissez pas submerger. Toutefois, n'oubliez pas qu'il y a d'autres matières que vous devriez réviser.
Références
- ↑ http://www.shodor.org/unchem/basic/atom/index.html
- ↑ http://www.shodor.org/unchem/basic/atom/index.html
- ↑ http://www.shodor.org/unchem/basic/atom/index.html
- ↑ http://www.shodor.org/unchem/basic/atom/index.html
- ↑ http://www.shodor.org/unchem/basic/atom/index.html
- ↑ http://www.shodor.org/unchem/basic/atom/index.html
- ↑ http://www.shodor.org/unchem/basic/atom/index.html
- ↑ http://www.shodor.org/unchem/basic/atom/index.html
- ↑ https://www.classzone.com/books/earth_science/terc/content/investigations/es0501/es0501page06.cfm
- ↑ https://www.classzone.com/books/earth_science/terc/content/investigations/es0501/es0501page06.cfm
- ↑ https://www.classzone.com/books/earth_science/terc/content/investigations/es0501/es0501page06.cfm
- ↑ http://www.shodor.org/unchem/basic/chemreac/index.html
- ↑ http://www.shodor.org/unchem/basic/chemreac/index.html
- ↑ http://www.shodor.org/unchem/basic/chemreac/index.html
- ↑ http://www.shodor.org/unchem/basic/chemreac/index.html
- ↑ http://www.shodor.org/unchem/basic/chemreac/index.html
- ↑ http://www.shodor.org/unchem/basic/chemreac/index.html
- ↑ http://www.shodor.org/unchem/basic/chemreac/index.html
- ↑ http://www.shodor.org/unchem/math/numbers/index.html
- ↑ http://www.shodor.org/unchem/math/numbers/index.html
- ↑ http://www.shodor.org/unchem/math/numbers/index.html
- ↑ http://www.shodor.org/unchem/math/numbers/index.html
- ↑ http://www.shodor.org/unchem/basic/stoic/index.html
- ↑ http://www.shodor.org/unchem/basic/stoic/index.html
- ↑ http://www.shodor.org/unchem/math/numbers/index.html
- ↑ http://www.shodor.org/unchem/math/numbers/index.html
- ↑ http://www.shodor.org/unchem/basic/stoic/index.html
- ↑ http://www.shodor.org/unchem/basic/stoic/index.html
- ↑ http://www.shodor.org/unchem/basic/lewis/index.html
- ↑ http://www.shodor.org/unchem/basic/lewis/index.html
- ↑ http://www.shodor.org/unchem/basic/lewis/index.html
- ↑ http://www.shodor.org/unchem/basic/lewis/index.html
- ↑ http://www.shodor.org/unchem/basic/lewis/index.html
- ↑ http://www.shodor.org/unchem/basic/nomen/index.html
- ↑ http://www.shodor.org/unchem/basic/nomen/index.html
- ↑ http://www.shodor.org/unchem/basic/nomen/index.html
- ↑ http://www.shodor.org/unchem/basic/nomen/index.html
- ↑ http://www.shodor.org/unchem/basic/nomen/index.html
- ↑ http://www.shodor.org/unchem/basic/nomen/index.html
- ↑ http://www.shodor.org/unchem/basic/nomen/index.html
- ↑ http://www.shodor.org/unchem/basic/nomen/index.html
- ↑ http://www.shodor.org/unchem/basic/nomen/index.html
- ↑ http://www.shodor.org/unchem/basic/nomen/index.html
- ↑ http://www.shodor.org/unchem/basic/nomen/index.html