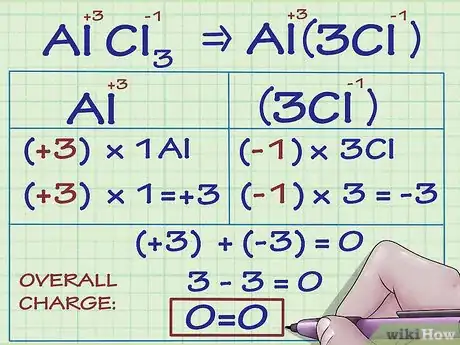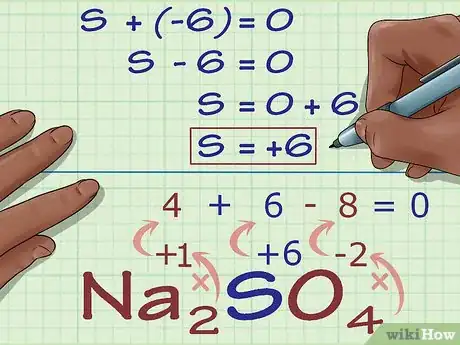wikiHow est un wiki, ce qui veut dire que de nombreux articles sont rédigés par plusieurs auteurs(es). Pour créer cet article, 13 personnes, certaines anonymes, ont participé à son édition et à son amélioration au fil du temps.
Cet article a été consulté 69 856 fois.
En chimie, les termes « oxydation » et « réduction » se réfèrent aux réactions au cours desquelles un atome (ou groupe d'atomes) perd ou gagne des électrons, respectivement. On appelle nombres d'oxydation des nombres assignés aux atomes (ou groupes d'atomes) et qui aident les chimistes à savoir combien d'électrons peuvent être transférés et si un réactif subit une oxydation ou une réduction au cours d'une réaction. Le processus par lequel on assigne un nombre d'oxydation aux atomes peut être simple à très compliqué en fonction de la charge des atomes et de la composition chimiques des molécules auxquelles ils appartiennent. Pour compliquer encore les choses, certains atomes peuvent avoir plus de deux nombres d'oxydation. Heureusement, la détermination du nombre d'oxydation est régie par des règles bien définies et faciles à mettre en œuvre, bien qu'il puisse être utile de posséder des connaissances en chimie et en algèbre.
Étapes
Partie 1
Partie 1 sur 2:Déterminer les nombres d'oxydation à partir de règles de chimie
-
1Identifiez si le produit sur lequel vous travaillez est un atome élémentaire. Le nombre d'oxydation des atomes élémentaires, libres et non combinés à d'autres éléments, est toujours de 0. Ceci est vrai pour les atomes dont la forme élémentaire est composée de ce simple atome, mais aussi pour les atomes dont la forme élémentaire est diatomique ou polyatomique.
- Par exemple, Al(s) et Cl2 possèdent tous les deux des nombres d'oxydation de 0, car ils sont sous forme élémentaire, non combinée.
- Notez que la forme élémentaire du souffre, S8 ou octasoufre, bien qu'irrégulier, possède aussi un nombre d'oxydation de 0.
-
2Identifiez si le produit en question est sous forme ionisée. Le nombre d'oxydation des ions est égal à leur charge. Ceci est vrai pour les ions qui ne sont pas liés à d'autres éléments, mais aussi pour les ions qui font partie d'un composé ionique.
- Par exemple, le nombre d'oxydation de l'ion Cl- est de -1.
- L'ion Cl possède toujours un nombre d'oxydation de -1 lorsqu'il fait partie du composé NaCl. Parce que la charge de l'ion Na, par définition, est de +1, nous savons que la charge de l'ion Cl est de -1. Ainsi, son nombre d'oxydation est toujours de -1.
-
3Pour les ions métalliques, il peut exister plusieurs nombres d'oxydation. De nombreux éléments métalliques possèdent plus d'une charge. Par exemple, le fer (Fe) peut être sous forme ionisée avec une charge de +2 ou +3 [1] . Les charges des ions métalliques (et donc leurs nombres d'oxydation) peuvent être déterminées en fonction des charges des autres atomes du composé dont ils font partie ou alors en utilisant les nombres romains lorsque l'information est écrite sous forme de texte (comme dans la phrase : « La charge de l'ion fer(III) est de +3 »).
- Prenons l'exemple d'un composé contenant l'ion métallique aluminium. Le composé AlCl3 possède une charge globale de 0. Nous savons que les ions Cl- possèdent une charge de -1 et qu'ils sont au nombre de 3 dans le composé, donc l'ion Al doit avoir une charge de +3 de sorte que la charge globale de tous les ions soit égale à 0. Donc, le nombre d'oxydation de Al est de +3.
-
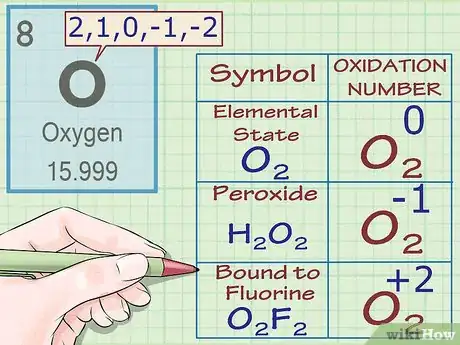
4Assignez à l'oxygène un nombre d'oxydation de -2 (sauf exceptions). Dans la plupart des cas, les atomes d'oxygène possèdent un nombre d'oxydation de -2. Il existe toutefois quelques exceptions à cette règle.
- Lorsque l'oxygène est à l'état élémentaire (O2), son nombre d'oxydation est de 0, comme c'est le cas pour tous les atomes élémentaires.
- Lorsque l'oxygène fait partie d'un peroxyde, alors son numéro d'oxydation est de -1. Les peroxydes sont une classe de composés qui possèdent une liaison simple oxygène-oxygène (ou anion peroxyde O2-2). Par exemple, dans la molécule d'H2O2 (peroxyde d'hydrogène), le nombre d'oxydation de l'oxygène (et sa charge) est de -1.
- Lorsque l'oxygène est lié au fluor, son nombre d'oxydation est de +2. Pour plus d'informations, lisez les règles pour le fluor dans la suite de cet article.
-
5Assignez un nombre d'oxydation de +1 à l'hydrogène (sauf exceptions). Comme pour l'oxygène, le nombre d'oxydation de l'hydrogène est soumis à des cas exceptionnels. En général, le nombre d'oxydation de l'hydrogène est de +1 (à moins, encore une fois, qu'il ne soit sous sa forme élémentaire, H2). Toutefois, dans le cas de composés spéciaux dits hybrides, l'hydrogène possède un nombre d'oxydation de -1.
- Par exemple, dans la molécule d'H2O, nous savons que l'hydrogène possède un nombre d'oxydation de +1 parce que l'oxygène possède une charge de -2 et que nous avons besoin de 2 +1 charges pour que la charge globale du composé soit égale à 0. Toutefois, dans la forme hybride de la soude, NaH, l'hydrogène possède un nombre d'oxydation de -1, car les ions Na possèdent une charge de +1 ; donc, pour que la charge totale du composé soit égale à zéro, la charge de l'hydrogène (et donc son nombre d'oxydation) doit être égale à -1.
-
6Le fluor possède toujours un nombre d'oxydation de -1. Comme nous l'avons déjà mentionné, le nombre d'oxydation de certains éléments peut varier pour de nombreuses raisons (c'est le cas des ions métalliques, des atomes d'oxygène dans les peroxydes, etc.). Toutefois, le fluor possède un nombre d'oxydation de -1, et celui-ci ne change jamais. Ceci est dû au fait que le fluor est l'élément le plus électronégatif, en d'autres termes, il est l'élément qui a le moins de chances de donner un de ses électrons et qui a le plus de chances de prendre le ou les électrons d'un autre élément. C'est pourquoi sa charge ne change pas.
-
7Considérez le nombre d'oxydation d'un composé comme égal à la charge de ce composé. La somme des nombres d'oxydation de tous les atomes d'un composé doit être égale à la charge de ce composé. Par exemple, si un composé n'est pas chargé, la somme des nombres d'oxydation de l'ensemble de ses atomes doit être égale à 0 ; si le composé est un ion polyatomique de charge -1, alors la somme des nombres d'oxydation doit être égale à -1, etc.
- C'est une bonne façon de vérifier si vous avez bien fait votre travail, si la somme des nombres d'oxydation de votre composé n'est pas égale à la charge totale de votre composé, alors vous pouvez être sûr que vous vous êtes trompé quelque part dans la détermination de vos nombres d'oxydation.
Publicité
Partie 2
Partie 2 sur 2:Déterminer les nombres d'oxydation pour les atomes qui ne suivent pas de règles spécifiques
-
1Trouvez les atomes qui ne possèdent pas de règles quant à l'assignation des nombres d'oxydation. Pour certains atomes, il n'existe pas de règle spécifique pour la détermination de leur nombre d'oxydation. Si votre atome n'apparaît pas dans les paragraphes précédents et que vous n'êtes pas sûr de sa charge (si par exemple il fait partie d'un composé plus important et que sa charge individuelle ne vous est pas donnée), alors vous pouvez trouver le nombre d'oxydation de l'atome en procédant par élimination. D'abord, vous allez déterminer le nombre d'oxydation de chacun des autres atomes du composé, avant de déterminer celui de l'atome qui vous intéresse en vous basant sur la charge globale du composé.
- Par exemple, dans le composé Na2SO4, la charge du souffre (S) est inconnue, tout ce que l'on peut dire c'est que sa charge est différente de 0, car il ne se trouve pas sous sa forme élémentaire. C'est un bon candidat pour appliquer cette méthode algébrique de détermination du nombre d'oxydation.
-
2Trouvez les nombres d'oxydation des autres éléments du composé. En utilisant les règles chimiques de détermination du nombre d'oxydation, trouvez les nombres d'oxydation des autres atomes du composé. Faites attention aux cas exceptionnels pour les atomes O, H, etc.
- Suivant les règles de chimie énoncées dans la section précédente, nous savons que dans le composé Na2SO4 les ions Na possèdent une charge (et donc un nombre d'oxydation) de +1 et que les atomes d'oxygène possèdent un nombre d'oxydation de -2.
-
3Pour chaque atome, multipliez leur nombre par leur nombre d'oxydation. À présent que nous connaissons les nombres d'oxydation de tous nos atomes à l'exception de l'atome qui nous intéresse, nous devons prendre en compte le fait que certains de ces atomes peuvent apparaitre plus d'une fois dans le composé. Multipliez le coefficient numérique de chaque atome (écrit en indice après le symbole chimique de l'atome dans le composé) par son nombre d'oxydation.
- Dans le composé Na2SO4, nous savons qu'il y a 2 atomes de Na et 4 atomes d’O. Nous devons donc multiplier +1 (le nombre d'oxydation de Na) par 2 pour obtenir un résultat de 2, puis multiplier -2 (le nombre d'oxydation d'O) par 4 pour obtenir un résultat de -8.
-
4Additionnez les résultats. Additionnez les résultats de vos multiplications pour obtenir le nombre d'oxydation sans tenir compte du nombre d'oxydation de l'atome qui nous intéresse.
- Dans l'exemple de Na2SO4, il aurait fallu additionner 2 et -8 pour obtenir -6.
-
5Calculez le nombre d'oxydation inconnu en vous basant sur la charge du composé. Vous possédez maintenant toutes les informations nécessaires pour trouver le nombre d'oxydation qui nous intéresse en utilisant de simples règles algébriques. Établissez une équation selon laquelle les résultats des étapes précédentes plus le nombre d'oxydation inconnu sont égaux à la charge globale du composé. En d'autres termes : (somme des nombres d'oxydation connus) + (nombre d'oxydation inconnu) = (charge du composé).
- En reprenant l'exemple de Na2SO4, voici comment s'y prendre :
- (somme des nombres d'oxydation connus) + (nombre d'oxydation inconnu) = (charge du composé)
- -6 + S = 0
- S = 0 + 6
- S = 6. Le nombre d'oxydation de S est égal à 6 dans le composé Na2SO4
Publicité - En reprenant l'exemple de Na2SO4, voici comment s'y prendre :
Conseils
- Le nombre d'oxydation des atomes sous forme élémentaire est toujours égal à 0. Le nombre d'oxydation d'un ion monoatomique est égal à sa charge. Les métaux du groupe 1A et sous forme élémentaire, comme l'hydrogène, le lithium et le sodium, possèdent un nombre d'oxydation de +1 ; les métaux du groupe 2A et sous leur forme élémentaire, comme le magnésium et le calcium, possèdent un nombre d'oxydation de +2. L'hydrogène et l'oxygène peuvent tous les deux avoir deux nombres d'oxydation différents en fonction du ou des éléments auxquels ils sont liés.
- Dans un composé donné, la somme de tous les nombres d'oxydation doit être égale à 0. Si un ion possède deux atomes, la somme des nombres d'oxydation doit être égale à la charge ionique.
- Il est très utile de savoir lire le tableau périodique des éléments et de savoir y situer les métaux et les non-métaux.
Éléments nécessaires
- Tableau périodique des éléments
- Un accès internet ou des livres de chimie
- Du papier, un stylo ou un crayon
- Une calculatrice