جرمانيوم
الجرمانيوم (بالإنجليزية: Germanium) عنصر كيميائي شبه موصل رقمه الذري 32، رمزه الذري هو Ge، وهو شبه فلزي مظهره، صلب ذو لون أبيض رمادي مائل للخضرة مداره الأخير يحتوي على 4 إلكترونات. وكيميائيًا مماثل لمجموعة الكربون أي لجيرانه مثل: القصدير والسليكون. هذا العنصر في الغالب لا يميل للاتحاد عند فقد الإلكترونات. وبذلك فهو عنصر نادر التواجد في الطبيعة.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المظهر | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
أبيض رمادي | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص العامة | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الاسم، العدد، الرمز | جرمانيوم، 32، Ge | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| تصنيف العنصر | شبه فلز | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | 14، 4، p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكتلة الذرية | 72.64 غ·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| توزيع إلكتروني | Ar]; 3d10 4s2 4p2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| توزيع الإلكترونات لكل غلاف تكافؤ | 2, 8, 18, 4 (صورة) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص الفيزيائية | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الطور | صلب | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكثافة (عند درجة حرارة الغرفة) | 5.323 غ·سم−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| كثافة السائل عند نقطة الانصهار | 5.60 غ·سم−3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الانصهار | 1211.40 ك، 938.25 °س، 1720.85 °ف | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطة الغليان | 3106 ك، 2833 °س، 5131 °ف | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة الانصهار | 36.94 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارة التبخر | 334 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| السعة الحرارية (عند 25 °س) | 23.222 جول·مول−1·كلفن−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ضغط البخار | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الخواص الذرية | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| أرقام الأكسدة | 4, 3, 2, 1, 0, -1, -2, -3, -4 أكاسيده تذبذب) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الكهرسلبية | 2.01 (مقياس باولنغ) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| طاقات التأين | الأول: 762 كيلوجول·مول−1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الثاني: 1537.5 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الثالث: 3302.1 كيلوجول·مول−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر ذري | 122 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر تساهمي | 122 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نصف قطر فان دير فالس | 211 بيكومتر | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| خواص أخرى | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| البنية البلورية | بنية الألماس | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المغناطيسية | مغناطيسية معاكسة[1] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مقاومة كهربائية | 1 أوم·متر (20 °س) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الناقلية الحرارية | 60.2 واط·متر−1·كلفن−1 (300 كلفن) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| التمدد الحراري | 6.0 ميكرومتر/(م·كلفن) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سرعة الصوت (سلك رفيع) | 5400 متر/ثانية (20 °س) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل يونغ | 103[2] غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل القص | 41[2] غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| معامل الحجم | 75[2] غيغاباسكال | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نسبة بواسون | 0.26[2] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| صلادة موس | 6.0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رقم CAS | 7440-56-4 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| طاقة فجوة النطاق عند 300 كلفن | 0.67 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| النظائر الأكثر ثباتاً | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| المقالة الرئيسية: نظائر الجرمانيوم | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
كيفية الحصول عليه
الجرمانيوم، يوجد عادة بكميات صغيرة مخلوطًا مع فلزات أخرى ويحصل عليه بتنقية كل من المعادن الآتية: النحاس والزنك والحديد. ويتم استخراج الجرمانيوم في المقام الأول من سفاليرايت.
تاريخ تطور الجرمانيوم
في الحقيقة يعتبر تطور الجرمانيوم حلقة متسلسلة لتطور تاريخ الترانزستور حسب التسلسل الزمني التالي: في 1869م توقع الكيميائي الروسي ديمتري إيفانوفيتش مندليف وجود عدة عناصر كيميائية غير معروفة، بما في ذلك عنصر جديد من شأنه أن يسد فجوة في عائلة الكربون في الجدول الدوري للعناصر. ونظرا لموقعه في الجدول الدوري الواقع بين السليكون والقصدير [3]، سماه مند ليف ب ekasilicon (الخانات)، وقال بأن كتلته الذرية تقدر ب 72.0 تقريبا.
في منتصف عام 1885 ، عند انفجار لغم بالقرب من مدينتي فرايبرغ، ساكسونيا، تم العثور على معدن جديد سُمي بـ (أرجيرودتي)، لما له من الفضة على نسبة عالية من (معادن).[4] قام الكيميائي كليمنس وينكلر بتحليل هذا المعدن الجديد، وفي سنة 1886 قام بعزل عنصر جديد يشبه إلى حد ما الأنتيمون. وقبل ذلك نشرت نتائج وينكلر على عنصر جديد، وقرر أنه يستطيع تسمية هذا العنصر بالنبتونيوم. ومنذ اكتشاف كوكب نبتون الأخير في عام 1846الذي سبقه التوقعات الرياضية من اكتشافه"سبق له أن اكتشف سنة 1940عنصر كيميائي آخر وإن لم يكن العنصر الذي يحمل اليوم اسم النبتونيوم ".[5][6]> وبدلا من ذلك، سعى إلى اكتشاف عنصر جديد الجرمانيوم (من الكلمة اللاتينية، جرمانيا، ل ألمانيا) على شرف وطنه. هذا العنصر الجديد أظهر بعض أوجه التشابه مع الزرنيخ العناصر والأنتيمون كما هو موضح بمكانه الصحيح في الجدول الدوري. وهذا ما يعطي أوجه التشابه لهذا العنصر مع التوقع السابق "ekasilicon" للعالم ديمتري مندليف ’بحيث أكدت الأوجه أنه ينتمي إلى هذا المكان في الجدول الدوري.[7] و في سنة 1887 أكد وينكلر الخصائص الكيميائية للعنصر الجديد.[8][9] وكان وينكلر قادر على إعداد عدة مركبات جديدة من الجرمانيوم، بما فيها الفلوريدات، الكلوريدات، كبريتيد، وثاني أكسيد الجرمانيوم، والمركب ((C2H5) 4) والبيانات الفعلية من هذه المركبات وأدلى اكتشافه تأكيدا هاما من فكرة مند ليف للعناصر الدورية (توقعات مند ليف). حتى أواخر سنة 1930 ، وكان يعتقد أن لا أهمية لمعدن الجرمانيوم. إلا بعد سنة 1945أصبحت لديه أهمية اقتصادية، عندما تم الاعتراف بخصائصه المماثلة لأشباه النواقل. ومع ذلك، خلال الحرب العالمية الثانية، بدأت كميات صغيرة من الجرمانيوم تستخدم في صناعة بعض الأجهزة الإلكترونية الخاصة، ومعظمها من الثنائيات. وهذه الأخيرة كان لها أول استخدام رئيسي في ربط نقاط الاتصال للكشف عن نبض الرادار خلال الحرب. قبل عام 1945 ، تم إنتاج سوى بضع مئات من كيلوغرام من الجرمانيوم في المصاهر كل عام، ولكن بحلول نهاية عام 1950 ، بلغ إنتاجه السنوي في جميع أنحاء العالم 40 متري طن.
تطورت صناعة الترانزستور وتقدم إنتاج الجرمانيوم في 1948 , وفتح الباب أمام عدد لا يحصى من تطبيقات الالكترونيات في الحالة الصلبة. وفي سنة1955 تم الحصول على أول الجرمانيوم من سبائك السليكون. وفي وقت مبكر من سنة 1970 للسوق المتزايد على الجرمانيوم حلت محله في الترانزستورات كل من الثنائيات، والمقومات. رغم تفوق الخواص الكهربائية للسيليكون، إلا أنه يتطلب نقاء أعلى من ذلك بكثير، وهذا النقاء لا يمكن أن يتحقق تجاريا في السنوات الأولى من الالكترونيات أشباه الموصلات. وفي الوقت نفسه، زاد الطلب على الجرمانيوم لاستخدامه في شبكات الألياف البصرية والاتصالات والأشعة تحت الحمراء لأنظمة الرؤية الليلية. ولاستخدامه في هذه الغاية مثل 85 ٪ من استهلاك الجرمانيوم في جميع أنحاء العالم في عام 2000. ولهذا اعتبرته الحكومة الأمريكية كمادة إستراتيجية وحاسمة، داعيا إلى 146 طن في مخزون الدفاع الوطني في عام 1987.
ملاحظة
الجرمانيوم يختلف عن السيليكون في: أن الجرمانيوم يقتصر العرض على توفير مصادر للاستغلال، في حين مصدرمعين من السيليكون يقتصر على تقديم الطاقة الإنتاجية لأن السيليكون يأتي من الرمال العادية أو الكوارتز. ونتيجة لذلك، في عام 1998 كان ثمن شراء السليكون أقل من 10 دولارات للكيلوغرام الواحد، إلا أن سعر 1 كغ من الجرمانيوم يقرب من 800 $.
خصائص الجرمانيوم


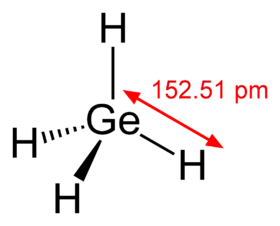
يمكننا التعرف على خصائص الجرمانيوم في ظل الظروف القياسية لذلك. وتتمثل فيما يلي:
- الجرمانيوم عنصر هش، أبيض فضي، وعنصر شبه معدنية.
يعرّف هذا النموذج تقنيا باسم متأصل الجرمانيوم - α , الذي لديه بريق معدني وبنية الكريستال الماس المكعب.
- الجرمانيوم في تركيبته يشبه غاز الميثان كما هو موضخ في الشكل المقابل (يشابه الميثان).
- في الضغوط فوق 120 جيغا باسكال تصبح معروفة باسم متأصل مختلف أشكال الجرمانيوم -β ، التي لديها بنية نفس القصدير β, إلى جانب العناصر التالية: السيليكون، الغاليوم، البزموت والأنتيمون.
- الجرمانيوم واحد من بين العناصر القليلة التي تتسع لأنه يتصلب (أي يتجمد) من حالته المنصهرة.
- الجرمانيوم شبه موصل يحتوي على شوائب من جزء واحد فقط في 1010، مما يجعله من أنقى المواد التي تم الحصول عليها من أي وقت مضى.
- سبيكة من الجرمانيوم مع اليورانيوم والروديوم. تعتبر موصل جيد للكهرباء في وجود مجال كهرومغناطيسي قوي للغاية.
الكيميائية
تصنيف مركبات الجرمانيوم
عنصر الجرمانيوم يتأكسد ببطء إلى GeO 2 في 250 درجة مئوية وفق المعادلة التالية: 250م° GeO 2 -- e G 2 + 2O الجرمانيوم غير قابل للذوبان في الأحماض المخففة والقلويات ولكن يذوب ببطء في حامض الكبريتيك المركز ويتفاعل بعنف مع القلويات. الجرمانيوم غالبا ما يكون في حالة الأكسدة (+4) على الرغم من أن العديد من المركبات المعروفة تصبح ذات أكسدة (+2). ويوجد تأكسد نادر، مثل (+3) وجدت في مركبات مثل Ge2Cl6 ، والتأكسدات (+)3 و (+1) لوحظت على سطح أكاسيد، والأكسدة السالبة لوحظت في الولايات الألمانية مثل: (-4) في المركب (GeH4). والتأكسد للعنصر في هذه الأيونات ليس صحيحا، على غرار الأكسجين ides Ooz on 3.
ومن المعروف يوجد نوعين من أكاسيد الجرمانيوم: أولها ثاني أكسيد الجرمانيوم (GeO2 ، جرمانيا) والثاني أول أكسيد الجرمانيوم (جيو)، يمكن الحصول على GeO2 من كبريتيد الجرمانيوم (GeS2)، وهو عبارة عن مسحوق أبيض غير قابل للذوبان (بشكل طفيف فقط)في الماء ولكنه يتفاعل مع القلويات لتشكيل germanates. وأيضا مع المركبات الثنائية التالية: كبريتيد (GeS2)، ثنائي سيلينيت (GeSe2)، سيلينيد (GeSe)، وتيلورايد (GeTe).
على سبيل المثال : يتم الحصول على رابع كلوريد الجرمانيوم، GeCl4 ، وهو سائل عديم اللون بالغليان حتى 83,1 درجة مئوية عن طريق تسخين معدن الجرمانيوم مع الكلور، حسب المعادلة الآتية: 83،1م° GeCl4 --- e+2ClG4
النظائر المشعة للجرمانيوم
للجرمانيوم خمسة نظائر طبيعية ذات أهمية كبيرة هي: ، 70Ge ، 72Ge ، 73Ge ،74Ge و76Ge. وتشكل عدد كبير من المركبات العضوية الفلزية. والجدول الممثل أعلاه يوضح بعض خصائصها من حيث: توافرها الطبيعي، نصف العمر، نمط اضمحلالها أي (طاقة الاضمحلال بالميغا إلكترون فولت) وناتج الاضمحلال 72Ge هو نظير مستقر وله 40 نيوترون كما سبق في الجدول ويعطي العنصر (_^77)Se مستقر مع تحرير إلكترونات ذات طاقة عالية يستخدم بالاشتراك مع غاز الرادون في البطاريات النووية. وأكثر من ذلك يوجد للجرمانيوم ما لا يقل عن 27 نظير وكلها نظائر مشعة تتراوح كتلتها الذرية مابين 58 – 89غ/مول.و الأكثر استقرارا من هذه العناصر هوGe 68، الناتج عن تحلل أسر الإلكترون. ويميزه نصف عمر يقدر ب270،95 د. والأقل استقرارا من هذه العناصر هو Ge 60 وله نصف عمر يقدرب 30 مللي ثانية. في حين أن معظم النظائر المشعة للجرمانيوم التي تضمحل عبر الوقت تنتج عن طريق تحلل أشعة بيتا β مثل العناصر التالية: Ge 61 ,Ge 64 تنتج عن طريق انبعاث بروتون + β. أما Ge 84 ,Ge 87 تنتج عن طريق تأخر تحرير النيوترون المنبعث.
الوفرة الطبيعية
تم الكشف عن [10] الجرمانيوم في الغلاف الجوي لكوكب المشتري [11] وفي بعض النجوم الأكثر بعدا.[12] كما له وفرة في القشرة الأرضية ما يقرب من 1,6 في المليون.[13] إلا أنه لا يوجد سوى عدد قليل من المعادن تحتوي على كميات ملموسة من الجرمانيوم مثل argyrodite . إلا أن بعض منها كالزنك و خام النحاس والرصاص تحتوي على ما يكفي من الجرمانيوم التي يمكن استخراجه في الأخير من التركيز الخام النهائي. [49] وثمة عملية تخصيب اليورانيوم غير عادي يؤدي إلى إنتاج نسبة عالية من الجرمانيوم في بعض طبقات الفحم، الذي تم اكتشافه من طرف الباحث فيكتور موريتز غولدشميت خلال مسح واسع للودائع الجرمانيوم.[14] وجد في هارتلي أعلى تركيز من الجرمانيوم من أي وقت مضى في رماد الفحم نسبتة تصل إلى 1,6 ٪.[14] ، وأيضا بالقرب من منغوليا الداخلية وجد أنها تحتوي على ما يقدر ب 1600 طن من الجرمانيوم.[13]
إنتاج الجرمانيوم

الإنتاج في عام 2006 كان حوالي 100 طن من الجرمانيوم. وفي الوقت الراهن، يتم استرداد المنتجات الناتجة عن خامات الزنك سفاليرايت بشكل رئيسي بحيث تعطي كميات تصل إلى 0,3 ٪، [15] وخاصة من الرواسب الضخمة التي تستضيفها من المعادن التالية: الزنك، الرصاص والنحاس. الزنك، الرصاص. [49] وبذلك أُتيح للولايات المتحدة أن تقدر أرقام احتياطها بكميات تقدر ب 500 طن تقريبا، على عكس الفرصة المتاحة لجميع بلدان أنحاء العالم.[13][13] وفي عام 2007 تم استقبال 35٪ من الجرمانيوم المعاد تدويرها.[13][13]
روسيا والصين تستخدم كل منهما مصدر آخر لإنتاج تركيز كبير من الجرمانيوم وهو الرماد المتطاير من محطات توليد الطاقة التي تستخدم الفحم. [54] فودائع روسيا تقع في أقصى شرق البلاد على جزيرة سخا لين. كما توجد بها مناجم الفحم شمال شرق فلاديفوستوك التي تستخدمها كمصدر للجرمانيوم.[13][13] أما ودائع الصين تقع أساسا في مناجم الفحم البني قرب لينكانغ ويوننان.[13][13] والجدول التالي يوضح مبالغ تكاليف الجرمانيوم حسب السنوات التالية:
| السنة | Cost ($/kg)[16] |
|---|---|
| 1999 | 1,400 |
| 2000 | 1,250 |
| 2001 | 890 |
| 2002 | 620 |
| 2003 | 380 |
| 2004 | 600 |
| 2005 | 660 |
| 2006 | 880 |
| 2007 | 1,240 |
| 2008 | 1,490 |
| 2009 | 950 |
انطلاقا من هذا الجدول نلاحظ تطور إنتاج الجرمانيوم على جميع الميادين.
تطبيقات الجرمانيوم
تم استخدام الجرمانيوم في عدة مجالات من بينها: البصريات، إلكترونيات وفي مجالات أخرى.
في البصريات
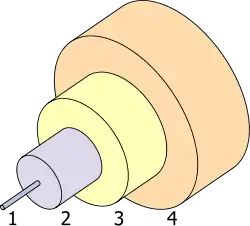
1.- قلب 8 µm
2.- الكسور 125 µm
3.- المصد 250 µm
4.- الحامي 400 µm
الاستخدامات الرئيسية للجرمانيوم في عام 2007 م، في جميع أنحاء العالم تشير التقديرات إلى أن استعماله بنسبة 35 ٪ لأنظمة الألياف الضوئية والبصريات والأشعة تحت الحمراء تمثل 30 ٪، 15 ٪ للمحفزات البلمرة، و 15 ٪ لتطبيقات الالكترونيات والكهرباء من الطاقة الشمسية. 5 ٪ الباقية تستعمل في استخدامات أخرى مثل فوسفورات والمعادن. الجرمانيوم يستخدم في شبكات الألياف البصرية والاتصالات والأشعة تحت الحمراء لأنظمة الرؤية الليلية. ولاستخدامه في هذه الغاية مثل 85 ٪ من استهلاك الجرمانيوم في جميع أنحاء العالم في عام2000.مما جعله مفيدا بشكل خاص لعدسات الزاوية الواسعة. [57] [58] وفي نهاية عام 2002 صناعة الألياف البصرية مثلت 6 ٪ من استخدام الجرمانيوم السنوية في الولايات المتحدة. والجرمانيوم يستخدم لتغيير الخصائص البصرية، كما هو الحال في أقراص الفيديو الرقمية لإعادة الكتابة فيها. [60] لأن الجرمانيوم شفاف في الأشعة تحت الحمراء ومهم جدا في المواد البصرية بالأشعة تحت الحمراء، والتي تمكن بسهولة من صقل العدسات والنوافذ. وتستخدم بوجه خاص باعتبارها أساس البصريات في كاميرات التصوير الحراري التي تعمل من 8 إلى 14 ميكرون، والذي يمثل مدى الطول الموجي للتصوير الحراري السلبي والساخن في الكشف عن العمليات العسكرية وتطبيقات مكافحة الحرائق. [56] كما أنه يستخدم في المطيافية ومعدات بصرية أخرى التي تتطلب حساسية للكشف عن الأشعة تحت الحمراء. [58]
عن إلكترونيات
والجرمانيوم من أَكثر المواد استخدامًا بوصفه شبه موصل شبه الموصل. وهو شبه موصل جيد لأنّه لا يحتوي على خواص فلزية قوية. ويستخدم الجرمانيوم في صناعة الأَجهزة شبْه الموصلة مثل الصِّمامات الثنائية، وبطاريات الطاقة الشمسية، والترانزستورات.
تستخدم فيها أيضا سبائك السيليكون الجرمانيوم -التي تتحول إلى مادة أشباه الموصلات - في الدوائر المتكاملة العالية السرعة.[17] السيليكون الجرمانيوم جدير بالاستعمال في أجهزة الاتصالات اللاسلكية. كما هو الحال عن رقائق SiGe التي تتميز بسرعة عالية وخصائص مميزة مع التكلفة المنخفضة لهذه التطبيقات، وتقنيات إنتاج راسخة من هذا المعدن.
زرنيخيد الجاليوم الخلية الجرمانيوم
هو بداية ليحل محل عنصر زرنيخيد الغاليوم (الغاليوم). لأن الجرمانيوم وزرنيخيد الغاليوم وثوابت شعرية مشابهة جدا، يمكن أن تستخدم في الخلايا الشمسية.[18] وهناك استخدامات أخرى في مجال الالكترونيات وتشمل فوسفورات مصابيح الفلورسنت.[19] ويعتبر الجرمانيوم القاعدة الصلبة لدولة الثنائيات الباعثة للضوء أي المصابيح. وإلى حد الآن لا تزال تستخدم ترانزستورات الجرمانيوم في بعض دواسات الآثار من قبل الموسيقيين الذين يرغبون في استنساخ الطابع المميز للدرجة اللونية.[20]
استخدامات أخرى الجرمانيوم
أيضا ثاني أكسيد الجرمانيوم في المواد المحفزة للبلمرة- وهو الاستخدام الذي غُيّب في الولايات المتحدة - وبنسب عالية من البوليستر لإنتاج الزجاجات وتسويقها في اليابان.
شهدت السنوات الأخيرة زيادة في استخدام الجرمانيوم في سبائك المعادن الثمينة’ الفضة على سبيل المثال، ويتطلب ذلك نسبة 1.2 ٪ من الجرمانيوم.
يمكن استخدامه في أحد كاشفات الكريستال بالضبط لتحديد مصادر الإشعاع، على سبيل المثال في أمن المطارات.[21] الجرمانيوم معدن مفيد لحيود الأشعة السينية.[22] وللكشف عن طيف أشعة غاما والبحث عن المادة المظلمة.[23]
الجرمانيوم من المكملات الغذائية
وقد اكتسب الجرمانيوم شعبية في السنوات الأخيرة لقدرتها على تحسين سمعته الطيبة على وظيفة نظام المناعة لدى مرضى السرطان. وهي متاحة في الولايات المتحدة كملحق صفة الغذائية في كبسولات أو أقراص عن طريق الفم، وكحل أدنى يمكن حقنه. وفي وقت سابق أدت الأشكال غير العضوية، ولا سيما الملح سيترات إلى عدد كبير من حالات الفشل الكلوي، التنكيس الدهني الكبدي والاعتلال العصبي في الأفراد الذين يستخدمون ما سبق على أساس التداوي من الأمراض المزمنة السابقة إلا أن تركيز الجرمانيوم في البلازما والبول لهؤلاء المرضى كان بنسبة كبيرة، أدت إلى وفاة العديد منهم.[24] .
الاحتياطات من الجرمانيوم
اعتبارا من عام 1922، استخدم مجموعة من الأطباء في الولايات المتحدة الجرمانيوم لعلاج المرضى الذين يعانون من فقر الدم.[25] وأكثر من ذلك كان يستخدم في أشكال أخرى من العلاجات، ولكن بكفاءات مشكوك فيها. وحسب التطور التكنولوجي قد تمت مناقشة دورها في علاج السكري والسرطان.[21] ولبعض المركبات من الجرمانيوم سمية منخفضة على الثدييات، ولكن لها آثار سامة ضد بكتيريا معينة. [25] هذه الخاصية تجعل من هذه المركبات مفيدة لوكلاء العلاج الكيميائي. [72] خلصت بحوث الإدارة الأمريكية في مجال الأغذية والدواء إلى أن الجرمانيوم، يمكن استخدامه "كمكمل غذائي "، مع احتمال بعض المخاطر الصحية الإنسان".[26]
ولا يعتقد آن الجرمانيوم على أنها ضرورية لصحة النباتات أو الحيوانات.لأن بعض مركباته تمثل خطرا على صحة الإنسان. ولكن على سبيل المثال كلوريد الجرمانيوم السائلة والغازية منها، على التوالي يمكن أن تكون مزعجة جدا للعيون والجلد والرئتين والحنجرة.[27] إلا أن الجرمانيوم له تأثير ضئيل أو لا: على البيئة لأنه عادة ما يرتبط مع العناصر في الخامات والمواد الكربونية، ويستخدم بكميات صغيرة جدا في التطبيقات التجارية.
اضافـــــــــــات
كان متوقعا وجود عنصر جديد، فإن وجود كوكب نبتون كان متوقعا في حوالي 1843 من قبل اثنين من الرياضيين جون آدمز الأريكة ووأربان، وذلك باستخدام طرق حسابات الميكانيكا السماوية. فعلوا ذلك في attemopts لشرح حقيقة أن أورانوس مستوي بناء على الملاحظة الدقيقة للغاية. [7] ومع ذلك واصل جيمس شاليس البحث عنه في يوليو 1846، حتى شاهد هذا الكوكب يوم 23 سبتمبر 1846بعد محاولات عديدة. [8]
المراجع
- Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics 81st edition, CRC press.
- "Properties of Germanium"، Ioffe Institute.
- Kaji, Masanori (2002)، "D. I. " (PDF)، Bulletin for the History of Chemistry، 27 (1): 4–16، مؤرشف من الأصل (pdf) في 21 يونيو 2010، اطلع عليه بتاريخ 20 أغسطس 2008.
- Argyrodite—Ag8GeS6 (PDF) (Report)، Mineral Data Publishing، مؤرشف من الأصل (pdf) في 3 مارس 2016، اطلع عليه بتاريخ 01 سبتمبر 2008.
{{استشهاد بتقرير}}: غير مسموح بالترميز المائل أو الغامق في:|ناشر=(مساعدة) - Adams, J. C. (13 نوفمبر 1846)، "Explanation of the observed irregularities in the motion of Uranus, on the hypothesis of disturbance by a more distant planet"، Monthly Notices of the Royal Astronomical Society، Blackwell Publishing، 7: 149، Bibcode:1846MNRAS...7..149A.
- Sears, Robert (1877)، "Scientific Miscellany"، The Galaxy، Columbus, O[hio]: Siebert & Lilley، 24 (1): 131، ISBN 0665501668، OCLC 16890343 243523661 77121148.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|شهر=تم تجاهله (مساعدة)، تأكد من صحة قيمة|oclc=(مساعدة) - "Germanium, a New Non-Metallic Element"، The Manufacturer and Builder: 181، 1887، مؤرشف من الأصل في 16 ديسمبر 2019، اطلع عليه بتاريخ 20 أغسطس 2008.
- Winkler, Clemens (1887)، "Mittheilungen über des Germanium. Zweite Abhandlung"، J. Prak. Chemie (باللغة الألمانية)، 36 (1): 177–209، doi:10.1002/prac.18870360119، مؤرشف من الأصل في 11 مايو 2019، اطلع عليه بتاريخ 20 أغسطس 2008.
- وقدر وزنه الذري بقيمة 72،32 من خلال التحليل الصرف لرابع كلوريد الجرمانيوم (GeCl4) . في حين العالم ليكوك دي استخلص الوزن الذري 72،3 للجرمانيوم من المقارنة بين الأسطر في شرارة الطيف لهذا العنصر.<ref>de Boisbaudran, M. Lecoq (1886)، "Sur le poids atomique du germanium"، Comptes rendus (باللغة الفرنسية)، 103: 452، مؤرشف من الأصل في 08 مايو 2019، اطلع عليه بتاريخ 20 أغسطس 2008.
- Sterling, N. C. (2002)، "Discovery of Enhanced Germanium Abundances in Planetary Nebulae with the Far Ultraviolet Spectroscopic Explorer"، The Astrophysical Journal Letters، 578 (1): L55–L58، Bibcode:2002ApJ...578L..55S، doi:10.1086/344473.
- Kunde, V. (1982)، "The tropospheric gas composition of Jupiter's north equatorial belt /NH3, PH3, CH3D, GeH4, H2O/ and the Jovian D/H isotopic ratio"، Astrophysical J.، 263: 443–467، Bibcode:1982ApJ...263..443K، doi:10.1086/160516.
- Cowan, John (01 مايو 2003)، "Astronomy: Elements of surprise"، Nature، 423 (29): 29، doi:10.1038/423029a، PMID 12721614.
- Höll, R. (2007)، "Metallogenesis of germanium—A review"، Ore Geology Reviews، 30 (3–4): 145–180، doi:10.1016/j.oregeorev.2005.07.034.
- Goldschmidt, V. M. (1930)، "Ueber das Vorkommen des Germaniums in Steinkohlen und Steinkohlenprodukten"، Nachrichten von der Gesellschaft der Wissenschaften zu Göttingen, Mathematisch-Physikalische Klasse: 141–167، مؤرشف من الأصل في 03 مارس 2018.
- Bernstein, L (1985)، "Germanium geochemistry and mineralogy"، Geochimica et Cosmochimica Acta، 49 (11): 2409، doi:10.1016/0016-7037(85)90241-8.
- R.N. Soar. (January 2003, January 2004, January 2005, January 2006,
January 2007,January 2010)، "Germanium" (PDF)، U.S. Geological Survey Mineral Commodity Summaries، USGS Mineral Resources Program، : 1–2، ISBN 0859340392، OCLC 16437701، مؤرشف من الأصل (pdf) في 10 يناير 2019، اطلع عليه بتاريخ 28 أغسطس 2008.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=و|سنة=/|تاريخ=mismatch (مساعدة)، line feed character في|تاريخ=في مكان 357 (مساعدة)، روابط خارجية في|تاريخ= - Washio, K. (2003)، "SiGe HBT and BiCMOS technologies for optical transmission and wireless communication systems"، IEEE Transactions on Electron Devices، 50 (3): 656، doi:10.1109/TED.2003.810484.
- Bailey, Sheila G.؛ Raffaelle, Ryne؛ Emery, Keith (2002)، "Space and terrestrial photovoltaics: synergy and diversity"، Progress in Photovoltaics Research and Applications، 10 (6): 399، doi:10.1002/pip.446.
- Crisp, D. (2004)، "The performance of gallium arsenide/germanium solar cells at the Martian surface"، Progress in Photovoltaics Research and Applications، 54 (2): 83–101، doi:10.1016/S0094-5765(02)00287-4.
- Szweda, Roy (2005)، "Germanium phoenix"، III-Vs Review، 18 (7): 55، doi:10.1016/S0961-1290(05)71310-7.
- "Germanium"، American Cancer Society، مؤرشف من الأصل في 28 يونيو 2010، اطلع عليه بتاريخ 31 أغسطس 2008.
- Ahmed, F. U. (1996)، "Optimization of Germanium for Neutron Diffractometers"، International Journal of Modern Physics E، 5 (1): 131، doi:10.1142/S0218301396000062.
- Diehl, R.؛ Prantzos, N؛ Vonballmoos, P (2006)، "Astrophysical constraints from gamma-ray spectroscopy"، Nuclear Physics A، 777: 70، doi:10.1016/j.nuclphysa.2005.02.155.
- Baselt, R. (2008)، Disposition of Toxic Drugs and Chemicals in Man (ط. 8)، Foster City, CA: Biomedical Publications، ص. 693–694.
- Brown Jr., Robert D.، Commodity Survey:Germanium (PDF) (Report)، US Geological Surveys، مؤرشف من الأصل (pdf) في 4 مارس 2018، اطلع عليه بتاريخ 09 سبتمبر 2008.
- Tao, S. H. (1997)، "Hazard Assessment of Germanium Supplements"، Regulatory Toxicology and Pharmacology، 25 (3): 211–219، doi:10.1006/rtph.1997.1098، PMID 9237323.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|شهر=تم تجاهله (مساعدة) - Gerber, G.B. (1997)، "Mutagenicity, carcinogenicity and teratogenicity of germanium compounds"، Regulatory Toxicology and Pharmacology، 387 (3): 141–146، doi:10.1016/S1383-5742(97)00034-3.
- بوابة العناصر الكيميائية
- بوابة الفيزياء
- بوابة الكيمياء
