ميوغلوبين
الميوغلوبين [1] (رمز Mb أو MB ) هو بروتين يربط الحديد والأوكسجين ويوجد في الأنسجة العضلية للفقاريات بصورةٍ عامّة، وجميع الثديات بصورةٍ خاصّة .[2] ؛ وهو ذات صلة بالهيموغلوبين ( بروتين ربط الحديد والأوكسجين في الدم، وتحديدًا في خلايا الدم الحمراء). في البشر، يتم العثور على الميوغلوبين فقط في مجرى الدم بعد إصابة في العضلات. وجود الميوغلوبين في الدم غير طبيعي ويكون مقياس في تشخيص بعض الأمور الطبيّة .[3]
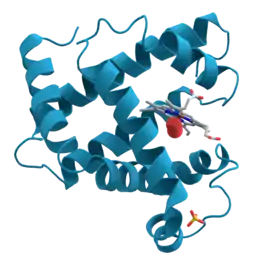
الميوغلوبين هو الخاصب الحامل للأوكسجين في الأنسجة العضلية. تركيزات عالية من الميوغلوبين في خلايا العضلات تسمح للكائنات الحية أن تحبس أنفاسها لفترة أطول من الزمن. الثدييات البحرية مثل الحيتان و الفقمات لها عضلات تتوافر فيها كميات عالية من الميوغلوبين. يتم العثور على ميوغلوبين في العضلات من النوع الأول، النوع الثاني أو النوع الثاني ب، ولكن معظم النصوص تعتبر أن الميوغلوبين غير موجود في العضلات الملساء.
كان الميوغلوبين أول بروتين تُعرف بنيته ثلاثية الأبعاد بواسطة علم البلورات السيني. تم الإبلاغ عن هذا الإنجاز في عام 1958 من قبل جون كيندرو ومساعديه. وبالنسبة لهذا الاكتشاف، حصل جون كيندرو في عام 1962 على جائزة نوبل في الكيمياء مع ماكس بيروتس. على الرغم من كون الميوغلوبين واحدة من أكثر البروتينات التي تمت دراستها في علم الأحياء، فإن وظيفتها الفسيولوجية لم يتم فهمها بعد بشكل قاطع: فالفئران المعدلة وراثيا لنقص الميوغلوبين يمكن أن تكون قابلة للحياة وخصبة ولكنها تظهر العديد من التكيفات الخلوية والفسيولوجية للتغلب على نقص الميوغلوبين. من خلال ملاحظة هذه التغيرات في الفئران المستنفدة لميوغلوبين، يُفترض أن وظيفة الميوغلوبين تتعلق بزيادة نقل الأوكسجين إلى العضلات وتخزين الأكسجين. في البشر يتم ترميز الميوغلوبين عن طريق جين MB.
الميوغلوبين يمكنه البقاء كأوكسهيموغلوبين (MbO2) [4] ، والكربوكسيميوغلوبين (MbCO) ، ولميتميوغلوبين (met-Mb). بشكل مشابه، يمكن للهيموغلوبين أن يأخذ أشكال الأكسيهيموغلوبين (HbO2)، الكربوكسيهيموغلوبين (HbCO) ، والميتهيموغلوبين (met-Hb).[5]
اختلاف الميوغلوبين عن الهيموغلوبين
مثل الهيموغلوبين، الميوغلوبين هو بروتين سيتوبلازمي يربط الأوكسجين في مجموعة الهيم ولكنه يؤوي مجموعة هيم واحدة فقط، في حين أن الهيموغلوبين لديه أربعة. على الرغم من أن مجموعة الهيم الخاصة به متطابقة مع تلك الموجودة في الهيموغلوبين، إلا أن الميوغلوبين لديه نسبة تقارب أعلى للأوكسجين مقارنة بالهيموغلوبين. ويرتبط هذا الاختلاف بدور الميوغلوبين المختلف: بينما ينقل الهيموجلوبين الأوكسجين، فإن وظيفة الميوغلوبين هي تخزين الأوكسجين.
لون اللحم
يحتوي الميوغلوبين على مجموعة الهيم، وهي أصباغ مسؤولة عن لون اللحم الأحمر. يتم تحديد درجة احمرار اللحم جزئيا من درجة أكسدة الميوغلوبين. في اللحوم الطازجة تكون ذرة الحديد في حالة الأكسدة الحديدية (2+) المرتبطة بجُزيء الأوكسجين. اللحوم المطهوة بشكل كامل تكون بنيَة اللون لأن ذرة الحديد هنا في حالة الأكسدة الحديدية (+3) بعد أن فقدت إلكتروناً. إذا تعرض اللحم للنيتريت، فسوف يبقى لونه ورديًا لأن ذرة الحديد تكون مرتبطة بأكسيد النيتريك (على سبيل المثال، لحم البقر المعلب أو لحم الخنزير المقدد). كذلك تتخذ اللحوم المشوية اللون الوردي «حلقة الدخان» الناتج من ارتباط الحديد بجُزيء أحادي أكسيد الكربون. كما أن اللحوم النيئة المعبأة في جوء مشبع من أول أكسيد الكربون تُظهر أيضاً نفس الطبقة الخارجية الوردية نتيجة لنفس الأسباب. ومن الجدير بالذكر أن سطح هذا اللحم النيء يكون أيضًا وردي اللون، والذي يرتبط عادةً في عقل المستهلك باللحم الطازجة. ويمكن أن يستمر هذا اللون الوردي الناجم بشكل اصطناعي لمدة سنة واحدة. ورد أيضا بأن هورمل وكارجيل يستخدمان عملية تعبئة اللحوم تلك، وتباع اللحوم المعالجة بهذه الطريقة في السوق منذ عام 2003.
دور الميوغلوبين في المرض
يخرج الميوغلوبين من الأنسجة العضلية المتضررة (انحلال الربيدات)، والذي يحتوي على تركيزات عالية من الميوغلوبين. يتم تصفية الميوغلوبين المنطلق بواسطة الكليتين ولكنه يكون ساماً بالنسبة للظهارة الأنبوبية لاكلوية وبالتالي قد يتسبب في إصابة حادة في الكِلى. ليس الميوغلوبين نفسه سامًا ولكن الجزء الذي ينفصل عن الميوغلوبين في البيئات الحمضية (على سبيل المثال، البول الحمضي، الأجسام الحالة).
يعتبر الميوغلوبين علامة حساسة لإصابة العضلات، مما يجعله علامة محتملة للنوبات القلبية لدى المرضى المصابين بألم الصدر. ومع ذلك، فإن للميوغلوبين المرتفع نوعية منخفضة في حالات النوبات القلبية المزمنة (AMI) وبالتالي كيناز الكرياتين (CK-MB) ، التروپونين القلبي (cardiac Troponin) ، مرسمة كهربائية القلب (ECG) ، والعلامات السريرية ينبغي أخذها في الحسبان عند التشخيص.[6]
التركيبة والترابط
ينتمي الميوغلوبين إلى عائلة بروتينات الغلوبين، وكما هو الحال مع أنواع أخرى من الغلوبين، يتألف من ثماني لوالب ألفا مرتبطة بواسطة حلقات. يحتوي الميوغلوبين على 154 حمض أميني. يحتوي الميوغلوبين على حلقة بورفيرين مع ذرة حديد في مركزها. ذرة الحديد تربط مع الحامض الأميني هيستيدين 94 القريب، والحامض الأميني هيستيدين 64 البعيد يحوم بالقرب من الوجه المعاكس.
لا يرتبط الإميدازول البعيد بشكل مباشر مع الحديد ولكنه متاح للتفاعل مع الأوكسجين الجزيئي. يشجع هذا التفاعل على ربط الأوكسجين الجزيئي، ولكن ليس أول أكسيد الكربون، الذي يربط بقوة حوالي 240 مرة أكبر من الأوكسجين الجزيئي.
يؤدي ربط الأوكسجين إلى تغير بنيوي كبير في مركز الحديد (Fe) ، حيث يتقلص إلى نصف القطر وينتقل إلى وسط N4. يحث ربط الأوكسجين الجزيئي «الاقتران الدوراني»: البنية الحديدية منزوعة الاكسجين ذات الإحداثيات الخمسة تكون عالية الدوران، والأوكسجين سداسي الإحداثيات تكون منخفضة الدوران.
النظائر الاصطناعية
تم تصنيع العديد من نماذج الميوغلوبين كجزء من الاهتمام الواسع بمركبات ثنائي الأوكسجين المعدنية الانتقالية. ومن الأمثلة المعروفة جيداً سياج البورفيرين الذي يتألف من مركب حديدي مشتق ضخم من رباعي فينيل البورفيرين. في ظل وجود إيميدازول، فإن هذا المركب الحديدي يربط الأوكسجين بشكل عكسي. تعتمد ركيزة الأوكسجين على الهندسة المنحنية وتحتل المركز السادس في مركز الحديد. الخاصية الرئيسية لهذا النموذج هي التشكيل البطيء لـدايمر µ-oxo. في الطبيعة، يتم منع مسارات التعطيل هذه عن طريق مصفوفة البروتين التي تمنع الاقتراب من تراكيب الحديد-البورفيرين.
اقرأ أيضا
المراجع
- ترجمة Myoglobin حسب المعجم الطبي الموحد نسخة محفوظة 07 يناير 2018 على موقع واي باك مشين.
- Nelson, D. L.; Cox, M. M. (2000)، Lehninger Principles of Biochemistry (ط. 3rd)، New York: Worth Publishers، ص. 206، ISBN 0-7167-6203-X.
{{استشهاد بكتاب}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Ordway GA, Garry DJ (2004)، "Myoglobin: an essential hemoprotein in striated muscle"، J. Exp. Biol.، 207 (Pt 20): 3441–6، doi:10.1242/jeb.01172، PMID 15339940.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|شهر=تم تجاهله (مساعدة) - (U.S.) National Science Foundation: Protein Data Bank Chronology (Jan. 21, 2004). Retrieved 3.17.2010 نسخة محفوظة 11 أغسطس 2017 على موقع واي باك مشين.
- JC Kendrew, G Bodo, HM Dintzis, RG Parrish, H Wyckoff, and DC Phillips (1958)، "A Three-Dimensional Model of the Myoglobin Molecule Obtained by X-Ray Analysis"، Nature، 181 (4610): 662–6، Bibcode:1958Natur.181..662K، doi:10.1038/181662a0، PMID 13517261.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - The Nobel Prize in Chemistry 1962 نسخة محفوظة 11 أكتوبر 2008 على موقع واي باك مشين. [وصلة مكسورة]
وصلات اضافية
- The Myoglobin Protein
- Protein Database featured molecule
- الوراثة المندلية البشرية عبر الإنترنت (OMIM): 160000 human genetics
- Which Cut Is Older? (It's a Trick Question) New York Times, February 21, 2006 article regarding meat industry use of carbon monoxide to keep meat looking red.
- Stores React to Meat Reports New York Times, March 1, 2006 article on the use of carbon monoxide to make meat appear fresh.
- Mirceta, S.؛ Signore, A. V.؛ Burns, J. M.؛ Cossins, A. R.؛ Campbell, K. L.؛ Berenbrink, M. (2013)، "Evolution of Mammalian Diving Capacity Traced by Myoglobin Net Surface Charge"، 340 (6138): 1234192، doi:10.1126/science.1234192، PMID 23766330.
{{استشهاد بدورية محكمة}}: Cite journal requires|journal=(مساعدة)
- بوابة الكيمياء الحيوية
- بوابة طب
- بوابة علم الأحياء الخلوي والجزيئي