1,4-diclorobutano
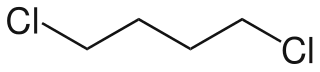
El 1,4-diclorobutano, llamado también cloruro de tetrametileno y 1,4-bis(cloranil)butano, es un compuesto orgánico de fórmula molecular C4H8Cl2. Es un haloalcano lineal de cuatro carbonos en donde un átomo de cloro está unido a cada uno de los carbonos terminales.[2][3][4]
| 1,4-diclorobutano | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| 1,4-diclorobutano | ||
| General | ||
| Otros nombres |
Cloruro de tetrametileno 1,4-bis(cloranil)butano | |
| Fórmula semidesarrollada | ClCH2-CH2-CH2-CH2Cl | |
| Fórmula molecular | C4H8Cl2 | |
| Identificadores | ||
| Número CAS | 110-56-5[1] | |
| ChemSpider | 21106032 | |
| PubChem | 8059 | |
| UNII | 8326YNM2B3 | |
|
C(CCCl)CCl
| ||
| Propiedades físicas | ||
| Apariencia | Líquido incoloro | |
| Olor | Suave, agradable | |
| Densidad | 1160 kg/m³; 1,16 g/cm³ | |
| Masa molar | 12 701 g/mol | |
| Punto de fusión | −38 °C (235 K) | |
| Punto de ebullición | 162 °C (435 K) | |
| Presión de vapor | 5 hPa | |
| Viscosidad | 1,46 mPa·s | |
| Índice de refracción (nD) | 1,454 | |
| Propiedades químicas | ||
| Solubilidad en agua | 0,24 % | |
| log P | 2,24 | |
| Familia | Haloalcano | |
| Peligrosidad | ||
| Punto de inflamabilidad | 313 K (40 °C) | |
| NFPA 704 |
2
3
0
| |
| Temperatura de autoignición | 493 K (220 °C) | |
| Límites de explosividad | 1,8% - 8,9% | |
| Compuestos relacionados | ||
| cloroalcanos |
1-clorobutano 2-clorobutano | |
| dicloroalcanos | 1,5-dicloropentano | |
| policloroalcanos |
2,2,3-triclorobutano 1,2,3,4-tetraclorobutano 1,1,1,3,3-pentaclorobutano 1,2,2,3,3,4-hexaclorobutano | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Propiedades físicas y químicas
A temperatura ambiente, el 1,4-diclorobutano es un líquido incoloro con un suave olor agrable. Tiene su punto de ebullición a 162 °C y su punto de fusión a -38 °C. Posee una densidad mayor que la del agua (ρ = 1,160 g/cm³) y en estado gaseoso es 4,4 veces más denso que el aire.[2] Su viscosidad a 20 °C es de 1,46 cP, superior a la del agua.[5]
El valor estimado del logaritmo de su coeficiente de reparto, logP = 2,25,[3] indica que es más soluble en disolventes apolares que en disolventes polares, siendo poco soluble en agua (0,24%).[5] Es incompatible con agentes oxidantes fuertes y con bases fuertes.[3]
Síntesis
El 1,4-diclorobutano se obtiene calentando tetrahidrofurano (THF) con ácido clorhídrico. En una primera reacción de sustitución, el tetrahidrofurano se convierte en 4-clorobutanol alifático, el cual se transforma en 1,4-diclorobutano por medio de una nueva reacción de sustitución:[6]
La anterior reacción se puede llevar a cabo de forma continua en fase líquida a una temperatura de 14150 °C y una presión de 50 - 150 lbs/in2.[7] El principal subproducto de esta reacción es 4,4'-diclorodibutil éter, el cual también puede ser convertido a 1,4-diclorobutano por calentamiento a 80 °C en presencia de un catalizador como cloruro férrico, cloruro de zinc, cloruro de antimonio, cloruro de bismuto o cloruro de aluminio.[8] De manera similar se puede preparar 1,4-diclorobutano introduciendo cloruro de hidrógeno gaseoso en 4-butilenglicol a 70 - 110 °C de temperatura.[9]
Asimismo, el 1,4-diclorobutano se puede obtener por cloración fotoquímica de 1-clorobutano en fase gas a 35 °C, si bien se forma solo un 17% de 1,4-diclorobutano junto a los otros isómeros de diclorobutano.[10]
Usos
El 1,4-diclorobutano se usa en síntesis orgánica, especialmente en la producción de adiponitrilo por reacción con cianuro de sodio; la posterior hidrogenación del adiponitrilo permite obtener 1,6-hexanodiamina, monómero para la fabricación del nylon-66.[11] Asimismo, la reacción de 1,4-diclorobutano con aminas primarias permite obtener aminas monocíclicas como pirrolidinas y piperidinas.[12] En esta misma línea, se usa para sintetizar heterociclos a partir de organoestannilaminas.[13] Por otra parte, la fosforilación de 1,4-diclorobutano con alquilfosfuros de litio sirve para preparar dialquilfosfinas.[14]
Otros usos del 1,4-diclorobutano son como intermediario farmacéutico activo y como disolvente orgánico para voltamperometría de transferencia de iones en interfaz de agua.
Precauciones
El 1,4-diclorobutano es un compuesto muy inflamable cuyos vapores pueden formar mezclas explosivas con el aire. Estos vapores pueden viajar hasta la fuente de ignición y regresar. El punto de inflamabilidad de este compuesto es 40 °C y su temperatura de autoignición 220 °C.[5]
Véase también
Los siguientes compuestos son isómeros del 1,4-diclorobutano:
Referencias
- Número CAS
- 1,4-Dichlorobutane (PubChem)
- 1,4-Dichlorobutane (ChemSpider)
- 1,4-Dichlorobutane (Chemical Book)
- 1,4-Dichloeobutane. MSDS (ThermoFisher)
- Organikum. 22ª edición, Wiley-VCH, 2004, ISBN 978-3-527-31148-4.
- Production of 1,4-dichlorobutane (1956) Hamel, E.E. Patente US2889380A
- Production of 1,4-dichlorobutane (1956) Hamel, E.E. Patente US2852532A
- Production of 1,4-dichlorobutane (1985) Takabe, A.; Yamagiwa, S. Patente JPS6216441A
- Hartung, J. (2007). «35.1.1.1.2 Haloalkanes and Halocycloalkanes». Science of Synthesis 35: 30. Consultado el 8 de enero de 2019.
- Alger, M. (2017). Polymer Science Dictionary. Springer. p. 241.
- Lawrence, S.A. (2009). «40.1.1.5.4.3.10 Method 10: Intra- and Intermolecular Cyclization Reactions». Science of Synthesis 40: 543. Consultado el 8 de enero de 2020.
- Jousseaume, B. (2003). «5.2.14 Product Subclass 14: Organostannylamines and Related Compounds». Science of Synthesis 5: 401. Consultado el 15 de diciembre de 2019.
- Hey-Hawkins, E.; Karasik, A.A. (2009). «42.5.1.1.1.1 Variation 1: Synthesis from Dialkylphosphides or Dialkylphosphines and Polyhaloalkanes». Science of Synthesis 42: 110. Consultado el 8 de enero de 2020.
