Herpes zóster
El herpes zóster[1] es una enfermedad producida por una reactivación del virus latente varicela-zóster, que afecta a los nervios periféricos —neuropatía gangliorradicular—[2] y a la piel, donde puede producir pequeñas ampollas dolorosas en forma de anillo agrupadas a lo largo de un dermatoma. Coloquialmente, es conocido como culebrilla, culebrina o culebrón. En algunas zonas del Mediterráneo, como en España y en Italia, también se le denomina «fuego de San Antonio».[3][4][nota 1]
| Herpes zóster | ||
|---|---|---|
 Ampollas características del herpes zóster. | ||
| Especialidad |
infectología dermatología neurología | |
El herpes zóster puede presentar diferentes complicaciones según los nervios afectados, sobre todo en individuos inmunodeprimidos, entre los que cabe destacar parálisis motora o facial temporal, insuficiencia respiratoria e infecciones bacterianas secundarias. La principal secuela que puede aparecer tras la desaparición de los signos cutáneos es la neuralgia posherpética (NPH), que consiste en una sensación dolorosa crónica en el dermatoma afectado y que puede durar desde varias semanas hasta años.[7]
Es de distribución universal, más común entre personas con edades avanzadas o con alteraciones de su sistema inmunitario.[8] Se trata de una enfermedad de fácil diagnóstico si se desarrollan todos los síntomas, ya que el patrón de distribución de las lesiones es característico. Además, pueden realizarse diferentes pruebas de laboratorio para confirmar el diagnóstico.[7] El tratamiento es paliativo, basado en analgésicos para controlar el dolor y antivirales para detener la infección.[9] Existe una vacuna preventiva que se está comenzando a administrar en aquellas poblaciones de riesgo.[10]
Etimología
El nombre de la familia Herpesviridae proviene del griego ἕρπης, que significa 'reptar'. Esto se debe a que provocan una diseminación de lesiones con aspecto reptante. El término zóster proviene del latín zoster, a su vez derivado del griego ζωστήρ, que viene a decir 'cinturón', por la distribución en banda de la erupción que se produce en esta patología.[11]
Historia
.jpg.webp)
La descripción del herpes zóster está presente en los textos médicos desde hace mucho tiempo, pero estos relatos históricos no distinguen la formación de ampollas causadas por el virus varicela-zóster (VVZ) y las causadas por la viruela, ergotismo y erisipela.[12] No fue hasta finales del siglo XVIII cuando William Heberden estableció una forma de diferenciar entre el herpes zóster y la viruela, y a finales del siglo XIX se distinguió de la erisipela.[13] En 1831, Richard Bright sostuvo la hipótesis de que la enfermedad surgía del ganglio de la raíz dorsal, lo cual fue confirmado por Felix von Bärunsprung en 1861.[14]
Los primeros indicios de que la varicela y el herpes zóster están causados por el mismo virus se observaron a principios del siglo XX. Algunos médicos comenzaron a informar que se producían casos de varicela en personas jóvenes que convivían con pacientes afectados de herpes zóster. La idea de una asociación entre las dos enfermedades tomó forma cuando se demostró que la linfa de una persona que sufre de herpes zóster puede inducir a la varicela en jóvenes. Finalmente, la relación se demostró al aislarse el virus en cultivos celulares por el premio Nobel Thomas Huckle Weller, en 1953.[15]
Hasta la década de 1940, la enfermedad era considerada benigna y las complicaciones graves se creían que eran muy raras.[16] Sin embargo, en 1942, se reconoció que el herpes zóster es más grave en adultos que en niños y que aumentaba la frecuencia con la edad. Otros estudios durante la década de 1950 en los individuos inmunodeprimidos mostraron que la enfermedad no era tan benigna como se pensaba, comenzándose a buscar medidas terapéuticas preventivas.[17]
Epidemiología
El herpes zóster es una enfermedad distribuida mundialmente. A diferencia de la varicela, el herpes zóster no presenta estacionalidad. Se calcula que afecta alrededor del 20 % de la población, presentando un mayor riesgo las personas caucásicas que las de otras etnias.[18][19] Puede aparecer a todas las edades, aunque es más común en personas mayores de 50 años. Otros factores de riesgo son el estrés, la exposición a inmunotoxinas y los traumatismos.[20][21] Aproximadamente, el 4 % de los enfermos padecen un segundo episodio de herpes zóster, y en algunos pacientes se han descrito más casos.[8]
La incidencia de esta patología varía en los diferentes grupos de edad. La frecuencia anual del herpes zóster es de 4,8 casos por cada 1000 habitantes y cerca del 75 % de los casos ocurren en personas mayores de 50 años.[8] La incidencia anual es de 1-3 casos por cada 1000 habitantes en menores de 50 años, mientras que para las personas con edades comprendidas entre los 50 y los 79 años, es de 5-7 casos por cada 1000. La incidencia se eleva hasta cerca de 11 casos por cada 1000 individuos mayores de 80 años. En niños de corta edad, el herpes zóster es raro. Si durante la gestación la madre ha padecido varicela, puede que haya ocurrido una primoinfectación del feto en el útero y que desarrolle herpes zóster en la lactancia.[7]
En un estudio, se estimó que el 26 % de los pacientes que contraen el herpes zóster, desarrollan complicaciones. La neuralgia postherpética se presenta en aproximadamente el 20 % de los pacientes.[22] Otro estudio llevado a cabo en California en 1994, encontró tasas de hospitalización de 2,1 pacientes por cada 100 000 personas al año, llegando a 9,3 por cada 100 000 personas al año para mayores de 60 años.[23] Un análisis anterior en Connecticut dio una tasa de hospitalización aún mayor, posiblemente debido a la prevalencia del VIH en el primer estudio, o a la introducción de los antivirales en California antes de 1994.[24]
Etiología
El herpes zóster es causado por el virus de la varicela zóster (VVZ). Se trata de un virus de la familia de los herpesvirus —herpesviridae—, en concreto clasificado como virus del herpes humano 3 (HHV-3). Su único reservorio es el ser humano y posee un solo serotipo. Su material genético es ADN bicatenario lineal y no segmentado protegido por una cápside icosaédrica. La replicación del virus ocurre en el núcleo de la célula huésped. Además tiene peplómeros de superficie densamente distribuidos que intervienen en la invasión celular y una envoltura lipídica que proviene de la propia membrana celular.[25][26] Los viriones necesitan tener esta envoltura para ser infectivos, lo que explica la labilidad del virus en el ambiente, ya que la envoltura es sensible a los detergentes, al éter etílico, al calor, a los pH extremos y al aire seco. Por lo tanto, la transmisión debe ser por contacto directo.[8]
El VVZ es también el causante de la varicela, enfermedad cutánea clásicamente infantil pero muy agresiva en adultos. Cuando remite la varicela, el organismo no elimina completamente el virus. Éste queda latente en los ganglios sensitivos del paciente, el cual se podrá reactivar cuando exista una inmunodeficiencia en el afectado. Por ello, el herpes zóster tiene una mayor incidencia en individuos de edad avanzada y en aquellos que tienen alterada su respuesta inmune debido a enfermedades o a estar sometidos a tratamientos inmunosupresores.[27]
Patogenia
La mayor parte de las personas toman contacto con el VVZ durante la infancia, aunque no siempre desarrollen la sintomatología de la varicela —cuadro subclínico—. Durante la infección primaria, el virus pasa a los nervios sensitivos y se extiende hasta las fibras sensitivas de los ganglios nerviosos. Cuando el sistema inmunitario controla la infección, el virus permanece latente en los ganglios de la raíz dorsal de la médula espinal, el ganglio de Gasser del trigémino u otros de los pares craneales en la cabeza. Al parecer puede permanecer allí de por vida, aunque no se sabe con certeza si es en las neuronas, en las células de glía o en ambas. El virus inactivo no causa daño y no se multiplica, aunque puede volver a ser infeccioso.[7]
Generalmente, el sistema inmunitario mantiene el virus inactivo. Cuando se deteriora, como por ejemplo con determinadas enfermedades, el aumento de la edad, el virus se reactiva y se replica en los ganglios, lo que frecuentemente produce dolor intenso por la inflamación y necrosis neuronal. Los nuevos virus circulan a lo largo del axón sensitivo provocando una neuritis intensa, hasta liberarse en el área de piel inervada por ese ganglio —dermatoma—. Una vez ahí, el virus puede causar inflamación de la piel con formación de ampollas.[4][28] Este mecanismo patógeno explica el motivo de que el dolor se manifieste antes de los síntomas cutáneos. La parálisis que puede existir junto con la erupción es debida a la afectación de la inervación motora.[7]
Una vez desaparecida la erupción, el paciente puede desarrollar una neuralgia posherpética al quedar dañadas las neuronas sensitivas. Estas se activan de manera espontánea y muestran una hipersensibilidad a los estímulos externos hasta que se produce su regeneración.[7]
Se han descrito numerosos factores como posibles o probables desencadenantes de la reactivación del VVZ. Todos ellos cursan con una disminución de la capacidad del sistema inmunitario para continuar manteniendo el virus en estado latente. Entre estos factores se encuentran la edad, el estrés emocional intenso, enfermedades graves, traumatismos medulares, inmunosupresión y corticoterapia. Sin embargo, los eventos patogénicos que conducen a la reactivación aún son poco conocidos.[29] Se han registrado casos de exacerbaciones debidas también a daños en la piel como pinchazos, rascado o mordeduras en áreas más sensitivas de la piel, como los pezones, orejas y axilas.[28]
Durante la latencia, el virus podría reactivarse sin producir un cuadro clínico al no estar inmunocomprometido el paciente. La respuesta inmune neutralizaría al agente infeccioso antes de provocar un daño celular apreciable. En otros casos, el control de la infección se retrasa, logrando el virus multiplicarse hasta producir una sintomatología dolorosa, pero sin llegar a desarrollar manifestaciones cutáneas —zoster sine herpete—.[7]
Cuadro clínico
Los primeros síntomas del herpes zóster son inespecíficos e incluyen cefaleas, fotosensibilidad, fiebre y malestar general, que pueden durar uno o varios días.[30][31] Se siguen de picores, hormigueos y dolor que puede llegar a ser extremo, todo ello en la zona del nervio afectado, donde aparecerá la erupción cutánea. Este dolor puede presentar múltiples características, como punzante, ardiente, picante, etcétera, y se suele desarrollar en brotes agudos y exacerbaciones.[32] Además, el paciente muestra sensibilidad e hiperestesia en el dermatoma afectado. En esta fase, puede haber problemas diagnósticos con otras patologías, como infarto de miocardio, cólico renal, colecistitis, pleuresía o glaucoma, según la zona afectada.[7] Algunos pacientes pueden tener estos síntomas y no desarrollar el rash cutáneo, lo que se denomina «zoster sine herpete», que puede dificultar el diagnóstico.[28]
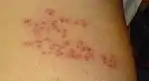
La fase posterior comienza a las 12-24 horas y constituye el desarrollo del característico sarpullido cutáneo. Las lesiones comienzan como manchas eritematosas que pasan a vesículas distribuidas en dermatomas, comúnmente en un patrón que simula un cinturón y sin pasar la línea media del cuerpo. No suelen afectarse más de tres metámeras. Las regiones más comunes son la región media del tórax —desde T3 a L2— y la zona oftálmica de la cara, donde puede tener consecuencias sobre la visión.[4][28] Rara vez ocurren en la mitad distal de las extremidades. Normalmente, aparecen nuevas lesiones durante la primera semana. Al tercer día, las vesículas se van transformando en ampollas llenas de un fluido seroso, generalmente dolorosas y acompañadas de ansiedad y un cuadro pseudogripal con fiebre, cansancio y dolor generalizado. Estas se secan, permaneciendo como costras durante 2 o 3 semanas.[7] Ocasionalmente, el contenido de las vesículas puede ser hemorrágico, y estallar en un plazo de 7 a 10 días. Cuando esto ocurre, resuelven con cicatriz e hiperpigmentación.[28]
 |
 |
 |
 |
Cuando el VVZ afecta a la división oftálmica del nervio trigémino, la erupción aparece en una mitad del cráneo, desde el ojo hasta la coronilla. Si implica a la rama nasociliar de este nervio, el herpes zóster se manifiesta con ampollas en la punta y el lateral de la nariz y puede provocar daños en la córnea. En caso de afectar a las demás divisiones del trigémino u otros nervios craneales, el herpes zóster provoca lesiones en boca, oreja, faringe y laringe.[7]
Las ampollas son contagiosas por contacto directo, normalmente en los primeros 7 días, y pueden pasar de una persona a otra. Si el VVZ pasa de una persona con herpes zóster a otra que nunca ha tenido contacto con el virus, el cuadro que le produce es una varicela. El virus no se contagia a través de la respiración, la tos o el contacto casual. Por ello, la enfermedad sólo es contagiosa en fase ampollosa, y no en las fases inicial, cicatricial o posherpética.[4][28]
Diagnóstico

Cuando la erupción aún no se ha desarrollado o ya han cicatrizado las ampollas, puede ser difícil de diagnosticar. También es así en el caso del zoster sine herpete. Aparte de la erupción, los demás síntomas pueden ocurrir en otras patologías.[33] Si el sarpullido ha aparecido, la identificación de esta patología sólo exige un examen visual, ya que muy pocas enfermedades producen una erupción con una distribución en dermatomas. En ocasiones, el virus del herpes simple (VHS) y el virus coxsackie pueden producir una erupción con este mismo patrón.[8] La preparación de Tzanck es útil para el diagnóstico de la infección aguda con el virus del herpes, pero no distingue entre el VHS y el VVZ.[34] Consiste en un examen microscópico de las células presentes en la base de las lesiones. En caso de estar infectadas por el virus del herpes, se observan células gigantes multinucleadas.[35]
Existen pruebas de laboratorio disponibles para el diagnóstico de herpes zóster. La prueba más utilizada es aquella que detecta los anticuerpos IgM específicos del VVZ en la sangre. Estos aparecen durante el curso del herpes zóster y la varicela, pero no se encuentran mientras el virus está latente.[36] En laboratorios más especializados, los fluidos recogidos de una ampolla pueden usarse para realizar una PCR y compararlas con un patrón de ADN del virus de la varicela zóster. También se puede realizar un cultivo del virus en líneas celulares susceptibles para aislar las partículas víricas e identificarlas con un microscopio electrónico.[8][37]
Diagnóstico diferencial
El herpes zóster puede ser confundido con el herpes simple, la dermatitis herpetiforme y el impétigo, y con lesiones cutáneas producidas por candidiasis, erupciones debidas a fármacos, dermatitis de contacto y picaduras de insectos.[38]
Tratamiento
Aún no se ha encontrado ningún tratamiento curativo, ni es posible la eliminación del virus del organismo. Sin embargo, existen tratamientos que pueden paliar los síntomas, y disminuir la duración y gravedad del proceso.[9] El tratamiento suele ser necesario para la complicación de la neuralgia posherpética. Sin embargo, algunos estudios sobre el dolor que se siente una vez que ha desaparecido la erupción, muestran que, sin tratar, la neuralgia posherpética es muy poco común en personas menores de 50 años y desaparece en poco tiempo. En los afectados mayores de 50 años, el dolor desaparece más lentamente, pero incluso en personas mayores de 70, el 85 % no padece dolor pasado un año desde su ataque de herpes zóster.[39]
Analgésicos
Los pacientes con dolor de leve a moderado pueden ser tratados con analgésicos de venta directa. Las lociones tópicas que contienen calamina se pueden utilizar sobre la erupción. En ocasiones, el dolor intenso puede requerir una medicación opioide, como la morfina. Una vez que las lesiones hayan formado costra, se pueden utilizar las cremas con capsaicina. El uso tópico de lidocaína puede reducir el dolor.[40] La administración de gabapentina con antivirales puede producir un alivio de la neuralgia posherpética.[9]
Antivirales

El aciclovir inhibe la replicación del ADN viral, y se usa tanto como tratamiento, como para la prevención. Durante la fase aguda, se recomienda este fármaco vía oral, ya que se ha mostrado como el más efectivo en disminuir la progresión de los síntomas, y en prevenir la neuralgia posherpética.[41] Otros antivirales utilizados son el valaciclovir y el famciclovir, que tienen una posología más cómoda que el anterior. Al ser ambos fármacos precursores del aciclovir, con dosis menores se obtienen concentraciones superiores en el organismo, con un efecto más duradero que el aciclovir. El valaciclovir tiene una eficacia similar al aciclovir, pero es mejor con respecto a la reducción de la incidencia y la duración de la neuralgia posherpética. El famciclovir no ofrece mejoras en el dolor agudo o crónico, pero sí acelera la cicatrización de las lesiones.[42]
La brivudina es otro fármaco que inhibe la función de las ADN polimerasas cuando se une al ADN vírico, lo que impide la replicación del virus. Se trata de un antiviral no nefrotóxico más potente que el aciclovir. El número de dosis recomendadas es de una al día, lo que hace que su posología sea bastante más cómoda. Además, ha demostrado una disminución de la incidencia de la neuralgia posherpética superior a la del aciclovir.[42]
Para el tratamiento del herpes zóster oftálmico, se prefiere el uso del valaciclovir, ya que tiene una eficacia similar que el aciclovir en esta manifestación de la enfermedad, pero con la ventaja de que se administra tres veces al día en comparación con las cinco dosis del aciclovir.[43][44]
Esteroides
La administración oral de corticosteroides se usa con frecuencia en el tratamiento de la infección, a pesar de que los ensayos clínicos con este tratamiento son poco convincentes. Asociados a fármacos antivirales, la ACTH, la prednisona, la prednisolona y la triamcinolona han demostrado ser eficaces en la reducción del dolor durante la fase aguda del herpes zóster, mejorando la calidad de vida de los pacientes. Sin embargo, no modifican la evolución o la curación de las lesiones cutáneas, ni afecta al desarrollo de la neuralgia postherpetica.[42][45]
Otros fármacos
La cimetidina, uno de los fármacos utilizados para patologías gastrointestinales, tiene eficacia demostrada en la disminución de la gravedad del cuadro, si bien aún no se ha aprobado su uso para el herpes zóster.[46][47][48] Por otro lado, se ha demostrado que la cimetidina y el probenecid reducen el aclaramiento renal del aciclovir. Los estudios han demostrado que estos fármacos reducen la metabolización de valaciclovir a aciclovir. El aclaramiento de aciclovir se reducía aproximadamente en un 24 % y un 33 % respectivamente con cada fármaco, y aumentaban los niveles plasmáticos máximos de aciclovir en un 8 y un 22 %. Las modificaciones farmacocinéticas no afectaron a la seguridad del valaciclovir. Debido a la tendencia del aciclovir a precipitar en los túbulos renales, la combinación de estos fármacos debe realizarse con precaución, especialmente en pacientes con insuficiencia renal.[49]
Terapias complementarias
Algunas opciones terapéuticas como las enzimas digestivas eran utilizadas antes de la era de los antivirales. Las enzimas pancreáticas fueron una opción terapéutica en diversos países, y se llevaron a cabo múltiples investigaciones con resultados prometedores.[50][51] Los resultados de un estudio clínico llevado a cabo en Alemania revelaron que el tratamiento con tripsina, quimiotripsina y papaína era igual de eficaz que la administración de aciclovir.[52] Los ensayos clínicos apoyan la idea de que la terapia enzimática oral es beneficiosa en pacientes que además tienen patologías con un aumento de la producción de factor de crecimiento tumoral-beta (β-TGF).[53] Por otro lado, se ha encontrado un aumento de los niveles de β-TGF en pacientes con VVZ.[54][55] Parece ser que los preparados enzimáticos aceleran la descomposición de los complejos inmunes y fortalecen el sistema inmunitario.[52]
También se ha demostrado que el uso del aminoácido lisina inhibe la replicación del VVZ.[56] Los síntomas de los pacientes recurrentes de herpes zóster a los que se les ha administrado este aminoácido son menos graves.[57]
Pronóstico
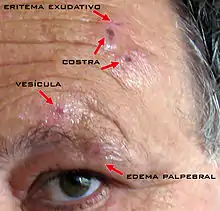
La erupción cutánea junto al dolor normalmente persiste de 3 a 5 semanas. Muchos pacientes presentan un cuadro doloroso crónico denominado neuralgia posherpética, difícil de tratar, que persiste cuando ha desaparecido la irritación. Ésta es más frecuente en mayores de 60 años y puede llegar a incapacitar al paciente dada su intensidad. Suele remitir tras varios meses, aunque la duración también está condicionada por la edad. La parálisis motora se produce cuando el virus se extiende a las zonas contiguas del ganglio nervioso infectado y afecta a los músculos cercanos al dermatoma implicado. En casi todos los casos se produce una recuperación total de la función. Una complicación potencialmente grave, pero infrecuente, es la insuficiencia respiratoria por parálisis diafragmática, en caso de afectación del nervio vago o X par craneal. Otras complicaciones neurológicas que pueden acompañar al herpes zóster incluyen meningoencefalitis, mielitis transversa y polineuropatías.[7]
En el caso del herpes zóster en la cara, se pueden producir complicaciones tales como parálisis facial, habitualmente de la zona temporal y disminución de la audición o encefalitis en el llamado síndrome de Ramsay Hunt, cuando están implicados el nervio facial y el nervio vestibulococlear. El zóster oftálmico requiere atención oftalmológica urgente, ya que deriva en complicaciones oculares en el 20-70 % de los pacientes, tales como conjuntivitis mucopurulenta, epiescleritis, queratitis, glaucoma secundario y uveítis anterior. Pueden existir parálisis de los pares craneales III, IV y VI, provocando problemas en el movimiento ocular. El zóster oftálmico es la causa principal de la necrosis aguda de la retina, una patología que puede provocar ceguera.[58] Otra complicación de la afectación del nervio oftálmico es el síndrome de herpes zóster y hemiplejía contralateral tardía, que aparece semanas después de los síntomas cutáneos y cursa con uno o varios infartos cerebrales debido a una angeitis granulomatosa de las arterias cerebrales.[7]
En individuos inmunodeprimidos puede producirse el herpes zóster generalizado: las lesiones aparecen a distancia del dermatoma afectado al diseminarse el virus por vía hematógena desde el ganglio, el nervio o la piel infectada. El herpes zóster necrótico se produce cuando las ampollas evolucionan a úlceras profundas y necróticas, que puede conllevar sobreinfección bacteriana y una posterior septicemia.[59]
Profilaxis
La única vacuna que existe hasta el momento contra el herpes zóster es la Zostavax®, desarrollada por la compañía farmacéutica estadounidense MSD.[10] Es una vacuna atenuada, es decir, está compuesta por virus vivos que han perdido su virulencia y patogenicidad. Estos se multiplican en el organismo del huésped con normalidad y provocan una respuesta inmune al igual que lo haría durante una infección natural, pero sin provocar un estado patológico. Se refuerza así la inmunidad específica al VVZ en la persona vacunada.[60]
Para comprobar la eficacia de esta vacuna, se realizó un estudio en 38 546 personas mayores de 60 años no inmunodeprimidos, a los que se les dividió en dos grupos. La farmacéutica administró un placebo al grupo control y Zostavax® al otro. Los resultados mostraron una reducción del 51,3 % en la incidencia de herpes zóster, y un 66,5 % la de la neuralgia posherpética. Como prevención del desarrollo del herpes zóster, la vacuna fue más eficaz en aquellos pacientes que tenían entre 60 y 69 años, mientras que para prevenir la NPH fue más efectiva para los mayores de 70 años.[10]
Sin embargo, previamente al desarrollo de la vacuna se conocía el hecho de que los adultos podían adquirir inmunidad natural a través del contacto con niños con varicela, lo cual ayudaba a disminuir la reactivación de herpes zóster.[61][62] La ingesta de micronutrientes, como vitaminas antioxidantes (vitamina A, C, E) o la vitamina B, así como el consumo de fruta fresca, pueden reducir el riesgo de padecer herpes zóster. Un estudio en el que un grupo de pacientes tomaban menos de una ración diaria de fruta mostraron un riesgo tres veces mayor de zóster que el grupo que consumía más de tres raciones diarias. Este efecto fue visible también para personas mayores de 60 años.[63]
Véase también
Notas
- El nombre fuego de San Antonio designaba principalmente al ergotismo, que durante siglos devastó Europa occidental.[5] Pero posteriormente se usó ese nombre también para el herpes zóster, creando confusión.[6]
Referencias
- Édouard Monneret, Louis Fleury (1848). Tratado completo de patología interna 7. Imprenta Vda. de Jordán é Hijos. p. 374. «Herpes zóster (fuego de San Antonio, fuego sacro, ignis sacer, erisipela pustulosa, zona, zona repens, zona serpiginosa, herpes flictenoides en zona de Alibert) ».
- Castañeda Fernández, J.A.; del Corral García, J. (2003). «Neuropatías periféricas». Medisan 7 (4). Archivado desde el original el 18 de agosto de 2011. Consultado el 18 de agosto de 2011.
- «Herpes zóster». www.fesemi.org. Consultado el 26 de septiembre de 2021.
- Zamula, Evelyn (2005). Administración de Alimentos y Medicamentos de los Estados Unidos, ed. «Shingles: An Unwelcome Encore» (en inglés). Consultado el 6 de enero de 2011.
- José Miguel Soriano del Castillo (2007). Micotoxinas en alimentos. Díaz de Santos. p. 6. ISBN 9788479788087. «Es importante saber que el fuego de San Antonio es el ergotismo, y no el escorbuto o el herpes zóster ».
- Joseph Jakob von Plenck (1798). Tratado de enfermedades cutáneas. Pedro Pereyra, Imprenta Real (Madrid). p. 22. «Zona seu zoster.[...] Otros llaman a esta enfermedad ignis sacer, o fuego de San Antonio, o erisipela pustulosa ».
- Thomas B. Fitzpatrick (2009). «194. Varicela y herpes zóster». Dermatología en medicina general. 3º (7.ª edición). Médica Panamericana. pp. 1885-1898. ISBN 978-950-06-1699-7. Consultado el 30 de marzo de 2011.
- Mandell,Gerald L.; Bennett, John E.; Dolin, Raphael (2006). «133. Virus de la varicela zóster». Enfermedades Infecciosas: principios y prácticas 2 (6ª edición). Elsevier. pp. 1780-1784. ISBN 84-8174-955-9. Consultado el 30 de marzo de 2011.
- Tyring SK (2007). «Management of herpes zoster and postherpetic neuralgia». J Am Acad Dermatol 57 (6 Suppl): S136-42. PMID 18021865. doi:10.1016/j.jaad.2007.09.016.
- Oxman, MN., Levin MJ., Johnson GR., et al. (2005). «A vaccine to prevent herpes zoster and postherpetic neuralgia in older adults». N Engl J Med (en inglés) 253 (22): 2271-2284. ISSN 1533-4406. Consultado el 31 de marzo de 2011.
- Rafael Falabella Falabella (2005). «29. Herpes zóster». Dermatología (6ª edición). Corporación para Investigaciones Biológicas. pp. 129-132. ISBN 958-9400-56-6.
- Weinberg JM (2007). «Herpes zoster: epidemiology, natural history, and common complications». J Am Acad Dermatol 57 (6 Suppl): S130-5. PMID 18021864. doi:10.1016/j.jaad.2007.08.046.
- Weller TH (2000). «Chapter 1. Historical perspective». En Arvin AM, Gershon AA, ed. Varicella-Zoster Virus: Virology and Clinical Management. Cambridge University Press. ISBN 0521660246.
- Oaklander AL (octubre de 1999). «The pathology of shingles: Head and Campbell's 1900 monograph». Arch. Neurol. 56 (10): 1292-4. PMID 10520948. doi:10.1001/archneur.56.10.1292.
- Weller TH (1953). «Serial propagation in vitro of agents producing inclusion bodies derived from varicella and herpes zoster». Proc. Soc. Exp. Biol. Med. 83 (2): 340-6. PMID 13064265.
- Holt LE, McIntosh R (1936). Holt's Diseases of Infancy and Childhood. D Appleton Century Company. pp. 931-3.
- Weller TH (1997). «Varicella-herpes zoster virus». En Evans AS, Kaslow RA, ed. Viral Infections of Humans: Epidemiology and Control. Plenum Press. pp. 865-92. ISBN 978-0306448553.
- Schmader K, George LK, Burchett BM, Pieper CF (1998). «Racial and psychosocial risk factors for herpes zoster in the elderly.». J Infect Dis 178 (Suppl 1): S67-70. PMID 9852978.
- Schmader K, George LK, Burchett BM, Hamilton JD, Pieper CF (1998). «Race and stress in the incidence of herpes zoster in older adults.». J Am Geriatr Soc 46 (8): 973-7. PMID 9706885.
- Livengood JM (2000). «The role of stress in the development of herpes zoster and postherpetic neuralgia». Curr Rev Pain 4 (1): 7-11. PMID 10998709.
- Gatti A, Pica F, Boccia MT, De Antoni F, Sabato AF, Volpi A. (2010). «No evidence of family history as a risk factor for herpes zoster in patients with post-herpetic neuralgia.». J Med Virol 82 (6): 1007-11. PMID 20419815.
- Volpi A (2007). «Severe complications of herpes zoster» (PDF). Herpes 14 (Suppl 2): 35A-9A. PMID 17939894. Archivado desde el original el 27 de enero de 2019. Consultado el 22 de agosto de 2011.
- Coplan P, Black S, Rojas C (2001). «Incidence and hospitalization rates of varicella and herpes zoster before varicella vaccine introduction: a baseline assessment of the shifting epidemiology of varicella disease». Pediatr Infect Dis J 20 (7): 641-5. PMID 11465834. doi:10.1097/00006454-200107000-00002.
- Weaver BA (1 de marzo de 2007). «The burden of herpes zoster and postherpetic neuralgia in the United States». J Am Osteopath Assoc 107 (3 Suppl): S2-7. PMID 17488884. Archivado desde el original el 13 de enero de 2008.
- Büchen-Osmond, C., ed. (2006). «Human herpesvirus 3». ICTVdB - The Universal Virus Database (en inglés). Universidad de Columbia, Nueva York, EE.UU. Archivado desde el original el 5 de enero de 2016. Consultado el 30 de marzo de 2011.
- Romero Cabello, Raúl (2007). «30. Familia hespesviridae». Microbiología y parasitología humana (3ª edición). Médica Panamericana. p. 291. ISBN 978-968-7988-48-1. Consultado el 30 de marzo de 2011.
- Quevauvilliers,J.; Perlemuter, L. «Herpes zóster (zona)». Diccionario de enfermería (2ª edición). Elsevier. pp. 389-390. ISBN 978-84-458-1251-8. Consultado el 30 de marzo de 2011.
- Stankus, SJ.; Dlugopolski, M.; Packer, D. (2000). «Management of Herpes Zoster (Shingles) and Postherpetic Neuralgia». Am Fam Physician (en inglés) 61 (8): 2437-2447. ISSN 0002-838X. Archivado desde el original el 29 de septiembre de 2007. Consultado el 4 de abril de 2011.
- Donahue, JG., Choo, PW., Manson, JE., Platt, R.año=1995. «The incidence of herpes zoster». Arch Intern Med (en inglés) 15 (155): 1605-1609. ISSN 0003-9926. Consultado el 4 de abril de 2011.
- Dworkin RH, Johnson RW, Breuer J et al. (2007). «Recommendations for the management of herpes zoster». Clin. Infect. Dis. 44 Supl 1: S1-26. PMID 17143845. doi:10.1086/510206.
- Zamula, E. (2001). «Shingles: an unwelcome encore». FDA Consumer (en inglés) 35 (3): 21-5. PMID 11458545. Consultado el 27 de marzo de 2011.
- Katz J, Cooper EM, Walther RR, Sweeney EW, Dworkin RH (2004). «Acute pain in herpes zoster and its impact on health-related quality of life». Clin. Infect. Dis 39 (3): 342-8. PMID 15307000. doi:10.1086/421942.
- Chan J, Bergstrom RT, Lanza DC, Oas JG (2004). «Lateral sinus thrombosis associated with zoster sine herpete». Am J Otolaryngol (en inglés) 25 (5): 357-60. PMID 15334402. doi:10.1016/j.amjoto.2004.03.007.
- Oranje AP, Folkers E (1988). «The Tzanck smear: old, but still of inestimable value». Pediatr Dermatol (en inglés) 5 (2): 127-9. PMID 2842739. doi:10.1111/j.1525-1470.1988.tb01154.x.
- Kelley, William N. (1992). «Reumatología, alergia y dermatología». Medicina interna (2ª edición). Médica Panamericana. p. 1122. ISBN 978-950-06-1230-2. Consultado el 27 de marzo de 2011.
- Arvin AM (1996). «Varicella-zoster virus» (PDF). Clin. Microbiol. Rev (en inglés) 9 (3): 361-81. PMC 172899. PMID 8809466. Archivado desde el original el 25 de junio de 2008. Consultado el 27 de marzo de 2011.
- Beards G, Graham C, Pillay D (1998). «Investigation of vesicular rashes for HSV and VZV by PCR». J. Med. Virol (en inglés) 54 (3): 155-7. PMID 9515761. doi:10.1002/(SICI)1096-9071(199803)54:3<155::AID-JMV1>3.0.CO;2-4.
- Sampathkumar P, Drage LA, Martin DP (marzo de 2009). «Herpes zoster (shingles) and postherpetic neuralgia». Mayo Clin Proc (Revisión) 84 (3): 274-80. PMC 2664599. PMID 19252116. doi:10.1016/S0025-6196(11)61146-4.
- Sigurdur Helgason et al (2000). «Prevalence of postherpetic neuralgia after a single episode of herpes zoster: prospective study with long term follow up» (PDF). British Medical Journal 321 (7264): 794-6. PMC 27491. PMID 11009518. doi:10.1136/bmj.321.7264.794.
- Baron R (2004). «Post-herpetic neuralgia case study: optimizing pain control». Eur. J. Neurol. 11 Suppl 1: 3-11. PMID 15061819. doi:10.1111/j.1471-0552.2004.00794.x.
- Johnson, RW & Dworkin, RH (2003). «Clinical review: Treatment of herpes zoster and postherpetic neuralgia». BMJ 326 (7392): 748. PMC 1125653. PMID 12676845. doi:10.1136/bmj.326.7392.748.
- Rey Pérez, Antoni. «Neuralgia posherpética». Dolor Neuropático. Neurología caso a caso (1ª edición). Médica Panamericana. p. 34. ISBN 978-84-9835-190-3.
- Colin J, Prisant O, Cochener B, Lescale O, Rolland B, Hoang-Xuan T (2000). «Comparison of the Efficacy and Safety of Valaciclovir and Acyclovir for the Treatment of Herpes zoster Ophthalmicus». Ophthalmology 107 (8): 1507-11. PMID 10919899. doi:10.1016/S0161-6420(00)00222-0.
- Osterberg L, Blaschke T (2005). «Adherence to medication». N. Engl. J. Med. 353 (5): 487-97. PMID 16079372. doi:10.1056/NEJMra050100.
- Whitley RJ, Weiss H, Gnann JW, Tyring S, Mertz GJ, Pappas PG, Schleupner CJ, Hayden F, Wolf J, Soong SJ (1996). «Acyclovir with and without prednisone for the treatment of herpes zoster. A randomized, placebo-controlled trial. The National Institute of Allergy and Infectious Diseases Collaborative Antiviral Study Group». Ann. Intern. Med. 125 (5): 376-83. PMID 8702088.
- Kapinska-Mrowiecka M., Toruwski G (1996). «Efficacy of cimetidine in treatment of herpes zoster in the first 5 days from the moment of disease manifestation». Pol Tyg Lek. (en inglés). 23-26 (51): 338-339. ISSN 0860-8857. Consultado el 29 de marzo de 2011.
- Hayne ST., Mercer JB (1983). «Herpes zoster: treatment with cemetidine». Can Med Assoc J (en inglés) 12 (129): 1284-1285. ISSN 0008-4409. Consultado el 27 de marzo de 2011.
- Notmann J., Arieli J., Hart J., et al. (1994). «In vitro cell-mediated immune reactions in herpes zoster patients treated with cimetidine». Asian Pac J Allergy Immunol (en inglés) 1 (12): 51-58. ISSN 0125-877X. Consultado el 27 de marzo de 2011.
- De Bony F., Tod M., Bidault R., et al. (2002). «Multiple interactions of cimetidine and probenecid with valaciclovir and its metabolite acyclovir». Antimicrob Agents Chemother (en inglés) 2 (46): 458-463. ISSN 1532-0227. Consultado el 27 de marzo de 2011.
- Billigmann P. (1995). «Enzyme therapy--an alternative in treatment of herpes zoster. A controlled study of 192 patients». Fortschr Med (en inglés) 4 (113): 43-8. ISSN 0015-8178. Consultado el 27 de marzo de 2011.
- Roxas M (2006). «Herpes zoster and postherpetic neuralgia: diagnosis and therapeutic considerations». Altern Med Rev (en inglés) 2 (11): 102-13. ISSN 1089-5159. Consultado el 27 de marzo de 2011.
- Murray, Michael T. La curación del cáncer (1ª edición). Robin book. p. 236. ISBN 84-7927-658-4.
- Desser L., Holomanova D., Zavadova E., et al. (2001). «Oral therapy with proteolytic enzymes decreases excessive TGF-beta levels in human blood». Cancer Chemother Pharmacol (en inglés) (47). ISSN 0344-5704. Consultado el 27 de marzo de 2011.
- Kaygusuz I., Gödekmerdan A., Keleş E., et al. (2004). «The role of viruses in idiopathic peripheral facial palsy and cellular immune response». Am J Otolaryngol (en inglés) 6 (25): 401-6. ISSN 0196-0709. PMID 15547808. Consultado el 27 de marzo de 2011.
- Sato M., Abe T., Tamai M. (2000). «Expression of the Varicella Zoster Virus Thymidine Kinase and Cytokines in Patients with Acute Retinal Necrosis Syndrome». Jpn J Ophthalmol (en inglés) 6 (44): 693. ISSN 0021-5155. Consultado el 27 de marzo de 2011.
- Griffith, RS., Walsh DE., Myrmel KH., et al. (1987). «Success of L-lysine therapy in frequently recurrent herpes simplex infection. Treatment and prophylaxis». Dermatologica (en inglés) 4 (175): 183-190. ISSN 0011-9075. Consultado el 27 de marzo de 2011.
- Griffith, RS., Walsh DE., Myrmel KH., et al. (1987). «Success of L-lysine therapy in frequently recurrent herpes simplex infection. Treatment and prophylaxis». Dermatologica (en inglés) 4 (175): 183-190. ISSN 0011-9075. Consultado el 27 de marzo de 2011.
- Johnson, RW., Dworkin, RH. (2003). «Clinical review: Treatment of herpes zoster and postherpetic neuralgia». BMJ (en inglés) 326 (7392). ISSN 0959-8138. Consultado el 6 de septiembre de 2007..
- Ferrandiz, C. (2001). «Infecciones por virus». Dermatología clínica (2ª edición). Elsevier. pp. 51-52. ISBN 84-8174-537-5. Consultado el 5 de abril de 2011.
- Piédrola Gil, G.; Sáenz González, M. C.; Valero Juan, L. F. (2002). «39. Características generales de las vacunas». Medicina preventiva y salud publica (10ª edición). Masson. pp. 436-437. ISBN 84-458-1024-3. Texto «31 de marzo de 2011» ignorado (ayuda)
- Brisson M., Gay N., Edmunds W. et al. (2002). «Exposure to varicella boosts immunity to herpes-zoster: implications for mass vaccination against chicken pox». Vaccine (en inglés) 20 (19-20). ISSN 0264-410X. Consultado el 31 de marzo de 2011.
- En Massachusetts, la campaña masiva de vacunación contra la varicela llevada a cabo entre 1999 y 2003 aumentó la incidencia en un 90 %, de 27,7 a 52,5 casos por cada 100,000 habitantes y año.
Yih, WK., Brooks DR., Lett SM., et al. (2005). «The incidence of varicella and herpes zoster in Massachusetts as measured by the Behavioral Risk Factor Surveillance System (BRFSS) during a period of increasing varicella vaccination coverage, 1998-2003». BMC Public Health |volumen=5 (en inglés) (1). ISSN 1471-2458. Consultado el 31 de marzo de 2011. - Thomas SL., Wheeler JG., Hall AJ. (2006). «Micronutrient intake and the risk of herpes zoster: a case-control study». Int J Epidemiol (en inglés) 35 (2). ISSN 1464-3685. Consultado el 31 de marzo de 2011.
_Virus_PHIL_1878_lores.jpg.webp)
