Teleostei
Los teleósteos (Teleostei) son una infraclase de peces óseos actinopterigios que incluye el 96 % de todas las especies de peces existentes. Se han descrito más de 26 000 especies, organizadas en unos 40 órdenes y unas 450 familias. Su tamaño va desde el pez remo gigante (Regalecus glesne), que puede medir más de siete metros, o el pez luna (Mola mola), que puede alcanzar las dos toneladas, hasta el diminuto Photocorynus spiniceps macho, de tan solo seis milímetros de longitud. La mayoría son fusiformes, pero pueden tener forma aplanada vertical u horizontalmente, serpentiforme, globular o adoptar formas especializadas, como los rapes o los caballitos de mar.
| Teleósteos | ||
|---|---|---|
| Rango temporal: Triásico Inferior-Presente[1][2] | ||
.jpg.webp) Ilustración de Castelnau (1856). De izquierda a derecha y de arriba abajo: Fistularia tabacaria, Mylossoma duriventre, Mesonauta acora, Brochis splendens, Pseudacanthicus spinosus, Acanthurus coeruleus, Stegastes pictus | ||
| Taxonomía | ||
| Reino: | Animalia | |
| Filo: | Chordata | |
| Clase: | Actinopterygii | |
| Subclase: | Neopterygii | |
| Infraclase: |
Teleostei Müller, 1845 | |
| Subdivisiones | ||
Ver texto | ||
Una de las principales diferencias entre los teleósteos y otros peces óseos radica en los huesos de la mandíbula; los teleósteos tienen un premaxilar de alta movilidad e independiente del cráneo que les permite la protrusión de la mandíbula y les facilita sujetar a la presa y atraerla hacia la boca. En la mayoría de teleósteos derivados su amplio premaxilar es el principal hueso portador de dientes y el maxilar, que está unido a la mandíbula inferior, actúa como palanca, empujando y tirando del premaxilar al abrir y cerrar la boca; unos huesos situados en la parte posterior de la boca sirven para triturar y tragar la comida. Otra diferencia es que los lóbulos superior e inferior de la aleta caudal son de un tamaño casi igual. La columna vertebral termina en el pedúnculo caudal, lo que distingue a este grupo de otros peces en los que la columna vertebral se extiende hasta el lóbulo superior de la aleta caudal.
Han adoptado diversas estrategias reproductivas. La mayoría utiliza la fecundación externa: la hembra pone un grupo de huevos, el macho los fecunda y las larvas se desarrollan sin más participación de los padres. Algunos son hermafroditas secuenciales y comienzan su vida como hembras y pasan a ser machos en algún momento y unas pocas especies invierten este proceso. Un pequeño porcentaje de especies son vivíparas[3] y algunas proporcionan cuidados parentales, normalmente el pez macho vigila el nido y abanica los huevos para mantenerlos bien oxigenados.
Constituyen un importante recurso económico para el ser humano; se capturan como fuente de alimento o como práctica deportiva. Algunas especies son comunes en la piscicultura y se estima que este método de producción sea cada vez más importante en el futuro. Otras se mantienen en acuarios o se utilizan en la investigación, especialmente en los campos de la genética y la biología del desarrollo.
Anatomía
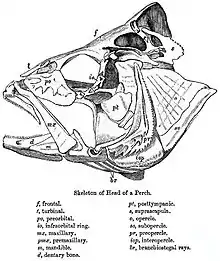
Los teleósteos se caracterizan por contar con un premaxilar móvil, arcos neurales[n 1] alargados en el extremo de la aleta caudal y placas dentales basibranquiales desparejadas.[n 2][6] El premaxilar no está unido al neurocráneo (caja cerebral); desempeña un papel en la protrusión de la boca y la creación de una abertura circular, lo que disminuye la presión dentro de la boca, succionando la presa en su interior. Luego la mandíbula inferior y el maxilar se retraen para cerrar la boca y el pez es capaz de sujetar la presa; si solo se cerraran las mandíbulas, se corre el riesgo de que el alimento salga de la boca. En los teleósteos más avanzados el premaxilar es mayor y está dotado de dientes, mientras que el maxilar carece de ellos. El maxilar sirve para empujar tanto el premaxilar como la mandíbula inferior hacia delante. Para abrir la boca un músculo aductor tira hacia atrás de la parte superior del maxilar, empujando la mandíbula inferior hacia delante. Además, el maxilar gira ligeramente, lo que empuja hacia delante una protuberancia ósea que encaja en el premaxilar.[7]

Las mandíbulas faríngeas de los teleósteos, un segundo conjunto de mandíbulas situadas en la garganta, se componen de cinco arcos branquiales, una serie de «bucles» óseos presentes en los peces que sostienen las branquias. Los tres primeros arcos incluyen un único hueso basibranquial rodeado por dos hipobranquiales, ceratobranquiales, epibranquiales y faringobranquiales. El basibranquial medio está cubierto por una placa dental. El cuarto arco está compuesto por parejas de ceratobranquiales y epibranquiales y en ocasiones adicionalmente por algunas faringobranquiales y una basibranquial. La base de las mandíbulas faríngeas inferiores está formada por los quintos ceratobranquiales, mientras que los segundos, terceros y cuartos faringobranquiales crean la base de las superiores. En los teleósteos más basales las mandíbulas faríngeas constan de partes delgadas y bien separadas que se unen al neurocráneo, la cintura escapular y el hueso hioides. Su función se limita al transporte de alimentos y dependen en gran medida de la actividad de la mandíbula inferior. En los teleósteos más derivados las mandíbulas son más potentes y los ceratobranquiales izquierdo y derecho se fusionan para formar una sola mandíbula inferior; los faringobranquiales se fusionan para crear una gran mandíbula superior que se articula con el neurocráneo. También han desarrollado un músculo que permite a las mandíbulas faríngeas participar en la trituración de los alimentos, además de transportarlos.[8]
La aleta caudal es homocercal, esto es, los lóbulos superior e inferior tienen un tamaño casi igual. La espina termina en el pedúnculo caudal, la base de la aleta caudal, lo que distingue a este grupo de aquellos en los que esta se extiende hasta el lóbulo superior de la aleta caudal, como la mayoría de los peces del Paleozoico. Los arcos neurales se alargan para formar los uroneurales, que proporcionan soporte a este lóbulo superior.[7] Además los hipurales, huesos que forman una placa aplanada en el extremo posterior de la columna vertebral, están agrandados proporcionando un mayor soporte a la aleta caudal.[9]
En general tienden a ser más rápidos y flexibles que los peces óseos más basales y su estructura esquelética ha evolucionado hacia una mayor ligereza. Aunque los huesos de los teleósteos están bien calcificados, están construidos a partir de un entramado de soportes, en lugar de los densos huesos cancelosos[n 3] de los peces holósteos. Además, la mandíbula inferior de los teleósteos se reduce a solo tres huesos: el dentario,[n 4] el angular y el articular.[11]
Evolución y filogenia
Relaciones externas
Los teleósteos se reconocieron por primera vez como un grupo independiente por el ictiólogo alemán Johannes Peter Müller en 1845.[12] Su nombre proviene del griego τέλειος téleios 'completo' y ὀστέον ostéon 'hueso',[13] Müller basó esta clasificación en ciertas características de los tejidos blandos, lo que resultó ser problemático, ya que no tenía en cuenta los rasgos distintivos de los teleósteos fósiles, por lo que 1966 Greenwood et al. ofrecieron una clasificación más consistente.[14][15] Los fósiles de teleósteos más antiguos conocidos se remontan a finales del Triásico y evolucionan a partir de peces emparentados con las amias en el clado Holostei. Durante el Mesozoico y el Cenozoico los teleósteos se diversificaron y acabaron constituyendo la gran mayoría de las especies de peces existentes. El siguiente cladograma muestra la relación de los teleósteos con otros peces óseos[16] y con los vertebrados terrestres (tetrápodos) que evolucionaron a partir de un grupo de peces relacionado.[17][18] Las fechas aproximadas están tomadas de Near et al., 2012.[16]
| Osteichthyes |
| |||||||||||||||||||||||||||||||||||||||||||||||||||
Relaciones internas
La filogenia de los teleósteos fue objeto de un prolongado debate, sin que se llegara a un consenso ni sobre la estructura de su árbol filogenético ni sobre el momento de la aparición de los principales grupos hasta la utilización de los modernos sistemas de análisis cladísticos basados en el ADN. Near et al. (2012) estudiaron la filogenia y los períodos de divergencia de cada uno de los principales linajes, analizando las secuencias de ADN de nueve genes no vinculados en 232 especies. Consiguieron filogenias consolidadas con un respaldo sólido para los nodos, por lo que es probable que el patrón de ramificación propuesto sea correcto. Calibraron (establecieron valores reales) los periodos de ramificación en este árbol a partir de 36 mediciones fiables del tiempo absoluto a partir del registro fósil.[16] En el siguiente cladograma se muestran los principales clados de los teleósteos.[19][16]
| Teleostei |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 310 Ma |
Rasgos evolutivos

Los primeros fósiles que pueden asignarse a este complejo grupo se remontan al Triásico Inferior,[20] tras lo cual los teleósteos han ido adoptando nuevas estructuras corporales de forma generalmente gradual durante los primeros 150 millones de años de su evolución.[20]
Los teleósteos más basales son Elopomorpha (anguilas y similares) y Osteoglossomorpha (peces elefante y similares). Hay clasificadas unas 800 especies de elopomorfos, casi todas marinas, cuyas larvas son leptocéfalas, caracterizadas por estar aplanadas dorsolateralmente y que se convierten en adultos morfológicamente muy distintos. Entre los elopomorfos, las anguilas tienen cuerpos alargados con fajas pélvicas perdidas y costillas y elementos fusionados en la mandíbula superior. Las aproximadamente 200 especies de osteoglosomorfos se definen por un elemento óseo en la lengua que cuenta con un basibranquial en su parte posterior, y ambas estructuras tienen grandes dientes que se emparejan con los del paraesfenoide en el paladar. El clado Otocephala incluye Clupeiformes (arenques) y Ostariophysi (carpas, peces gato y afines). Los teleósteos clupeiformes están formados por unas 350 especies vivas de arenques y similares. Este grupo se caracteriza por un escudo abdominal[n 5] poco común y una disposición diferente de los hipurales; en la mayoría de las especies la vejiga natatoria se extiende hasta la cavidad cerebral y desempeña un papel en la audición. Ostariophysi, que engloba a la mayoría de los peces de agua dulce, incluye especies que han desarrollado algunas adaptaciones singulares,[7] como el aparato weberiano, una disposición de huesos (huesecillos de Weber) que conecta la vejiga natatoria con el oído interno, lo que mejora su audición ya que las ondas sonoras hacen vibrar la vejiga y los huesos transportan las vibraciones al oído interno;[21][22] también disponen de un sistema de alarma química que, cuando un pez resulta herido, emiten una sustancia de advertencia al agua alarmando a los peces cercanos.[23]
La mayoría de las especies de teleósteos pertenecen al clado Euteleostei, que consta de más de 17 000 especies clasificadas en casi 3000 géneros y unas 350 familias.[24] Entre los rasgos que comparten los euteleósteos se encuentran las similitudes en el desarrollo embrionario de las estructuras óseas o cartilaginosas situadas entre la cabeza y la aleta dorsal (huesos supraneurales), una excrecencia en el hueso estegural (un hueso situado cerca de los arcos neurales de la cola) y los cartílagos caudales medios situados entre los hipurales de la base caudal. La mayor parte de las especies de este grupo pertenecen al clado Neoteleostei. Un rasgo derivado de los neoteleósteos es un músculo que controla las mandíbulas faríngeas, lo que les proporciona una funcionalidad de trituración del alimento. Los miembros de Acanthopterygii tienen una aleta dorsal espinosa que se encuentra delante de la aleta dorsal de nervios blandos que les proporciona empuje en la locomoción y también puede desempeñar un papel en la defensa.[25] [26] Los acantomorfos han desarrollado escamas ctenoides espinosas (a diferencia de las escamas cicloides de otros grupos), premaxilar con dientes y una mayor adaptación a la natación de alta velocidad.[7]
Se consideraba que la aleta adiposa, presente en más de 6000 especies de teleósteos, ha evolucionado en una ocasión en su linaje y se ha perdido varias veces debido a su limitada función; un estudio de 2014 cuestiona esta teoría y propone que la aleta adiposa es un ejemplo de evolución convergente. En Characiformes la aleta adiposa se desarrolla a partir de una excrecencia tras la reducción del pliegue de la aleta larvaria, mientras que en Salmoniformes la aleta parece ser un remanente del pliegue.[27]
Diversidad

Existen más de 26 000 especies de teleósteos, distribuidas en unos 40 órdenes y 448 familias,[28] que constituyen el 96 % de todas las especies de peces existentes.[29] Aproximadamente 12 000 especies se encuentran en hábitats de agua dulce,[30] aunque los teleósteos se encuentran en casi todos los medios acuáticos. Han desarrollado múltiples especializaciones para alimentarse según la especie (carnívoros, herbívoros, filtradores y parásitos).[31] El teleósteo actual de mayor tamaño es el pez remo gigante (Regalecus glesne), que puede alcanzar más de 7 m de longitud,[32][33] aunque lo eclipsa el extinto Leedsichthys, del que de un ejemplar se ha calculado que alcanzaba los 27,6 m de longitud;[34] el de mayor peso es el pez luna (Mola mola), con un espécimen capturado en 2003 que tenía un peso estimado de 2,3 t,[35][36] mientras que el adulto de menor tamaño es el macho de Photocorynus spiniceps, que puede medir solo 6,2 mm, aunque la hembra, mucho mayor, puede alcanzar los 50 mm.[37][32] El pez infante (Schindleria brevipinguis) es el de menor tamaño y peso, de hecho, es el vertebrado más pequeño del mundo: la hembra mide 8,4 mm y el macho solo 7 mm.[38]

Las especies de aguas abiertas suelen adoptar formas hidrodinámicas, ahusadas o similares a las de los torpedos, para minimizar las turbulencias cuando se desplazan por el agua y utilizan sobre todo las aletas caudales. Las especies de arrecife viven en un entorno submarino complejo y relativamente reducido, por lo que la maniobrabilidad es más importante que la velocidad y muchas han desarrollado cuerpos que optimizan su capacidad para lanzarse y cambiar de dirección. Muchas tienen el cuerpo comprimido lateralmente, lo que les permite introducirse en las fisuras y nadar por huecos estrechos; algunas utilizan las aletas pectorales para la locomoción y otros ondulan sus aletas dorsales y anales.[39] Algunas especies han desarrollado apéndices dérmicos para camuflarse; Chaetodermis penicilligerus es muy difícil de distinguir entre las algas a las que se asemeja y Scorpaenopsis oxycephala acecha camuflado sigilosamente en el fondo marino listo para emboscar a su presa. Otras, como Chaetodon capistratus, tienen manchas similares a ojos para asustar o engañar, mientras que algunas, como Pterois spp., tienen una coloración aposemática para advertir que son tóxicos o tienen espinas venenosas.[40]
.jpg.webp)
Los peces planos son especies demersales que presentan un mayor grado de asimetría que cualquier otro vertebrado. Las larvas son inicialmente de simetría bilateral, pero en el transcurso de su desarrollo sufren una metamorfosis en la que un ojo se desplaza al otro lado de la cabeza y, al mismo tiempo, comienzan a nadar de lado, paralelos al fondo, lo que tiene la ventaja de que, cuando se posan en el lecho marino o lacustre, ambos ojos están situados en la parte superior, lo que les proporciona un amplio campo de visión. La parte superior suele estar moteada para camuflarse, mientras que la parte inferior generalmente es pálida.[41]

Las rémoras tienen sus aletas dorsales delanteras modificadas en forma de grandes ventosas con las que se aferran a un animal huésped, como ballenas, tortugas marinas, tiburones o rayas, una relación comensal más que parasitaria, ya que tanto la rémora como el huésped se benefician de la eliminación de los ectoparásitos y de las escamas de piel desprendidas.[42] Algunos siluros, como la subfamilia Vandelliinae son más dañinos para su huésped, ya que entran en las cámaras branquiales de los peces y se alimentan de su sangre y tejidos.[43] Simenchelys, un género de anguilas de branquias bajas, aunque suelen ser carroñeras a veces perfora la carne del pez e incluso se ha encontrado en el interior del corazón de un marrajo.[44]

Algunas especies, como las anguilas eléctricas o los peces gato eléctricos, pueden producir potentes corrientes eléctricas, lo suficientemente fuertes como para aturdir a sus presas. Otras, como Gymnotiformes spp., generan débiles campos eléctricos oscilantes para detectar a sus presas, para lo cual nadan con el dorso recto para no distorsionar estos campos. La generación de estas corrientes eléctricas, o bioelectrogénesis se produce mediante células musculares o nerviosas modificadas.[23]
Distribución

Los teleósteos se encuentran en todo el mundo y en la mayoría de los ecosistemas acuáticos, incluidos mares cálidos y fríos, aguas dulces con corrientes o estancadas,[45] e incluso, como en el caso de Cyprinodon macularius, en masas de agua aisladas, en ocasiones calientes y salinas, de los desiertos.[46] Su diversidad se reduce en latitudes extremadamente altas; en la Tierra de Francisco José, por encima de los 82°N, la capa de hielo y las temperaturas del agua por debajo de 0 °C durante gran parte del año limitan el número de especies; el 75 % de las especies que se encuentran allí son endémicas del Ártico.[47]
De los principales grupos de teleósteos, Elopomorpha, Clupeomorpha y Percomorpha tienen una distribución mundial y son mayoritariamente oceánicos; Ostariophysi y Osteoglossomorpha también se extienden por todo el mundo, sobre todo en los trópicos, pero generalmente son de agua dulce; Atherinomorpha tienen una distribución mundial, tanto de agua dulce como salada, en zonas del agua a nivel superficial. Esociformes se limitan a las aguas dulces del hemisferio norte, mientras que Salmoniformes se encuentran aguas dulces de zonas templadas tanto del norte como del sur y algunas especies migran hacia y desde el mar. Paracanthopterygii son peces del hemisferio norte, con especies tanto de agua salada como dulce.[45]
Algunos teleósteos son migratorios. Algunas especies de agua dulce se desplazan anualmente a través de los sistemas fluviales; otras especies son anádromas, pasan su vida en el mar y se desplazan tierra adentro para desovar, como el salmón o la lubina rayada y otras, como la anguila, son catádromas y lo hacen a la inversa.[48] La anguila europea (Anguilla anguilla) migra a través del océano Atlántico cuando es adulta para reproducirse entre las algas flotantes del mar de los Sargazos. Los adultos desovan allí y luego mueren, pero las crías en desarrollo son arrastradas por la corriente del Golfo hacia Europa; cuando llegan, ya son peces jóvenes y se adentran en los estuarios y ascienden por los ríos, superando los obstáculos que encuentran en su camino para llegar a los arroyos y estanques donde pasan su vida adulta.[49]
Especies como la trucha común (Salmo trutta) y Diptychus maculatus se encuentran en los lagos de montaña de Cachemira a alturas de hasta 3819 m.[50] Algunos teleósteos se encuentran a grandes profundidades oceánicas; Pseudoliparis amblystomopsis se ha localizado a una profundidad de 7700 m y una especie relacionada (sin catalogar) ha sido avistada a 8145 m.[51][52]
Fisiología
Respiración
El principal medio de respiración en los teleósteos, como en la mayoría de los peces, es la transferencia de gases a través de la superficie de las branquias, a medida que el agua es aspirada por la boca y bombeada por las branquias. Aparte de la vejiga natatoria, que contiene una pequeña cantidad de aire, el cuerpo no dispone de reservas de oxígeno, y la respiración debe ser continua a lo largo de la vida del pez. Algunos teleósteos viven en entornos en los que la disponibilidad de oxígeno es baja, como el agua estancada o el lodo húmedo, por lo que han desarrollado tejidos y órganos accesorios para facilitar el intercambio de gases en estos hábitats.[53]
Algunos géneros han desarrollado de forma independiente la capacidad de respirar a través del aire y otros han desarrollado rasgos de anfibios. Algunas especies de blénidos emergen para alimentarse en tierra y las anguilas de agua dulce pueden absorber oxígeno a través de la piel húmeda. Oxudercinae spp. pueden permanecer fuera del agua durante periodos de tiempo prolongados, intercambiando gases a través de la piel y las membranas mucosas de la boca y la faringe. Las anguilas de lodo tienen un revestimiento bucal bien vascularizado y pueden permanecer fuera del agua durante días respirando de manera bucofaríngea o intestinal y entrar en estado de letargo (estivación) entre el fango.[54] Los anabántidos o laberíntidos han desarrollado un órgano respiratorio accesorio en el primer arco branquial que les sirve para respirar en el aire;[n 6] los cláridos tienen un órgano suprabranquial similar y otros siluros, como los loricáridos, pueden respirar utilizando el aire retenido en su tracto digestivo.[56]
Sistemas sensoriales

Los teleósteos poseen órganos sensoriales muy desarrollados. Casi todas las especies diurnas tienen una visión del color al menos tan buena como la de un ser humano normal. Muchas también disponen de quimiorreceptores que les permiten tener agudos sentidos del gusto y el olfato. La mayoría tienen receptores sensitivos que forman el sistema de la línea lateral, que detecta corrientes y vibraciones suaves y percibe el movimiento de los peces y presas cercanos.[57] Perciben los sonidos de diversas formas: utilizando la línea lateral, la vejiga natatoria y, en algunas especies, el aparato weberiano. Se orientan mediante puntos de referencia y pueden utilizar mapas mentales basados en puntos de referencia o símbolos múltiples; diversos experimentos realizados utilizando laberintos demuestran que los peces poseen la memoria espacial[n 7] necesaria para elaborar dicho mapa mental.[59]
Osmorregulación

La piel de los teleósteos es muy impermeable al agua y la principal interacción entre el cuerpo del pez y su entorno son las branquias. Las especies de agua dulce obtienen agua a través de sus branquias por ósmosis y la pierden en el agua de mar; del mismo modo, las sales se difunden hacia el exterior a través de las branquias en el agua dulce y hacia el interior en el agua salada. La platija europea (Platichthys flesus) pasa la mayor parte de su vida en el mar, pero a menudo se desplaza a estuarios y ríos. En el mar, en una hora puede obtener iones de catión sodio (Na+) equivalentes al 40 % de su contenido total de sodio libre, de los cuales el 75 % entra por las branquias y el resto bebiendo; por el contrario, en los ríos se produce un intercambio de solo el 2 % del contenido corporal de Na+ por hora. Además de poder limitar selectivamente la sal y el agua intercambiada por difusión, existe un mecanismo activo a través de las branquias para la eliminación de la sal en el agua de mar y su captación en el agua dulce.[60]
Termorregulación
Los peces son animales de sangre fría y, en general, su temperatura corporal es la misma que la de su entorno. Ganan y pierden calor a través de la piel y durante la respiración y pueden regular su circulación en respuesta a los cambios de la temperatura del agua aumentando o reduciendo el flujo de sangre que llega a las branquias. El calor metabólico generado en los músculos o el intestino se disipa rápidamente a través de las branquias, y la sangre se desvía de las branquias durante la exposición al frío.[61] Debido a su relativamente escasa capacidad de control de la temperatura de la sangre, la mayoría de los peces solo pueden sobrevivir en un reducido rango de temperatura corporal.[62]
Las especies de teleósteos que habitan en aguas más frías tienen una mayor proporción de ácidos grasos insaturados en las membranas de las células cerebrales en comparación con los peces de aguas más cálidas, lo que les permite mantener una fluidez de membrana[n 8] adecuada en los entornos en los que viven.[64] Cuando se aclimatan al frío, los teleósteos muestran cambios fisiológicos en el músculo esquelético como un aumento de la densidad mitocondrial y capilar;[65] esto reduce las distancias de difusión y ayuda a la producción de ATP aeróbico, lo que ayuda a compensar la caída de la tasa metabólica basal asociada a las temperaturas más frías.
Los atunes y otros peces oceánicos que nadan a gran velocidad mantienen los músculos a temperaturas más altas que su entorno para lograr una locomoción eficiente.[66] Los atunes alcanzan temperaturas musculares de 11 °C o incluso superiores a las del entorno gracias a un intercambio por contracorriente en el que el calor metabólico producido por los músculos y presente en la sangre venosa precalienta la sangre arterial antes de que llegue a los músculos. Otras adaptaciones a la velocidad del atún son un cuerpo fusiforme hidrodinámico, aletas diseñadas para reducir el arrastre[66][67] y músculos con un mayor contenido de mioglobina, lo que les confiere su color rojizo y permite un uso más eficaz del oxígeno.[68] En las regiones polares y en las profundidades del océano, donde la temperatura se encuentra unos pocos grados por encima del punto de congelación, algunos peces de gran tamaño, como los peces espada, los marlines y los atunes, disponen de un mecanismo de calentamiento que eleva la temperatura cerebral y ocular, lo que les permite una visión considerablemente mejor que la de sus presas de sangre fría.[69]
Flotabilidad

Su cuerpo es más denso que el agua, por lo que deben compensar el diferencial o se hundirían. Muchos teleósteos cuentan con una vejiga natatoria que ajusta su flotabilidad mediante una regulación de gases que les permite mantenerse en la profundidad requerida o ascender o descender sin tener que gastar energía nadando. En los grupos más primitivos, como algunos miembros de Leuciscinae, la vejiga natatoria se abre al esófago y hace las veces de pulmón. Las especies de natación rápida, como el atún y la caballa, no suelen tenerla. En los peces en los que la vejiga natatoria está cerrada, el contenido de gas se controla a través de la rete mirabile, una red de vasos sanguíneos que sirve de intercambiador de gases de flujo a contracorriente entre la vejiga natatoria y la sangre.[70] Los condrósteos, como los esturiones, también tienen vejiga natatoria, pero ésta parece haber evolucionado por separado: otros actinopterigios, como Amiiformes y Polypteridae, no la tienen, por lo que las vejigas natatorias parecen haber evolucionado dos veces, y la vejiga natatoria de los teleósteos no es homóloga a la de los condrósteos.[71]
Locomoción

La mayoría de los teleósteos cuentan con un cuerpo hidrodinámico que les permite nadar velozmente y se desplazan generalmente mediante una ondulación lateral de la parte posterior del tronco y la cola, que impulsa al pez a través del agua.[72] Sin embargo hay muchas excepciones a este método de locomoción, especialmente cuando la velocidad no es el objetivo principal, como las especies que se mueven entre las rocas y en los arrecifes de coral, donde es preferible una natación lenta con gran maniobrabilidad.[73] Las anguilas se desplazan moviendo todo el cuerpo. Los caballitos de mar, que viven entre algas y vegetación marina, adopta una postura erguida y se desplaza agitando sus aletas pectorales, y los peces aguja, estrechamente relacionados con ellos, se desplazan ondulando su alargada aleta dorsal. Los góbidos «saltan» por el fondo, apoyándose e impulsándose con sus aletas pectorales.[74] Las especies de la subfamilia Oxudercinae se mueven de forma muy parecida por el suelo terrestre.[75] En algunas especies una ventosa pélvica les permite trepar y Lentipes concolor asciende por las cascadas mientras migra.[74] Los bejeles tienen tres pares de radios libres en sus aletas pectorales que tienen una función fundamentalmente sensorial, pero que también utilizan para desplazarse por el fondo.[76] Los peces voladores combinan los movimientos natatorios con la capacidad de planear cientos de metros en el aire utilizando sus grandes aletas pectorales.[77]
Emisión de sonidos
Para atraer a sus parejas algunos teleósteos producen sonidos, mediante estridulación o por la vibración de la vejiga natatoria. En los esciénidos los músculos asociados a la vejiga natatoria hacen que ésta oscile rápidamente, creando sonidos similares a los de un tambor. Los siluros marinos, los caballitos de mar y los [Haemulidae|hemúlidos]] estridulan frotando partes del esqueleto, dientes o espinas; en estos peces la vejiga natatoria puede actuar como un resonador. Los sonidos de la estridulación son en su mayor parte de 1000-4000 Hz, aunque los sonidos modificados por la vejiga natatoria tienen frecuencias inferiores a 1000 Hz.[78][79][80]
Reproducción y ciclo vital
La mayoría de las especies de teleósteos son ovíparas, con fertilización externa en la que tanto los huevos como los espermatozoides son liberados en el agua para su fecundación.[81] A diferencia de los peces cartilaginosos, donde se da en más del 50 % de las especies, la fertilización interna se da tan solo en el 2-3 % de las especies de teleósteos;[81] en este caso, el macho insemina a la hembra con un órgano intromitente.[n 9][85] Menos de uno de cada millón de huevos fecundados externamente sobrevive para convertirse en un pez adulto, pero hay muchas más posibilidades de supervivencia entre las crías de una docena de familias que son vivíparas, donde los huevos se fecundan internamente por la hembra durante el desarrollo. Algunas de estas especies, como los peces de acuario de la familia Poeciliidae, son ovovivíparas: cada huevo tiene un saco vitelino que nutre al embrión en desarrollo y cuando éste se agota el huevo eclosiona y la larva es expulsada al agua. Otras especies, como las de la familia Goodeidae, son totalmente vivíparas y el embrión en desarrollo se nutre de la sangre materna a través de una estructura similar a la placenta que se desarrolla en el útero. Unas pocas especies, como Nomorhamphus ebrardtii, practican la oofagia; la madre pone huevos no fecundados de los que se alimentan las larvas en desarrollo en el útero, y se ha descrito el canibalismo intrauterino en algunos medio picos.[86]
La estrategia reproductiva de la mayoría de las especies de teleósteos es la iteroparidad, es decir, los individuos maduros pueden reproducirse varias veces a lo largo de su vida, pero algunas se reproducen por semelparidad, en la que un individuo se reproduce una vez después de alcanzar la madurez y luego muere; esto se debe a que los cambios fisiológicos que conlleva la reproducción acaban provocando la muerte.[87] Los salmones del género Oncorhynchus son conocidos por esta característica; nacen en agua dulce y luego migran al mar durante un máximo de cuatro años antes de regresar a su lugar de nacimiento, donde desovan y mueren.[88][89] La semelparidad también se da en algunas anguilas y capellanes.[90]
Identificación y determinación del sexo

Aproximadamente el 90 % de las especies de teleósteos son gonocóricas,[91] con individuos que permanecen como machos o hembras durante toda su vida adulta. El sexo puede determinarse genéticamente, como en las aves y los mamíferos, o ambientalmente, como en los reptiles y, en el caso de algunos teleósteos, tanto la genética como el medio ambiente intervienen en la determinación del sexo.[92] En el caso de las especies cuyo sexo está determinado por la genética, puede presentarse de tres formas. En la determinación del sexo monofactorial, un único locus determina la herencia del sexo. Entre los teleósteos existen tanto el sistema de determinación del sexo XY como el sistema ZW y algunas especies, como Xiphophorus maculatus, tienen ambos sistemas y un macho puede estar determinado por XY o ZZ dependiendo de la población.[93]
La determinación del sexo multifactorial se da en numerosas especies neotropicales y en ella intervienen los sistemas XY y ZW. Los sistemas multifactoriales implican reordenamientos de los cromosomas sexuales y autosomas. Apareiodon affinis tiene un sistema multifactorial ZW en el que la hembra está determinada por ZW1W2 y el macho por ZZ y Hoplias malabaricus tiene un sistema multifactorial XY donde las hembras están determinadas por X1X1X2X2 y el macho por X1X2Y.[94] Algunas especies, como el pez cebra (Danio rerio), tienen un sistema polifactorial, en el que varios genes intervienen en la determinación del sexo.[95] La determinación del sexo dependiente del entorno se ha documentado en al menos setenta especies de teleósteos y en este caso la temperatura es el principal factor, pero los niveles de pH, la tasa de crecimiento, la densidad y el entorno social también pueden ser factores determinantes. En el caso de la sardina atlántica (Menidia menidia) el desove en aguas más frías genera más hembras, mientras que las aguas más cálidas genera más machos.[95]
Hermafroditismo
Algunas especies de teleósteos son hermafroditas, bien del tipo simultáneo o secuencial. En el primero, tanto los espermatozoides como los óvulos están presentes en las gónadas y tienen ambos sexos durante toda su vida fértil; suele darse en especies donde las parejas potenciales se encuentran dispersas.[96] [97] La autofecundación es rara y solo se ha registrado en dos especies, Kryptolebias marmoratus y Kryptolebias hermaphroditus.[97] En el caso del hermafroditismo secuencial los individuos pueden tener un solo sexo al principio de su vida adulta y cambiar más tarde. Entre las especies de este tipo se encuentran los peces loro, lábridos, serránidos, platifefálidos espáridos y los peces luciérnaga.[96]
Cuando un individuo comienza siendo macho y se convierte en hembra, se conoce como protandria, mientras que la condición inversa se denomina protoginia y es la más común. El cambio de sexo puede darse en distintas circunstancias. En el caso de Labroides dimidiatus, donde los machos tienen acceso a hasta diez hembras, si desaparece el macho la hembra de mayor tamaño y dominante desarrolla un comportamiento similar al de los machos y, finalmente, órganos masculinos; si ella falta, la siguiente hembra en importancia ocupa su lugar. Anthias squamipinnis, donde los individuos se reúnen en grandes grupos y las hembras superan ampliamente a los machos, si faltan un cierto número de machos de un grupo, el mismo número de hembras cambia de sexo y los sustituye. Los peces payaso viven en grupos y solo los dos individuos de mayor tamaño de un grupo se reproducen: la hembra más grande y el macho más grande; si la hembra muere, el macho cambia de sexo y el siguiente macho de mayor tamaño ocupa su lugar.[98]
En los Lophiiformes (suborden Ceratioidei), el macho, mucho más pequeño, se une permanentemente a la hembra y se convierte en un complemento productor de esperma; la hembra y su macho adherido conforman una especie de «unidad semihermafrodita».[99]
Estrategias reproductivas
_courting_a_female_1471-2148-11-233-1.jpeg.webp)
Los teleósteos utilizan múltiples estrategias reproductivas dependiendo de la especie. Algunas son promiscuas y tanto los machos como las hembras se reproducen con múltiples parejas y no hay una elección de pareja clara, como en el caso del arenque del Báltico, el guppy, el mero estriado, el pez damisela blanco y negro, Clepticus parrae o los cíclidos. La poligamia, en la que uno de los sexos puede tener múltiples parejas, puede adoptar muchas formas. La poliandria consiste en que una hembra adulta se reproduce con varios machos, que por su parte solo se reproducen con esa hembra, algo poco habitual entre los teleósteos y los peces en general, pero que se da en los peces payaso y, en cierta medida, entre los Lophiiformes, donde algunas hembras tienen más de un macho vinculado a ellas. La poliginia, en la que un macho se reproduce con varias hembras, es mucho más común y se da, por ejemplo, entre Cottoidea, peces luna, Etheostomatinae, damiselas y cíclidos, donde varias hembras pueden recurrir a un macho territorial que vigila y cuida los huevos y las crías. La poliginia también puede implicar que un macho mantenga un harén de varias hembras, como en el caso de algunas especies de arrecifes de coral, como los peces damisela, lábridos, escáridos, acantúridos, pejepuercos y blanquillos.[90]
Las agrupaciones en forma de lek, en las que los machos se reúnen para exhibirse y competir ante las hembras, se ha registrado en al menos una especie, Cyrtocara eucinostomus. En las especies monógamas, los machos y las hembras pueden formar parejas y reproducirse exclusivamente con sus parejas, como en el caso de los bagres de agua dulce de Norteamérica, en muchos peces mariposa, en los caballitos de mar y en otras especies.[90]
El cortejo desempeña un papel en el reconocimiento de las especies, el fortalecimiento de los vínculos de pareja, la posición del lugar de desove y la sincronización de la liberación de gametos. Incluye cambios de color, producción de sonidos y exhibiciones visuales (erección de las aletas, natación rápida, saltos), que a menudo realiza el macho. El cortejo puede ser realizado por una hembra para imponerse a un macho territorial que, de otro modo, la ahuyentaría.[100]
En algunas especies existe dimorfismo sexual. Los individuos de un sexo, generalmente los machos, desarrollan caracteres sexuales secundarios que aumentan sus posibilidades de éxito reproductivo. En Coryphaena los machos tienen la cabeza más grande y roma que las hembras. En varias especies de ciprínidos los machos desarrollan cabezas hinchadas y pequeñas protuberancias conocidas como tubérculos reproductores durante la temporada de cría.[101] El macho de Bolbometopon muricatum tiene una frente más desarrollada con una cresta osificada que utiliza para realizar unos golpes de cabeza rituales.[102] El dimorfismo también puede adoptar la forma de diferencias de coloración. Generalmente son los machos los que tienen colores brillantes, como en Cyprinodontiformes (familias Aplocheilidae, Cyprinodontidae, Fundulidae, Profundulidae y Valenciidae), melanotaénidos y lábridos, en los que los colores son permanentes, mientras que en ciprínidos, espinosos, Etheostomatinae y los peces luna, el color cambia en función de las estaciones. Esta coloración puede ser muy llamativa y atraer a los depredadores, lo que pone de manifiesto que el deseo de reproducirse puede ser mayor que el de evitar la depredación.[101]
Los machos que no han podido cortejar a una hembra con éxito pueden intentar reproducirse de otras maneras. En algunas especies de peces luna, como Lepomis macrochirus, los machos más grandes y de mayor edad, conocidos como machos parentales, que han conseguido cortejar a una hembra, construyen nidos para los huevos que fecundan y los machos secundarios, más pequeños, imitan el comportamiento y la coloración de la hembra para acceder al nido y fertilizar los huevos. Los machos pequeños de salmones del género Oncorhynchus que no han podido posicionarse ante una hembra se arrojan y escabullen mientras el gran macho dominante está en pleno desove con la hembra.[103]
Lugares de desove y cuidados parentales

Los teleósteos pueden desovar en la columna de agua o, más comúnmente, en el fondo. Los que desovan en la columna de agua se limitan sobre todo a los arrecifes de coral. Los peces suben a la superficie y liberan sus gametos, una acción que parece proteger los huevos de algunos depredadores y les permite dispersarse fácilmente por medio de las corrientes, en este caso no reciben cuidados parentales. Las especies que utilizan la columna de agua es más habitual que desoven en grupo que los del fondo. El desove en el sustrato suele producirse en nidos, grietas en las rocas o incluso en madrigueras. Algunos huevos pueden adherirse a diversas superficies como rocas, plantas, madera o conchas.[104]

De los teleósteos ovíparos, la gran mayoría no proporciona cuidados parentales.[110] El cuidado por parte de los machos es mucho más común que el de las hembras.[110][111] La territorialidad de los machos «preadapta» a las especies para que desarrollen el cuidado parental masculino.[112][113] Un ejemplo de cuidado parental por parte de las hembras es el del pez disco, que proporciona nutrientes a sus crías en desarrollo en forma de una mucosidad.[114] Algunas especies portan los huevos o crías en su propio cuerpo. En el caso de los áríidos, apogónidos, bocones y algunos otros, el huevo puede ser incubado o transportado en la boca (incubación bucal) y, en el caso de algunos cíclidos africanos, los huevos pueden ser fecundados en ella. En especies como Bujurquina vittata las crías son cuidadas después de la eclosión por ambos padres. En las especies de incubación bucal el momento de la liberación de las crías varía según la especie; algunas liberan a las crías recién eclosionadas mientras que otras pueden mantenerlas hasta que se convierten en juveniles. Algunos teleósteos han desarrollado estructuras para transportar a las crías. Los machos de los peces nodriza tienen un gancho óseo en la frente para transportar los huevos fecundados, donde permanecen hasta que eclosionan. En el caso de los caballitos de mar, el macho tiene una bolsa de cría donde la hembra deposita los huevos fecundados y éstos permanecen allí hasta que se convierten en juveniles que pueden nadar libremente. Las hembras de los guitarrillos tienen estructuras en el vientre en las que se sujetan los huevos.[115]
En algunas especies parentales, las crías de un desove anterior pueden permanecer con sus padres y ayudar a cuidar de las nuevas crías, como en el caso de unas diecinueve especies de cíclidos del lago Tanganica; estos ayudantes participan en la limpieza y el ventilado de los huevos y las larvas, la limpieza del hoyo de cría y la protección del territorio. Tienen una tasa de crecimiento reducida, pero se ganan protección frente a los depredadores. Entre los teleósteos también existe el parasitismo de puesta; Leuciscinae spp. pueden desovar en los nidos de los centrárquidos y de otras especies de Leuciscinae. El siluro Synodontis multipunctata deposita sus huevos en el sustrato mientras los cíclidos incubadores bucales recogen los suyos y los jóvenes siluros se comen las larvas de los cíclidos. El canibalismo filial se da en algunas familias de teleósteos y puede haber evolucionado para combatir situaciones de inanición.[116]
Desarrollo

El desarrollo de los teleósteos pasa por cuatro etapas principales: huevo, larva, juvenil y adulto. Pueden comenzar su vida en un entorno pelágico o demersal. La mayoría de las especies marinas ponen sus huevos en el piélago y son ligeros, transparentes y flotantes con envolturas finas que dependen de las corrientes oceánicas para dispersarse y no reciben cuidados parentales. Cuando eclosionan, las larvas son planctónicas y todavía no pueden nadar; llevan adherido un saco vitelino que les proporciona los nutrientes necesarios para subsistir. La mayoría de las especies de agua dulce ponen huevos demersales que son gruesos, pigmentados, relativamente pesados y capaces de adherirse a los sustratos; el cuidado de los padres es mucho más común entre los peces de agua dulce. A diferencia de las pelágicas, las larvas demersales son capaces de nadar y alimentarse nada más nacer.[96] Las larvas de teleósteos suelen tener un aspecto muy diferente al de los adultos, sobre todo en las especies marinas. Las larvas tienen elevadas tasas de mortalidad; la mayoría muere por inanición o depredación en su primera semana. A medida que crecen las tasas de supervivencia aumentan y hay una mayor tolerancia fisiológica y sensibilidad, así como competencia ecológica y de comportamiento.[117]
Durante la fase juvenil se parecen más a su forma adulta. En esta fase su esqueleto axial, órganos internos, escamas, pigmentación y aletas están completamente desarrollados. La transición de larva a juvenil puede ser corta y bastante sencilla, con una duración de minutos u horas, como en algunos peces damisela, mientras que en otras especies, como el salmón, Holocentrinae spp., los gobios y los peces planos, la transición es más compleja y tarda varias semanas en completarse.[118]
En la etapa adulta ya pueden producir gametos viables para la reproducción. Al igual que muchos peces, los teleósteos siguen creciendo durante toda su vida. La longevidad depende de la especie; algunos perciformes, como la perca de río y la lubina, viven hasta 25 años. Los peces de roca[n 11] parecen ser los teleósteos más longevos, ya que algunas especies viven más de 100 años.[119]
Cardúmenes

Muchos teleósteos forman cardúmenes, que sirven para diferentes propósitos dependiendo de la especie. La formación de estos bancos a veces es una adaptación utilizada como defensa frente a la depredación. A menudo también resulta más eficaz recolectar alimentos trabajando en grupo; los peces individualmente optimizan sus estrategias eligiendo unirse a un banco o abandonarlo. Cuando se advierte la presencia de un depredador, los peces presa responden de forma defensiva que en ocasiones se traduce en comportamientos colectivos de cardumen, como movimientos sincronizados. Las respuestas no consisten únicamente en intentar esconderse o huir; las tácticas contra los depredadores también incluyen, por ejemplo, la dispersión y la reagrupación. También pueden agruparse en bancos para desovar.[120]
Relación con los humanos

Los teleósteos tienen gran importancia económica para los humanos. Se pescan como alimento en todo el mundo; algunas especies como el arenque, el bacalao, el abadejo, la anchoa, el atún y la caballa proporcionan a las personas millones de toneladas de alimentos al año, mientras que muchas otras especies se pescan en cantidades menores.[121] También constituyen una gran parte de la pesca deportiva.[122] La pesca comercial y la recreativa en conjunto proporcionan empleo a millones de personas.[123] Algunas especies como la carpa, el salmón,[124] la tilapia y los siluros, se crían comercialmente y producen al año millones de toneladas de alimentos ricos en proteínas; el Banco Mundial calcula que la producción aumente considerablemente y que en 2030 tal vez el 62 % de los peces destinados a la alimentación provendrán de la piscicultura.[125]
El pescado puede consumirse fresco o conservarse mediante métodos tradicionales como el secado, ahumado, salazón o fermentación,[126] o con métodos modernos de conservación como la congelación, la liofilización o el tratamiento térmico (como en el caso de las conservas). La harina de pescado se utiliza como complemento alimenticio para los peces de piscifactoría y para el ganado. Los aceites de pescado se elaboran a partir del hígado de los peces, especialmente rico en vitaminas A y D, o del cuerpo de pescados grasos como la sardina y el arenque y se utilizan como complementos alimenticios y para tratar las carencias vitamínicas.[127]
Algunas especies de pequeño tamaño y coloridas sirven como especímenes en la acuariofilia. Los anarricádidos se utilizan en la industria del cuero.[122]

Algunos teleósteos pueden resultar peligrosos para los humanos. Especies como el siluro de cola de anguila (familia Plotosidae), el pez escorpión (Scorpaenidae) o el pez piedra (Synanceiidae) tienen espinas venenosas que pueden herir gravemente o matar a una persona. La anguila eléctrica y el pez gato eléctrico pueden provocar una fuerte descarga eléctrica. La piraña y las barracudas tienen una potente mordedura y a veces han atacado a bañistas y submarinistas.[122]
La medaka y el pez cebra se utilizan como animales de experimentación en estudios de genética y biología del desarrollo. El pez cebra es el vertebrado de laboratorio más utilizado,[122] debido a ventajas como su similitud genética con los mamíferos, pequeño tamaño, necesidades ambientales sencillas, larvas transparentes que permiten la obtención de imágenes no invasivas, abundante descendencia, rápido crecimiento y su capacidad para absorber mutágenos añadidos al agua.[128]

Las actividades humanas han afectado a las poblaciones de muchas especies de teleósteos, debido a la sobrepesca,[129] la contaminación y el calentamiento global. Entre los muchos casos registrados, la sobrepesca provocó un colapso total de la población de bacalao del Atlántico en las costas de Terranova en 1992, lo que llevó al cierre indefinido de ese caladero por parte de Canadá.[130] La contaminación, especialmente en los ríos y en las costas, ha afectado a los teleósteos, ya que las aguas residuales, los pesticidas y los herbicidas han entrado en el agua y muchos contaminantes, como metales pesados, organoclorados o carbamatos, interfieren en su reproducción, a menudo alterando sus sistemas endocrinos. En los rutilos la contaminación fluvial ha provocado casos de intersexualidad, en la que las gónadas de un individuo contienen tanto células que pueden producir gametos masculinos (como la espermatogonia) como células que pueden producir gametos femeninos (como la ovogonia). Dado que las alteraciones endocrinas también afectan a los seres humanos, algunas especies se utilizan para indicar la presencia de esas sustancias químicas en el agua. La contaminación hídrica provocó la extinción local de las poblaciones de teleósteos en muchos lagos del norte de Europa en la segunda mitad del siglo XX.[131]
Los efectos del cambio climático sobre los teleósteos podrían llegar a ser importantes, aunque su evaluación es compleja. Así, el aumento de las precipitaciones invernales (lluvia y nieve) podría perjudicar a las poblaciones de peces de agua dulce en Noruega, mientras que los veranos más cálidos podrían aumentar el crecimiento de los peces adultos.[132] En los océanos se cree que los teleósteos podrían hacer frente al calentamiento, ya que se trataría de una extensión de la variación natural del clima.[133] Se desconoce cómo podría afectarles la acidificación de los océanos, causada por el aumento de los niveles de dióxido de carbono.[134]
Notas y referencias
- Notas
- Arco de la superficie dorsal de las vértebras por donde va el conducto de la médula espinal.[4]
- Basibralquial: parte esquelética central, ventral o basal, del arco branquial.[5]
- El hueso canceloso, también llamado trabecular o esponjoso, es el tejido interno del esqueleto óseo y es una red porosa de células abiertas. El hueso esponjoso tiene una mayor relación superficie/volumen que el hueso cortical y es menos denso.
- En los peces de aletas lobuladas y en los primeros tetrápodos fósiles, el hueso homólogo a la mandíbula de los mamíferos es tan solo el mayor de varios huesos de la mandíbula inferior. En estos animales, se denomina hueso dentario u os dentale y forma el cuerpo de la superficie externa de la mandíbula.[10]
- En biología, un escudo (del latín scutum) es una placa o escama externa quitinosa, como en el caparazón de las tortugas, la piel de los cocodrilos o las patas de las aves. El término también se utiliza para describir la parte anterior del mesonoto en los insectos y en algunos arácnidos.
- El órgano laberíntico, una característica que define a los peces del suborden Anabantoidei, es un órgano respiratorio accesorio suprabranquial con numerosos pliegues. Está formado por una expansión altamente vascularizada del hueso epibranquial del primer arco branquial que se halla bajo el opérculo y se utiliza para la respiración aérea.[55]
- En psicología cognitiva y neurociencia, la memoria espacial es una forma de memoria responsable del registro y la recuperación de la información necesaria para planificar un recorrido hacia un lugar y recordar la ubicación de un objeto o la ocurrencia de un evento.[58]
- En biología, la fluidez de membrana se refiere a la viscosidad de la bicapa lipídica de una membrana celular o de una membrana lipídica sintética. La viscosidad de la membrana puede afectar a la rotación y difusión de las proteínas y otras biomoléculas dentro de la membrana, afectando así a las funciones de éstas.[63]
- Órgano intromitente es un término utilizado para hacer referencia a un órgano externo de un organismo macho que está especializado en la transmisión de esperma durante la cópula.[82][83] Se encuentran con mayor frecuencia en las especies terrestres, ya que la mayoría de las especies acuáticas no mamíferas fecundan sus huevos externamente. Para muchas especies del reino animal, el órgano intromitente masculino es una característica distintiva de la fecundación interna.[84]
- El término «preñez» se define tradicionalmente como el periodo de incubación de los huevos en el cuerpo tras la unión óvulo-esperma.[105] Aunque el término suele utilizarse en referencia a los mamíferos placentarios, también se ha utilizado en numerosos artículos científicos sobre peces.[106][107][108][109]
- Pez de roca es un término utilizado para referirse a varias especies de peces por su tendencia a esconderse entre las rocas. Este nombre común se utiliza para diversos grupos que no están estrechamente relacionados y puede ser arbitrario.
- Referencias
- Palmer, Douglas (1999). The Marshall Illustrated Encyclopedia of Dinosaurs & Prehistoric Animals. Marshall Editions Developments. ISBN 978-1-84028-152-1.
- Li, Q. (2009). «A New Parasemionotid-Like Fish from the Lower Triassic of Jurong, Jiangsu Province, South China». Palaeontology 52 (2): 369-384. doi:10.1111/j.1475-4983.2009.00848.x.
- Campuzano Caballero, Juan Carlos (2010). Estructura histológica comparada del gonoducto de dos especies de peces teleósteos: una ovípara, Brachydanio rerio (Cyprinidae), y una vivípara, Poecilia reticulata (Poeciliidae), durante tres etapas del ciclo reproductor (Tesis de Maestría). Universidad Nacional Autónoma de México.
- Lawrence, 2003, p. 60.
- Lawrence, 2003, p. 79.
- Patterson, C.; Rosen, D. E. (1977). «Review of ichthyodectiform and other Mesozoic teleost fishes, and the theory and practice of classifying fossils». Bulletin of the American Museum of Natural History 158 (2): 81-172. ISSN 0003-0090.
- Benton, Michael J. (2005). «The Evolution of Fishes After the Devonian». Vertebrate Palaeontology (3.ª edición). John Wiley & Sons. pp. 175-184. ISBN 978-1-4051-4449-0.
- Vandewalle, P.; Parmentier, E.; Chardon, M. (2000). «The branchial basket in Teleost feeding». Cybium: International Journal of Ichthyology 24 (4): 319-342.
- Moriyama, Y.; Takeda, H. (2013). «Evolution and development of the homocercal caudal fin in teleosts». Development, Growth & Differentiation 55 (8): 687-698. PMID 24102138. S2CID 5073184. doi:10.1111/dgd.12088.
- Romer, A. S.; Parsons, T. S. (1977). The Vertebrate Body. Holt-Saunders International. pp. 244-247. ISBN 978-0-03-910284-5.
- Bone, Q.; Moore, R. (2008). Biology of Fishes. Garland Science. p. 29. ISBN 978-0-415-37562-7.
- Müller, J. P. (1845). «Über den Bau und die Grenzen der Ganoiden, und über das natürliche System der Fische». Archiv für Naturgeschichte 11 (1): 129.
- Real Academia Española. «teleósteo». Diccionario de la lengua española (23.ª edición).
- Greenwood, P.; Rosen, D.; Weitzman, S.; Myers, G. (1966). «Phyletic studies of teleostean fishes, with a provisional classification of living forms». Bulletin of the American Museum of Natural History 131 (4): 339-456.
- Arratia, G. (1998). «Basal teleosts and teleostean phylogeny: response to C. Patterson». Copeia 1998 (4): 1109-1113. JSTOR 1447369. doi:10.2307/1447369.
- Near, T. J.; Eytan, R. I.; Dornburg, A.; Kuhn, K. L.; Moore, J. A.; Davis, M. P.; Wainwright, P. C.; Friedman, M. et al. (2012). «Resolution of ray-finned fish phylogeny and timing of diversification». Proceedings of the National Academy of Sciences of the United States of America 109 (34): 13698-13703. Bibcode:2012PNAS..10913698N. PMC 3427055. PMID 22869754. doi:10.1073/pnas.1206625109.
- Betancur-R., Ricardo, et al. (2013). «The Tree of Life and a New Classification of Bony Fishes». PLOS Currents: Tree of Life (1.ª edición) 5. PMC 3644299. PMID 23653398. doi:10.1371/currents.tol.53ba26640df0ccaee75bb165c8c26288. Archivado desde el original el 17 de febrero de 2020. Consultado el 28 de marzo de 2021.
- Laurin, M.; Reisz, R. R. (1995). «A reevaluation of early amniote phylogeny». Zoological Journal of the Linnean Society 113 (2): 165-223. doi:10.1111/j.1096-3642.1995.tb00932.x.
- Betancur-R, R.; Wiley, E. O.; Arratia, G. et al. (2017). «Phylogenetic classification of bony fishes». BMC Ecology and Evolution 17 (162). doi:10.1186/s12862-017-0958-3.
- Clarke, John T.; Friedman, Matt (2018). «Body-shape diversity in Triassic-Early Cretaceous neopterygian fishes: sustained holostean disparity and predominantly gradual increases in teleost phenotypic variety». Paleobiology 44 (3): 402-433. S2CID 90207334. doi:10.1017/pab.2018.8.
- Rosen, D. E.; Greenwood, P. H. (26 de agosto de 1970). «Origin of the Weberian Apparatus and the Relationships of the Ostariophysan and Gonorynchiform Fishes». American Museum Novitates (American Museum of Natural History) (2428).
- Grande, T.; Pinna, Mario de (2004). «The evolution of the Weberian apparatus: A phylogenetic perspective». En Arratia, G.; Tintori, A., eds. Mesozoic Fishes 3 – Systematics, Paleoenvironments and Biodiversity. Verlag. pp. 429-448. ISBN 3-89937-053-8.
- Helfman et al., 2009, pp. 268-274.
- Helfman et al., 2009, p. 274.
- Drucker, E. G.; Lauder, G. V. (2001). «Locomotor function of the dorsal fin in teleost fishes: experimental analysis of wake forces in sunfish». The Journal of Experimental Biology 204 (17): 2943-2958. PMID 11551984. doi:10.1242/jeb.204.17.2943.
- Helfman et al., 2009, pp. 274-276.
- Steward, T. A.; Smith, W. L.; Coates, M. I. (2014). «The origins of adipose fins: an analysis of homoplasy and the serial homology of vertebrate appendages». Proceedings of the Royal Society B 281 (1781): 20133120. PMC 3953844. PMID 24598422. doi:10.1098/rspb.2013.3120.
- Miller, Stephen; Harley, John P. (2007). Zoology (7.ª edición). McGraw-Hill. p. 297. ISBN 0073228079.
- Berra, Tim M. (2008). Freshwater Fish Distribution. University of Chicago Press. p. 55. ISBN 978-0-226-04443-9.
- Lackmann, Alec R.; Andrews, Allen H.; Butler, Malcolm G.; Bielak-Lackmann, Ewelina S.; Clark, Mark E. (2019). «Bigmouth Buffalo Ictiobus cyprinellus sets freshwater teleost record as improved age analysis reveals centenarian longevity». Communications Biology 2 (197). ISSN 2399-3642. PMC 6533251. PMID 31149641. doi:10.1038/s42003-019-0452-0.
- Dorit, R. L.; Walker, W. F.; Barnes, R. D. (1991). Zoology. Saunders College Publishing. pp. 67-69. ISBN 978-0-03-030504-7. (requiere suscripción).
- Guinness World Records 2015. Guinness World Records. 2014. pp. 56-57. ISBN 978-1-908843-70-8. (requiere suscripción).
- Paxton, Charles (2013). «Systematics, biology, and distribution of the species of the oceanic oarfish genus Regalecus (Teleostei, Lampridiformes, Regalecidae) By T. R. Roberts». Journal of Fish Biology 83 (1): 231-232. doi:10.1111/jfb.12170.
- Martill, D. M. (1988). «Leedsichthys problematicus, a giant filter-feeding teleost from the Jurassic of England and France». Neues Jahrbuch für Geologie und Paläontologie 1988 (11): 670-680. doi:10.1127/njgpm/1988/1988/670.
- Roach, John (13 de mayo de 2003). «World's Heaviest Bony Fish Discovered?». National Geographic News. Archivado desde el original el 10 de junio de 2004. Consultado el 27 de marzo de 2021.
- Grijalba-Bendeck, M.; Franco-Herrera, A.; Jauregui, A.; Tigreros, P. (2004). «Presencia del pez luna Mola mola (Linnaeus, 1758) (Pisces: Molidae) en el Departamento del Magdalena, Caribe colombiano». Boletín de investigaciones marinas y costeras 33: 271-274. ISSN 0122-9761. doi:10.25268/BIMC.INVEMAR.2004.33.0.278.
- Pietsch, T. (2005). «Dimorphism, parasitism, and sex revisited: modes of reproduction among deep-sea ceratioid anglerfishes (Teleostei: Lophiiformes)». Ichthyological Research 52: 207-236. doi:10.1007/s10228-005-0286-2.
- Watson, W.; Walker Jr., H. J. (2004). «The world's smallest vertebrate, Schindleria brevipinguis, a new paedomorphic species in the family Schindleriidae (Perciformes: Gobioidei)». Records of the Australian Museum 56 (2): 139-142. ISSN 0067-1975. doi:10.3853/j.0067-1975.56.2004.1429.
- Maddock, L.; Bone, Q.; Rayner, J. M. V. (1994). The Mechanics and Physiology of Animal Swimming. Cambridge University Press. pp. 54-56. ISBN 978-0-521-46078-1.
- Ross, David A. (2000). The Fisherman's Ocean. Stackpole Books. pp. 136-138. ISBN 978-0-8117-2771-6. (requiere suscripción).
- Schreiber, Alexander M. (2006). «Asymmetric craniofacial remodeling and lateralized behavior in larval flatfish». The Journal of Experimental Biology 209 (Pt 4): 610-621. PMID 16449556. doi:10.1242/jeb.02056.
- Jackson, John (30 de noviembre de 2012). «How does the Remora develop its sucker?». National History Museum. Consultado el 2 de enero de 2016.
- Combes, Claude (2001). Parasitism: The Ecology and Evolution of Intimate Interactions. University of Chicago Press. p. 23. ISBN 978-0-226-11446-0.
- Caira, J. N.; Benz, G. W.; Borucinska, J.; Kohler, N. E. (1997). «Pugnose eels, Simenchelys parasiticus (Synaphobranchidae) from the heart of a shortfin mako, Isurus oxyrinchus (Lamnidae)». Environmental Biology of Fishes 49: 139-144. S2CID 37865366. doi:10.1023/a:1007398609346.
- «Vertebrate Diversity: Actinopterygii - ray-finned fishes». Grant Museum of Zoology. University College London. Consultado el 6 de abril de 2021.
- Desert Renewable Energy Conservation Plan (DRECP). Appendix Q: Baseline Biology Report. California Energy Commission. Octubre de 2015. p. 4-38.
- Chernova, N. V.; Friedlander, A. M.; Turchik, A.; Sala, E. (2014). «Franz Josef Land: extreme northern outpost for Arctic fishes». PeerJ 2: e692. PMC 4266852. PMID 25538869. doi:10.7717/peerj.692.
- «21 Migratory Fish Facts That'll Make You Say, "I Never Knew That!"». Fish FAQ. National Oceanic and Atmospheric Administration. 19 de abril de 2018. Consultado el 6 de abril de 2021.
- The Danish Aquaculture Development Group (2004). «Anguilla anguilla (Linnaeus, 1758)». Programa de información de especies acuáticas. Departamento de Pesca y Acuicultura de la FAO. Consultado el 6 de abril de 2021.
- Raina, H. S.; Petr, T. «Coldwater Fish and Fisheries in the Indian Himalayas: Lakes and Reservoirs». Food and Agriculture Organization. Consultado el 6 de abril de 2021.
- Morelle, Rebecca (7 de octubre de 2008). «'Deepest ever' living fish filmed». BBC News. Consultado el 6 de abril de 2021.
- Morelle, Rebecca (19 de diciembre de 2014). «New record for deepest fish». BBC News. Consultado el 6 de abril de 2021.
- Randall, David; Daxboeck, Charles (1984). «Oxygen and Carbon Dioxide Transfer across Fish Gills». En Hoar, W. S.; Randall, D. J., eds. Fish Physiology. Volume X: Gills. Academic Press. pp. 263-. ISBN 978-0-08-058531-4.
- Liem, Karel F. (1998). Paxton, J. R.; Eschmeyer, W. N., eds. Encyclopedia of Fishes. Academic Press. pp. 173-174. ISBN 978-0-12-547665-2.
- Pinter, H. (1986). Labyrinth Fish. Barron's. ISBN 0-8120-5635-3.
- Armbruster, Jonathan W. (1998). «Modifications of the digestive tract for holding air in loricariid and scoloplacid catfishes». Copeia 1998 (3): 663-675. JSTOR 1447796. doi:10.2307/1447796.
- Parker, Steve (1994). Fearsome Fish. Raintree Steck-Vaughn. ISBN 978-0-8114-2346-5. (requiere suscripción).
- Burgess, Neil (2018). «Spatial memory». Encyclopædia Britannica. Consultado el 12 de abril de 2021.
- Chung, Seraphina (2008). «Appropriate maze methodology to study learning in fish». Journal of Undergraduate Life Sciences 2 (1): 52-55. Archivado desde el original el 6 de julio de 2011.
- Bentley, P. J. (2013). Endocrines and Osmoregulation: A Comparative Account in Vertebrates. Springer. p. 26. ISBN 978-3-662-05014-9.
- Whittow, G. Causey (2013). Comparative Physiology of Thermoregulation: Special Aspects of Thermoregulation. Academic Press. p. 223. ISBN 978-1-4832-5743-3.
- McFarlane, Paul (enero de 1999). «Warm-blooded fish». Monthly Bulletin of the Hamilton and District Aquarium Society. Archivado desde el original el 15 de mayo de 2013. Consultado el 16 de abril de 2021.
- Gennis, R. B. (1989). Biomembranes: Molecular Structure and Function. Springer. ISBN 0387967605.
- Logue, J. A.; Vries, A. L. de; Fodor, E.; Cossins, A. R. (2000). «Lipid compositional correlates of temperature-adaptive interspecific differences in membrane physical structure». Journal of Experimental Biology 203 (14): 2105-2115. ISSN 0022-0949. PMID 10862723. doi:10.1242/jeb.203.14.2105.
- Johnston, I. A.; Dunn, J. (1987). «Temperature acclimation and metabolism in ectotherms with particular reference to teleost fish». Symposia of the Society for Experimental Biology 41: 67-93. ISSN 0081-1386. PMID 3332497.
- Martin, R. Aidan. «Fire in the Belly of the Beast». Biology of Sharks and Rays. ReefQuest Centre for Shark Research. Consultado el 6 de enero de 2016.
- «Tuna: Biology of Tuna». Science Encyclopedia. Consultado el 2 de enero de 2016.
- Brown, W. Duane (1962). «The concentration of myoglobin and hemoglobin in tuna flesh». Journal of Food Science 27 (1): 26-28. doi:10.1111/j.1365-2621.1962.tb00052.x.
- Fritsches, Kerstin (11 de enero de 2005). «Warm eyes give deep-sea predators super vision». University of Queensland. Consultado el 16 de abril de 2021.
- Kardong, K. (2008). Vertebrates: Comparative anatomy, function, evolution (5.ª edición). McGraw-Hill. ISBN 978-0-07-304058-5.
- Fernandes, Marisa N. (2007). Fish Respiration and Environment. CRC Press. p. 42. ISBN 978-1-4398-4254-6.
- Numerical Studies of Hydrodynamics of Fish Locomotion and Schooling by a Vortex Particle Method. 2008. pp. 1-4. ISBN 978-1-109-14490-1.
- Kapoor, B. G.; Khanna, Bhavna (2004). Ichthyology Handbook. Springer. pp. 149-151. ISBN 978-3-540-42854-1.
- Patzner, Robert; Van Tassell, James L.; Kovacic, Marcelo; Kapoor, B. G. (2011). The Biology of Gobies. CRC Press. pp. 261, 507. ISBN 978-1-4398-6233-9.
- Pace, C. M.; Gibb, A. C. (2009). «Mudskipper pectoral fin kinematics in aquatic and terrestrial environments». The Journal of Experimental Biology 212 (Pt 14): 2279-2286. PMID 19561218. doi:10.1242/jeb.029041.
- Jamon, M.; Renous, S.; Gasc, J. P.; Bels, V.; Davenport, J. (2007). «Evidence of force exchanges during the six-legged walking of the bottom-dwelling fish, Chelidonichthys lucerna». Journal of Experimental Zoology 307 (9): 542-547. PMID 17620306. doi:10.1002/jez.401.
- Dasilao, J. C.; Sasaki, K. (1998). «Phylogeny of the flyingfish family Exocoetidae (Teleostei, Beloniformes)». Ichthyological Research 45 (4): 347-353. S2CID 24966029. doi:10.1007/BF02725187.
- «How do fish produce sounds?». Discovery of Sound in the Sea. Consultado el 26 de abril de 2021.
- Lobel, P. S. (2002). «Diversity of fish spawning sounds and the application of passive acoustic monitoring». Bioacoustics 12 (2-3): 286-289. doi:10.1080/09524622.2002.9753724. Archivado desde el original el 10 de enero de 2018. Consultado el 26 de abril de 2021.
- Amorim, M. Clara; Vasconcelos, Raquel; Fonseca, P.J. (2015). «Fish Sounds and Mate Choice». En Ladich, F., ed. Sound communication in fishes. Animal Signals and Communication 4. Springer-Verlag. pp. 1-33. doi:10.1007/978-3-7091-1846-7_1.
- Coward, K.; Bromage, N. R.; Hibbitt, O.; Parrington, J. (2002). «Gamete physiology, fertilization and egg activation in teleost fish». Reviews in Fish Biology and Fisheries 12: 33-58. doi:10.1023/A:1022613404123.
- Brennan, Patricia L. R. (2016). «Studying Genital Coevolution to Understand Intromittent Organ Morphology». Integrative and Comparative Biology 56 (4): 669-681. PMID 27252198. doi:10.1093/icb/icw018.
- Kelly, Diane A.; Moore, Brandon C. (2016). «The Morphological Diversity of Intromittent Organs». Integrative and Comparative Biology 56 (4): 630-634. PMID 27471228. doi:10.1093/icb/icw103.
- Eberhard, W. G. (1985). Sexual selection and animal genitalia. Harvard University Press.
- Wootton y Smith, 2014, p. 5.
- Springer, Joseph T.; Holley, Dennis (2012). An Introduction to Zoology: Investigating the Animal World. Jones & Bartlett Publishers. p. 370. ISBN 978-0-7637-5286-6.
- Wootton y Smith, 2014, p. 4.
- Dickhoff, Walton W. (1989). «Salmonids and Annual Fishes: Death After Sex». En Schreibman, Martin P.; Scanes, Colin G., eds. Development, Maturation, and Senescence of Neuroendocrine Systems. Academic Press. pp. 253-266. ISBN 9780126290608. doi:10.1016/b978-0-12-629060-8.50017-5.
- Morbey, Yolanda E.; Brassil, Chad E.; Hendry, Andrew P. (2005). «Rapid Senescence in Pacific Salmon». The American Naturalist 166 (5): 556-568. PMID 16224721. doi:10.1086/491720.
- Helfman et al., 2009, p. 457.
- Smith, Carl; Wootton, Robert J. (2016). «The remarkable reproductive diversity of teleost fishes». Fish and Fisheries 17 (4): 1208-1215. doi:10.1111/faf.12116.
- Wootton y Smith, 2014, p. 2.
- Wootton y Smith, 2014, pp. 14, 19.
- Wootton y Smith, 2014, p. 20.
- Wootton y Smith, 2014, pp. 21-22.
- Miller, Bruce S.; Kendall, Arthur W. (2009). «Fish Reproduction». Early Life History of Marine Fishes. University of California Press. ISBN 0520249720. doi:10.1525/9780520943766-005.
- Wootton y Smith, 2014, pp. 2-4.
- Helfman et al., 2009, p. 458.
- Wootton y Smith, 2014, p. 320.
- Helfman et al., 2009, p. 465.
- Helfman et al., 2009, p. 463.
- Muñoz, R.; Zgliczynski, B.; Laughlin, J.; Teer, B. (2012). «Extraordinary aggressive behavior from the giant coral reef fish, Bolbometopon muricatum, in a remote marine reserve». PLoS One 7 (6): e38120. Bibcode:2012PLoSO...738120M. PMC 3368943. PMID 22701606. doi:10.1371/journal.pone.0038120.
- Helfman et al., 2009, p. 473.
- Helfman et al., 2009, pp. 465-468.
- Stölting, K. N.; Wilson, A. B. (2007). «Male pregnancy in seahorses and pipefish: beyond the mammalian model». BioEssays 29 (9): 884-896. PMID 17691105. S2CID 12744225. doi:10.1002/bies.20626.
- Avise, J. C.; Liu, J-X. (2010). «Multiple mating and its relationship to alternative modes of gestation in male-pregnant versus female-pregnant fish species». Proceedings of the National Academy of Sciences USA 107 (44): 18915-18920. Bibcode:2010PNAS..10718915A. PMC 2973910. PMID 20956296. doi:10.1073/pnas.1013786107.
- Plaut, I. (2002). «Does pregnancy affect swimming performance of female Mosquitofish, Gambusia affinis?». Functional Ecology 16 (3): 290-295. doi:10.1046/j.1365-2435.2002.00638.x.
- Korsgaard, B. (1994). «Calcium metabolism in relation to ovarian functions during early and late pregnancy in the viviparous blenny Zoarces viviparus». Journal of Fish Biology 44 (4): 661-672. doi:10.1111/j.1095-8649.1994.tb01242.x.
- Seebacher, F.; Ward, A. J. W; Wilson, R. S. (2013). «Increased aggression during pregnancy comes at a higher metabolic cost». Journal of Experimental Biology 216 (5): 771-776. PMID 23408800. doi:10.1242/jeb.079756.
- Reynolds, John; Goodwin, Nicholas B.; Freckleton, Robert P. (2002). «Evolutionary Transitions in Parental Care and Live Bearing in Vertebrates». Philosophical Transactions of the Royal Society B: Biological Sciences 357 (1419): 269-281. PMC 1692951. PMID 11958696. doi:10.1098/rstb.2001.0930.
- Clutton-Brock, T. H. (1991). The Evolution of Parental Care. Princeton University Press.
- Werren, John; Gross, Mart R.; Shine, Richard (1980). «Paternity and the evolution of male parentage». Journal of Theoretical Biology 82 (4): 619-631. PMID 7382520. doi:10.1016/0022-5193(80)90182-4.
- Baylis, Jeffrey (1981). «The Evolution of Parental Care in Fishes, with reference to Darwin's rule of male sexual selection». Environmental Biology of Fishes] 6 (2): 223-251. S2CID 19242013. doi:10.1007/BF00002788.
- Wootton y Smith, 2014, p. 280.
- Wootton y Smith, 2014, pp. 257-261.
- Helfman et al., 2009, pp. 472-473.
- Helfman et al., 2009, pp. 146-147.
- Helfman et al., 2009, p. 149.
- Helfman et al., 2009, pp. 153-156.
- Pitcher, T. J. (1986). «Functions of Shoaling Behaviour in Teleosts». En Pitcher, T. J., ed. The Behaviour of Teleost Fishes. Springer. pp. 294-337. ISBN 978-1-4684-8263-8. doi:10.1007/978-1-4684-8261-4_12.
- «Estadísticas de pesca y acuicultura 2017». Organización de las Naciones Unidos para la Alimentación y la Agricultura. Consultado el 7 de mayo de 2021.
- Kisia, S. M. (2010). Vertebrates: Structures and Functions. CRC Press. p. 22. ISBN 978-1-4398-4052-8.
- «Commercial and recreational saltwater fishing generated $214 billion in 2014». National Oceanic and Atmospheric Administration. 26 de mayo de 2016. Consultado el 7 de mayo de 2021.
- Scottish Fish Farm Production Survey 2014. The Scottish Government/Riaghaltas na h-Alba. septiembre de 2015. ISBN 978-1-78544-608-5.
- «Fish to 2030: prospects for fisheries and aquaculture». World Bank Group. 1 de diciembre de 2013. Consultado el 7 de mayo de 2021.
- «Fish and fish products». Food and Agriculture Organization. Archivado desde el original el 8 de febrero de 2019. Consultado el 8 de abril de 2016.
- Maqsood, Sajid; Singh, Prabjeet; Samoon, Munir Hassan; Wani, Gohar Bilal. «Various Fish and Fish Products Being Produced in Fish Processing Industries and Their Value Addition». Aquafind (Aquatic Fish Database). Consultado el 7 de mayo de 2021.
- «Five reasons why zebrafish make excellent research models». NC3Rs. 10 de abril de 2014. Consultado el 7 de mayo de 2021.
- Vince (20 de septiembre de 2012). «How the world's oceans could be running out of fish». BBC. Consultado el 1o de mayo de 2021. Texto «nombreGaia » ignorado (ayuda)
- Kunzig, R. (1 de abril de 1995). «Twilight of the Cod». Discover: 52.
- Wootton, Robert J.; Smith, Carl (2014). Reproductive Biology of Teleost Fishes. John Wiley & Sons. pp. 123-125. ISBN 978-0-632-05426-8.
- Kernan, Martin; Battarbee, Richard W.; Moss, Brian R. (2011). Climate Change Impacts on Freshwater Ecosystems. John Wiley & Sons. p. 93. ISBN 978-1-4443-9127-5.
- Fisheries Management and Climate Change in the Northeast Atlantic Ocean and the Baltic Sea. Nordic Council of Ministers. 2008. p. 48. ISBN 978-92-893-1777-1.
- Committee on the Review of the National Ocean Acidification Research and Monitoring Plan, Ocean Studies Board, Division on Earth and Life Studies, National Research Council (2013). Review of the Federal Ocean Acidification Research and Monitoring Plan. National Academies Press. p. 3. ISBN 978-0-309-30152-7.
Bibliografía
- Helfman, Gene; Collette, Bruce B.; Facey, Douglas E.; Bowen, Brian W. (2009), The Diversity of Fishes: Biology, Evolution, and Ecology (2.ª edición), Wiley-Blackwell, ISBN 978-1-4051-2494-2.
- Lawrence, E., ed. (2003), Diccionario Akal de términos biológicos, Traducido por Codes, R. y Espino, F. J., Akal Ediciones, ISBN 84-460-1582-X.
- Wootton, Robert J.; Smith, Carl (2014), Reproductive Biology of Teleost Fishes, Wiley, ISBN 978-1-118-89139-1.
Bibliografía adicional
- La reproducción de los peces: Aspectos básicos y sus aplicaciones en Acuicultura. M. A. Carrillo Estévez (coordinador). Fundación Obasevatorio Español de Acuicultura. 2009. ISBN 978-84-00-08842-2.