Accumulateur électrique
Un accumulateur électrique est un système destiné au stockage de l'énergie électrique sous une forme différente. Il repose sur une technique de conversion réversible d'énergie. Tous les processus de conversion d'énergie sont complexes et entraînent des pertes.
Pour les articles homonymes, voir accumulateur.

Le rapport entre l'énergie initiale et l'énergie restituée donne le rendement de conversion-accumulation, qui atteint au mieux 80 % dans le cas des barrages. Les accumulateurs qui atteignent cette valeur ne sont pas transportables, ce qui oblige les utilisateurs à un compromis.
On distingue les accumulateurs selon leur technique :
- la conversion en énergie mécanique, dans laquelle l'énergie électrique est convertie en énergie potentielle puis restituée ultérieurement : énergie hydraulique potentielle de pesanteur, énergie de compression d'un gaz, énergie cinétique... ;
- l'électrostatique : bouteille de Leyde, condensateur ou supercondensateur ;
- l'électrochimie, où les électrodes sont le siège de réactions chimiques ;
- l'électrodynamique : circuit bobiné.
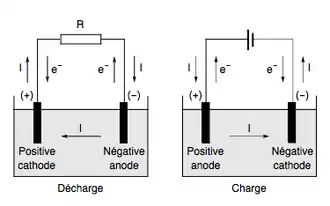
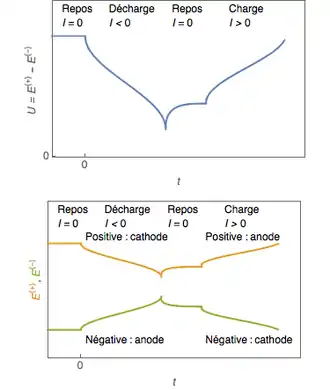
Généralités

L'énergie électrique peut donc se stocker de différentes manières.
- Sous forme d'énergie électrostatique, en accumulant des charges électriques dans un ou plusieurs condensateurs. L'apparition vers 1995 de condensateurs dont la capacité peut atteindre quelques centaines de farads, les supercondensateurs, permet de réaliser des substituts aux batteries d'accumulateurs classiques. Les avantages sont une diminution du poids et un fonctionnement possible par très grand froid (véhicules polaires). Avec un inconvénient de taille : le prix au kWh stocké est nettement plus élevé.
- Sous forme d'énergie électromagnétique, en établissant un courant électrique dans un circuit bobiné autour d'un circuit magnétique, de telle sorte que l'énergie nécessaire pour mettre en mouvement les charges électriques puisse être restituée par induction. La durée de stockage de l'énergie reste faible même avec les meilleurs métaux conducteurs que sont l'argent et le cuivre en raison des pertes dans le circuit par effet Joule ; un stockage de longue durée nécessite alors l'utilisation de matériaux supraconducteurs. Les dispositifs réalisés de cette façon sont connus sous le nom de SMES : Superconducting Magnet Energy Storage.
- Sous forme électrochimique, qui présente la caractéristique intéressante de fournir une tension (différence de potentiel) à ses bornes peu dépendante de sa charge (quantité d'énergie stockée) ou du courant débité. On utilise la propriété qu'ont certains couples chimiques d'accumuler une certaine quantité d'électricité en modifiant leur structure moléculaire et ceci de manière réversible.
- Différents types de couples chimiques sont utilisés pour la réalisation d'accumulateurs électriques.
Compte tenu des limites des techniques de stockage direct de l'électricité, le mot « accumulateur » désigne principalement le dispositif électrochimique mais depuis très longtemps on utilise aussi les trois autres formes d'accumulation pour les durées très courtes inférieures à la seconde (bobine, condensateur, principalement utilisés en conversion et redressement du courant alternatif). Depuis peu, on voit apparaître des nouveautés techniques jusqu'alors impensables, ainsi que l'annonce d'usages nouveaux de ces technologies. Par exemple, il n'existait pas de perceuses à accumulateurs efficaces avant les années 1980. Désormais, ces appareils autonomes portables possèdent une densité d'énergie toujours plus forte. Dans le domaine des super-condensateurs, les applications entrent désormais en concurrence avec les technologies classiques dans la course à la densité d'énergie pour certaines applications, avec des temps de charge et décharge très courts.
Exemples récents de développements des usages et des technologies
- Automobiles : exemple emblématique, la société Tesla développe des technologies avant-gardistes dans le domaine de la voiture électrique.
- Vélos et micros-véhicules assistés : l'usage des vélos à assistance électrique se développe.
- Transport en commun : les super-condensateurs sont particulièrement intéressants pour les autobus, qui font des arrêts fréquents. Ils peuvent être équipés de gros super-condensateurs récupérant l'énergie du freinage et effectuant des recharges très brutales, à très forte puissance, en très peu de temps et à chaque arrêt du parcours, par un système de recharge adapté. En , la RATP a commandé 15 autobus hybrides Diesel-supercondensateur permettant d'économiser jusqu'à 30 % de carburant[1].
- Aérien : depuis peu, de nombreux aéromodélistes utilisent des accumulateurs électriques pour la propulsion principale.
- Outils : la société Bosch a par exemple commercialisé une tondeuse à gazon professionnelle électrique-accumulateur en 2015 à la largeur standard, 43 cm, très adaptée aux coupes d'entretien régulier.
- Énergie : des sociétés spécialisées annoncent développer des moyens fixes et compacts de conversion réversible d'énergie électrique de grande contenance (ERDF, Siemens, Toshiba, etc.).
- Tesla a fait l'annonce en 2015 de la commercialisation aux États-Unis de la batterie privée PowerWall de 7 à 10 kWh pour 3 000 € dès 2015[2].
- le barrage hydraulique, technique très ancienne, est chargé d'accumuler de l'énergie hydraulique potentielle de pesanteur (déplacement en hauteur d'une quantité d'eau) et appelée pompage-turbinage. C'est cette technique de conversion-accumulation d'énergie qui a les meilleurs rendements, rendement d'un aménagement hydroélectrique dépassant 80 %[3], mais elle ne permet pas de construire des accumulateurs transportables.
Caractéristiques générales des accumulateurs électrochimiques
Tension électrique
La tension, ou potentiel (en volts), est un paramètre important. Fixée par le potentiel d'oxydo-réduction du couple redox utilisé, elle est de l'ordre de un à quelques volts pour un élément. En pratique des tensions plus élevées sont requises, typiquement de 12, 24 voire 48 V. Il suffit alors de raccorder des éléments du même type en série pour augmenter la tension, au sein d'une batterie d'accumulateurs. C'est l'origine du terme « batterie » comme synonyme courant de regroupement d’ « accumulateur » et, en anglais, de « pile »[4].
Charge électrique
La charge électrique (la quantité d'électricité emmagasinée par l'accumulateur) est exprimée en Ah (ou mAh : (milli)ampère-heure). Dans la pratique, elle se mesure en multipliant un courant constant (en ampères) par le temps de charge/décharge (en heures). Cependant l'unité officielle de charge du Système international d'unités (SI) est le coulomb, équivalent à un As (ampère pendant une seconde) : 1 Ah = 3 600 C avec 1 C = 1⁄3 600 Ah = 0,278 mAh. Elle ne doit pas être confondue avec l'énergie stockée (voir ci-dessous).
La capacité de charge électrique, souvent appelée dans le langage courant capacité de l'accumulateur, est la charge électrique que peut fournir l'accumulateur complètement chargé pendant un cycle complet de décharge. Sa valeur initiale théorique doit être indiquée par le constructeur, suivant la réglementation actuelle (en Ah ou mAh, voir ci-dessus). Elle dépend de l'intensité de décharge (selon la loi de Peukert) et diminue au cours de la vie de l'accumulateur. La méthode de mesure la plus répandue consiste à mesurer, pour un courant de décharge constant donné, le nombre d'heures durant lesquelles l'accumulateur fournit ce courant, avec une tension supérieure à la tension de seuil (qui vaut, par exemple, 0,9 V pour un accumulateur NiMH)[5]. La tension à vide de l'accumulateur, facile à mesurer avec un voltmètre, ne donne généralement pas une indication fiable de la charge restant dans l'accumulateur, sauf dans le cas de la technologie lithium-ion.
Énergie stockée
L'énergie stockée dans la batterie est égale à sa charge électrique multipliée par la tension moyenne sous laquelle cette charge est déchargée. L'énergie stockée se mesure habituellement en watts-heures (Wh), mais l'unité officielle (SI) est le joule.1 Wh = 3 600 J = 3,6 kJ ; 1 J = 0,278 mWh.
Débit maximum
Le débit maximum, ou courant de pointe, d'un accumulateur se mesure en ampères. Il est généralement spécifié en amplitude et en durée et est généralement largement supérieur au débit permanent autorisé.
Résistance interne
La résistance interne, exprimée en ohms, est la résistance qui provoque une chute de tension lors de la charge et de la décharge, induisant des pertes par effet joule. La résistance interne limite les courants de charge et de décharge. Comme les accumulateurs sont des dipôles non linéaires, elle est généralement mesurée pour des faibles variations de tension et de courant (de l'ordre de 10 mV pour la tension). Sa mesure requiert un appareillage spécialisé. La résistance interne est assez simple à mesurer au moyen d'un voltmètre et d'un ampèremètre.
Beaucoup d'accumulateurs ont leur résistance interne qui augmente lorsqu'ils entrent en fin de vie.
La résistance interne est définie par l'équation : , donnée par la loi de Pouillet pour les générateurs de courant continu.
est la tension à vide de l'accumulateur, est le courant de décharge et la résistance interne.
La résistance interne prend seulement en compte la composante continue du courant de décharge. Hors, lors des appels de courant provoqués par les appareils auxquels l'accumulateur est relié, le générateur ne se comporte pas tout à fait de la même manière, car les composantes selfiques et capacitives des accumulateurs entrent aussi en compte, c'est pourquoi on parle alors d'impédance interne. Les fabricants et testeurs professionnels réalisent des mesures sur le principe de l'équation de Pouillet présentée ci-dessus, mais en ayant recours à un courant haché à 1 000 Hz.
Courant de charge maximum
Le courant maximum supportable pendant la recharge est indiqué en ampères, mais il est souvent exprimé en unités de charge, c'est-à-dire rapporté à la capacité. L'unité de charge est le rapport entre le courant de charge en A et la capacité C en Ah. Une valeur de 0,5 C correspond à 0,5 A pour une capacité de 1 Ah, ou à 1 A pour une capacité de 2 Ah. Dans les deux cas précédents, la charge dure 2 h.
Efficacité énergétique
L'utilisation de la batterie à travers charge puis décharge donne lieu à des pertes. Ces pertes sont caractérisées par une efficacité énergétique, décomposée en deux termes[6] : efficacité coulombique (de courant) et efficacité de voltage.
La non-utilisation donne lieu à des pertes d'auto-décharge. Celles-ci ne sont pas directement liées à la quantité d'énergie stockée mais à la durée de stockage.
Densité
La densité massique d'énergie est une caractéristique importante d'un accumulateur. Elle correspond à la quantité d'énergie (exprimée en Wh/kg) qu'il peut restituer par rapport à sa masse.
La densité volumique, ou densité d'énergie, est une autre caractéristique qui peut avoir son importance et correspond à la quantité d'énergie (exprimée en Wh/m³) qu'il peut restituer par rapport à son volume. On utilise plus couramment les Wh/dm³, soit Wh/L.
La densité de puissance en pointe, ou puissance spécifique, correspond à la puissance maximale rapportée à la masse de l'accumulateur (exprimée en watts par kilogramme, W/kg). De la même manière, on peut calculer la puissance rapportée au volume, moins usitée. Cette puissance spécifique est surtout fonction inverse de la résistance interne de l'accumulateur.
Vieillissement et usure
Le vieillissement et l'usure entraînent une perte progressive de la capacité des batteries avec le temps (plusieurs années) et l'usage (plusieurs centaines ou milliers de cycles de charge et de décharge). Ils sont souvent fortement dépendant des conditions d'emploi (amplitude du cyclage, température de stockage et d'utilisation).
Forme physique

Certains éléments sont fabriqués selon les normes établies par la Commission électrotechnique internationale (CEI) et par l'American National Standards Institute (ANSI). Cependant, beaucoup de formes physiques sont propres aux fabricants d'accumulateurs, ou correspondent à des besoins particuliers des utilisateurs. C'est le cas de la plupart des batteries de téléphones portables.
Le marquage « Rechargeable » est obligatoire sur les accumulateurs NiMH et NiCd[7]. Lorsque le marquage est illisible ou effacé, sur les éléments cylindriques, on peut distinguer les accumulateurs des piles alcalines par le fait que les accumulateurs ont souvent une borne supérieure (pôle +) entourée de plastique, alors que les piles alcalines ont une borne supérieure en métal. La connaissance de ce détail permet d'éviter des erreurs, mais la règle n'est pas absolue.
Différentes technologies
Plomb-acide
La tension nominale d'un élément d'accumulateur de type plomb-acide est de 2,1 V. C'est le dispositif de stockage d'énergie électrique utilisé pour la batterie de démarrage de la plupart des véhicules automobiles à moteur thermique.
Invention
L'accumulateur au plomb a été inventé en 1859 par Gaston Planté qui observait l'électrolyse de l'eau acidulée. En essayant le plomb dans sa recherche de matières plus économiques que le platine, il remarqua que son appareil rendait de l'électricité lorsqu'on coupait l'alimentation ; comme si l'oxygène et l'hydrogène pouvaient rendre l'électricité qui les avait produits. Gaston Planté crut avoir inventé la pile à combustible, mais comprit vite que ce n'étaient pas l'oxygène et l'hydrogène gazeux qui produisaient le courant, mais la modification chimique (oxydation) de la surface du plomb.
Son appareil se composait de deux lames de plomb maintenues écartées par des bandes isolantes. Pour augmenter la surface des électrodes, Gaston Planté enroula concentriquement deux bandes de plomb séparées par deux intercalaires de caoutchouc pour éviter tout contact entre elles, le tout contenu dans un bocal de verre rempli d’eau acidulée. Pour obtenir une capacité de décharge importante, il constata qu’il était nécessaire de faire subir aux électrodes une série de cycles charge/décharge qui constituaient ce qu’il appela « la formation ».
Avantages et inconvénients
Le fonctionnement de l'accumulateur ne disperse pas de plomb.
Le plomb est un polluant, mais le recyclage des batteries d'accumulateurs au plomb est facile. Malgré une réglementation de plus en plus sévère sur le transport et le recyclage des batteries, qui augmente les frais et diminue la rentabilité du recyclage, le taux de recyclage des batteries au plomb atteint les meilleurs résultats de valorisation, avec 95 % de collecte et plus 65 % de valorisation en matière première secondaire sèche[réf. souhaitée]. Le prix du kilogramme de batteries est deux fois supérieur au prix du kilogramme de ferraille et permet ainsi de financer son recyclage sans devoir demander de soutien financier aux pouvoirs publics ou aux consommateurs.
La durée de vie ainsi que les performances d’une batterie d'accumulateurs au plomb dépendent fortement de l’utilisation qui en est faite. Ainsi, on a vu des batteries rendre l’âme après seulement 50 cycles, alors que d’autres du même type ont tenu plus de 500 cycles[réf. nécessaire]. Cette forte disparité est en partie due au fait que ces batteries sont influencées par le type de cycle charge/décharge qu’on leur impose, sachant qu'elles supportent très mal les décharges profondes. En revanche, un système embarqué de contrôle de la tension assez rudimentaire suffit pour une utilisation courante, par exemple sur les automobiles dans lesquelles la régulation à 14,4 V est incorporée à l'alternateur, monté en parallèle sur la batterie 12 V ; en limitant à 2,3 V par élément, tension de floating[pas clair][8], on peut laisser le chargeur branché en permanence, la charge se limitant d'elle-même en courant.
Avantages : peu cher, solide, capable de fournir des courants élevés, faible autodécharge (1%/mois)[5],
Inconvénients : risques de fuite d'acide sulfurique si la batterie est non étanche, densité énergétique faible, risque de cristallisation du sulfate de plomb si la batterie reste trop longtemps déchargée et donc perte de capacité irréversible[5].
Ni-Cd (nickel-cadmium)

La tension nominale d'un élément accumulateur de ce type est de 1,2 V.
Ce type d'accumulateur possède un effet mémoire, ce qui impose son stockage dans un état déchargé (0,6 V). La fin de charge est caractérisée par une variation de la tension de charge (dv/dt) négative. C'est ce seuil qui est détecté par les chargeurs automatiques de qualité pour arrêter la charge.
Par rapport au Ni-MH, le Ni-Cd peut supporter des pointes de courant en décharge plus importantes (de l'ordre de 100 fois[réf. nécessaire]), mais sa décharge naturelle est plus rapide que celle du Ni-MH.
Ce type d'accumulateur permet un nombre de cycles charge/décharge plus important que les accus Li-ion ou les Ni-MH (durée de vie supérieure)[réf. nécessaire].
Ce couple électrochimique a été l'un des plus couramment utilisés pendant plusieurs décennies pour fabriquer des batteries d'accumulateurs alimentant les appareils portatifs.
Pour la plupart de ces applications, il est en voie d'abandon au profit du Ni-MH et du Li-Ion. Malgré l'augmentation considérable des cours du nickel ces dernières années, son marché se maintient dans ses usages industriels (applications aéronautiques, ferroviaires, stationnaires, où son utilisation reste autorisée) en raison de ses performances (notamment sa forte puissance spécifique).
Ni-MH (nickel-métal hydrure)
La tension nominale d'un élément accumulateur de ce type est de 1,2 V. Cet accumulateur n'incorpore ni cadmium, ni plomb et est donc peu polluant. De plus, son énergie massique est supérieure de 40 % à celle des Ni-Cd et son effet mémoire est très faible.
Lorsque la charge est rapide (courant de charge au moins égal à C/5), la fin de charge se caractérise par une variation de tension (δv/δt) très faiblement négative. Cette variation de tension, de l'ordre de quelques millivolts, est détectée par les chargeurs automatiques de qualité pour arrêter la charge.
Ni-Zn (nickel-zinc)
Le Ni-Zn est un couple redox connu depuis plus de cent ans, mais qui n'a pu être industrialisé de manière significative, à cause d'une très faible durée de vie en nombre de cycles. Ce problème est aujourd'hui résolu par une nouvelle technique de stabilisation de l’électrode de zinc[Laquelle ?] développée en France entre 1998 et 2005.
Le Ni-Zn constitue désormais un système à la fois d'énergie et de puissance, aux performances supérieures à celles du Ni-Cd et du Ni-MH. Il accepte des régimes élevés de charge et de décharge. Sa tension nominale est de 1,65 V. C'est un accumulateur robuste, fiable et parfaitement sûr[réf. nécessaire], fonctionnant sans besoin de maintenance (étanche). Il ne contient aucun métal lourd et est aisément et intégralement recyclable en fin de vie.
Sa durée de vie en cyclage est équivalente à celle du Ni-Cd, son autodécharge et son effet mémoire étant inférieurs.
La fabrication des accumulateurs Ni-Zn est plus économique que celle des autres accumulateurs alcalins (Ni-Cd et Ni-MH).
La baisse du prix des accumulateurs au lithium, plus performants tant du point de vue de la densité énergétique, du nombre de cycles charge/décharge et de la tension nominale (3,7 V face à 1,65 V), fait de l'ombre à cette technologie. Les accumulateurs nickel-zinc présentent toutefois des avantages par rapport à ceux à base de lithium. En effet, les accumulateurs au lithium nécessitent des circuits de protection spécialisés (surcharge, décharge profonde et court-circuit) et ont une durée de vie plus faible[réf. nécessaire]. Enfin, leur recyclage n'est pas encore bien maîtrisé.
Lithium

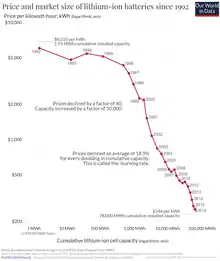
Les accumulateurs à base de lithium sont d'une technologie récente et toujours en développement, qui présente un très important potentiel électrochimique.
Les différentes technologies
On distingue la technique lithium métal, où l'électrode négative est composée de lithium métallique (matériau qui pose d'importants problèmes de sécurité, ce qui limite l'emploi de ce matériau tel quel), et la technique lithium ion, où le lithium reste à l'état ionique grâce à l'utilisation d'un composé d'insertion aussi bien à l'électrode négative (généralement en graphite) qu'à l'électrode positive.
Les accumulateurs lithium-ion sont parfois remplacés par leur variante lithium polymère dite Li-Po. Le principe électrochimique de celle-ci est le même, mais un gel (polymère) fige l'électrolyte, ce qui permet de réduire son contenant à une simple enveloppe plastique souple. Toutefois le polymère ralentissant le déplacement des ions, l'aptitude à la fourniture de courants importants est réduite, donc sa puissance spécifique (voir définition plus haut) est généralement inférieure à celle des éléments Li-Ion de même capacité.
La durée de vie de ces accumulateurs est sujette à polémique : pour les fabrications très grand public : elle peut n'être que de deux à quatre ans après fabrication, indépendamment du nombre de cycles de charges[9]. Par contre des fabrications orientées professionnelles d'un coût nettement supérieur et bénéficiant d'une électronique de gestion plus évoluée permettent une endurance supérieure à 10 années avec plus de 3 000 cycles. Par exemple l'astromobile Opportunity possède une batterie d'accumulateurs au lithium-ion rechargeable avec ses panneaux solaires. Il a fonctionné pendant plus de 15 années, malgré un froid intense à −100 °C sur la planète Mars[10].
Le potentiel le plus répandu d'une cellule au lithium-ion est de 3,7 V.
Recyclage
Les difficultés rencontrées pour recycler le lithium ne permettent pas de valoriser les matériaux utilisés actuellement pour une seconde utilisation des composés chimiques. Les techniques de traitement permettent seulement de stabiliser les impacts dangereux des matériaux composant cette technologie d'accumulateur. Le coût de traitement est l'un des plus importants en fin de vie de l'ensemble des accumulateurs.
Restriction de transport
En raison de la possibilité d'explosion et de combustion de ces accumulateurs, ils font l'objet de restrictions dans les transports aériens et même de précautions particulières en cabine passager pressurisée. Documents officiels : Air France[11], OFAC[12], FAA[13].
Batteries lithium-ion solides
En , Saft, filiale de Total spécialisée dans les batteries de haute technologie, annonce la formation d'une alliance avec Solvay, Manz et Siemens, pour réaliser un programme de recherche, de développement et d'industrialisation de batteries lithium-ion solides. L'électrolyte solide rendra les batteries plus sûres (en éliminant les risques d'explosion), plus performantes et moins onéreuses[14].
Une alliance financée par le gouvernement japonais a été créée en pour accélérer le développement des batteries solides ; elle comprend des constructeurs (Toyota, Nissan et Honda), des fabricants de batteries (Panasonic et GS Yuasa) et le Libtec, l’organisme de recherche nippon sur les batteries lithium-ion. L'objectif est de doubler l’autonomie des voitures électriques pour passer à 800 kilomètres d’ici 2030, avec un premier objectif fixé à 550 kilomètres à l’horizon 2025[15].
Après avoir investi 100 millions d'euros dans la start-up californienne QuantumScape, spécialisée dans le développement de batteries solides, le groupe Volkswagen annonce qu’il envisage la construction d’une usine pour produire ces batteries dès 2025 ; si l’industrialisation de leur fabrication réussit, une production pilote sera lancée en 2022 ou 2023[16].
Sodium-ion
Une start-up française créée en 2017, Tiamat, en collaboration avec le CEA et le CNRS, est en train d'industrialiser un nouveau couple chimique, la batterie sodium-ion. Celle-ci a comme avantage de n'incorporer que des matières premières répandues, peu chères et faciles à recycler : sodium (composant du sel marin) pour une électrode, aluminium pour l'autre. Autres avantages, une durabilité annoncée de 4 000 à 8 000 cycles, soit deux à quatre fois plus que les accumulateurs Lithium et, surtout, une densité de puissance par unité de masse deux à cinq fois supérieure, ce qui autorise des recharges très rapides, compensant pour les automobiles hybrides électriques et les automobiles électriques une densité de stockage encore inférieure de 40 % par rapport aux meilleures Li-ion.
Une première ligne de production est prévue en fin 2020 à Amiens[17],[18].
Pile alcaline
Contrairement aux mentions inscrites sur leurs emballages, les piles alcalines dites « non rechargeables » peuvent parfois être régénérées partiellement, sous certaines conditions (pas trop déchargées, pas oxydées, etc.) et avec un appareil adapté, jusqu'à une dizaine de fois selon les cas[19]. Eu égard à ce nombre limité de cycles, les piles alcalines ne sont pas habituellement considérées comme des accumulateurs.
Certains modèles de piles alcalines renforcés, que l'on appelle usuellement les piles alcalines rechargeables, peuvent être considérés comme des accumulateurs[réf. nécessaire].
Magnésium
Des accumulateurs au magnésium-soufre (Mg/S) (technologie encore émergente en 2019) utilisent l'ion magnésium comme support de charge, le magnésium-métal comme anode et le soufre comme cathode[20].
Il suscite des espoirs importants, car théoriquement les caractéristiques physicochimiques du couple Mg/S lui permettent de fournir une densité d'énergie de 1 722 Wh/kg, avec une tension d'environ 1,7 V[20].
À partir de 2015, la recherche devient très active sur ce sujet[21], notamment pour des électrolytes non nucléophiles, avec l'espoir qu'elles soient une alternative économique et sûre aux accumulateurs Li-ion, notamment pour les véhicules électriques du futur, avec une quantité d'électricité stockée plus importante. Elles pourraient aussi bénéficier de cathodes à haute capacité, fonctionnant éventuellement sous haute tension, dont le matériau (à base de soufre, avec le borohydrure de magnésium[22], le borate de magnésium[23] ou le sulfure de magnésium par exemple[24],[25]) permettrait une densité d'énergie plus élevée qu'avec les accumulateurs lithium-ion[26]. La conductivité électronique de la cathode de soufre peut être dopée par du carbone (composite cathodique semi-organique)[20].
Le magnésium est inflammable au contact de l'oxygène pur, mais présente l'avantage d'être abondant, non-toxique, non-corrosif, il ne se dégrade pas au contact de l'air, ne forme pas de dendrites comme le fait lithium ionique des batteries au lithium rechargeables[20],[27].
Calcium
Le calcium semble être l'une des alternatives les moins chères et les moins toxiques au lithium et au cobalt, en remplacement des accumulateurs lithium-ion utilisées dans les téléphones portables et beaucoup d'autres appareils électroniques[28]. L'industrie étudie des prototypes de piles à anodes de calcium remplaçant les piles à anodes en lithium, mais jusqu'en 2018, l'électrolyte approprié manquait encore. En 2019 à l'Institut Helmholtz d'Ulm (Allemagne), Zhirong Zhao-Karger et al. ont pu associer deux composés de calcium et de fluor, et non seulement ce matériau (un type nouveau de sel de calcium) se montre meilleur conducteur d'électricité que tous les électrolytes calciques connus jusqu'alors, mais de plus, il le fait avec une tension supérieure à celle des autres électrolytes à base de calcium. On espère pourvoir ainsi produire des batteries peu coûteuses et efficaces pouvant stocker l'électricité issue de sources intermittentes (éoliennes et solaires)[28].
Brome
Actuellement au stade de prototype, les accumulateurs à base de brome seront probablement réservés aux installations fixes car ils nécessitent la circulation de l'électrolyte et, de plus, le brome est particulièrement dangereux.
Les couples étudiés sont : sodium-brome, vanadium-brome et zinc-brome.
Batteries à flux au vanadium
Une batterie redox vanadium (ou batterie à oxydoréduction au vanadium), est un type de batterie rechargeable à flux qui utilise le vanadium dans différents états d'oxydation pour stocker l'énergie potentielle chimique.
La capacité est augmentable à volonté, simplement en utilisant des réservoirs de plus en plus grands, et la batterie peut être laissée déchargée pour de longues périodes sans se dégrader. Ces batteries sont bien adaptées aux applications nécessitant des stockages importants, une réponse à un pic de consommation, ou le lissage de la production de sources variables comme les centrales solaires ou éoliennes.
Batteries à flux aux quinones
Une voie pour le stockage d'énergie, explorée en 2014 par des chercheurs de l'université américaine d'Harvard, est une batterie utilisant des quinones dans un bain d'acide sulfurique et de simples électrodes de carbone[29]. Les quinones présentent une rapidité de charge/décharge exceptionnelle : la réaction quinone–hydroquinone est 1 000 fois plus rapide que celle du vanadium, et le coût serait modeste, s'élevant à seulement 27 $/kWh (20 €/kWh), le tiers du coût des batteries au vanadium[30].
Batteries métal liquides
La technologie des batteries « métal liquides », inventée par le Dr Donald Sadoway, professeur au Massachusetts Institute of Technology, est développée par la start-up Ambri. Chaque cellule consiste en trois couches de liquide se séparant spontanément : deux de métaux liquides et une de sel fondu — qui flottent l'une au-dessus de l'autre du fait de différences de densité et de leur non-miscibilité. Le système fonctionne à température élevée, maintenue par auto-échauffement durant la charge et la décharge. Il en résulte un système de stockage efficace et à bas coût, grâce à l'utilisation de matériaux peu coûteux, abondants dans le monde et à une conception qui tire avantage des économies d'échelle inhérentes à l'électro-métallurgie et à l'industrialisation conventionnelle. Le procédé est très souple : il peut répondre à des signaux de régulation en quelques millisecondes et peut stocker jusqu'à douze heures d'énergie et la restituer lentement. Les électrodes liquides évitent les défauts des batteries conventionnelles, en particulier le déclin de la capacité de cycle en cycle, car les électrodes sont reconstituées à chaque charge (objectif de 98 % de capacité après 10 000 cycles complets de charge/décharge). Les batteries sont modulaires, permettant une adaptation sur mesure à des usages variés ; les cellules sont empilées dans des modules de la taille d'un réfrigérateur, placés dans un conteneur de 40 pieds (12 mètres) d'une puissance de 500 kW et de 2 MWh de capacité de stockage[31]. Ambri, créée en 2010 avec Total et Bill Gates parmi ses actionnaires, a installé une chaîne de production pilote à l'automne 2013, annonce son premier prototype commercial pour 2015, destiné à plusieurs clients pilotes aux États-Unis, et prévoit d'atteindre la production à plein régime de la première usine fin 2016, avec 130 MWh par an. Le marché visé est le stockage de l'électricité, à de nombreux endroits sur le réseau et pour un faible coût, pour permettre l'utilisation massive d'énergies renouvelables en compensant leur irrégularité[32].
Graphène-aluminium
La société australienne Graphene Manufacturing Group (GMG) annonce en mai 2021 un accord avec l'Université du Queensland pour la réalisation de prototypes d'accumulateurs graphène aluminium-ion à cathode en graphène. Pour des accumulateurs au format des piles boutons (montres, téléphones portables et autres appareils nomades), la technologie graphène aluminium-ion serait accessible dès 2022, et pour la mobilité électrique en 2024. Selon GMG, ces batteries se rechargeraient jusqu’à 60 ou 70 fois plus rapidement que les actuelles cellules lithium-ion, sans échauffement, et leur durée de vie serait deux fois plus longue : 2000 cycles de recharge/décharge. mais la densité énergétique, serait seulement de 150-160 Wh/kg contre 250 Wh/kg pour la technologie lithium-ion[33].
Tableau comparatif des différentes technologies
| Type | Énergie massique Wh/kg |
Énergie volumique Wh/l |
Tension d'un élément V |
Puissance en pointe W/kg |
Durée de vie (nombre de recharges) |
Efficacité
de courant |
Efficacité
de voltage |
Efficacité
énergétique |
Autodécharge en % par mois |
Statut |
|---|---|---|---|---|---|---|---|---|---|---|
| Plomb - Acide | 30 - 50 | 75 - 120 | 2,25 | 700 | 400 - 800 | 5 | Production | |||
| Ni-Fe | 20 - 60 | ? | ? | ? | ? | ~ 30 | Production | |||
| Li-Ti | 50 - 67[34] | 75 - 131[34] | 2,4[34] | 3 000 | 6 000[35] | ? | Production | |||
| Ni-Cd | 45 - 80 | 80 - 150 | 1,2 | ? | 1 500 - 2 000 | > 20 | Interdit (toxique) | |||
| Ni-H2 | 75 | 60 | 1,25 | ? | ? | ? | ? | |||
| Ni-MH | 60 - 110 | 220 - 330 | 1,2 | 900 | 800 - 1 000 | > 30 | Production | |||
| Ni-Zn | 90[36] | 280[36] | 1,60[36] | 1 000 | 200[36] | > 20 | Production | |||
| Na-S | 100 - 110 | ? | ? | ? | ? | ? | Production[37] | |||
| LMP | 110 | 110 | 2,6 | 320 | ? | ? | ? | |||
| Li-Po | 100 - 295 | 220 - 330 | 3,7 | 250 | 200 - 300 | 2 | Production | |||
| Na-NiCl2 | 140[38] | 280[38] | 2,58[38] | 200 | 3 000[38] | → 100 (12 %/jour) | Production | |||
| Pile alcaline | 80 - 160 | ? | 1,5 - 1,65[39] | ? | 25 - 500 | < 0,3 | Production | |||
| LFP | 120 - 140 | 190 - 250 | 3,2 | > 2 000[40] | 2 000 | 5 | Production | |||
| Li-ion | 100 - 265[41] | 220 - 400[41] | 3,6 | 1 500 | 500 - 1 000 | 2 | Production | |||
| Li-S | 400[42] | 200 | 2,8[42] | 400[42] | ? | <1 | Production | |||
| Na-ion | 90[43] | ? | 3,6 | > 3 000 | 4 000[43] | ? | R&D[44] | |||
| Ni-Li (en) | 935[34] | ? | 3,49[45] | ? | ? | ? | ? | |||
| Li-air | 1 500 - 2 500 | ? | 3,4 | 200 | ? | ? | R&D | |||
| Redox Vanadium | 10 - 20 | 15 - 25 | 1,15 - 1,55 | ? | > 10 000 cycles (10 - 20 ans) | 85 – 93 % | 80 – 90 % | 65 – 83 % |
L'accumulateur Li-Po(lymère) est moins performant que le Li-ion, est plus compact et est fabriqué selon des procédés différents. Par conséquent, une batterie Li-Po de même taille qu'une batterie Li-ion possède une capacité plus importante. Le tableau précédent donne le rapport entre l'énergie stockée (en Wh) et la masse de la batterie (en kg). Or, une batterie Li-Po est plus dense qu'une Li-ion, d'où la différence.[Passage contradictoire]
Recherche et prospective
La R&D recherchant activement de nouveaux moyens, plus écologiques, plus efficients ou moins coûteux de stockage de l'énergie est très active, via de nouveaux concepts, de la bioinspiration à l'intelligence artificielle, pour notamment tenter de répondre aux défis posés aux systèmes de batteries dans le contexte du développement des véhicules électriques et des énergies renouvelables irrégulières[46].
Notes et références
- « Bus à supercondensateur : l'autobus hybride arrive à Paris », sur supercondensateur.com, (consulté le ).
- « Une batterie pour économiser l'énergie domestique », France Info, 4 mai 2015.
- (en) « Pumped Hydropower », Energy storage association (consulté le 15 octobre 2019).
- Définitions lexicographiques et étymologiques de « batterie » (sens A.2.− P. anal., ÉLECTR.) dans le Trésor de la langue française informatisé, sur le site du Centre national de ressources textuelles et lexicales
- « Caractéristiques des Batterie - informations », sur www.aero-hesbaye.be (consulté le )
- Electrosuisse (de), Les batteries redox pour le stockage d’énergie : Des applications conventionnelles à la production d’hydrogène (lire en ligne [PDF]), p. 37.
- « Le monde des accus rechargeables : Le marquage des accus au Nickel », sur www.ni-cd.net.
- Qu'est-ce la tension de floating ?, sur regenebatt.com (consulté le 18 Janvier 2019).
- « La théorie des accus au Lithium », sur ni-cd.net (consulté le 23 décembre 2018).
- (en) Mars exploration Rover - MER, nirgal.net (consulté le 14 septembre 2019).
- « Air france et KLM : Information et restrictions bagages avce batterie au lithium », sur airfrance.fr, (consulté le )
- Office fédéral de l’aviation civile OFAC, « Batteries, piles et appareils électroniques », sur www.bazl.admin.ch (consulté le )
- (en) « FAA : Batteries Carried by Airline Passengers », sur faa.gov, (consulté le )
- « Saft forme une alliance pour développer une batterie lithium-ion solide », L'Usine nouvelle, 22 février 2018.
- « Un consortium nippon pour développer les batteries solides », automobile-propre.com, 9 mai 2018.
- « Volkswagen envisage la fabrication de batteries à électrolyte solide », automobile-propre.com, 4 août 2018.
- « Les batteries sodium-ion passent le cap de l’industrialisation », Éditions techniques de l'ingénieur, 8 novembre 2019.
- « « Nous voulons créer en France un Tesla de la batterie sodium-ion », affirme Laurent Hubard, directeur de Tiamat Energy », Industrie et Technologies, 28 novembre 2019.
- « Recharger des piles alcalines non rechargeables », sur astuces-pratiques.fr, 23 juillet 2015 (consulté le 15 septembre 2019).
- (en) X. Zhou, J. Tian, J. Hu, & C. Li, « High rate magnesium–sulfur battery with improved cyclability based on metal–organic framework derivative carbon host ». Advanced Materials, numéro 30; volume 7, 2018, 1704166 résumé.
- (en) Zhao-Karger, Zhirong; Fichtner, Maximilian, « Magnesium–sulfur battery: its beginning and recent progress », MRS Communications, no 7, volume 4, septembre 2017, p. 770–784 (doi:10.1557/mrc.2017.101, ISSN 2159-6859).
- (en) Rana Mohtadi, Masaki Matsui, Timothy S. Arthur et Son-Jong Hwang, « Magnesium Borohydride: From Hydrogen Storage to Magnesium Battery », Angewandte Chemie International Edition, vol. 51, no 39, , p. 9780–9783 (ISSN 1521-3773, PMID 22907926, PMCID PMC3588139, DOI 10.1002/anie.201204913, lire en ligne, consulté le ).
- (en) Aobing Du et al., « An efficient organic magnesium borate-based electrolyte with non-nucleophilic characteristics for magnesium–sulfur battery », Energy & Environmental Science, vol. 10, no 12, , p. 2616–2625 (ISSN 1754-5706, DOI 10.1039/C7EE02304A, résumé, lire en ligne [PDF], consulté le ).
- Zhao‐Karger, Z., Zhao, X., Wang, D., Diemant, T., Behm, R. J., & Fichtner, M. (2015) Performance Improvement of Magnesium Sulfur Batteries with Modified Non‐Nucleophilic Electrolytes. Advanced Energy Materials, 5(3), 1401155.
- Zhao-Karger, Z., Liu, R., Dai, W., Li, Z., Diemant, T., Vinayan, B. P.,... & Ruben, M. (2018). Toward highly reversible magnesium–sulfur batteries with efficient and practical Mg [B (hfip) 4] 2 electrolyte. ACS Energy Letters, 3(8), 2005-2013 (résumé).
- Zhang, Z., Dong, S., Cui, Z., Du, A., Li, G., & Cui, G. (2018) Rechargeable Magnesium Batteries using Conversion‐Type Cathodes: A Perspective and Minireview. Small Methods, 2(10), 1800020 (résumé)
- Zhao-Karger, Z., Bardaji, M. E. G., Fuhr, O., & Fichtner, M. (2017) A new class of non-corrosive, highly efficient electrolytes for rechargeable magnesium batteries. Journal of Materials Chemistry A, 5(22), 10815-10820.
- « How a cheap mineral could make a better battery — and help the planet ; Calcium could replace lithium in batteries that store solar and wind power », Nature, le 6 septembre 2019.
- (en) « A metal-free organic–inorganic aqueous flow battery », Nature, (consulté le 14 janvier 2014).
- (en) « Cheap battery stores energy for a rainy day », Nature (consulté le 14 janvier 2014).
- (en)« Storing Electricity for our future - Technology », Ambri (consulté le 13 mai 2014).
- « Bill Gates mise sur les batteries métal liquides d’Ambri », La Tribune (consulté le 13 mai 2014).
- GMG annonce des batteries graphène aluminium-ion révolutionnaires, automobile-propre.com, 25 mai 2021.
- (en) Toshiba's New Secondary Battery Squashed... No Explosion, Fire... Why?, sur techon.nikkeibp.co.jp
- (en) A rechargeable battery, sur scib.jp, janvier 2009.
- (en) NI-ZN Battery Specification (2010), sur conrad.com [PDF].
- « Une batterie géante au sodium de 4 MW au Texas », sur enerzine.com.
- (en) « Batterie FIAMM SoNick 48TL200 », sur off-grid-europe.com (consulté le ).
- Cette appellation regroupe des piles de techniques diverses, d'où la variabilité.
- (en) «Lithium Ion Prismatic Cell », sur a123systems.com (consulté le 6 octobre 2014).
- (en) Panasonic - Technologie Li-Ion, sur le site panasonic.com [PDF].
- (en) Primary Li-SO2 single cells and multi-cell battery packs, sur saftbatteries.com [PDF].
- « Bientôt des batteries sodium-ion pour stocker les énergies renouvelables ? », EDF France, (lire en ligne, consulté le )
- « Une start-up pour des batteries de plus en plus rapides », sur CNRS (consulté le ).
- « Les batteries Li-Ion bientôt dépassées ? », sur presence-pc.com
- (en) Teo Lombardo, Marc Duquesnoy, Hassna El-Bouysidy, Fabian Årén, Alfonso Gallo-Bueno, Peter Bjørn Jørgensen, Arghya Bhowmik, Arnaud Demortière, Elixabete Ayerbe, Francisco Alcaide, Marine Reynaud, Javier Carrasco, Alexis Grimaud, Chao Zhang, Tejs Vegge, Patrik Johansson et Alejandro A. Franco, « Artificial Intelligence Applied to Battery Research: Hype or Reality? », Chemical Reviews, , acs.chemrev.1c00108 (ISSN 0009-2665 et 1520-6890, DOI 10.1021/acs.chemrev.1c00108, lire en ligne, consulté le ).
Articles connexes
- Portail de l’électricité et de l’électronique
- Portail de la chimie
- Portail de l’énergie