Extraction du nickel
La métallurgie extractive du nickel est l’ensemble des opérations permettant la fabrication de nickel métallique à partir du minerai. Elle concerne aussi le recyclage des déchets métallurgiques recyclés contenant du nickel (40 % du nickel consommé en 2005 est recyclé[E 1],[1]).
2.PNG.webp)
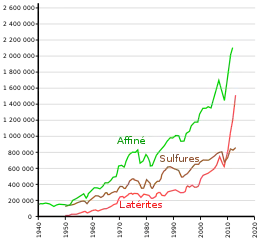
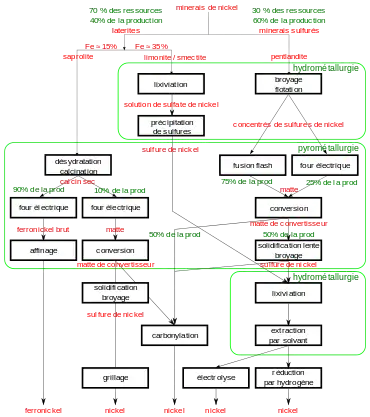
Au début du XXIe siècle, le nickel est extrait de deux types de minerais : les latérites et les sulfures. Mais bien que 70 % des réserves de nickel soient des minerais latéritiques, ceux-ci ne correspondent qu'à 40 % de la production mondiale. Les minerais latéritiques sont essentiellement destinés à la production de ferronickel, les minerais sulfureux étant généralement destinés à la production de nickel très pur[E 2].
Qu'ils soient latéritiques ou sulfureux, les minerais de nickel sont exploités dès que leur richesse dépasse 1,3 % de nickel[E 3]. Cette faible teneur explique la complexité et la diversité des procédés, déterminés par la nature de la gangue du minerai, ainsi que par la qualité du nickel désiré à la fin de l'extraction.
Histoire
_p166_Mines_de_nickel.jpg.webp)
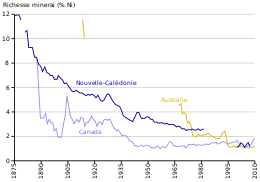
Jules Garnier parcourt de 1863 à 1866 la Nouvelle-Calédonie et y découvre un minerai contenant, au maximum, 6 à 7 % de nickel, qui est nommé en son honneur la garniérite. La production de nickel y démarre en 1875[2]. Déjà à cette époque, le débat est vif entre ceux qui préconisent un traitement hydrométallurgique et Garnier, qui adopte un procédé pyrométallurgique[3].
Pendant la construction du Chemin de fer transcontinental au Canada en 1883, du nickel est découvert dans le bassin du Grand Sudbury en Ontario. Cette découverte a alors provoqué une forte immigration européenne. L'abondance de nickel dans la région lui vaut le surnom de « Capitale du nickel ».
Mise au point à Grand Sudbury (Canada) en 1905[2], la production de nickel à partir de minerais sulfureux, par ailleurs riches en cuivre et en cobalt, dépasse rapidement la production à partir de latérites[4].
En 1921, des filons de nickel sont découverts en Finlande dans la région Petsamo. L'exploitation du nickel commence en 1935 par l'entreprise canadienne Inco.
En 1935, Staline décide de créer la ville de Norilsk en Sibérie pour l'exploitation d'un gisement de nickel par l'entreprise Norilsk Nickel et un camp de travaux forcés - ou goulag - dénommé Norillag.
Après la guerre d'Hiver russo-finlandiase, en 1940, un consortium germano-soviétique, comprenant entre autres IG Farben et Krupp, se partagent l'exploitation du nickel dans la région de Petsamo. Après la Seconde Guerre mondiale, l'industrie du nickel russe est développée par l'entreprise soviétique Norilsk Nickel.
Minerais primaires
Latérites
Les latérites sont généralement situées dans les régions tropicales. On les exploite notamment en Nouvelle-Calédonie, en Indonésie, aux Philippines et à Cuba. On exploite ce minerai quand sa teneur en nickel dépasse 1,3 %, et la teneur en cobalt 0,1 %[E 3].
Les latérites sont des minéraux complexes issus de la désagrégation des fonds océaniques en péridotite, lorsque ceux-ci émergent à la suite de mouvements tectoniques (cas de la Nouvelle-Calédonie). Il s'agit donc de gisements superficiels. L'altération de la péridotite (mélange d'olivine et de pyroxène[E 4]) provoque une ségrégation verticale, de la surface du sol à la roche-mère[E 5] :
- de la limonite, riche en fer hydraté (goethite) et pauvre en magnésie. Elle constitue le chapeau de fer du gisement ;
- des smectites, comme la nontronite, est rencontrée dans quelques gisements (Australie-Occidentale), sous la limonite ;
- des saprolites, comme la garniérite. À l'inverse de la limonite, elles sont riches en magnésie et plus pauvres en fer.
La configuration des strates change suivant le climat et l'âge du sol. Chaque strate mesure de 2 à 5 m d'épais. La pluie et la végétation lessivent la couche superficielle de limonite, retirant la magnésie et la silice contenue dans le roc originel de péridotite, ce qui l'enrichit en fer, nickel et cobalt. Le nickel dissous a aussi tendance à descendre par percolation, enrichissant ainsi la couche profonde de saprolite. Ce lessivage se produisant sur une période de 1 à 10 millions d'années, son avancement diffère suivant le gisement[E 5].
 De haut en bas : cuirasse latéritique (chapeau de fer), limonite tendre, soubassement en roche ultramafique à Yaté, en Nouvelle-Calédonie.
De haut en bas : cuirasse latéritique (chapeau de fer), limonite tendre, soubassement en roche ultramafique à Yaté, en Nouvelle-Calédonie. Mine de latérite de Kouaoua, Nouvelle-Calédonie. L'exploitation ne concerne que les couches superficielles.
Mine de latérite de Kouaoua, Nouvelle-Calédonie. L'exploitation ne concerne que les couches superficielles.
Minerais sulfurés
Contrairement aux latérites, la formation des minerais sulfureux est indépendante du climat. On les trouve au Canada et dans le nord de la Sibérie[E 3]. Les gisements de minerais sulfurés sont issus de[E 6] :
- une poussée de magma au travers de la croute terrestre ;
- une concentration de métaux due à la présence d'eaux géothermales.
Le minéral le plus fréquent trouvé dans les gisements sulfurés de nickel est la pentlandite. Le soufre vient de la roche-mère, et la proportion molaire nickel/fer évolue entre 0,34 et 2,45, la moyenne étant 1,15. Ce minéral est fréquemment accompagné de pyrrhotite et de chalcopyrite, ainsi que de métaux plus ou moins précieux, comme le cobalt, l'argent et des platinoïdes. Les gisements utilisés pour l'extraction du nickel contiennent de 1 à 3 % de nickel[E 6].
À l'exception de la pyrrhotite où le nickel se substitue au fer en des proportions variables, les gisements de minerais sulfureux de nickel ne contiennent que très peu de minéraux sulfureux de nickel. Comme pour les gisements latéritiques, la nature de leur gangue a donc une grande influence sur les procédés d'extraction.
| Minéraux sulfureux pouvant contenir du nickel[E 7] | |
|---|---|
| Minéral | Formule chimique |
| Chalcopyrite | CuFeS2 |
| Magnétite | Fe3O4 |
| Cubanite | CuFe2S3 |
| Chromite | (Mg,Fe)Cr2O4 |
| Galène | PbS |
| Sphalérite | ZnS |
| Bornite | Cu5FeS4 |
| Mackinawite | (Fe,Ni,Co)S |
| Valleriite (en) | Cu3Fe4S7 |
| Minéraux sulfureux de nickel[E 7] | ||
|---|---|---|
| Minéral | Formule chimique | Contenu théorique en nickel dans le minéral (en % massique) |
| Pentlandite | Ni9Fe9S8 | 34,2 |
| Millérite | NiS | 64,7 |
| Heazlewoodite | Ni3S2 | 73,4 |
| Polydymite | Ni3S4 | 57,9 |
| Violarite | Ni2FeS4 | 38,9 |
| Siegénite | (Co,Ni)3S4 | 28,9 |
| Fletchérite (en) | Ni2CuS4 | 75,9 |
| Nickéline | NiAs | 43,9 |
| Mauchérite | Ni11As8 | 51,9 |
| Rammelsbergite | NiAs2 | 35,4 |
| Breithauptite | NiSb | 32,5 |
| Annabergite | Ni3As2O8.8H2O | 34,2 |
| Pyrrhotite | (Ni,Fe)7S8 | 1 - 5 |
 Pentlandite américaine.
Pentlandite américaine. Chevalements de la Nickel Rim South Mine, Grand Sudbury, Canada. Les gisements sulfureux se développent généralement en profondeur.
Chevalements de la Nickel Rim South Mine, Grand Sudbury, Canada. Les gisements sulfureux se développent généralement en profondeur.
Extraction
Gisements latéritiques
Il est important de bien distinguer les minerais superficiels (limonite et smectite) du minerai profond (saprolite) dans le gisement. En effet, la haute teneur en fer dans la limonite et la smectite pénalise les procédés pyrométallurgiques, alors que dissous dans l'acide sulfurique chaud, le fer précipite en hématite ou en jarosite. Par ailleurs, la consommation d'acide sulfurique due à la magnésie est économiquement acceptable, celle-ci ne dépassant pas 3 % du poids minerai à traiter[E 8].
À l'inverse, la teneur en magnésie de la saprolite (20 %) rend son traitement hydrométallurgique trop coûteux à cause de la consommation d'acide sulfurique. Mais la faible teneur en fer (15 %) permet d'obtenir un ferronickel riche, contenant 20 à 30 % de nickel. Un peu de cobalt est présent dans ce ferroalliage, mais en quantité trop faible pour influencer les clients sidérurgistes[E 8].
Concentration du minerai par hydrométallurgie
Les latérites, qui contiennent typiquement entre 1,3 et 2,5 % de nickel, sont broyées, criblées et, si le procédé est humide, hydrocyclonées pour en retirer un maximum de stériles. On parvient ainsi typiquement à doubler la teneur en nickel. Plus le broyage est fin (jusqu'à 75 µm), plus l'enrichissement est efficace. Toutes les méthodes d'enrichissement des latérites sont fondées sur le principes que les minéraux riches sont plus tendres que les minéraux pas encore transformés en latérites (olivine) ou transformés en des produits à la fois durs et pauvres en nickel (quartz). Une condition est donc de réaliser un broyage « doux » qui ne concerne pas les minéraux les plus durs[E 9].
La limonite est lixivée dans une solution d'acide sulfurique à 250 °C et 40 bar[E 10].

Les minerais sulfureux sont finement broyés (granulométrie inférieure à 50 µm), en typiquement deux étapes : un concasseur giratoire puis un moulin à billes travaillant sur un produit humide à 50%[E 11]. Une étape de flottation permet de séparer[E 12] :
- la gangue stérile (moins de 0,3 % de nickel, riche en pyrrhotite[E 13])
- le concentré de nickel (10 à 20 % de nickel, essentiellement de la pentlandite)
- le concentré de cuivre.
La flottation est une flottation par moussage avec de l'air, qui consiste à isoler les constituants naturellement ou artificiellement hydrophiles (souvent la pyrrhotite et la gangue), des constituants hydrophobes (souvent la pentlandite). Les constituants hydrophobes s'attachent aux bulles montent dans le bain, les hydrophiles restants dans la solution aqueuse[E 13]. Les concentrés de cuivre et de nickel sont ensuite traités par pyrométallurgie[E 12].
Saprolite
La saprolite, qui contient peu de fer, est la seule latérite adaptée à la fusion au four à arc électrique. On peut en faire soit du ferronickel, soit une matte de nickel qui sera affinée par pyrométallurgie.
La production de ferronickel exploite deux caractéristiques chimiques du fer et du nickel[E 14] :
- les oxydes de fer et de nickel sont, à 800 °C facilement réduits par le carbone par une réaction de réduction directe. L'alumine et la magnésie ne sont pas réductibles à ces températures, l'oxyde de chrome(III) (Cr2O3) et la silice le sont dans une faible mesure, ce qui explique la présence de quelques pourcents de chrome et de silicium dans le ferronickel ;
- l'oxyde de fer(II) (ou la wustite), qui est l'oxyde de fer stable à 800 °C, présente une réductibilité proche de celle de l'oxyde de nickel(II) : il n'est donc pas possible de réduire l'un sans l'autre. Bien entendu, le fer n'apportant pas de valeur au ferronickel, on sélectionne les minerais pour limiter au maximum sa présence.
Le minerai concentré de saprolite destiné à la production de ferronickel, qui contient 35 % d'eau, est d'abord séché dans un premier tambour rotatif (4 m de diamètre et 30 m de long), puis calciné et pré-réduit dans un grand tambour de réduction directe (5 m de diamètre et 100 m, voire 185 m, de long)[note 1]. Du tambour de réduction directe sort une poudre, ou un calcin sec, contenant de 1,5 à 3 % de nickel à 900 °C[note 2], partiellement réduite[note 3],[E 17]. Ce calcin peut être obtenu par d'autres fours mais, au début du XXIe siècle, « les procédés [à base de fours] statiques ont été essayés, avec des succès cependant limités. La plupart des producteurs de ferronickel investissent dans des fours rotatifs. [En 2011], un seul producteur installe des fours à cuve statique[E 18] ».
Le calcin est ensuite fondu dans des fours électriques de 15 à 20 m de diamètre, produisant 100 à 200 tonnes de ferronickel par jour[E 17],[note 4]. Cette étape de fusion permet de séparer, par décantation, les oxydes (qui forment les scories) du fer et du nickel en fusion. La fusion, qui s'opère à 1 500 °C, est très énergivore. De plus, la réduction des oxydes de fer et de nickel par le carbone, apporté par le graphite des électrodes ou contenu dans la poudre, est très endothermique : les fours consomment ainsi généralement 500 kWh par tonne de poudre enfournée. Cependant, dans le métal en fusion, aucune réaction de réduction ne concerne les autres oxydes, qui forment les scories[note 5],[E 19]. Le métal s'en sépare facilement car, outre sa densité beaucoup plus faible, c'est un composé ionique, non miscible avec le métal en fusion[E 20],[7]. À ce stade, on récupère donc à la sortie du four électrique un ferronickel brut, ou non affiné[E 19].
Le four électrique réalisant une réduction du fer et du nickel, il est incapable d'ôter le soufre et le phosphore, éléments indésirables et présents dans le ferronickel à hauteur de, respectivement, 0,4 % et 0,06 %. En effet, comme pour la production de l'acier, ces éléments sont en effet typiquement retirés par une réaction d'oxydation. De plus, l'élimination de leurs oxydes nécessite un milieu basique, donc riche en chaux et pauvre en silice, pour former du CaS et du (CaO)4P2O5, qui flottent alors dans des scories riches en chaux. La désulfuration et la déphosphoration sont donc réalisées dans un atelier distinct de métallurgie en poche, où des fours électriques à poche, beaucoup moins puissants que ceux dédiés à la fusion, assurent le brassage du métal en fusion[E 21].
Il est aussi possible d'ajouter du soufre dans le four rotatif de réduction directe. On obtient alors à la sortie du four électrique une matte sulfureuse (63 % de fer, 28 % de nickel, 10 % de soufre) qui est ensuite affinée dans un convertisseur Peirce-Smith. Le soufflage, qui se limite à la première étape du procédé Manhès-David[note 6], ôte tout le fer à la matte[note 7]. La « matte blanche » qui en sort (78 % de nickel et 20 % de soufre)[E 24] est solidifiée, broyée et grillée deux fois (un grillage oxydant pour ôter le soufre, puis un réducteur pour ôter l'oxygène apporté par le premier grillage) pour donner du nickel pur[E 25]. Il est aussi possible de purifier cette matte blanche par électrolyse, ou d'en faire des sels de nickel par des procédés hydrométallurgiques[8]. La resulfuration du nickel ne concerne, approximativement, que 10 % du traitement des minerais latéritiques, soit moins de 4 % de la production de nickel à partir de minerais[E 17].
Limonite et smectite
La limonite et la smectite sont trop riches en fer pour être économiquement traitées par des procédés pyrométallurgiques. En revanche, leur faible teneur en magnésie facilite leur traitement par hydrométallurgie. En effet, il importe de minimiser la consommation d'acide sulfurique qui se combine avec la magnésie, une base.
Les minerais concentrés issus de la limonite et la smectite sont donc lixiviés par l'acide sulfurique. La réaction se déroule dans un autoclave de 4,5 m de diamètre et 30 m de long, pouvant traiter 2 000 tonnes de concentrés par jour. Ce procédé, appelé « procédé HPAL », pour High-pressure Acid-Leaching process, est mené à 250 °C et 40 bar. Il retire plus de 95 % du nickel et du cobalt et consiste à la fois à :
- précipiter le fer, arrivé sous forme de goethite, en le transformant en hématite. Celle-ci est évacuée avec la boue[E 10], contenant 51 % de poids en fer[E 26] ;
- transformer l'hydroxyde de nickel(II) Ni(OH)2 en sulfate de nickel(II) NiSO4 soluble. Ce soluté contient 95 % du nickel et du cobalt contenu dans le minerai concentré[E 27].
Le liquide acide et riche en nickel (6 g.L−1 de nickel, 0,5 g.L−1 de cobalt, 30 à 50 g.L−1 de H2SO4[E 26]), est alors débarrassé des impuretés (aluminium, chrome, cuivre, etc.) par une neutralisation. Enfin, un nouveau traitement à l'acide sulfurique, à plus basse température et pression, permet de précipiter le sulfate de nickel NiSO4 sous forme de composé à base de sulfure de nickel NiS (composition : 55 % nickel, 5 % cobalt, 40 % soufre)[E 10],[E 28].
Minerais sulfureux
Les concentrés de nickel (10 à 20 % de nickel, essentiellement de la pentlandite) produits par la flottation par moussage des minerais sulfureux, sont traités par pyrométallurgie. En effet, les minerais sulfureux comme la pentlandite contiennent généralement une quantité appréciable de métaux précieux (or, argent, platine, etc.), difficilement récupérables par les procédés hydrométallurgiques[E 29]. Les concentrés peuvent être fondus de deux manières : la fusion flash ou le four à arc électrique[E 12]. Dans les deux cas, on obtient un laitier, qui est écarté, et une matte de nickel, tous deux à 1 450 °C[E 30].
En 2009, un quart des sulfures de nickel sont fondus au four électrique. Avant la fusion au four électrique, le minerai concentré est grillé dans un réacteur à lit fluidisé (caractéristiques typiques : 5 m de diamètre, 6 m de haut, production de 50 t/h) à une température située entre 600 et 760 °C. Ce grillage est oxydant : une partie du soufre part sous la forme de SO2 gazeux, ce qui enrichit encore le concentré en nickel[E 31].
Le calcin chaud et sec (environ 300 °C) est alors apporté dans le four électrique, généralement rectangulaire et chauffé par 6 électrodes[E 32]. La fusibilité du laitier est améliorée par l'addition de fondant siliceux. À l'instar de la production de ferronickel, la fusion-réduction réalisée dans le four consomme environ 500 kWh par tonne de calcin enfournée. De même, on apporte du carbone dans le bain pour produire du CO, afin de maintenir un milieu réducteur vis-à-vis du NiO[E 33]. Cependant, contrairement à la production du ferronickel, c'est le soufre, présent sous la forme de sulfure de fer(II) FeS, qui y réalise l'essentiel de la réduction de l'oxyde de nickel NiO, qui devient du sulfure de nickel NiS[E 34]. La matte issue du four électrique contient environ 30 % de nickel[E 35].
Le procédé alternatif est la fusion flash, qui traite trois quarts des sulfures de nickel[E 36],[note 8]. Elle réalise les opérations de grillage et de fusion dans un même réacteur. En effet[E 38] :
- la fusion flash est oxydante (alors que la fusion au four électrique est réductrice), ce qui permet d'évacuer une partie du soufre sous la forme de SO2 gazeux, et une partie du fer sous la forme de FeO, un oxyde qui part avec le laitier ;
- le grillage préalable avant la fusion au four électrique, qui est une opération d'oxydation du minerai concentré, n'est pas nécessaire. De plus, ce grillage étant exothermique, il aide la fusion.
Un four de fusion flash mesure typiquement 25 m de long et 8 m de large. Un tel four produit de manière continue entre 1 000 et 2 000 tonnes de matte en fusion par jour, contenant environ 40 % de nickel[E 36].
La matte, qui rassemble 98 % du nickel apporté par le calcin ou le concentré, se sépare facilement du laitier[E 34], même si le laitier issu de la fusion flash comporte souvent une quantité appréciable de nickel oxydé, ce qui amène parfois à sa récupération dans un four électrique dédié[E 39]. La matte est ensuite affinée dans un convertisseur Peirce-Smith, suivant le procédé Manhès-David (procédé dérivé du procédé Bessemer), qui est interrompu au moment où tout le fer est oxydé et est passé dans le laitier. La matte affinée (appelée parfois matte blanche, ou matte de convertisseur) contient alors de 40 à 70 % de nickel, du soufre et les métaux qui n'ont pas été oxydés (cuivre, or, argent et platinoïdes) par le convertisseur[E 30].
Le laitier issu du convertisseur est presque systématiquement envoyé dans un four électrique qui le maintient en fusion, afin de décanter toutes les gouttes de métal en fusion qu'il contient. En effet, l'agitation importante du bain dans le convertisseur ne permet pas une séparation parfaite entra laitier et matte[E 40].
Près de la moitié des mattes de nickel issues de minerais sulfureux est refroidie lentement (trois jours à 500 °C puis un jour à 200 °C). Cela permet de faire passer la taille moyenne des grains de 10 à 100 μm. Puis un broyage du métal jusqu'à cette granulométrie prépare la séparation du Cu2S, Ni3S2 et Ni-Cu. Une première séparation magnétique retire l'alliage métallique Ni-Cu (65 % nickel, 17 % cuivre et métaux précieux) des sulfures. Puis ces sulfures sont traités par lixiviation en solution basique (PH 12), le Cu2S flottant tandis que le Ni3S2 descend au fond[E 41].
Affinages finaux
On peut distinguer 4 grandes méthodes d'affinage final[E 42] :
- un grillage oxydant puis réducteur ;
- un traitement hydrométallurgique ;
- carbonylation du nickel, ou procédé Mond ;
- l'électrolyse.
Grillage de la matte
Le grillage concerne la matte de convertisseur (ou « matte blanche ») produite par l'injection de soufre dans le traitement des saprolites. Ce procédé appartient à une filière métallurgique assez marginale. La matte de convertisseur (78 % de nickel et 20 % de soufre)[E 43] est solidifiée, broyée et grillée deux fois : un grillage oxydant pour ôter le soufre, puis un réducteur pour ôter l'oxygène apporté par le premier grillage. Le résultat est du nickel pur[E 44].
Hydrométallurgie des sulfures de nickel
Une dernière étape d'hydrométallurgie peut traiter aussi bien la matte issue du convertisseur Peirce-Smith, que les sulfures issus du traitement des latérites riches en fer (limonite et smectite). Les procédés sont nombreux et complexes, à la fois à cause des brevets et de la diversité des minerais. En effet, à cause de la richesse en nickel des produits, les quantités à traiter sont limitées : la complexité n'affecte donc guère la rentabilité. Mais il est essentiel de récupérer tous les métaux sans déchets. L'affinage hydrométallurgique, consiste successivement à[E 30] :
- une lixiviation qui peut se faire selon trois chimies différentes : soit du chlore gazeux dans une solution chlorée (généralement suivie d'une électrolyse[E 46]), soit de l'oxygène dans de l'ammoniaque (procédé Sherritt, consistant à faire précipiter un sulfate de méthénamine de nickel (2Ni(NH3)6SO4)[E 47]), soit de l'oxygène dans de l'acide sulfurique ;
- une purification de la solution pour en retirer les précipités de cobalt et de cuivre. Elle se fait par cristallisation ou par une extraction par solvant ;
- une réduction par l'hydrogène qui donne une poudre de nickel frittée en briquettes, ou une électrolyse[E 46].
Les sulfures de nickel issus du traitement des latérites ont comme composition 55 % nickel, 5 % cobalt et 35 % de soufre[E 48]. Ils sont plus faciles à traiter que ceux issus des minerais sulfureux, qui contiennent du cuivre [E 46].
Carbonylation

La carbonylation du nickel, ou procédé Mond, est une méthode d'affinage capable d'extraire efficacement le nickel contenus dans des alliages métalliques pauvres en fer. En effet, parmi les métaux, le nickel présente la caractéristique de pouvoir former, en présence de monoxyde de carbone, du tétracarbonyle de nickel Ni(CO)4 gazeux à 50 °C qui, lorsqu'il est chauffé à une température de 220 à 250 °C se redécompose en nickel métallique pur et en monoxyde de carbone. La décomposition du tétracarbonyle de nickel se fait généralement en faisant passer le gaz au travers un lit de boulettes (ou pellets) de nickel chauffées à 240 °C. Comme le fer peut également former du pentacarbonyle de fer dans les conditions opératoires du procédé, on minimise la teneur en fer du métal à affiner, raison pour laquelle le procédé Mond est appliqué aux mattes de convertisseur débarrassées du fer par le procédé Manhès-David[E 49].
En 2009, ce procédé concerne un peu moins de 300 000 tonnes par an de nickel sur les 1 500 000 tonnes de nickel primaire produites dans le monde[E 50].
Électrolyse

Le nickel peut être affiné par électrolyse. Il s'amasse sur la cathode, pendant que l'oxygène s'échappe à l'anode, l'électrolyte étant un sulfure de nickel mélangé avec de l'acide sulfurique. Les cathodes sont récoltées au bout d'environ 7 jours[E 51].
En 2009, environ 200 000 tonnes par an de nickel d'une pureté de 99,9 %, sur les 1 500 000 tonnes de nickel primaire produites dans le monde, sont affinées par électrolyse[E 52].
Aspects économiques
Caractéristiques industrielles
Comme toutes les industries d'extraction minière, il est essentiel de bien évaluer la taille du gisement puisque les installations seront inutiles dès que celui-ci sera épuisé. En 2004, un projet d'extraction doit avoir une capacité minimale de 40 000 tonnes par an pendant 20 ans[4].
Les coûts d'investissement liés à la mise en exploitation d'une mine de nickel dépendent fortement du type d'exploitation (les mines à ciel ouvert sont nettement moins coûteuses que celles en galeries). Bien sûr, la richesse du minerai permet de diminuer considérablement le coût d'investissement de la mine comme de l'usine qui lui est associée[E 53]. Le niveau d'enrichissement d'un minerai latéritique ne doit pas être supérieur à trois. Concrètement, les industriels renoncent à traiter les minerai demandant un niveau d'enrichissement supérieur à deux[4].
Au début du XXIe siècle, quelques projets permettent de chiffrer le coût de construction d'une usine produisant 60 000 tonnes par an de ferronickel à partir de latérite à environ 4 milliards de dollars (Koniambo, Nouvelle-Calédonie). Soit un investissement de 70 000 dollars par tonne de nickel produite annuellement. La capacité minimale pour être rentable d'une usine produisant du ferronickel est estimée à 60 000 tonnes par an. Pour une usine produisant du nickel pur, les coûts sont identiques[E 53]. Ainsi, le secteur se distingue par une forte concentration de la production entre quelques multinationales : en 2010, Inco, BHP Billiton, Eramet, Falconbridge et Norilsk Nickel assurent plus de la moitié de l'extraction du nickel dans le monde[9].
En 2010, la tonne de nickel commercialisée sous la forme de ferronickel est cotée 26 000 dollars. Le coût de transformation du minerai en ferronickel se situe à la même époque entre 4 000 et 6 000 dollars pour une usine performante : l'amortissement du capital explique une bonne partie de la différence entre prix de vente et coût de production[E 53].
Comme beaucoup de procédés métallurgiques, la consommation d'énergie est un facteur clé de rentabilité. L'utilisation de charbon au lieu d'hydrocarbures, la production d'électricité à partir de barrages sont quelques-unes des méthodes les plus courantes pour réduire les coûts de l'énergie[E 54].
Poids économique
Pour les quelques pays disposant de gisements de nickel, l'extraction peut être un élément clé de leur économie. Dans les années 2010, les mines et la métallurgie du nickel représentent 80 % de la valeur des exportations de la Nouvelle-Calédonie, bien que seuls 45 % du minerai extrait est traité sur place[10]. À la même époque, le nickel est la troisième source de revenus d'exportation de Cuba, après le tourisme et le sucre[11].
Évolutions actuelles et à venir
L'extraction du nickel à partir de latérite, qui a commencé au début du XXe siècle en Nouvelle-Calédonie, est devenue rapidement minoritaire vis-à-vis de l'extraction à partir de minerais sulfureux, dont l'essor s'est amorcé peu après à Grand Sudbury. Cependant, au vu des projets actuels, la production à partir de minerais sulfureux devrait stagner alors que celle à partir de latérites devrait assurer l'essentiel de la croissance[4].
Un axe de recherche actuel concerne la mise au point de procédés « omnivores », compatibles à la fois avec la saprolite et la smectite, c'est-à-dire capables de traiter les gisements latéritiques de nickel sans devoir isoler ces deux minerais[E 6].
L'enrichissement du minerai est essentiel à la rentabilité. Mais « tous les gisements latéritiques sont différents. Pour cette raison, tous les minerais doivent être minutieusement testés pour déterminer jusqu'où ils peuvent être enrichis[E 55] ». Ainsi, certaines sociétés, comme Le Nickel défendent vigoureusement l’intérêt de l'enrichissement, tout en restant très discrètes sur les détails de leurs procédés[E 55].
On doit aussi relever la résurrection, à partir de 2005, de la production de fonte brute de nickel, un ferronickel contenant de 4 à 13 % de nickel lorsqu'il est produit au haut fourneau, et de 8 à 15 % de nickel lorsqu'il est produit au four électrique[12]. En 2010, ce substitut bon marché au ferronickel produit en Chine représente 10 % du marché de l'extraction du nickel[13]. Cette année-là, un tiers est issu de petits hauts fourneaux (le reste étant issu de fours électriques), à partir de latérites venant d'Indonésie et des Philippines. Cette innovation chinoise est attentivement étudiée par les industriels. Cependant, en , l'interdiction indonésienne d'exportation de minerai de nickel menace cette filière qui s'approvisionne pour moitié dans ce pays[14], poussant certains producteurs à construire des hauts fourneaux sur le lieu même de l'extraction, en Indonésie[15].
Notes et références
Notes
- Cette configuration rappelle le procédé Krupp-Renn, un sidérurgique de réduction directe inventé en Allemagne dans les années 1930. Au cours du XXe siècle, les Japonais améliorent régulièrement ce procédé et le dédient à l'extraction du nickel[5]. Au début du XXIe siècle, la fonderie de Nihon Yakin Kogyo à Ōeyama, au Japon, reste la seule usine du monde à utiliser le procédé Krupp-Renn pour la production de ferronickel, avec une production mensuelle de 1 000 tonnes de luppen[6].
- Au-delà de 900 °C, le nickel et le fer se combinent avec la silice et forment des silicates peu réactifs[E 15].
- Un quart du nickel est sous la forme métallique, le reste est encore oxydé. Le fer, qui représente 15 % du poids de cette poudre, n'est réduit en métal qu'à hauteur de 5 %, 95 % étant du FeO. Enfin, on y trouve 40 % de SiO2, 25 % de MgO, 2 % de charbon imbrûlé (qui servira de combustible lors de l'étape ultérieure de fusion au four électrique) et 1 % d’Al2O3[E 16].
- Ces fours électriques de fusion sont alimentés par trois grandes électrodes en graphite (ou 6 lorsque le four est rectangulaire) mesurant chacune 1,5 m de diamètre et 25 m de long. Chaque électrode transporte environ 30 000 A, la puissance d'un four variant de 40 à 80 MW[E 19].
- La composition des scories de four électrique est, typiquement : 40 à 55 % de SiO2, 20 à 30 % de MgO, 5 à 20 % de FeO (on cherche à maximiser la teneur en fer des scories en jouant sur la quantité de carbone disponible pour sa réduction), 1 à 7 % de CaO, 1 à 2 % d'Al2O3 et moins de 0,2 % de nickel (le métal en fusion contient 90 à 98 % du nickel enfourné). La production de scories est importante : un gros four électrique transforme quotidiennement 4 000 tonnes de poudre calcinée en 250 tonnes de ferronickel brut et 3 700 tonnes de scories[E 19].
- Il existe encore le procédé de l'entreprise « Le Nickel » : au lieu d'ajouter le soufre dans le four rotatif de réduction directe, il est injecté plus tard, dans le convertisseur Peirce-Smith, au moment où celui-ci souffle le ferronickel en fusion[E 22].
- Le fer est donc évacué sous forme d'oxyde par les scories, dont la composition est typiquement : 25 % de SiO2, 53 % de FeO et moins de 0,6 % de nickel[E 23].
- En 2011, il existe 9 fours de fusion flash dans le monde : 7 fours de type Outotec (en forme de U) assurant 70 % de la fusion flash de nickel, et 2 fours de type Inco (en forme de T renversé) assurant les 30 % restants[E 37].
Références
- (en) Frank K. Krundwell, Michael S. Moats, Venkoba Ramachandran, Timothy G. Robinson et William G. Davenport, Extractive Metallurgy of Nickel, Cobalt and Platinum Group Metals, Elsevier, , 610 p. (ISBN 978-0-08-096809-4, lire en ligne)
- p. 12
- p. 1-2
- p. 3
- p. 39
- p. 3-5
- p. 8
- p. 148
- p. 5 ; 8
- p. 5 ; 43
- p. 5 ; 118 ; 121
- p. 164-166
- p. 9
- p. 172
- p. 51
- p. 62
- p. 59 ; 64
- p. 51-53
- p. 63
- p. 69-82
- p. 67
- p. 85-90
- p. 104-105
- p. 103
- p. 96 ; 103
- p. 108-114
- p. 124
- p. 124 ; 128
- p. 141
- p. 154-155
- p. 9-10
- p. 203-206
- p. 209
- p. 207
- p. 208
- p. 206
- p. 215
- p. 225
- p. 215 ; 221
- p. 221-222 ; 573
- p. 237
- p. 259-262
- p. 281
- p. 96 ; 103
- p. 108-114
- p. 353
- p. 290
- p. 284-285
- p. 283
- p. 271-275
- p. 2 ; 282
- p. 297
- p. 327
- p. 29-32
- p. 72
- p. 46
- Autres références
- (en) L. David Roper, « World Minerals Recycling »,
- (en) Richard Mills, « Nickel Mining Like its 1864 »
- Jules Garnier, « Notice historique sur la découverte des minerai de nickel de la Nouvelle-Calédonie », dans Mémoires et comptes rendus des travaux de la société des ingénieurs civils, CNAM, (lire en ligne), p. 89-93
- (en) Ashok D. Dalvi, W. Gordon Bacon et Robert C. Osborne, The Past and the Future of Nickel Laterites, Inco Limited, 7-10 mars 2004 (lire en ligne)
- (en) Akira Kudo, Japanese-German Business Relations : Co-operation and Rivalry in the Interwar (lire en ligne), p. 89-108
- (en) Shigenobu Yamasaki, Masato Noda et Noboru Tachino, « Production of Ferro-Nickel and Environmental Measures at YAKIN Oheyama Co., Ltd. », Journal of The Mining and Materials Processing Institute of Japan (MMIJ), (DOI 10.2473/journalofmmij.123.689, lire en ligne)
- Pierre Blazy et El-Aid Jdid, « Pyrométallurgie et électroraffinage du cuivre - Pyrométallurgie », dans Techniques de l'ingénieur, Éditions techniques de l'ingénieur (lire en ligne)
- « Les produits commercialisés : ferronickel et matte », Société Le Nickel
- « Nickel / Sociétés / Introduction », CNUCED,
- « Nickel / Politiques économiques », CNUCED,
- « Nickel / Filière », CNUCED,
- (en) Conee Orsal, « Nickel Pig Iron: A Cheaper Nickel Alternative », Born2Invest,
- (en) « A breakthrough in China, another blow for Sudbury », The Globe and Mail,
- (en) Robert Cartman, « Nickel pig iron - A long term solution? », Hatch,
- (en) « Presentation page », sur indoferro.growthsteelgroup.com
Voir aussi
Articles connexes
- Minéraux :
- Produits intermédiaires :
- Procédés d'affinage:
- Portail de la mine
- Portail des sciences des matériaux
- Portail de la métallurgie
- Portail de la production industrielle
- Portail de la Nouvelle-Calédonie
.JPG.webp)
