Histoire évolutive des végétaux
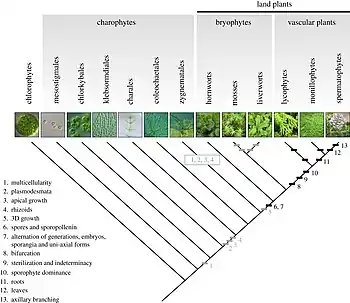
L’histoire évolutive des végétaux est un processus de complexification croissante, depuis les premières algues, en passant par les bryophytes, les lycopodes et les fougères, jusqu'aux complexes gymnospermes et angiospermes actuels. Bien que les végétaux plus primitifs continuent de prospérer, particulièrement dans leur milieu d'origine, chaque nouveau degré d'organisation évolue et développe de nouvelles capacités qui lui permettent de mieux s'adapter à de nouveaux milieux.

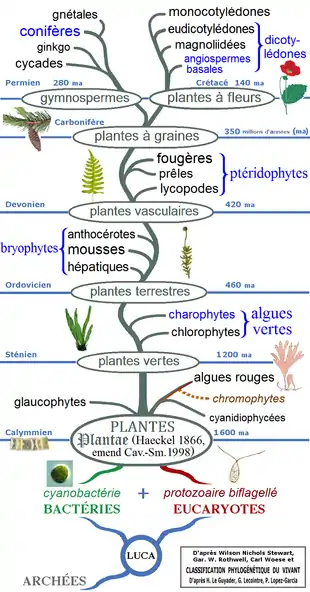
Tout porte à penser que les algues (d'abord monocellulaires, puis pluricellulaires) sont apparues en milieu aquatique il y a au moins 1,2 milliard d'années. La symbiose entre des bactéries photosynthétiques (cyanobactéries) et des eucaryotes (biflagellés) semble être à l'origine des algues vertes, apparues pendant l'Ordovicien, il y a près de 500 millions d'années, et produisant de la chlorophylle a et b. C'est à l'Ordovicien supérieur que les végétaux partent à la conquête des terres, donnant naissance aux premières plantes terrestres. Celles-ci ont commencé à se diversifier à la fin du Silurien, il y a environ 420 millions d'années, et les résultats de cette diversification sont visibles en détail dans un fossile du début du Dévonien connu sous le nom de flore de Rhynie.
Vers le milieu du Dévonien, la plupart des caractéristiques connues des plantes actuelles sont déjà présentes, y compris les racines, les feuilles et certains tissus secondaires tels que le bois. Les premières graines apparaissent à la fin du Dévonien. À cette époque, les plantes avaient déjà atteint un degré de complexité qui leur permettait de former des forêts de grands arbres.
L'innovation par évolution continue après le Dévonien. La plupart des groupes de végétaux ont été relativement épargnés par les extinctions Permo-Triassique, bien que les structures des communautés aient changé. Ceci a peut-être contribué à l'évolution des plantes à fleurs au Trias (il y a environ 200 millions d'années), ce groupe s'étant fortement diversifié au Crétacé et au Tertiaire.
L'évolution la plus récente est celle des graminées, groupe qui est devenu important au milieu du Tertiaire, il y a environ 40 millions d'années. Les graminées, comme de nombreux autres groupes, ont créé de nouveaux mécanismes métaboliques pour survivre au taux relativement faible de CO2 ainsi qu'aux conditions sèches et chaudes des régions tropicales au cours des 10 derniers millions d'années.
Premiers végétaux
Les précurseurs des végétaux semblent être des Cyanobactéries, qu'on classait traditionnellement parmi les algues, sous le nom de cyanophytes ou algues bleu-vert. Elles apparaissent déjà dans des fossiles du Précambrien, datant d'environ 3,8 milliards d'années. Elles auraient joué un grand rôle dans la production du dioxygène de l'atmosphère, et, ce faisant, été responsables de la Grande Oxydation. Leurs cellules ont une structure procaryote typique des bactéries, la photosynthèse se produisant directement dans le cytoplasme.
Elles sont à l'origine des chloroplastes des cellules eucaryotes, et ont ainsi permis aux végétaux de réaliser la photosynthèse, à la suite d'une endosymbiose[2] ; les premières algues pluricellulaires seraient ainsi apparues il y a 1 200 millions d'années[réf. nécessaire].
Colonisation des terres émergées

Les plantes ne furent pas les premiers organismes terrestres : des microorganismes fossiles ont été trouvés dans des dépôts de lacs d'eau douce vieux d'un milliard d'années[3] ; l'analyse de la composition isotopique de ces fossiles tend à montrer qu'ils devinrent assez nombreux pour modifier la composition de l'atmosphère il y a 850 millions d'années[4]. Ces organismes, bien que d'origines phylogénétiques diverses[5], étaient probablement petits et de structure simple, ne formant guère plus qu'une sorte de tapis de mousse[6].
Les plantes terrestres évoluèrent à partir d'algues chlorophytes, peut-être dès le Cambrien, il y a 510 millions d'années[6], voire même encore plus tôt, au Protérozoîque il y a 700 millions d'années[7],[8] ; les plus proches espèces actuelles de ces colonisateurs primitifs seraient les charophytes, et plus particulièrement les Charales. En admettant que les comportements des Charales aient peu changé depuis leur apparition, cela signifierait que les plantes terrestres ont évolué à partir d'algues haplophasiques ramifiées et filamenteuses, vivant dans des eaux douces peu profondes[9], peut-être en bordure de mares subissant un assèchement saisonnier[6]. Des associations symbiotiques avec des champignons peuvent avoir aidé ces plantes primitives à s'adapter aux difficultés de leur nouvel environnement[10].
Les premières traces certaines de plantes terrestres sont des spores datant du milieu de l'Ordovicien (au Dapingien inférieur, il y a 470 millions d'années)[11],[12],[13]. Ces spores, connues sous le nom de cryptospores, sont isolées (monades), en paires (diades) ou en groupes de quatre (tétrades), et leur microstructure ressemble à celle des spores des hépatiques modernes, ce qui suggère une organisation comparable[14]. Elles sont composées de sporopollénine – indice supplémentaire d'une parenté proche avec les Embryophyta[15]. Il est possible que les caractéristiques atmosphériques des époques plus anciennes aient empêché les eucaryotes de coloniser le milieu terrestre plus tôt[16], à moins qu'il ait simplement fallu tout ce temps pour que l'évolution permette aux végétaux d'atteindre le niveau de complexité nécessaire à cette colonisation[17].
Des spores trilètes (ayant une cicatrice en forme de Y) semblables à ceux des plantes vasculaires apparaissent peu après, dans des roches de l'Ordovicien supérieur[18]. Cette cicatrice reflète le point où chaque cellule d'une tétrade de spores était comprimée par ses voisines[11]. Cela suppose que les parois des spores soient résistantes dès leur formation, et donc capables de résister au dessèchement, un trait qui n'a d'avantages que pour des spores devant survivre hors de l'eau ; d'ailleurs, les embryophytes revenus à une vie aquatique perdent ce trait et n'ont pas de marques trilètes[11],[note 1].
Les premiers macro-fossiles de plantes terrestres sont des organismes thallophytes, qui prospéraient dans les terres humides alluviales, et semblent avoir couvert la plus grande partie des plaines inondées du Silurien inférieur[19].
Pour les plantes devenues terrestres, deux approches aux problèmes posés par la dessiccation sont possibles. Les bryophytes l'évitent ou y cèdent, restreignant leurs habitats à des environnements humides ou se desséchant et arrêtant leur métabolisme jusqu'à ce que l'eau revienne. Les trachéophytes, en revanche, résistent à la dessiccation à l'aide d'une cuticule externe imperméable réduisant les pertes en eau, mais — comme une paroi complètement étanche les priverait d'accès au CO2 atmosphérique — elles ont rapidement développé des stomates, petites ouvertures permettant les échanges gazeux. Les trachéophytes ont aussi développé des tissus vasculaires facilitant le mouvement des liquides à l'intérieur de l'organisme (voir la section ci-dessous), et se sont éloignés d'un cycle de vie dominé par une phase gamétophyte (voir plus bas). La vascularisation facilite également la croissance verticale, et a ainsi permis l'apparition de grandes plantes terrestres.
La colonisation de la terre ferme par la flore accéléra l'accumulation de dioxygène dans l'atmosphère. Quand la concentration atmosphérique en O2 dépassa 13 %, des incendies devinrent possibles. Les premières traces fossiles connues de ces feux, sous forme de charbon, datent du Silurien supérieur[20] ; en dehors d'une interruption aux causes controversées au Dévonien supérieur, du charbon a toujours été présent depuis cette époque.
La formation de charbon est un bon processus de conservation permettant une fossilisation intéressante des structures végétales. Les incendies détruisent les composés volatils, ne laissant qu'un squelette de carbone, lequel ne peut servir de source de nourriture ni pour les herbivores, ni pour les détritivores. Ce squelette se conserve donc bien ; étant robuste, il résiste également à la pression, permettant d'observer intacts des détails allant parfois jusqu'au niveau intracellulaire.
Évolution des cycles de vie
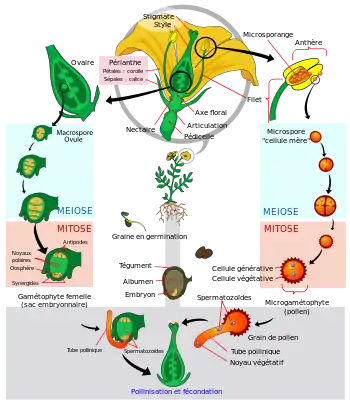
Toutes les plantes multicellulaires ont un cycle de vie formé de deux phases (haplophase et diplophase) se superposant, pour ces plantes, à deux générations. L'une, appelée gamétophyte, produit des gamètes (mâles ou femelles), et correspond à l'haplophase : les cellules possèdent un seul jeu de chromosomes (noté 1N). L'autre, appelée sporophyte, produit des spores, et correspond à la diplophase : les cellules possèdent deux jeux de chromosomes regroupés en paires (notés 2N). Les deux générations peuvent avoir une apparence identique (on parle d’isomorphie) ou très dissemblable (on parle d’hétéromorphie).
En général, l'évolution des plantes est allée de l'isomorphie vers l'hétéromorphie. Les algues ayant donné naissance aux plantes terrestres étaient presque certainement monogénétiques : une seule génération haploïde durant tout leur cycle de vie ; l'étape 2N est réduite au zygote, par définition unicellulaire. En revanche, toutes les plantes terrestres (les embryophytes) sont digénétiques, c'est-à-dire que les haplophases et les diplophases sont toutes deux multicellulaires[21]. Cependant deux tendances opposées apparaissent : les bryophytes (les hépatiques et les mousses) ont une haplophase développée, et la phase sporophyte en devient presque complètement dépendante, alors que les plantes vasculaires, au contraire, ont développé la phase sporophyte, la phase gamétophyte étant particulièrement réduite chez les plantes à graines.
Deux théories s'opposent pour expliquer l'apparition de ces plantes digénétiques.
La théorie de l'interpolation (connue aussi comme théorie antithétique ou intercalaire)[22] considère la phase sporophyte comme une nouveauté fondamentale, causée par la division mitotique d'un zygote fraîchement germé, qui continue jusqu'à ce que la méiose produise des spores. Cette théorie demande que les premiers sporophytes aient eu une morphologie très différente de celle des gamétophytes dont ils dépendaient[22]. Cela semble correspondre à ce que nous savons des bryophytes, pour lesquels un gamétophyte à thalle est "parasité" par des sporophytes simples, qui ne sont souvent formés que d'un sporange sur une tige. Par la suite, la complexification croissante de ces sporophytes leur permettrait d'acquérir des cellules capables de photosynthèse, les rendant indépendants d'un gamétophyte, comme c'est le cas de certains Anthocérotes, et finalement devait aboutir au développement d'organes et de tissus vasculaires, le sporophyte devenant la phase dominante[21]. L'observation de petits spécimens de Cooksonia (ne se développant que grâce à une génération gamétophyte), comparés à des individus de plus grande taille axiale permettant l'apparition de tissu photosynthétique, fournit une route possible pour cette évolution, justifiant ce modèle théorique[22].
L'autre hypothèse est la théorie de la transformation (ou théorie homologue). Elle postule l'apparition soudaine des sporophytes correspondant à une méiose retardée après la germination du zygote. Comme elles utiliseraient le même matériel génétique, l'haplophase et la diplophase se ressembleraient. Ceci expliquerait le comportement de certaines algues, alternant des générations sporophytes et gamétophytes identiques. Des adaptations ultérieures à des environnements terrestres plus secs, rendant la reproduction sexuée difficile, résulteraient en une simplification du gamétophyte sexuellement actif, et en une élaboration de la phase sporophyte permettant une meilleure dispersion de spores imperméables[21]. Les tissus des sporophytes et des gamétophytes conservés dans la flore de Rhynie sont de complexité comparable, ce qui est considéré comme un argument en faveur de cette théorie[22],[23],[24].
Évolution de la morphologie
Tissus conducteurs
Pour pouvoir effectuer la photosynthèse, les plantes doivent absorber du CO2 atmosphérique. Cela présente un inconvénient : quand les stomates sont ouverts pour permettre l'entrée du dioxyde de carbone, l'eau de la plante s'évapore[25]. Cette perte en eau est beaucoup plus rapide que l'absorption du CO2, et, pour la compenser, les plantes ont développé des systèmes de transport de l'eau du sol humide vers les sites de photosynthèse[25]. Les plantes primitives aspiraient l'eau par capillarité entre les parois de leurs cellules, mais des tissus spécialisés dans le transport de l'eau ont évolué progressivement, passant des hydroïdes et des trachéides à du xylème secondaire, puis à un endoderme végétal et finalement à des vaisseaux[25].
Xylème
Les taux élevés de CO2 atmosphérique au Silurien et au Dévonien, c'est-à-dire au début de la colonisation de la terre ferme par les plantes, impliquaient des besoins en eau relativement peu importants. À mesure que le CO2 fut fixé par les plantes, les pertes en eau augmentèrent, et des mécanismes de transport de l'eau plus élégants firent leur apparition[25]. Avec l'évolution de ces mécanismes, et celle des cuticules imperméables, les plantes purent finalement survivre sans avoir besoin d'être continuellement couvertes par une pellicule d'eau. Cette transition de la poïkilohydrie vers l'homoïohydrie ouvrit de nouvelles possibilités de colonisation[25]. Les plantes durent également acquérir une structure interne robuste, soutenant les canaux longs et étroits assurant le transport de l'eau vers toutes les parties de l'organisme situées au-dessus du sol, notamment celles assurant la photosynthèse.

Si durant le Silurien le CO2 était facilement disponible, à la fin du Carbonifère, son niveau de concentration avait diminué jusqu'aux valeurs actuelles, et environ 17 fois plus d'eau était perdue pour la même consommation de dioxyde de carbone[25]. Mais même au début du Silurien, l'eau était une ressource précieuse et devait être transportée à partir du sol pour éviter le dessèchement. Les premiers systèmes de transport de l'eau utilisaient ses propriétés physiques : la diffusion vers les parties plus sèches, et la force de capillarité. Dans les passages étroits (entre les parois cellulaires, ou dans des trachéides), l'eau se comporte comme un milieu élastique : l'évaporation à une extrémité « tire » la colonne d'eau le long du canal. Ainsi, l'évapotranspiration à elle seule fournissait le mécanisme de transport de l'eau chez les plantes primitives[25]. Cependant, en l'absence de canalisations spécifiques, ce mécanisme ne peut transporter l'eau sur plus de 2 cm de hauteur, ce qui limitait sévèrement la taille de ces premières plantes[25]. Ce processus demande une réserve permanente d'eau à une extrémité, pour éviter que la chaîne ne se rompe ; pour la maintenir, les plantes développèrent une cuticule imperméable. Les cuticules primitives n'avaient peut-être pas de pores, et ne couvraient qu'une partie de la surface de la plante, pour que les échanges gazeux se maintiennent[25]. La déshydratation restait cependant inévitable par moments ; les plantes primitives s'en accommodaient en stockant une importante réserve d'eau entre leurs parois cellulaires, et en mettant leur métabolisme au repos jusqu'au retour de l'humidité[25].
Pour se libérer de ces contraintes de taille réduite et d'humidité constante imposées par la circulation d’eau via les cellules de parenchyme, les plantes ont dû développer des systèmes de transport plus efficaces. Dès le Silurien inférieur apparurent des cellules spécialisées, qui étaient lignifiées pour éviter leur implosion[25]. Ce processus de lignification coïncide avec la mort programmée (ou apoptose) de ces cellules, vidant leur intérieur et permettant à l'eau d'y circuler[25]. Ces larges cellules mortes et vides étaient un million de fois plus efficaces que l'ancien mécanisme intercellulaire[réf. nécessaire], permettant le transport sur de plus longues distances et un taux de diffusion du CO2 plus élevé[réf. nécessaire].
Les premiers macrofossiles connus possédant ces tubes de transport datent du Dévonien inférieur ; ce sont les prétrachéophytes Aglaophyton (en) et Horneophyton (en), Polysporangiophytes qui présentent des structures très similaires aux hydroïdes des mousses modernes. Ils apparaissent dans d'immenses plaines sédimentaires formées à l'embouchure des fleuves qui ont transporté les sédiments issus de l'érosion des chaînes calédoniennes créées par l'orogenèse calédonienne[26]. Les plantes continuèrent à innover, réduisant par exemple la résistance à l'écoulement à l'aide de cannelures sur les parois des tubes[27] (ces cannelures apparaissent en fait dès le Silurien inférieur[28]). Les tubes cannelés, ainsi que des tubes présentant des excroissances sur leurs parois, étaient lignifiés[29]. Ils sont considérés comme des trachéides lorsqu'ils forment des conduites unicellulaires.
Les trachéides, plus rigides que les hydroïdes, peuvent supporter des pressions d'eau bien plus importantes[25]. Les trachéides peuvent avoir eu une origine unique, peut-être chez les Anthocerotophyta[30], ce qui impliquerait une origine monophylétique pour les trachéophytes, mais il est également possible qu'elles soient apparues plus d'une fois[25].
Le transport de l'eau demande à être régulé ; le contrôle dynamique est effectué par les stomates[31]. En ajustant les quantités de gaz échangées, ceux-ci permettent de diminuer la quantité d’eau perdue par évapotranspiration. C'est un rôle important lorsque l'approvisionnement en eau n'est pas constant, et il semble, de fait, que les stomates soient apparus avant les trachéides : on les rencontre chez les Anthocérotes non vascularisés[25], où ils remplacent les pores aérifères plus primitifs.
Un endoderme végétal apparut probablement au Dévonien, mais le premier témoignage fossile d'une telle structure date du Carbonifère[25]. Cette structure racinaire recouvre les tissus transportant l'eau, régule les échanges d'ions, et a aussi une fonction protectrice contre les organismes pathogènes. L'endoderme génère également une pression hydrostatique poussant l'eau à quitter les racines et à monter dans la plante. Ce phénomène est particulièrement notable lorsque l'évapotranspiration n'est plus un moteur suffisant pour la circulation de l'eau.
Les plantes ayant acquis ce système de transport étaient devenues véritablement homoiohydriques. Elles devenaient capables d'extraire de l'eau de leur environnement par des organes semblables à des racines, et cette dépendance moindre aux aléas climatiques leur permettait d'atteindre des tailles bien plus importantes[25]. Mais, conséquence de cette relative indépendance vis-à-vis de l'environnement, elles perdirent leur capacité à survivre à la dessiccation, un trait trop coûteux à conserver[25].
Durant le Dévonien, le diamètre maximal des trachéides du xylème s'accroit, le diamètre minimal demeurant relativement constant[27]. Au Dévonien moyen, le diamètre des trachéides de certaines classes de plantes[note 2] avait atteint un plateau[27]. Des trachéides plus larges permettent un transport de l'eau plus rapide, mais le flux total dépend également du diamètre du faisceau entier de trachéides formant le xylème[27]. L'augmentation d'épaisseur de ce faisceau vasculaire semble corrélée avec la largeur et la hauteur des plantes ; elle est également fortement liée à l'apparition des feuilles[27], et à un accroissement de la densité des stomates, deux facteurs d'augmentation des besoins en eau[25].
Si ces trachéides plus larges et à parois robustes permettent d'obtenir des pressions d'eau plus élevées, elles augmentent le risque de cavitation[25]. Cela se produit lorsqu'une bulle d'air se forme dans un vaisseau, brisant les chaînes de molécules responsables des forces de capillarité. Une trachéide présentant une telle embolie devient inutilisable (sauf chez quelques angiospermes avancés ayant développé des mécanismes de réparation), et il est donc très important pour les plantes de minimiser ce risque. Pour cette raison, les pores des parois des trachéides ont un diamètre très faible, empêchant l'air d'entrer et de former des sites de nucléation de bulles[25]. Les cycles de gel et de dégel sont une cause majeure de cavitation, créant des dommages dans les parois laissant l'air entrer ; il est donc important que de nombreuses trachéides travaillent en parallèle[25].
La cavitation est difficile à éviter, mais, une fois survenue, les plantes disposent de plusieurs mécanismes pour limiter les dégâts[25]. De petits pores relient des conduites adjacentes, permettant aux fluides, mais non à l'air, de circuler entre elles[25]. Cependant, ironiquement, ces pores empêchant les embolies de s'étendre en sont également une cause majeure ; de plus, ces surfaces irrégulières diminuent le flux d'eau à travers le xylème, parfois jusqu'à 30 %[25]. À partir du Jurassique, les conifères développèrent une ingénieuse amélioration, utilisant des valves pour isoler les sections cavitées. Ces structures toriques contiennent un globule flottant au centre de l'anneau ; lorsqu'une dépressurisation survient d'un côté, le globule est aspiré et bloque l'écoulement[25]. D'autres plantes se contentent de supporter les conséquences de la cavitation. Ainsi, les chênes font pousser un anneau de vaisseaux larges au début de chaque printemps, aucun de ces vaisseaux ne survivant au gel hivernal. Les érables utilisent la pression des racines pour forcer la sève vers le haut au printemps, écrasant les bulles d'air éventuelles.
Dans les plantes primitives, les trachéides étaient trop fragiles d'un point de vue mécanique, et conservaient une position centrale, les tiges étant protégées par une couche de sclérenchyme plus solide[25]. Le support offert par les parois lignifiées des trachéides ultérieures permit une croissance verticale. Les trachéides mortes ne sont plus éliminées, mais forment une tige solide analogue au bois, et produite dans la plupart des cas par un xylème secondaire. Cependant, même dans ce cas, les trachéides restent soutenues par du tissu sclérenchymatique.
Les trachéides n'étant formées que d'une seule cellule, leur longueur est limitée, ce qui à son tour limite leur diamètre maximum utile à 80 μm[25] ; de plus, étant fermées à leurs extrémités, le flux est sévèrement limité. Des éléments de vaisseaux, formés de plusieurs cellules reliées par leurs extrémités, permirent de dépasser ces limites, et de former des tubes, les vaisseaux, d'un diamètre allant jusqu'à 500 μm, et d'une longueur atteignant parfois dix mètres[25].
Durant les périodes sèches et à basse concentration en CO2 de la fin du Permien, les vaisseaux firent leur apparition de façon indépendante, chez les fougères, les prêles et les Selaginellales ; ils apparurent par la suite chez les angiospermes et les gnétophytes au milieu du Crétacé[25]. Pour la même section transversale de bois, les vaisseaux permettent de transporter jusqu'à cent fois la quantité d'eau que permettent les trachéides. Cela permit aux plantes de remplir davantage leurs tiges d'éléments de structure, et ouvrit aussi une nouvelle niche écologique pour les plantes grimpantes, qui pouvaient transporter l'eau sans avoir à être aussi épaisses que l'arbre leur servant de support. Malgré ces avantages, le bois formé de trachéides reste bien plus léger (donc plus avantageux à fabriquer), car les vaisseaux demandent un renforcement important pour éviter la cavitation[25].
Phloème
Il a été suggéré que l'origine du phloème est la nécessité d'apporter des sucres aux organes n'ayant pas accès à la photosynthèse, tels que les racines[réf. nécessaire].
Feuilles


Les feuilles, actuellement, sont dans presque tous les cas une adaptation destinée à accroître la quantité de lumière solaire utilisable pour la photosynthèse. Elles sont certainement apparues plusieurs fois depuis la sortie des eaux des plantes. Il est possible qu'avant l'évolution des feuilles, les plantes terrestres aient développé la photosynthèse dans leurs tiges[note 3], conservant des tiges sans feuilles ou avec des appendices épineux pendant au moins 40 Ma après leur sortie des eaux[32].
En termes d'évolution, les feuilles sont classées en deux types fondamentaux : les microphylles, irriguées par une seule nervure et le plus souvent petites, et les mégaphylles, plus grandes et ayant une nervation complexe. Il a été suggéré que ces structures soient apparues indépendamment[33].
Selon la « théorie de l'énation », les microphylles auraient probablement pour origine la vascularisation progressive, sur des tiges initialement nues, de poils ou d'excroissances épineuses destinées à protéger les plantes primitives contre les herbivores[note 4], ce qui en ferait un exemple d'exaptation. Selon une autre hypothèse, elles ont évolué à partir de sporanges stériles chez des Lycophytes ancestraux. Les microphylles sont caractéristiques des Lycophytes actuels.
Les mégaphylles, selon la théorie du télome, auraient évolué à partir de branches présentant une architecture tridimensionnelle, à travers trois transformations : la planation, « aplatissant » cette architecture ; le tissage, formant des réseaux entre ces branches, et la fusion, regroupant ces réseaux pour former un limbe complet. Ces trois étapes auraient eu lieu à de multiples reprises dans l'évolution des feuilles modernes[34]. Les feuilles composées modernes sont probablement devenues majoritaires il y a 360 millions d'années, environ 40 millions d'années après la colonisation des terres au Dévonien inférieur par des plantes dépourvues de feuilles ayant acquis des mégaphylles, donnant naissance aux Euphyllophytes (littéralement « plantes à vraies feuilles »).
Cette évolution est notamment liée à la diminution de concentration du CO2 atmosphérique à la fin du Paléozoïque, elle-même associée à une augmentation de la densité des stomates à la surface des feuilles, ce qui assurait une meilleure évapotranspiration, et des échanges gazeux accrus. Un meilleur refroidissement des feuilles leur permettait ainsi d'acquérir une plus grande surface[35],[36].
Microphylles
Les rhyniophytes de la flore de Rhynie n'étaient formés que de tiges minces et sans ornements. Aussi, les trimérophytes (en) du Dévonien moyen sont les premières plantes à présenter un aspect que l'on puisse qualifier de « feuillu ». Les plantes vasculaires de ce groupe se reconnaissent à des masses de sporanges situées à leurs extrémités, lesquelles peuvent bifurquer ou trifurquer[31]. Certains organismes, tels que Psilophyton (en), portent des énations, de petites excroissances de la tige, épineuses et dépourvues de vascularisation.
À peu près à la même époque, les zostérophyllophytes (en) prenaient de l'importance. Ce groupe est reconnaissable à des sporanges en forme de rein, poussant sur de courtes branches latérales, à proximité de la tige principale, parfois ramifiées dans des formes en H caractéristiques[31]. La majorité des plantes de ce groupe portaient des épines sur leurs tiges, mais elles n'étaient pas vascularisées. Les premières traces d'énations vascularisées se trouvent dans le genre Asteroxylon (en). Les épines de Asteroxylon présentent des traces de vaisseaux partant du protostèle central et allant irriguer chaque « feuille » individuelle. Un fossile connu sous le nom de Baragwanathia apparait un peu plus tôt, au Silurien supérieur[37] ; dans cet organisme, ces traces de vaisseaux continuent jusqu'au milieu de la feuille[38]. La théorie des énations soutient que les feuilles se sont développées comme des excroissances du protostèle se reliant à des énations déjà existantes, mais il est également possible que les feuilles simples aient évolué à partir de tiges se ramifiant et formant un réseau[31].
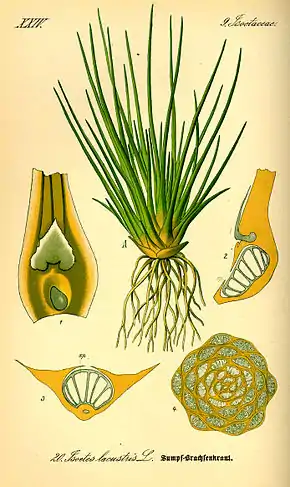
Asteroxylon[39] et Baragwanathia sont généralement considérés comme des lycopodes primitifs[31]. Les lycopodes existent toujours aujourd'hui (par exemple l’Isoète) ; ces lycopodes modernes portent des feuilles simples. Elles pouvaient être assez grandes – les Lepidodendrales avaient des feuilles simples de plus d'un mètre de long – mais elles sont presque toutes irriguées par un seul vaisseau, à l'exception de la ramification observée chez Selaginella.
Mégaphylles
Les feuilles composées ont sans doute des origines séparées ; elles sont de fait apparues indépendamment à quatre reprises, chez les fougères, les prèles, les progymnospermes et les plantes à graines[40]. Elles semblent provenir de branches ramifiées, qui se sont d'abord chevauchées, puis reliées entre elles, jusqu'à évoluer vers la structure typique d'un limbe foliaire[38]. Cette théorie explique pourquoi la « lacune foliaire » laissée lorsque le pétiole se sépare de la branche ressemble à une ramification[38]. Dans chacun des quatre groupes où sont apparues des feuilles composées, ces feuilles ont subi une évolution rapide entre la fin du Dévonien et le début du Carbonifère, se diversifiant jusqu'à ce que les formes se stabilisent au milieu du Carbonifère[40].
La fin de cette diversification peut être attribuée à des contraintes de développement[40] mais une question reste ouverte : pourquoi les feuilles ont-elles mis si longtemps à apparaître ? Les plantes avaient conquis le sol depuis au moins 50 millions d'années avant que les feuilles composées apparaissent de manière significative. Cependant, de petites feuilles composées étaient déjà présentes dans le genre Eophyllophyton (en) au début du Dévonien – ce n'est donc pas en soi leur complexité qui explique le temps écoulé avant leur généralisation[41]. La meilleure explication donnée jusqu'à présent est que le taux de CO2 atmosphérique diminuait rapidement à cette époque – divisé par 10 durant le Dévonien[42]. Ceci est en relation avec une multiplication par 100 de la densité des stomates. Les stomates permettent à l'eau de s'évaporer des feuilles ; la faible densité des stomates au début du Dévonien avait pour conséquence que des feuilles trop grandes se seraient échauffées, et cette densité ne pouvait augmenter, car les tiges et les systèmes de racines primitifs ne pouvaient apporter d'eau assez vite pour soutenir un rythme d'évapotranspiration accru[43].
Les arbres à feuillage caduc sont une réponse à un autre inconvénient des feuilles. La croyance populaire selon laquelle c'est une adaptation au raccourcissement des jours en hiver est erronée : des arbres à feuillage persistant prospéraient au-delà du cercle polaire durant la période chaude de la fin du Paléocène[44]. La raison de la perte des feuilles en hiver la plus souvent retenue est la protection contre le vent et la neige, cette perte diminuant la surface totale de l'arbre. Ce mécanisme de perte saisonnière est apparu à plusieurs reprises, et se présente actuellement chez les ginkgoales, les pinophyta et les angiospermes[45]. Il est possible également que ce mécanisme soit une réponse à la pression des insectes : il est peut-être moins coûteux d'abandonner entièrement les feuilles en hiver que de continuer à investir des ressources dans leur réparation[46].
Facteurs influençant l'architecture des feuilles
L'évolution de la forme des feuilles et de leur taille a été influencée par divers facteurs physiques et physiologiques, tels que l'intensité de la lumière[47], l'humidité, la température[48] ou la vitesse du vent[49]. Par exemple, les arbres des régions tempérées ou de la taïga ont des feuilles pointues, ce qui empêche la nucléation de la glace et réduit les pertes en eau dues à l'évapotranspiration. Les herbivores, que ce soient les grands mammifères ou les insectes, font également partie des contraintes ayant modelé les feuilles ; un exemple est donné par les plantes du genre Aciphylla fréquentes en Nouvelle-Zélande. Les moas (à présent éteints) les consommaient, or leurs feuilles présentent des épines sur leur face, lesquelles servaient sans doute à décourager ces oiseaux ; d'autres Aciphylla, qui ne coexistaient pas avec les moas, ne présentent pas ces épines[50].
Au niveau génétique, les études du développement ont montré que l'inhibition des gènes KNOX est nécessaire pour que le primordium des feuilles soit initié. Cela est effectué par les gènes ARP, qui codent des facteurs de transcription. Des gènes de ce type ont été trouvés dans les nombreuses plantes étudiées jusqu'à présent, et le mécanisme d'inhibition semble toujours conservé. Il est envisagé que cette fonction des ARP soit apparue très tôt dans l'évolution des plantes vasculaires, parce que des membres du groupe primitif des Lycophytes possèdent un gène qui lui est fonctionnellement similaire[51]. D'autres facteurs ayant conservé leur rôle dans la définition des primordia des feuilles sont des phytohormones : l'auxine, la gibbérelline et la cytokinine.

La phyllotaxie est une caractéristique importante des plantes. La disposition des feuilles sur la tige permet à la plante d'exploiter la lumière disponible de façon optimale (compte tenu des autres contraintes) ; on s'attendrait donc à ce que ce trait soit génétiquement robuste. Ce n'est cependant pas toujours le cas. Chez le maïs, une mutation d'un seul gène appelé abphyl (ABNORMAL PHYLLOTAXY, phyllotaxie anormale) suffit à changer la disposition des feuilles. Par la suite, il fut montré que ce gène codait une protéine régulant la réponse à la cytokinine[52].
Une fois les cellules primordiales des feuilles établies à partir des cellules du méristème, les axes de croissance sont définis, le plus étudié d'entre eux étant l'axe abaxial-adaxial, différenciant les surfaces inférieures et supérieures. Les gènes mis en jeu dans cette définition (et dans celle des autres axes) semblent être plus ou moins toujours les mêmes chez les plantes supérieures. Il a été montré que des protéines de la famille HD-ZIPIII interviennent, en déviant certaines cellules du primordium de la feuille de leur état abaxial de base vers l'état adaxial. On pense que les premières plantes à feuilles n'avaient qu'un type de surface, celui qui constitue actuellement leur face inférieure, et que la différenciation d'une identité adaxiale se produisit quelque deux cents millions d'années plus tard[53]. Les feuilles primitives correspondaient sans doute à un état intermédiaire entre les excroissances épineuses qui leur avaient donné naissance et les feuilles à deux faces modernes, elles étaient complètement recouvertes de stomates et n'étaient pas encore optimisées pour la photosynthèse.
La façon dont l'infinie variété des formes des feuilles apparait est le sujet de recherches actives. Parmi les éléments communs, on trouve l'implication des gènes KNOX dans la construction des feuilles composées, comme chez la tomate ou le maïs. Mais ce n'est nullement universel : les pois emploient un mécanisme différent pour le même résultat[54],[55] Des mutations chez les gènes affectant la courbure des feuilles peuvent aussi changer leur forme, en les obligeant à replier leur surface[56] comme c'est le cas pour les feuilles des choux. Il existe également, dans une feuille en développement, plusieurs morphogènes régulant les gradients qui définissent l'axe de la feuille ; des changements de ces gradients peuvent aussi affecter la forme. Enfin, une autre classe importante de régulateurs sont les microARNs, dont le rôle commence seulement à être étudié.
Formes arborescentes


Les paysages du début du Dévonien étaient dépourvus de végétation de plus d'un mètre de hauteur : avant l'évolution d'un système vasculaire robuste, des tailles supérieures ne pouvaient être atteintes. Il y a cependant une pression évolutionnaire constante pour dépasser les compétiteurs, l'avantage le plus évident étant de capter plus de lumière solaire, mais la distribution des spores (et plus tard, des graines) est également mieux assurée s'ils partent d'une plus grande hauteur. On le voit peut-être déjà chez Prototaxites, un lichen de la fin du Silurien dont on a pensé qu'il pouvait atteindre huit mètres de haut[57],[note 5].
Pour atteindre des formes arborescentes, les plantes primitives devaient développer des tissus ligneux fournissant un support et transportant l'eau. Ce développement est appelé la croissance secondaire (ou croissance en diamètre) ; le stèle central est entouré par le cambium vasculaire, un anneau de cellules produisant plus de xylème (du côté interne) et de phloème (du côté externe). De nouvelles couches de xylème sont formées, s'ajoutant à celles qui meurent pour constituer le bois.
Les premières plantes à avoir connu une croissance secondaire semblent avoir été les fougères, et dès le milieu du Dévonien, une espèce, Wattieza, avait atteint une hauteur de huit mètres et une forme arborescente[58].
D'autres clades ne mirent pas longtemps à les suivre ; à la fin du Dévonien, Archaeopteris, un précurseur des gymnospermes ayant évolué à partir des trimérophytes[59], atteignait une hauteur de 30 mètres. Ces progymnospermes étaient les premières plantes montrant la présence d'un véritable bois, poussé à partir d'un cambium à deux faces ; le premier exemple connu est chez Rellimia, au milieu du Dévonien[60]. On pense que le bois véritable n'est apparu qu'une fois, ce qui a donné naissance à l'idée du clade des lignophytes.
Ces forêts d’Archaeopteris furent bientôt supplantées par des lycopodes, et plus précisément des Lepidodendrales, qui atteignaient cinquante mètres de hauteur et deux mètres de diamètre à la base. Ces lycopodes vinrent à dominer les dépôts de charbon de la fin du Dévonien et du Carbonifère[61]. Les Lepidodendrales diffèrent des arbres modernes en ce que leur croissance est prédéterminée : après avoir accumulé une réserve de nourriture à faible hauteur, les plantes "jaillissent" jusqu'à une hauteur génétiquement déterminée, se ramifient à ce niveau, dispersent leurs spores, et meurent[62]. Elles étaient formées d'un bois grossier leur permettant une croissance rapide, la moitié des pousses au moins étant creuses et remplies de moelle[31]. Leur bois semble avoir été formé à partir d'un cambium à une seule face, ne créant pas de nouveau phloème, et donc ne permettant pas à l'arbre de croître en largeur.
Calamites apparut ensuite, au Carbonifère. Contrairement aux prêles modernes Equisetum, Calamites possédait un cambium vasculaire à une face, ce qui lui permettait de développer du bois et d'atteindre des hauteurs dépassant 10 m. Ils avaient également des branches se ramifiant à plusieurs étages.
Bien que la forme de ces arbres primitifs soit semblable aux formes actuelles, aucun d'eux n'en est l'ancêtre. Les groupes dominants actuels sont les gymnospermes, contenant les conifères, et les angiospermes, contenant tous les arbres à fleurs et à fruits. On a longtemps pensé que les angiospermes étaient issus des gymnospermes, mais des études moléculaires récentes suggèrent que leurs représentants actuels forment deux groupes distincts[63],[64],[65]. Ces données moléculaires ne sont pas encore complètement réconciliées avec les analyses morphologiques[66],[67],[68], mais il est désormais admis que les indices morphologiques en faveur de la paraphylie ne sont pas très concluants[69]. Ceci amènerait à penser que les deux groupes sont issus des ptéridospermes, probablement dès le Permien[69].
Les angiospermes et leurs ancêtres ne jouèrent qu'un rôle secondaire jusqu'à leur diversification au cours du Crétacé. Ils sont issus de petits organismes aimant l'humidité et prospérant dans les sous-bois, et ne connurent d'expansion qu'à partir du milieu du Crétacé, occupant alors tous les biotopes de la terre (sauf les régions polaires) : déserts (Cactacées), hautes montagnes (Graminées), épiphytes (Orchidacées), plantes parasites (Cuscute), eaux douces (Sagittaires, lentilles d'eau), ou eaux marines (Posidonies, Hydrocharitacées, Potamogétonacées). Leur succès évolutif est tel qu'elles sont devenues l'élément végétal dominant dans les forêts de feuillus et les forêts tropicales (seules les forêts boréales sont dominées par les gymnospermes), mais aussi dans les prairies, les déserts et les toundras. Elles représentent la quasi-totalité des végétaux cultivés par l'homme[70].
Racines
 |
 |
| On pense que les racines des Lepidodendrales (image du bas) sont des équivalents fonctionnels des tiges (en haut), comme le montre l'aspect analogue des cicatrices laissées par les feuilles ou sur les racines de ces spécimens venant d'espèces différentes. |
Les racines jouent deux rôles essentiels : elles fournissent un ancrage de la plante à son support, et, plus important encore, elles fournissent une source d'eau et de nutriments venus du sol. Les racines permettent aux plantes de croître plus vite et d'atteindre une plus grande taille.
Un système vasculaire est indispensable à des plantes enracinées, car des racines ne pouvant accomplir la photosynthèse doivent être approvisionnées en sucres, tandis que l'eau et les autres nutriments doivent être transportées des racines au reste de la plante[9]. Il est donc probable que l'origine du phloème soit à chercher dans la réponse apportée à ces besoins[réf. nécessaire].
L'apparition de plantes à racines a eu également des conséquences écologiques importantes. En aérant le sol, et en l'acidifiant (par la consommation de nutriments tels que les nitrates et les phosphates), elles intensifièrent ses échanges avec l'atmosphère, augmentant la fixation du CO2[71], ce qui devait modifier le climat[72]. Ces effets peuvent avoir été marqués au point d'entraîner l'extinction du Dévonien[73].
Bien qu'il y ait des traces ressemblant à celles de racines dans les sols fossilisés de la fin du Silurien[74], les fossiles des organismes montrent que les plantes primitives en étaient dépourvues. Beaucoup d'entre elles présentaient cependant des filaments s'étendant sous le sol ou à sa surface, d'où partaient çà et là des thalles verticaux ; certaines développaient même des branches souterraines non photosynthétiques et manquant de stomates ; mais les racines modernes diffèrent des branches par l'organisation de leurs ramifications, par un développement distinct, et par la présence d'une coiffe[6]. Aussi, bien que des plantes du Silurien et du Dévonien telles que Rhynia (en) et Horneophyton (en) présentent l'équivalent physiologique de racines, celles-ci, considérées comme physiologiquement différentes des branches, n'apparurent qu'ultérieurement[6]. Les racines sont malheureusement rarement préservées par la fossilisation, et notre compréhension de leur histoire évolutive est incomplète[6].
Les plantes du Dévonien n'étaient guère plus élaborées que leurs ancêtres dépourvus de racines du Silurien ; cependant, leurs tiges montrent clairement des excroissances semblables aux rhizoïdes des bryophytes actuels[75]. Les rhizoïdes (de petites structures n'ayant généralement qu'une cellule de diamètre et jouant le même rôle que les racines) évoluèrent probablement très tôt, peut-être même avant que les plantes colonisent la terre ferme ; on peut les reconnaître chez les Characeae, un groupe d'algues proche des plantes terrestres[6]. Cela dit, les rhizoïdes sont probablement apparues à plusieurs reprises ; les rhizines des lichens, par exemple, accomplissent une fonction similaire, et même certains animaux (les Lamellibrachia) possèdent des structures semblables à des racines[6]!
Des structures plus avancées sont fréquentes dans la flore de Rhynie, et de nombreux autres fossiles du début du Dévonien présentent des organes ressemblant à des racines, et qui avaient des fonctions similaires[6]. Les rhyniophytes avaient de fines rhizoïdes, et les trimérophytes ainsi que les lycopodes herbacés présentaient des structures semblables à des racines, pénétrant de quelques centimètres dans le sol[76]. Cependant, aucun de ces fossiles ne présente toutes les structures des racines modernes[6]. Ces structures devinrent plus fréquentes et pénétrant plus profondément dans le sol durant le Dévonien, les lycopodes arborescents formant des racines de 20 cm de long durant l'Eifelien et le Givétien. Au cours de la période suivante, le Frasnien, ils furent rejoints par les progymnospermes, qui s'enracinaient à un mètre de profondeur[76]. Enfin, les vrais gymnospermes et les fougères zygoptérides formèrent des systèmes radiculaires superficiels durant le Famennien[76].
Les rhizomorphes des lycopodes fournissent une solution légèrement différente au problème de l'enracinement. Ils ressemblaient à des branches, avec des organes semblables à des feuilles jouant le rôle de radicules[6]. Une structure analogue peut être observée chez le lycopode actuel Isoetes, ce qui montrerait qu'une évolution indépendante des racines a eu lieu au moins deux fois[6].
À la fin du Dévonien, la plupart des groupes de plantes avaient développé indépendamment un système de racines d'un type ou d'un autre[75]. En devenant plus puissantes, elles purent soutenir des arbres plus grands, et le sol fut aéré sur une plus grande profondeur[73]. Ceci devait non seulement amener à une plus grande fixation du CO2, mais aussi ouvrir de nouveaux habitats colonisés par les champignons et les animaux[76].
Les racines actuelles se sont développées jusqu'à leurs limites physiques. Elles peuvent pénétrer jusqu'à plusieurs dizaines de mètres[note 6] pour atteindre les nappes phréatiques. Les radicules les plus étroites ne font que 40 μm de diamètre, et ne pourrait physiquement pas transporter d'eau si elles étaient plus fines encore[6]. En comparaison, les plus anciennes racines fossiles retrouvées avaient un diamètre compris entre 3 mm et 700 μm ; bien sûr, la taphonomie limite les épaisseurs que nous pouvons voir[6].
Mycorhizes
L'efficacité des racines est souvent accrue par une relation symbiotique avec un champignon. Les plus fréquentes de ces associations sont les mycorhizes. Dans ce cas, certaines cellules des racines sont envahies par des champignons, remplissant la membrane cellulaire de leur hyphe. Ils se nourrissent des sucres de la plante, mais lui fournissent en retour des nutriments qu'ils créent ou extraient du sol (en particulier des phosphates), et auxquels la plante ne pourrait avoir accès autrement.
Cette symbiose semble être apparue très tôt dans l'histoire des plantes. On trouve des mycorhizes dans tous les groupes, et chez 80 % des plantes vasculaires existantes[77], ce qui suggère une origine très ancienne ; une symbiose avec des champignons a peut-être même été l'étape permettant la conquête du sol[78]. Même la productivité de plantes simples comme les hépatiques est accrue par les mycorhizes[79]. De fait, elles sont abondantes dans la flore de Rhynie[80] ; cette association apparut avant même qu'il y ait de vraies racines à coloniser, et il a été suggéré que les racines ont aussi évolué pour fournir un habitat plus confortable à ces champignons[81].
Graines

Les premières plantes terrestres se reproduisaient à la façon des fougères : des spores germaient pour former de petits gamétophytes, lesquelles produisaient des gamètes mâles. Chacun d'eux nageait à travers le sol humide pour trouver l'archégone, l'organe femelle du même gamétophyte ou d'un autre, où il fusionnerait avec un ovule pour produire un embryon, lequel germerait en produisant un sporophyte[76].
Ce mode de reproduction confinait les plantes primitives à des environnements suffisamment humides pour que cette natation soit possible ; aussi ces plantes ne pouvaient occuper que les terres proches des côtes et des cours d'eau. Le développement de l'hétérosporie les libéra de cette contrainte.
Les organismes hétérosporiques, comme leur nom l'indique, portent des spores de deux tailles, des microspores et des mégaspores, lesquels germent pour former des microgamétophytes et des mégagamétophytes, respectivement. Le mégasporange, dans les cas extrêmes, ne pouvait porter qu'une seule tétrade, et pour compléter la transition vers les vraies graines, il suffisait que trois des mégaspores de la tétrade soient avortés.
La transition continua lorsque l'unique mégaspore restant fut retenu dans son sporange durant sa germination. Le mégagamétophyte est alors enfermé dans un tégument imperméable, qui forme le corps de la graine. Le microgamétophyte – un grain de pollen ayant germé à partir d'un microspore – sert à disséminer le sperme, lequel, risquant le dessèchement, n'est relâché que lorsqu'il rencontre un mégagamétophyte réceptif[31]. Les lycopodes parcoururent une bonne partie de ce chemin vers les graines, mais ne franchirent jamais l'étape finale. On connait des mégaspores de lycopodes fossiles atteignant 1 cm de diamètre, et entourés de tissu végétatif ; ils germent même in situ en un mégagamétophyte. Cependant, ce ne sont tout de même pas des graines, parce que le nucelle, la couche intérieure recouvrant la spore, ne se referme pas complètement, ce qui expose la graine au contact de l'atmosphère. Cela a pour conséquence une certaine fragilité face à la dessiccation, mais en revanche, le sperme n'a pas de difficulté à pénétrer le mégaspore pour atteindre l'archégone[31].
Les premières plantes à avoir de vraies graines (les spermatophytes, littéralement : « plantes à graines ») furent les ptéridospermes, ou fougères à graines, ainsi appelées parce que leurs feuillages ressemblaient aux frondes des fougères (bien qu'elles ne leur soient pas particulièrement apparentées en fait). Les plus anciennes traces fossiles de ces plantes apparaissent à la fin du Dévonien ; elles semblent avoir évolué à partir du groupe des progymnospermes. Leur taille allait de petits buissons à celle de véritables arbres ; comme la plupart des premiers progymnospermes, c'était des plantes ligneuses au feuillage semblable à des fougères. Elles portaient des ovules, mais pas de cônes ou de fruits. Bien qu'il soit difficile de retracer le début de l'évolution des graines, on sait que les ptéridospermes proviennent des trimérophytes, puis du groupe (homospore) des Aneurophytes[31].
Ce modèle de graine est partagé par essentiellement tous les gymnospermes (littéralement, « graines nues ») ; la plupart enchâssent leurs graines dans un cône (fibreux, ou charnu chez les ifs), mais aucun ne les enveloppe complètement. Les angiospermes (« graines encloses ») sont le seul groupe dans lequel les graines sont complètement enveloppées par un carpelle.
Des graines complètement isolées de l'atmosphère permirent aux plantes d'exploiter une nouvelle voie de développement : l'endodormance des graines[note 7]. L'embryon, protégé de la dessiccation, peut survivre plusieurs années de sécheresse avant de germer. On a trouvé des graines de gymnospermes contenant des embryons datant du Carbonifère supérieur, ce qui impliquerait un laps de temps important entre la fertilisation et la germination[82]. On associe cette époque à l'entrée dans une période chaude[note 8], et plus aride ; cela suggère que la dormance apparut comme une réponse à ces conditions climatiques, la possibilité d'attendre une période humide pour germer devenant un avantage[82]. Cette avancée de l'évolution ouvrit toute une série d'habitats auparavant inhospitaliers, comme les pentes arides des montagnes, lesquelles se couvrirent bientôt d'arbres[82].
Les graines offrent des avantages supplémentaires : elles accroissent le taux de réussite des gamétophytes fertilisés, et, comme elles peuvent également contenir un stock de nutriments, elles permettent à l'embryon de germer rapidement dans des environnements hostiles, et d'atteindre une taille lui permettant de se défendre par lui-même, par exemple de faire croître des racines assez profondes pour atteindre la nappe phréatique avant de mourir de dessiccation[76]. La combinaison de ces avantages permit aux plantes à graines de supplanter le genre Archaeopteris dominant jusque-là, accroissant la biodiversité des forêts primitives[76].
Fleurs et fruits


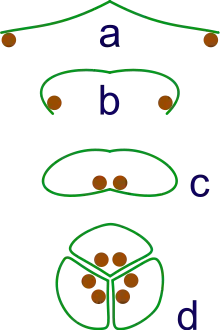
a: des sporanges apparaissent à l'extrémité des feuilles
b: Les feuilles s'enroulent pour protéger les sporanges
c: Des rouleaux fermés se forment
d: Trois rouleaux se regroupent pour former un syncarpe

Les fleurs sont des organes modifiés à partir des feuilles, possédées uniquement par les angiospermes (cependant, des structures colorées ou parfumées entourent les cônes de certains gymnospermes tels que les cycadales et les gnétophytes, rendant délicate une définition rigoureuse de la notion de « fleur[68] ») ; elles apparaissent relativement tardivement dans les archives fossiles : les premières structures semblables à des fleurs remontent à 130 millions d'années, au milieu du Crétacé[83]. La fonction principale d'une fleur est la reproduction, laquelle, avant l'évolution des angiospermes, était assurée par les microsporophylles et les mégasporophylles. Les fleurs constituent une importante innovation de l'évolution, qui a permis au monde des plantes d'accéder à des méthodes de reproduction entièrement nouvelles, et a amené à une importante coévolution avec les pollinisateurs à partir du Trias. Le Crétacé voit ainsi l'explosion des Angiospermes qui a favorisé la diversification des insectes phytophages (d'où l'accroissement de la diversité des Lépidoptères, des Hyménoptères et des Coléoptères qui consomment essentiellement des plantes à fleurs[84]) et, sans doute, à l'autre bout de la chaîne alimentaire, celle des oiseaux et des mammifères[46].
On a longtemps pensé que les plantes à fleurs avaient évolué à partir des gymnospermes ; d'après leur morphologie, elles semblaient apparentées aux gnétophytes. Cependant, comme noté plus haut, des analyses moléculaires récentes infirment cette hypothèse[64],[65] et suggèrent d'ailleurs que les gnétophytes sont plus proches de certains gymnospermes que des angiospermes[note 9],[63] et que les gymnospermes actuels forment un clade distinct des angiospermes[64],[65],[63], les deux clades ayant divergé il y a quelque 300 millions d'années[85].
La détermination du groupe ayant donné naissance aux angiospermes est importante pour comprendre l'évolution des fleurs. La convergence évolutive augmente le risque de mal l'identifier : comme la protection du mégagamétophyte apporte un avantage, il est probable que plusieurs groupes distincts l'ont développée indépendamment. Dans le cas des fleurs, cette protection prend la forme d'un carpelle, venu d'une feuille transformée pour assurer un rôle d'enveloppement des ovules, lesquels sont de plus recouverts d'un tégument à double paroi.
La pénétration de ces enveloppes protectrices demande davantage qu'un microgamétophyte flottant librement. Les grains de pollen des angiospermes sont formés de trois cellules. L'une d'elles est chargée de frayer le chemin à travers les téguments, et permet aux deux cellules reproductrices de parvenir à l'ovule. Celui-ci est formé de sept cellules ; l'une d'elles fusionne avec l'un des gamètes mâles pour former le noyau de l'œuf, et une autre se joint au deuxième gamète pour former un albumen riche en nutriments. Ce processus de « double fécondation » est unique dans le monde végétal, et commun à tous les angiospermes.
Trois groupes fossiles présentent des structures analogues à des fleurs. Le premier est Glossopteris, un groupe de ptéridospermes du Permien dont les feuilles recourbées ressemblaient déjà à des carpelles. Les Caytoniales du Trias étaient encore plus proches, avec des ovules complètement enclos, mais dans un tégument à simple paroi ; de plus, les détails des pollens et des étamines les distinguent nettement des vraies plantes à fleurs. Enfin, les Bennettitales portaient des organes remarquablement semblables à des fleurs, protégés par des enroulements de bractées qui jouaient peut-être un rôle analogue à celui des pétales et des sépales des vraies fleurs ; mais ces structures ont évolué indépendamment, car les Bennettitales sont plus proches des cycadales et des ginkgos que des angiospermes[86]. Cependant, on ne rencontre aucune vraie fleur en dehors de groupes (d'angiospermes) toujours existants aujourd'hui. La plupart des analyses morphologiques et moléculaires placent Amborella, les nymphaeales et les Austrobaileyaceae dans un clade basal connu sous le sigle "ANA". Ce clade semble avoir divergé au début du Crétacé, il y a 130 millions d'années – vers la même époque que celle d'Archaefructus, le plus vieil angiosperme fossile connu[87],[note 10], et juste après les premiers pollens similaires à ceux des angiospermes, ceux des Clavatipollenites, il y a 136 millions d'années[69]. Les magnoliidées apparurent peu après, et une rapide radiation évolutive avait produit des monocotylédones et des dicotylédones vers -125 Ma. À la fin du Crétacé, il y a 65 millions d'années, plus de la moitié des ordres actuels d'angiospermes étaient apparus, et près de 70 % des espèces[88] ; c'est vers cette époque que les arbres à fleurs commencèrent à dominer les conifères[89].
Les caractéristiques des groupes du clade basal "ANA" suggèrent que les angiospermes apparurent dans des endroits humides, sombres, et fréquemment perturbés[90]. Il semble que les angiospermes restèrent confinés dans de tels habitats durant tout le Crétacé, y occupant la niche des petites herbes[88]. Cela pourrait leur avoir donné la flexibilité expliquant la rapidité de leur diversification ultérieure dans d'autres habitats[90].
Origine des fleurs
.jpg.webp)
La famille Amborellaceae est considérée comme la famille sœur de toutes les plantes à fleurs actuelles. En d'autres termes, les membres de cette famille furent très vraisemblablement les premières plantes à porter des fleurs.
Au niveau des organes, la feuille est sans doute l'ancêtre de la fleur, ou du moins de certaines de ses parties. La mutation de certains gènes critiques du développement floral conduit à un buisson de structures semblables à des feuilles ; on estime donc que le programme amenant à la formation des feuilles a dû être altéré au cours de l'évolution pour construire les fleurs. Il existe probablement également un plan d'ensemble robuste dans le cadre duquel la diversité florale a été engendrée. Un exemple est le gène appelé Leafy (en) (LFY), mis en jeu dans le développement de la fleur de Arabidopsis thaliana. On trouve des homologues de ce gène chez des angiospermes aussi divers que la tomate, le muflier, les pois ou le maïs, et même chez certains gymnospermes. Lorsque ce gène s'exprime chez des plantes aussi éloignées de Arabidopsis thaliana que le peuplier ou le citronnier, des fleurs sont également produites. Le gène LFY régule l'expression de gènes appartenant à la famille MADS-box (voir ci-dessous). Ces gènes, à leur tour, contrôlent directement le développement floral.
Évolution de la famille MADS-box
Les facteurs de transcription de la famille MADS-box jouent un rôle très important dans le développement des fleurs, rôle qui a été conservé par l'évolution. Selon le modèle ABC (en) du développement floral, trois zones - A, B et C - sont engendrées dans le primordium de la fleur, sous l'action de certains de ces facteurs ; les fonctions des gènes contrôlant les domaines B et C ont été mieux préservées par l'évolution que celles correspondant au domaine A. Beaucoup de ces gènes sont apparus par duplication, et présentent souvent des fonctions redondantes.
L'évolution de la famille MADS-box a été abondamment étudiée. On rencontre déjà ces gènes même chez les ptéridophytes, mais leur étendue et leur diversité est bien plus grande chez les angiospermes[91]. L'évolution de cette famille semble avoir suivi des schémas assez réguliers. Ainsi, le gène Agamous (en)(AG) de la région C s'exprime chez les fleurs actuelles dans les étamines et le carpelle, qui sont les organes reproducteurs. Son ancêtre chez les gymnospermes s'exprime de même dans le strobile, un organe qui produit du pollen ou des ovules[92]. De même, les ancêtres des gènes AP3 et PI de la région B ne s'expriment que dans les organes mâles des gymnospermes. Leurs descendants chez les angiospermes modernes ne s'expriment que dans les étamines, les organes mâles analogues des fleurs.
Facteurs de la diversité florale

Il y a énormément de variabilité dans le programme du développement des fleurs. Ainsi, les herbes possèdent une structure florale unique, dans laquelle le carpelle et les étamines sont entourés de lodicules ressemblant à des écailles et de deux bractées, le lemma et le palea. Des indices génétiques et morphologiques suggèrent que les lodicules sont les homologues des pétales des dicotylédones[93]. Le palea et le lemma sont peut-être des homologues des sépales d'autres groupes, ou des structures uniques propres aux herbes ; l'évidence génétique à ce sujet n'est pas concluante.
Les variations de structure des fleurs sont typiquement dues à de légers changements des gènes de la MADS-box et de leur ordre d'expression. Ainsi, chez Linaria vulgaris, qui présente deux sortes de symétries florales (radiale et bilatérale), celles-ci sont dues à des changements épigénétiques dans un seul gène appelé CYCLOIDEA[83].
Arabidopsis thaliana possède un gène appelé Agamous[94] qui joue un rôle important dans la détermination du nombre de pétales, de sépales et des autres organes. Des mutations de ce gène ont pour conséquence une perte de détermination du méristème floral[95], ce qui, chez des fleurs comme les roses ou les œillets, se traduit par une augmentation considérable du nombre de pétales, raison pour laquelle ces fleurs ont été depuis longtemps sélectionnées par les horticulteurs. De nombreuses études sur diverses plantes telles que les pétunias, les tomates, les impatientes, ou le maïs suggèrent de façon générale que l'énorme diversité des formes des fleurs résulte de petites modifications de ce gène et d'autres contrôlant leur développement[96].
Certaines de ces modifications changent également les expressions de ces gènes, aboutissant à différents phénotypes. Le Projet Génome Floral (en) a étudié les marqueurs génétiques de tissus variés chez de nombreuses plantes à fleurs, confirmant que le modèle ABC (en) n'est pas valide chez tous les angiospermes. Les domaines d'expression changent parfois, en particulier chez les angiospermes primitifs et chez les monocotylédones ; d'autres modèles de développement, supposant des frontières moins rigides, ont été proposés pour expliquer ces architectures[97]. Il se peut que ces domaines d'expression aient été fixés par l'évolution conduisant aux angiospermes modernes.
Période de floraison
Une autre caractéristique des fleurs modelée par la sélection naturelle est le moment de la floraison. Certaines plantes fleurissent tôt dans leur cycle de vie, d'autres demandent une période de vernalisation. Cette décision est fondée sur des facteurs environnementaux tels que la température, l'intensité lumineuse ou la présence de pollinisateurs. On sait que des gènes tels que CONSTANS (CO), Flowering Locus C (en) (FLC) et FRIGIDA régulent l'intégration de ces signaux environnementaux dans le développement : des variations de ces gènes ont été associées à des variations du moment de floraison. Ainsi, des écotypes de Arabidopsis thaliana poussant dans les régions tempérées demandent une vernalisation prolongée avant de fleurir, ce qui n'est pas le cas des variétés tropicales ; on sait désormais que cette différence est due à des mutations des gènes FLC et FRIGIDA, les rendant non fonctionnels[98].
Beaucoup d'acteurs de ce processus restent les mêmes à travers toutes les plantes étudiées. Parfois, cependant, en dépit de la conservation des gènes, les mécanismes diffèrent. Ainsi, le riz et Arabidopsis thaliana utilisent tous deux les protéines CO et FLOWERING LOCUS T (FT), mais chez Arabidopsis thaliana, CO augmente la production de FT, tandis que son homologue la réprime chez le riz, résultant en des effets opposés sur la durée de floraison[99].
Théories sur l'évolution des fleurs
De nombreuses théories concernant l'évolution des fleurs ont été proposées ; deux d'entre elles sont décrites ci-dessous
La théorie anthophyte était fondée sur l'observation selon laquelle l'ovule des Gnétales, un groupe de gymnospermes, ressemblait à celui des fleurs : il possède des vaisseaux semblables à ceux des angiospermes, et le mégasporange est recouvert de trois enveloppes. Cependant, de nombreux autres arguments montrent que les Gnétales ne sont pas apparentés aux angiospermes[86].
La théorie de la masculinisation a une base plus génétique, partant de la remarque selon laquelle les gymnospermes possèdent deux copies très semblables du gène LFY, alors que les angiospermes n'en ont qu'une. Des analyses utilisant l'horloge moléculaire ont montré que l'autre copie de LFY s'était perdue chez les angiospermes vers la même époque où les fossiles de fleurs sont devenus abondants, suggérant que cet événement aurait pu amener à leur évolution[100]. Selon cette théorie, la perte de l'un des paralogues LFY créa des fleurs plus masculines, dont les ovules s'exprimaient ectopiquement. Ces ovules avaient pour fonction initiale d'attirer des pollinisateurs, mais furent intégrés ultérieurement au centre de la fleur.
Fruits

Les fruits (et les organes analogues comme les faux-fruits) sont une autre innovation caractéristique des Angiospermes, fournissant un milieu propice à la germination et au développement des graines (lesquelles restent nues chez les Gymnospermes).
Évolution du métabolisme
Améliorations de la photosynthèse

Le chemin métabolique C4 est une innovation récente de grande importance.
La photosynthèse ne consiste pas simplement à ajouter de l'eau au dioxyde de carbone pour produire des sucres et de l'oxygène. Une succession complexe de réactions chimiques sont mises en jeu, facilitées par un ensemble d'enzymes et de coenzymes. L'enzyme Rubisco est responsable de la fixation du CO2, l'attachant à une molécule à squelette carboné pour former un sucre, que la plante peut utiliser pour produire de l'énergie, et libérant une molécule de dioxygène en chemin. Cependant, cette enzyme est assez inefficace, et peut tout aussi bien fixer l'oxygène plutôt que le CO2, un processus appelé la photorespiration. Cela est énergétiquement coûteux, la plante devant alors retransformer les produits de la photorespiration en des formes pouvant réagir avec le dioxyde de carbone.
Concentration du carbone
Les plantes C4 développèrent des mécanismes de concentration du carbone, augmentant la quantité de CO2 autour de l'enzyme RubisCO, ce qui facilite la photosynthèse et diminue la photorespiration. Ces mécanismes demandent plus d'énergie que de laisser les gaz se diffuser, mais sous certaines conditions (des températures supérieures à 25 °C, de faibles concentrations en CO2 et de fortes concentrations en oxygène), cela reste avantageux grâce à la diminution des pertes en sucres due à la photorespiration.
Un type de métabolisme C4 utilise l’anatomie de Kranz. Cela consiste à transporter le CO2 à travers une couche mésophylle externe, par une succession de molécules organiques, jusqu'au faisceau central de cellules gaines, où le CO2 est relâché. Ainsi, l'enzyme RubisCO opère dans un environnement riche en CO2, et donc de façon plus efficace.
Un second mécanisme, la photosynthèse CAM, sépare temporellement la photosynthèse proprement dite de l'action de RubisCO. RubisCO n'est active que le jour, alors que les stomates sont fermés et que le CO2 provient de la décomposition des malates. Le CO2 est ensuite pris à l'atmosphère (et stocké) lorsque les stomates s'ouvrent durant les nuits fraîches et humides, ce qui réduit les pertes en eau.
Traces fossiles
Ces deux processus, ayant le même effet sur RubisCO, ont évolué indépendamment un grand nombre de fois – de fait, C4 à lui seul est apparu dans 18 familles de plantes distinctes. La construction C4 est surtout utilisée par des herbes, tandis que la photosynthèse CAM se trouve surtout chez les plantes succulentes et les cactus. Ces traits semblent être apparus durant l'Oligocène, il y a 30 millions d'années[101] ; cependant, ils ne prirent d'importance écologique qu'au Miocène, il y a 6 ou 7 millions d'années[102]. Il est remarquable que la transformation en charbon de certains fossiles ait préservé l'organisation anatomique de Kranz, laissant intacts les faisceaux de cellules gaines[103], permettant d'identifier la présence de métabolisme C4 à cette époque sans le moindre doute.
Pour pouvoir déterminer la distribution et l'importance de ce métabolisme, on doit utiliser des marqueurs isotopiques : les plantes C3 utilisent de préférence 12C, le plus léger des deux isotopes de carbone dans l'atmosphère, qui entre plus facilement en jeu dans les réactions chimiques amenant à sa fixation. De plus, le métabolisme C4 mettant en jeu une réaction supplémentaire, cet effet est encore accentué dans ce cas. Les fossiles des plantes peuvent être analysés par spectrométrie de masse pour déduire le rapport des proportions de l'isotope 13C, plus lourd, à celles de 12C (ce rapport est noté δ13C). Les plantes C3 ont en moyenne un δ13C 1,4 % plus léger que le rapport des proportions de l'atmosphère, et les plantes C4 ont un rapport 2,8 % plus léger ; les plantes CAM varient entre ces deux valeurs selon qu'elles fixent ou non tout leur carbone durant la nuit[104].
Il est presque impossible de se procurer du matériel fossile en quantité suffisante pour analyser les herbes elles-mêmes, mais heureusement, les herbivores, et en particulier les chevaux, constituent un relais exploitable. Dans la période où le métabolisme C4 est apparu, les chevaux étaient répandus dans le monde entier, et se nourrissaient presque exclusivement d'herbes. La composition isotopique d'un organisme reflète celle de ce qu'il mange (à un petit facteur d'ajustement près). On dispose d'un bon ensemble de dents de chevaux fossiles, dont on a pu mesurer le δ13C ; celui-ci présente une baisse soudaine il y a six ou sept millions d'années, durant le Messinien, ce qu'on interprète comme l'apparition d'un nombre significatif de plantes C4 à l'échelle mondiale[102].
Apparition du métabolisme C4
Bien que C4 améliore l'efficacité de RubisCO, la concentration du carbone est énergétiquement très coûteuse. Aussi, les plantes C4 n'ont un avantage sur les organismes C3 que dans certaines conditions : des températures élevées, peu de précipitations, et un important ensoleillement[105]. Des modélisations ont suggéré qu'en l'absence de feux de forêts éliminant les arbres et les buissons formant de l'ombre, il n'y aurait pas de niches écologique pour les plantes C4[106]. Cependant, des feux de forêts se produisent depuis 400 millions d'années remettant en question cette hypothèse. Au Carbonifère, il y a 300 millions d'années, le niveau d'oxygène était notoirement élevé, presque assez pour permettre la combustion spontanée[note 11], et le niveau de CO2 était bas, mais la signature isotopique de C4 n'apparait jamais.
Il ne semble pas non plus qu'un déclencheur soudain puisse expliquer le rapide développement de ce métabolisme au Miocène. Durant cette époque, l'atmosphère et le climat étaient relativement stables ; la concentration en dioxyde de carbone a même augmenté graduellement il y a 14 millions d'années, avant de se stabiliser à des valeurs semblables aux valeurs actuelles[107] ; cela semble indiquer que ce n'était pas un facteur-clé de l'évolution des plantes C4[101]. Les herbes elles-mêmes (le groupe présentant le plus d’occurrences de C4) ont probablement été présentes depuis plus de 60 millions d'années, et donc auraient eu largement le temps d'évoluer ce métabolisme[108],[109]. Au sud de l'Asie, on constate d'importants changements climatiques[101] ; une aridité accrue – et donc une augmentation de la fréquence et de l'intensité des incendies – peut avoir amené un développement des savanes[110]. Cependant, cela s'accorde mal avec les données provenant d'Amérique du Nord[101]. Il est possible que le signal déclencheur ait été entièrement biologique, induit par l'évolution accélérée des herbes due aux feux (et aux éléphants[111] ?) laquelle, en augmentant l'érosion et en fixant davantage de carbone dans les sédiments, aurait réduit les proportions du CO2 atmosphérique[111]. Enfin, il est possible que l'apparition des plantes C4 il y a 8 millions d'années ne soit en fait vraie qu'en Amérique du Nord, d'où proviennent la plupart des fossiles étudiés ; de nouvelles observations suggèrent que les prairies devinrent dominantes en Amérique du Sud au moins 15 millions d'années plus tôt.
Métabolites secondaires

Bien que l'on connaisse de nombreux métabolites secondaires fabriqués par les plantes, on est loin de pouvoir mesurer l'étendue de leur production. Ces métabolites sont en général des composés de faible poids moléculaire, bien qu'ayant souvent une structure complexe. Ils interviennent dans des fonctions aussi diverses que les défenses immunitaires, la lutte contre les herbivores, l'attraction des pollinisateurs, la communication entre plantes, le maintien d'associations symbiotiques avec la flore du sol, la fertilisation, etc., et jouent par conséquent un rôle significatif d'un point de vue évolutionnaire. La diversité structurelle et fonctionnelle de ces métabolites dans le royaume végétal est grande ; on estime que des centaines de milliers d'enzymes sont mis en jeu dans leur production, avec 15 à 25 % du génome codant ces enzymes, chaque espèce possédant son lot unique de métabolites secondaires[112]. Nombre de ces métabolites ont une importance médicale considérable pour les humains.
Quelle est la fonction d'une telle quantité de métabolites, dont la production occupe une partie significative du métabolome ? On a fait l'hypothèse que la majorité sert à des défenses immunitaires, et que leur diversité est la conséquence de la guerre permanente entre les plantes et leurs parasites ; il y a des indices de ce que cela doit être vrai dans beaucoup de cas, mais le coût reproductif pour maintenir cet impressionnant inventaire semble élevé. Divers modèles explorant cet aspect de la question ont été suggérés, mais le consensus sur l'importance de ce coût n'est pas atteint[113] ; on ne sait pas estimer l'avantage qu'aurait une plante ayant plus de métabolites secondaires que ses voisines.
La production de métabolites secondaires semble être apparue très tôt durant l'évolution ; même les bactéries possèdent la capacité de les fabriquer. Mais leur rôle est devenu plus important à partir des champignons, et surtout chez les plantes, où ils semblent s'être diversifiés en utilisant différents mécanismes, comme la duplication de gènes et l'évolution de gènes nouveaux ; de plus, des études ont montré que la diversité de certains de ces métabolites a subi une sélection positive.
Bien qu'on ne puisse nier le rôle de ces grands changements génétiques, on connait plusieurs exemples où de nouveaux métabolites ont été formés par de petites variations des réactions les produisant. Par exemple, on a suggéré que les hétérosides cyanogénétiques avaient évolué à plusieurs reprises dans des lignées assez éloignées. On connait de nombreux exemples analogues d'évolution convergente ; ainsi, on sait désormais que les enzymes synthétisant le limonène – un terpène – sont plus semblables entre les angiospermes et les gymnospermes qu'avec ceux synthétisant d'autres terpènes chez les mêmes plantes, ce qui suggère une évolution indépendante des chemins de la biosynthèse du limonène dans ces deux lignées[114].
Mécanismes et participants à l'évolution des formes

Bien que les facteurs environnementaux jouent un rôle significatif dans les changements évolutifs, ce ne sont que des agents de la sélection naturelle. Le changement est produit en fait par des évènements au niveau génétique : mutations, réarrangements chromosomiques et modifications épigénétiques. Ces types généraux existent dans tout le monde vivant, mais chez les plantes, des mécanismes plus spécialisés ont pris une place significative.
La polyploïdie se produit très fréquemment chez les plantes : on pense qu'au moins la moitié des plantes (et peut-être toutes) sont ou ont été polyploïdes. La polyploïdie amène à un dédoublement du génome, créant une redondance fonctionnelle de la plupart des gènes. Les gènes dupliqués peuvent prendre en charge de nouvelles fonctions, soit par changement du mode d'expression, soit par changement d'activité. La duplication des gènes est considérée comme l'un des plus importants facteurs de l'évolution des plantes, mais on ne sait pas pourquoi elle apparaît si souvent dans le monde végétal ; une explication est peut-être que la production abondante de métabolites secondaires par les cellules des plantes peut interférer avec le mécanisme normal de ségrégation des gènes, menant à la polyploïdie.
Récemment, on a montré que les plantes possédaient des familles significatives de microARN, que l'on retrouve à travers de nombreuses lignées. Le nombre de ces familles est plus petit que dans le cas des animaux, mais chaque famille est beaucoup plus étendue, et les gènes miRNA sont beaucoup plus dispersés dans tout le génome que ceux des animaux. Il a été suggéré que ces familles se sont développées par duplications de régions chromosomiques[115]. Beaucoup de ces gènes miRNA participent à la régulation du développement des plantes, et varient peu entre les espèces qui ont été étudiées.
La domestication de plantes comme le maïs, le riz, l'orge, le blé, etc. a joué également un rôle significatif dans leur évolution. Des études sur l'origine du maïs ont montré qu'il a été dérivé par domestication d'une plante sauvage du Mexique, la téosinte. Celle-ci, tout comme le maïs, appartient au genre Zea, mais n'a qu'une très petite inflorescence, porte 5 à 10 épis durs, et possède une tige très étalée et ramifiée.

Les croisements entre certaines variétés de téosinte et le maïs ont des descendants fertiles dont le phénotype est intermédiaire. L'analyse QTL a également déterminé certains emplacements des gènes du maïs dont la mutation provoque une tige ou des épis semblables à ceux de la téosinte. L'analyse de ces gènes (par horloge moléculaire) fait remonter leur apparition à 9 000 ans, ce qui s'accorde bien avec d'autres données connues sur la domestication du maïs, sans doute sélectionné par un petit groupe de fermiers mexicains à cette époque à partir d'un mutant naturel de la téosinte, et soumis ensuite à une sélection continuelle pour arriver à la plante actuelle[116].
Un autre exemple intéressant est celui du chou-fleur. Le chou-fleur comestible est une version domestiquée de la plante sauvage Brassica oleracea, qui ne possède pas la dense inflorescence indifférenciée du chou-fleur. Celui-ci en diffère par une seule mutation d'un gène appelé CAL, qui contrôle la différenciation du méristème amenant à l'inflorescence. Cette mutation amène les cellules du méristème floral à perdre leur identité, et à former un amas de cellules indifférenciées au lieu d'une fleur[117]. Cette mutation a été sélectionnée par la domestication au moins depuis la Grèce antique.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Evolutionary history of plants » (voir la liste des auteurs).
Notes
- Un examen minutieux des spores des algues a montré qu'aucune ne présente cette marque, soit parce que leurs parois ne sont pas assez résistantes, soit parce que les spores sont dispersées par l'eau avant d'avoir pu développer la marque ou même de former une tétrade.
- Par exemple les Zostérophyllophytes (en)
- Ce que font encore certaines plantes modernes, comme les plantes succulentes
- Pour plus de détails, on pourra consulter l'article Défense des plantes contre les herbivores.
- Mais cette estimation est remise en question ; voir l'article Prototaxites pour plus de détails
- Des racines ont été retrouvées à 68 mètres de profondeur ; voir Profondeurs atteintes pour plus de détails
- On trouvera plus de détails dans l'article anglais sur la dormance des graines
- Pour plus de détails, voir l'article anglais sur la Terre à effet de serre
- Voir Classification des gnétophytes
- En fait, Archaefructus ne portait probablement pas de vraies fleurs : voir (en) Friis, E.M., Doyle, J.A., Endress, P.K. et Leng, Q., « Archaefructus--angiosperm precursor or specialized early angiosperm? », Trends in Plant Science, vol. 8, no 8, , p. 369–373 (PMID 12927969, DOI 10.1016/S1360-1385(03)00161-4)
- Quand la proportion d'oxygène atmosphérique dépasse 35 %, la propagation des feux ne peut plus être stoppée. De nombreux modèles qui prédisaient des valeurs plus élevées ont dû être révisés pour cette raison, puisqu'une extinction totale de la vie végétale ne s'est jamais produite.
Références
- (en) Jaume Pellicer et al, « Genome Size Diversity and Its Impact on the Evolution of Land Plants », Genes, vol. 9, no 2, , p. 88 (DOI 10.3390/genes9020088).
- (en) McFadden, G., Gilson, P., Hofmann, C., Adcock, G. and Maier, U, « Evidence that an Amoeba Acquired a Chloroplast by Retaining Part of an Engulfed Eukaryotic Alga », PNAS, vol. 91, , p. 3690-3694 (lire en ligne)
- (en) L. Battison, M. Brasier, 2009 : Exceptional Preservation of Early Terrestrial Communities in Lacustrine Phosphate One Billion Years Ago, dans Smith, Martin, etc. International Conference on the Cambrian Explosion (ISBN 978-0-9812885-1-2). Résumé en ligne.
- (en) P. Knauth et J. Kennedy, « The late Precambrian greening of the Earth », Nature, 460 (7256) : pp. 728–732, 2009
- (en) Battistuzzi, F. U.; Feijao, A.; Hedges, S. B. (2004). "A genomic timescale of prokaryote evolution: insights into the origin of methanogenesis, phototrophy, and the colonization of land" (pdf en ligne), BMC Evolutionary Biology, 4: 44. doi:10.1186/1471-2148-4-44
- (en) Raven, J.A. et Edwards, D., « Roots : evolutionary origins and biogeochemical significance », Journal of Experimental Botany, vol. 52, no 90001, , p. 381–401 (PMID 11326045, DOI 10.1093/jexbot/52.suppl_1.381, lire en ligne)
- S. Blair Hedges, Jaime E. Blair, Maria L. Venturi et Jason L. Shoe, « A molecular timescale of eukaryote evolution and the rise of complex multicellular life », BMC Evolutionary Biology, vol. 4, no 1, , p. 2 (PMID 15005799, PMCID PMC341452, DOI 10.1186/1471-2148-4-2, lire en ligne, consulté le )
- D. S. Heckman, D. M. Geiser, B. R. Eidell et R. L. Stauffer, « Molecular evidence for the early colonization of land by fungi and plants », Science (revue), vol. 293, no 5532, , p. 1129–1133 (PMID 11498589, DOI 10.1126/science.1061457, lire en ligne, consulté le )
- (en) P. Kenrick, P.R. Crane (1997), The origin and early diversification of land plants. A cladistic study. Smithsonian Institution Press, Washington & London, Washington, Smithsonian Inst. Press, , 441 p. (ISBN 1-56098-729-4, lire en ligne)
- (en) Heckman; Geiser, D. M.; Eidell, B.R.; Stauffer, R. L.; Kardos, N. L; Hedges, S. B. "Molecular evidence for the early colonization of land by fungi and plants" (abstract). Science 293 (5532): 1129–1133. (2001)
- (en) Gray, J., W. G. Chaloner et T. S. Westoll, « The Microfossil Record of Early Land Plants : Advances in Understanding of Early Terrestrialization, 1970-1984 (abstract) », Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences (1934-1990), vol. 309, no 1138, , p. 167–195 (DOI 10.1098/rstb.1985.0077, JSTOR 2396358, lire en ligne)
- (en) Wellman, H.; Gray, J. (Jun 2000). "The microfossil record of early land plants". Philosophical Transactions: Biological Sciences 355 (1398): 717–732.
- (en) Rubinstein, C. V.; Gerrienne, P.; De La Puente, G. S.; Astini, R. A.; Steemans, P. (2010). "Early Middle Ordovician evidence for land plants in Argentina (eastern Gondwana)" (abstract). New Phytologist 188 (2): 365–369.
- (en) Wellman, C. H.; Osterloff, P. L.; Mohiuddin, U. "Fragments of the earliest land plants". Nature 425 (6955): 282
- (en) Steemans, P.; Lepot, K.; Marshall, C. P.; Le Hérissé, A.; Javaux, E. J. . "FTIR characterisation of the chemical composition of Silurian miospores (cryptospores and trilete spores) from Gotland, Sweden". Review of Palaeobotany and Palynology 162: 577 (2010)
- (en) Kump, L. R.; Pavlov, A.; Arthur, M. A. "Massive release of hydrogen sulfide to the surface ocean and atmosphere during intervals of oceanic anoxia" (abstract). Geology 33 (5): 397. (2005)
- (en) Butterfield, N. J. "Oxygen, animals and oceanic ventilation: an alternative view" (abstract). Geobiology 7 (1): 1–7(Jan 2009)
- (en) Steemans, P.; Hérissé, L.; Melvin, J.; Miller, A.; Paris, F.; Verniers, J.; Wellman, H. (Apr 2009). "Origin and Radiation of the Earliest Vascular Land Plants" (abstract). Science 324 (5925): 353–353.
- (en) Tomescu, A. M. F.; Rothwell, G. W. . "Wetlands before tracheophytes: Thalloid terrestrial communities of the Early Silurian Passage Creek biota (Virginia)" (texte intégral en pdf), dans Wetlands Through Time (2006)
- (en) Scott, C.; Glasspool, J. . "The diversification of Paleozoic fire systems and fluctuations in atmospheric oxygen concentration", PNAS, 103(29): 10861–10865. (2006).
- (en) Stewart, W.N. and Rothwell, G.W. 1993. Paleobotany and the evolution of plants, 2e éd., Cambridge University Press, Cambridge, (ISBN 0-521-38294-7)
- (en) Boyce, C. K., « How green was Cooksonia? The importance of size in understanding the early evolution of physiology in the vascular plant lineage », Paleobiology, vol. 34, , p. 179-194 (DOI 10.1666/0094-8373(2008)034[0179:HGWCTI]2.0.CO;2, lire en ligne)
- (en) Kerp, H., Trewin, N. H. & Hass, H., New gametophytes from the Early Devonian Rhynie chert, vol. 94, , chap. 4, p. 411–428
- (en) Taylor, T. N., Kerp, H. & Hass, H., Life history biology of early land plants : deciphering the gametophyte phase, vol. 102, (PMID 15809414, DOI 10.1073/pnas.0501985102, lire en ligne), chap. 16, p. 5892–5897
- (en) Sperry, J. S. « Evolution of Water Transport and Xylem Structure », International Journal of Plant Sciences, 164(3): S115–S127. doi:10.1086/368398.
- Gérard Cobut, Comprendre l'évolution : 150 ans après Darwin, De Boeck Supérieur, (lire en ligne), p. 31
- (en) Niklas, K. J. (1985). "The Evolution of Tracheid Diameter in Early Vascular Plants and Its Implications on the Hydraulic Conductance of the Primary Xylem Strand", Evolution, 39(5): 1110–1122 (1985) ; JSTOR 2408738
- (en) Niklas, K. J.; Smocovitis, V. (1983). "Evidence for a Conducting Strand in Early Silurian (Llandoverian) Plants: Implications for the Evolution of the Land Plants" (première page). Paleobiology 9 (2): 126–137. (JSTOR 2400461)
- (en) Niklas, K. ; Pratt, L. « Evidence for lignin-like constituents in Early Silurian (Llandoverian) plant fossils », Science, 1980, 209(4454): 396–397.
- (en) Qiu, Y.L., Li, L., Wang, B., Chen, Z., Knoop, V., Groth-malonek, M., Dombrovska, O., Lee, J., Kent, L., Rest, J. et al., The deepest divergences in land plants inferred from phylogenomic evidence, vol. 103, (PMID 17030812, lire en ligne), chap. 42, p. 15511–15516
- (en) Stewart, W.N.; Rothwell, G.W., Paleobiology and the evolution of plants, Cambridge University Press, , p. 521pp
- (en) Paul Kenrick, « Palaeontology : Turning over a new leaf », Nature, vol. 410, , p. 309-310 (DOI 10.1038/35066649)
- (en) Peret R. Crane et Paul Kenrick, « Diverted development of reproductive organs : A source of morphological innovation in land plants », Plant System. And Evol., vol. 206, no 1, , p. 161–174 (DOI 10.1007/BF00987946)
- (en) P. Piazza et al., Evolution of leaf developmental mechanisms, vol. 167, (PMID 16101907, DOI 10.1111/j.1469-8137.2005.01466.x), chap. 3, p. 693–710
- (en) D. Beerling et al., Evolution of leaf-form in land plants linked to atmospheric CO2 decline in the Late Palaeozoic era, vol. 410, (lire en ligne), chap. 6826, p. 352–354
- (en) A perspective on the CO2 theory of early leaf evolution, analyse en ligne de cet article.
- (en) Rickards, R.B., « The age of the earliest club mosses : the Silurian Baragwanathia flora in Victoria, Australia », Geological Magazine, vol. 137, no 2, , p. 207–209 (DOI 10.1017/S0016756800003800, lire en ligne [abstract])
- (en) Kaplan, D.R., « The Science of Plant Morphology : Definition, History, and Role in Modern Biology », American Journal of Botany, vol. 88, no 10, , p. 1711–1741 (DOI 10.2307/3558347, JSTOR 3558347)
- (en) Taylor, T.N. et Hass, H.; Kerp, H.; Krings, M.; Hanlin, R.T., Perithecial ascomycetes from the 400 million year old Rhynie chert : an example of ancestral polymorphism, vol. 97, , abstract (PMID 16389979, DOI 10.3852/mycologia.97.1.269, lire en ligne), chap. 1, p. 269–285
- (en) C. K. Boyce et A. H. Knoll, « Evolution of developmental potential and the multiple independent origins of leaves in Paleozoic vascular plants », Paleobiology, vol. 28, , p. 70–100 (DOI 10.1666/0094-8373(2002)028<0070:EODPAT>2.0.CO;2)
- (en) Hao, S. et Beck, C.B.; Deming, W., « Structure of the Earliest Leaves : Adaptations to High Concentrations of Atmospheric CO2 », International Journal of Plant Sciences, vol. 164, , p. 71–75 (DOI 10.1086/344557)
- (en) Berner, R.A. et Kothavala, Z., « Geocarb III : A Revised Model of Atmospheric CO2 over Phanerozoic Time », American Journal of Science, vol. 301, (DOI 10.2475/ajs.301.2.182, lire en ligne [abstract])
- (en) Beerling, D.J. et Osborne, C.P.; Chaloner, W.G., « Evolution of leaf-form in land plants linked to atmospheric CO2 decline in the Late Palaeozoic era », Nature, vol. 410, no 6826, , p. 287–394 (PMID 11268207, DOI 10.1038/35066546)
- (en) Shellito, C.J. et Sloan, L.C., « Reconstructing a lost Eocene paradise : Part I. Simulating the change in global floral distribution at the initial Eocene thermal maximum », Global and Planetary Change, vol. 50, nos 1-2, , p. 1–17 (DOI 10.1016/j.gloplacha.2005.08.001, lire en ligne)
- (en) Aerts, R., « The advantages of being evergreen », Trends in Ecology & Evolution, vol. 10, no 10, , p. 402–407 (DOI 10.1016/S0169-5347(00)89156-9)
- (en) C. C. Labandeira, D. L. Dilcher, D. R. Davis et D. L. Wagner, « Ninety-seven million years of angiosperm-insect association : paleobiological insights into the meaning of coevolution », PNAS, vol. 91, no 25, , p. 12278–12282 (PMID 11607501, DOI 10.1073/pnas.91.25.12278)
- Les feuilles d'ombre montrent une plus grande surface foliaire spécifique, où elles sont plus minces et moins enroulées que les feuilles ensoleillées. Cf. (en) G. G. McMillen & J. H. McClendon, « Dependence of photosynthetic rates on leaf density thickness in deciduous woody plants grown in sun and shade », Plant Physiology, no 72, , p. 674-678.
- Des plantes soumises à des températures élevées (milieu désertique, bois méditerranéen associés généralement à une forte radiation solaire) ont généralement des feuilles au limbe plus découpé afin de favoriser leur refroidissement par convection thermique et à la taille réduite afin d'affaiblir leur surchauffe, ce qui permet en plus un renforcement mécanique de la feuille exposée à la fanaison (Cf. (en) D. M. Gates, « Energy Exchange and Transpiration », Ecological Studies, vol. 19, , p. 137-147). Ce processus pourrait expliquer que le changement climatique actuel se traduit par des dentelures foliaires plus profondes (Cf. (en) D.J. Peppe et al, « Sensitivity of leaf size and shape to climate: global patterns and paleoclimatic applications », New Phytol., vol. 190, no 3, , p. 724-739).
- Les feuilles des arbres de grande taille sont relativement plus petites et plus flexibles pour ne pas être déchirées ou arrachées par les vents. Cf. (en) S. Vogel, « Leaves in the lowest and highest winds: temperature, force and shape », New Phytol., vol. 183, no 1, , p. 13-26 (DOI 10.1111/j.1469-8137.2009.02854.x).
- (en) Brown V, et al., Herbivory and the Evolution of Leaf Size and Shape, vol. 333, Royal Society, (DOI 10.1098/rstb.1991.0076), chap. 1267, p. 265–272
- (en) Harrison C. J. et al., « Independent recruitment of a conserved developmental mechanism during leaf evolution », Nature, vol. 434, no 7032, , p. 509–514 (PMID 15791256, DOI 10.1038/nature03410)
- (en) Jackson D., Hake S., « Control of Phyllotaxy in Maize by the ABPHYL1 Gene », Development, vol. 126, no 2, , p. 315–323 (PMID 9847245)
- (en) Cronk Q., « Plant evolution and development in a post-genomic context », Nature Reviews Genetics, vol. 2, , p. 607–619 (lire en ligne)
- (en) Tattersall et al., L Turner, MR Knox, MJ Ambrose, TH Ellis et JM Hofer, « The Mutant crispa Reveals Multiple Roles for PHANTASTICA in Pea Compound Leaf Development », Plant Cell, vol. 17, no 4, , p. 1046–1060 (PMID 15749758, DOI 10.1105/tpc.104.029447, lire en ligne)
- (en) Bharathan et Sinha et NR Sinha, « The Regulation of Compound Leaf Development », Plant Physiology, vol. 127, , p. 1533–1538 (PMID 11743098, lire en ligne)
- (en) Nath U et al., « Genetic Control of Surface Curvature », Science, vol. 299, no 5611, , p. 1404–1407 (PMID 12610308, DOI 10.1126/science.1079354)
- (en) Boyce, K.C., Hotton, C.L., Fogel, M.L., Cody, G.D., Hazen, R.M., Knoll, A.H. et Hueber, F.M., « Devonian landscape heterogeneity recorded by a giant fungus », Geology, vol. 35, no 5, , p. 399–402 (DOI 10.1130/G23384A.1, lire en ligne [PDF])
- (en) Stein, W.E. et Mannolini, F.; Hernick, L.V.; Landing, E.; Berry, C.M., « Giant cladoxylopsid trees resolve the enigma of the Earth's earliest forest stumps at Gilboa. », Nature, vol. 446, no 7138, , p. 904-907 (PMID 17443185, DOI 10.1038/nature05705)
- (en) Retallack, G.J. et Catt, J.A.; Chaloner, W.G., « Fossil Soils as Grounds for Interpreting the Advent of Large Plants and Animals on Land [and Discussion] », Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences, vol. 309, no 1138, , p. 105–142 (DOI 10.1098/rstb.1985.0074, JSTOR 2396355)
- (en) Dannenhoffer, J.M. et Bonamo, P.M., « Rellimia thomsonii from the Givetian of New York: Secondary Growth in Three Orders of Branching », American Journal of Botany, vol. 76, no 9, , p. 1312–1325 (DOI 10.2307/2444557, JSTOR 2444557)
- Davis, P; Kenrick, P., Fossil Plants, Smithsonian Books, Washington D.C., (ISBN 1-58834-156-9)
- (en) Donoghue, M.J., « Key innovations, convergence, and success : macroevolutionary lessons from plant phylogeny », Paleobiology, vol. 31, , p. 77–93 (DOI 10.1666/0094-8373(2005)031[0077:KICASM]2.0.CO;2, lire en ligne [abstract])
- (en) Bowe, L.M. et Coat, G., « Phylogeny of seed plants based on all three genomic compartments : Extant gymnosperms are monophyletic and Gnetales' closest relatives are conifers », PNAS, vol. 97, no 8, (DOI 10.1073/pnas.97.8.4092)
- (en) Chaw, S.M., Parkinson, C.L., Cheng, Y., Vincent, T.M. et Palmer, J.D., « Seed plant phylogeny inferred from all three plant genomes : Monophyly of extant gymnosperms and origin of Gnetales from conifers », PNAS, vol. 97, no 8, (DOI 10.1073/pnas.97.8.4086)
- (en) Soltis, D.E., Soltis, P.S. et Zanis, M.J., « Phylogeny of seed plants based on evidence from eight genes », American Journal of Botany, vol. 89, (DOI 10.3732/ajb.89.10.1670, lire en ligne [abstract], consulté le )
- (en) Friis, E.M. et Pedersen, K.R.; Crane, P.R., « Cretaceous angiosperm flowers : Innovation and evolution in plant reproduction », Palaeogeography, Palaeoclimatology, Palaeoecology, vol. 232, , p. 251–293 (DOI 10.1016/j.palaeo.2005.07.006)
- (en) Hilton, J. et Bateman, R.M., « Pteridosperms are the backbone of seed-plant phylogeny », The Journal of the Torrey Botanical Society, vol. 133, , p. 119–168 (DOI 10.3159/1095-5674(2006)133[119:PATBOS]2.0.CO;2)
- (en) Bateman, R.M., Hilton, J. et Rudall, P.J., « Morphological and molecular phylogenetic context of the angiosperms : contrasting the 'top-down' and 'bottom-up' approaches used to infer the likely characteristics of the first flowers », Journal of Experimental Botany, vol. 57, no 13, , p. 3471–503 (PMID 17056677, DOI 10.1093/jxb/erl128)
- (en) Frohlich, M.W. et Chase, M.W., « After a dozen years of progress the origin of angiosperms is still a great mystery. », Nature, vol. 450, no 7173, , p. 1184–1189 (PMID 18097399, DOI 10.1038/nature06393)
- Abderrazak Marouf et Joël Reynaud, La botanique de A à Z : 1 662 définitions, Dunod, , p. 18.
- (en) Mora, C.I., Driese, S.G. et Colarusso, L.A., « Middle to Late Paleozoic Atmospheric CO2 Levels from Soil Carbonate and Organic Matter », Science, vol. 271, no 5252, , p. 1105–1107 (DOI 10.1126/science.271.5252.1105)
- (en) Berner, R.A., « GEOCARB II : A revised model of atmospheric CO2 over Phanerozoic time », American Journal of Science, vol. 294, no 1, , p. 56–91 (DOI 10.2475/ajs.294.1.56)
- (en) Algeo, T.J., Berner, R.A., Maynard, J.B. et Scheckler, S.E., « Late Devonian Oceanic Anoxic Events and Biotic Crises : "Rooted" in the Evolution of Vascular Land Plants? », GSA Today, vol. 5, (lire en ligne)
- (en) Retallack, G. J., Paleosols: their Recognition and Interpretation, Oxford, Blackwell,
- (en) Kenrick, P. et Crane, P.R., « The origin and early evolution of plants on land », Nature, vol. 389, no 6646, (DOI 10.1038/37918)
- (en) Algeo, T.J. et Scheckler, S.E., « Terrestrial-marine teleconnections in the Devonian : links between the evolution of land plants, weathering processes, and marine anoxic events », Philosophical Transactions of the Royal Society B: Biological Sciences, vol. 353, , p. 113–130 (DOI 10.1098/rstb.1998.0195)
- (en) Schüßler, A. et al., « A new fungal phlyum, the Glomeromycota: phylogeny and evolution. », Mycological Research, vol. 105, no 12, (DOI 10.1017/S0953756201005196, lire en ligne)
- (en) Simon, L.; Bousquet, J.; Lévesque, R. C.; Lalonde, M. "Origin and diversification of endomycorrhizal fungi and coincidence with vascular land plants". Nature 363 (6424): 67. (1983)
- (en) Claire P. Humphreys, Peter J. Franks, Mark Rees, Martin I. Bidartondo, Jonathan R. Leake & David J. Beerling, « Mutualistic mycorrhiza-like symbiosis in the most ancient group of land plants », New Phytologist, 154(8): 275. (2010)
- (en) Remy, W.; Taylor, T. N.; Hass, H.; Kerp, H. (1994). "Four Hundred-Million-Year-Old Vesicular Arbuscular Mycorrhizae", PNAS, 91(25): 11841–11843 (1994)
- (en) Brundrett, M. C. "Coevolution of roots and mycorrhizas of land plants", New Phytologist, 154 (2): 275(2002)
- (en) Mapes, G. et Rothwell, G.W.; Haworth, M.T., « Evolution of seed dormancy », Nature, vol. 337, no 6208, , p. 645–646 (DOI 10.1038/337645a0)
- (en) Lawton-Rauh A. et al., « Molecular evolution of flower development », Trends in Ecology And Evolution, vol. 15, , p. 144–149 (lire en ligne)
- Nicolas Sauvion, Paul-André Calatayud, Denis Thiéry, Frédéric Marion-Poll, Interactions insectes-plantes, Éditions Quae, , p. 556.
- (en) Nam, J., CW Depamphilis, H Ma et M Nei, Antiquity and Evolution of the MADS-Box Gene Family Controlling Flower Development in Plants, vol. 20, (PMID 12777513, DOI 10.1093/molbev/msg152, lire en ligne), chap. 9, p. 1435–1447
- (en) Crepet, W. L., « Progress in understanding angiosperm history, success, and relationships : Darwin's abominably "perplexing phenomenon" », PNAS, vol. 97, no 24, , p. 12939–12941 (PMID 11087846, DOI 10.1073/pnas.97.24.12939, lire en ligne)
- (en) Sun, G. et Ji, Q.; Dilcher, D.L.; Zheng, S.; Nixon, K.C.; Wang, X., « Archaefructaceae, a New Basal Angiosperm Family », Science, vol. 296, no 5569, , p. 899–904 (PMID 11988572, DOI 10.1126/science.1069439)
- (en) Wing, S.L. et Boucher, L.D., « Ecological Aspects Of The Cretaceous Flowering Plant Radiation », Annual Reviews in Earth and Planetary Sciences, vol. 26, no 1, , p. 379–421 (DOI 10.1146/annurev.earth.26.1.379)
- (en) Wilson Nichols Stewart & Gar W. Rothwell, Paleobotany and the evolution of plants, 2e éd., Cambridge University Press, 1993, p. 498.
- (en) Feild, T.S. et Arens, N.C.; Doyle, J.A.; Dawson, T.E.; Donoghue, M.J., « Dark and disturbed : a new image of early angiosperm ecology », Paleobiology, vol. 30, no 1, , p. 82–107 (lire en ligne)
- (en) Medarg NG and Yanofsky M, « Function and evolution of the plant MADS-box gene family », Nature Reviews Genetics, vol. 2, , p. 186–195 (lire en ligne)
- (en) Jager et al., A Hassanin, M Manuel, H Le Guyader et J Deutsch, « MADS-Box Genes in Ginkgo biloba and the Evolution of the AGAMOUS Family », Molecular Biology and Evolution, vol. 20, no 5, , p. 842–854 (PMID 12679535, DOI 10.1093/molbev/msg089, lire en ligne)
- (en) Biology: From Arabidopsis Flowers to Grass Inflorescence Architecture. Beth E. Thompson* and Sarah Hake, 2009, Plant Physiology 149:38-45.
- http://www.inra.fr/genomique/SIA2001/MUTANTS/Agamous/agamous.html
- (en) Kitahara K et Matsumoto S., « Rose MADS-box genes ‘MASAKO C1 and D1’ homologous to class C floral identity genes », Plant Science, vol. 151, no 2, , p. 121–134 (PMID 10808068, DOI 10.1016/S0168-9452(99)00206-X, lire en ligne)
- (en) Kater M et al., « Multiple AGAMOUS Homologs from Cucumber and Petunia Differ in Their Ability to Induce Reproductive Organ Fate », Plant Cell, vol. 10, no 2, , p. 171–182 (PMID 9490741, DOI 10.1105/tpc.10.2.171, lire en ligne)
- (en) Soltis D et al., « Floral genome : an evolutionary history of gene duplication and shifting patterns of gene expression », Trends in Plant Science, vol. 12, no 8, , p. 358–367 (lire en ligne)
- (en) Putterhill et al., « It's time to flower : the genetic control of flowering time », BioEssays, vol. 26, , p. 353–363 (lire en ligne)
- (en) Blazquez et al., M Koornneef et J Putterill, « Flowering on time : genes that regulate the floral transition », EMBO Reports, vol. 2, no 12, , p. 1078–1082 (PMID 11743019, DOI 10.1093/embo-reports/kve254, lire en ligne)
- (en) Lawton-Rauh A. et al., « The Mostly Male Theory of Flower Evolutionary Origins : from Genes to Fossils », Systematic Botany, American Society of Plant Taxonomists, vol. 25, no 2, , p. 155–170 (DOI 10.2307/2666635, JSTOR 2666635)
- (en) Osborne, C.P. et Beerling, D.J., « Review. Nature's green revolution : the remarkable evolutionary rise of C4 plants », Philosophical Transactions: Biological Sciences, vol. 361, , p. 173–194 (PMID 16553316, DOI 10.1098/rstb.2005.1737, lire en ligne)
- (en) Retallack, G. J. « Neogene Expansion of the North American Prairie »., PALAIOS, 1997, 12(4): 380–390.
- (en) Thomasson, J.R., Nelson, M.E. et Zakrzewski, R.J., « A Fossil Grass (Gramineae : Chloridoideae) from the Miocene with Kranz Anatomy », Science, vol. 233, , p. 876–878 (PMID 17752216, DOI 10.1126/science.233.4766.876)
- (en) Marion O'Leary, « Carbon Isotopes in Photosynthesis », BioScience, vol. 38, , p. 328–336 (DOI 10.2307/1310735, JSTOR 1310735)
- Osborne, P.; Freckleton, P. "Ecological selection pressures for C4 photosynthesis in the grasses". Proceedings. Biological sciences / the Royal Society 276 (1663): 1753. (2009)
- (en) Bond, W.J., Woodward, F.I. et Midgley, G.F., « The global distribution of ecosystems in a world without fire », New Phytologist, vol. 165, , p. 525–538 (PMID 15720663, DOI 10.1111/j.1469-8137.2004.01252.x)
- (en) Pagani, M., Zachos, J.C., Freeman, K.H., Tipple, B. et Bohaty, S., « Marked Decline in Atmospheric Carbon Dioxide Concentrations During the Paleogene », Science, vol. 309, no 5734, , p. 600–603 (PMID 15961630, DOI 10.1126/science.1110063)
- (en) Piperno, D.R. et Sues, H.D., « Dinosaurs Dined on Grass », Science, vol. 310, no 5751, , p. 1126–1128 (PMID 16293745, DOI 10.1126/science.1121020)
- (en) Prasad, V., Stroemberg, C.A.E., Alimohammadian, H. et Sahni, A., « Dinosaur Coprolites and the Early Evolution of Grasses and Grazers », Science, vol. 310, no 5751, , p. 1177–1180 (PMID 16293759, DOI 10.1126/science.1118806)
- (en) Keeley, J.E. et Rundel, P.W., « Fire and the Miocene expansion of C4 grasslands », Ecology Letters, vol. 8, , p. 683–690 (DOI 10.1111/j.1461-0248.2005.00767.x)
- (en) Retallack, G.J., « Cenozoic Expansion of Grasslands and Climatic Cooling », The Journal of Geology, vol. 109, no 4, , p. 407–426 (DOI 10.1086/320791, Bibcode 2001JG....109..407R)
- (en) Pichersky E. et Gang D., « Genetics and biochemistry of secondary metabolites in plants : an evolutionary perspective », Trends in Plant Science, vol. 5, , p. 439–445 (lire en ligne)
- (en) Nina Theis et Manuel Lerdau, « The evolution of function in plant secondary metabolites », International Journal of Plant Sciences, vol. 164, , S93–S102 (lire en ligne)
- (en) Bohlmann J. et al., « Plant terpenoid syntheses : molecular and phylogenetic analysis », PNAS, vol. 95, no 8, , p. 4126–4133 (PMID 9539701, DOI 10.1073/pnas.95.8.4126, lire en ligne)
- (en) Li A et Mao L., « Evolution of plant microRNA gene families », Cell Research, vol. 17, no 3, , p. 212–218 (PMID 17130846, DOI 10.1038/sj.cr.7310113)
- (en) Doebley J.F., « The genetics of maize evolution », Annual Review og Genetics, vol. 38, no 1, , p. 37–59 (PMID 15568971, DOI 10.1146/annurev.genet.38.072902.092425, lire en ligne)
- (en) Purugannan et al., AL Boyles et JI Suddith, « Variation and Selection at the Cauliflower Floral Homeotic Gene Accompanying the Evolution of Domesticated Brassica olerace », Genetics, vol. 155, , p. 855–862 (PMID 10835404)
Annexes
Bibliographie
- (en) Wilson Nichols Stewart, Gar W. Rothwell, Paleobotany and the Evolution of Plants, Cambridge University Press, , 521 p. (lire en ligne)
- (en) David Briggs et Stuart Max Walters, Plant Variation and Evolution, Cambridge University Press, , 512 p. (lire en ligne)
- (en) Carole T. Gee, Plants in Mesozoic Time. Morphological Innovations, Phylogeny, Ecosystems, Indiana University Press, , 424 p. (lire en ligne)
- (en) Karl J. Niklas, Plant Evolution : An Introduction to the History of Life, University of Chicago Press, , 536 p. (lire en ligne)
- Marcel Bournérias et Christian Bock, Le génie des végétaux. Des conquérants fragiles, Humensis, (lire en ligne), p. 211-235
- Jean-Marie Pelt, L’évolution vue par un botaniste, Fayard, (ISBN 9782213655420)
Articles connexes
- Paléobotanique
- Galerie de Paléobotanique du Muséum national d'histoire naturelle de Paris
- Paléovégétation
- Coévolution des herbivores et des plantes
- Génétique évolutive du développement des plantes
- Glossaire de botanique
- Stefano Mancuso
- Domestication des plantes
- Portail origine et évolution du vivant
- Portail de la botanique


