Histoire génétique des populations européennes
L’Histoire génétique des populations européennes débute au Paléolithique supérieur avec l'arrivée en Europe il y a 45 000 ans des hommes modernes[2] venus d'Afrique via le Moyen-Orient.
Avec le dernier maximum glaciaire, un effet fondateur se produit, et provoque une augmentation de la pression sélective qui permet à une lignée de prendre de l'ampleur au Mésolithique. Ce premier groupe est appelé chasseurs-cueilleurs ouest-européen (West Hunter Gatherers ou WHG). La révolution néolithique voit l’arrivée d'un second groupe, des agriculteurs (Early European farmers ou EEF) venus de l’ouest de l’Anatolie. Puis, au cours de l'âge du bronze, parviennent en Europe les Yamnayas (Western Steppe Herders ou WSH) originaires des steppes pontiques. Cette population est notamment associée à l’expansion des langues indo-européennes.
La plupart des Européens modernes descendent de ces trois populations anciennes en des proportions différentes : la part de fermiers anatoliens (EEF) est plus importante en Europe du Sud, et l’ascendance chasseur-cueilleur de l’ouest (WHG) et Yamnayas (WSH) domine génétiquement l'Europe du Nord et du Nord-Est.
Les recherches sur la génétique des populations ont débuté à partir de la seconde moitié du XXe siècle, notamment avec les premières publications de Luigi Luca Cavalli-Sforza en 1964, mais le premier génome humain ne fut entièrement séquencé qu'en 2004. L’étude du génome des individus anciens devint plus accessible à partir des années 2010 grâce à l'équipe de Svante Pääbo, et accélère considérablement depuis 2014. Ainsi, les données connues aujourd’hui sont récentes et évoluent au fil des nouvelles études.
Paléolithique
La préhistoire des peuples européens peut être retracée par l’étude des sites archéologiques, de la linguistique et de l’ADN des européens modernes ou des génomes anciens.
Néandertal et l'Homme moderne

- en Europe
- au Moyen-Orient
- en Asie centrale
- dans l'Altaï
Les Néandertaliens ont occupé une grande partie de l’Europe et de l’Asie de l’ouest il y a au moins 130 000 ans, l’individu le plus ancien retrouvé en Europe ayant 430 000 ans. Ils y ont prospéré jusqu’à il y a environ 30 000 ans. Les hommes modernes quant à eux arrivèrent d'Afrique, via le Moyen-Orient, en Europe il y a environ 45 000 ans. La transition entre le Paléolithique moyen et le Paléolithique supérieur en Europe se caractérise donc par le remplacement ou l’absorption partielle de l'homme de Néandertal par l'homme moderne.
Étant donné que les deux hominidés ont cohabité pendant un certain laps de temps, les anthropologues se sont longtemps demandés comment ils avaient pu interagir. Cette question fut résolue seulement en 2010, quand il fut démontré que les populations eurasiennes possédaient une moyenne d’1,5-2,1 % d’ADN néandertaliens (1,8 à 2, 4 % pour les Européens et 2,3-2,6 % pour les Asiatiques de l’est)[3].
En effet, des découvertes réalisées par Svante Pääbo (Société Max-Planck pour le développement des sciences), Richard E. Green (Université de Californie) et David Reich (Harvard Medical School) en comparant le matériel génétique de trois néandertaliens avec ceux de cinq hommes modernes, ont démontré un lien entre l’homme de Néandertal et les populations modernes non-africaines.
Par ailleurs, une étude de 2017 suggère que l’ADN néandertal au sein des anciens Européens ne serait pas issu des populations néandertaliennes présentes en Europe au même moment[4]. L’introgression entre Néandertal et l’homme moderne aurait plutôt eu lieu au Proche-Orient il y a environ 60 000 ans avant l’arrivée de l’homme moderne en Europe[5].
Il y a pu avoir toutefois des mélanges sporadiques entre les deux espèces en Europe comme c’est le cas avec l’individu Oase 1 daté entre 42 000–37 000 ans retrouvé en Roumanie[6]. Cependant, l’individu n’étant pas plus étroitement apparenté aux Européens qu’aux Asiatiques de l’est, on peut en déduire que la population à laquelle il appartenait est restée sans descendance.
Du fait de la sélection naturelle, le pourcentage d’ADN néandertalien des anciens Européens a chuté progressivement à travers le temps. De 45 000 à 7 000 ans de notre ère, ce pourcentage est passé de 6 à 3 % en moyenne à 2 %[7].
Paléolithique supérieur
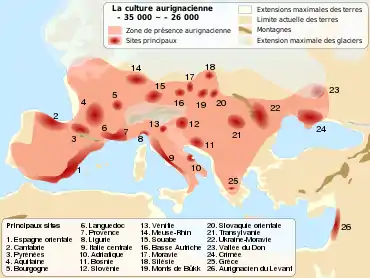
Les premiers hommes modernes venus d'Afrique via le Moyen-Orient ont commencé à s’installer en Europe pendant le Paléolithique supérieur, il y a environ 45 000 ans. Les plus anciens restes en Europe ont été retrouvés pour le moment en Bulgarie dans la grotte de Bacho Kiro, et datés par leur ADN mitochondrial entre 44 830 et 42 616 ans de notre ère[8].
Les plus anciens individus séquencés en Europe-Eurasie de l’ouest, sont Ust-Ishim (Sibérie) daté de 45 000 ans et Oase1 (Roumanie) autour de 40 000 ans. Ces deux individus faisaient probablement parties des populations pionnières dans cette zone mais n’ont pas contribué au génome des populations européennes modernes. Il y a 39 000 ans, un supervolcan situé près de Naples (Italie) a projeté une nappe de cendre sur l’Europe. Cet évènement a pu provoquer un long hiver durant plusieurs années et exacerbé la compétition entre humains modernes et néandertaliens. L’archéologie a montré qu’après cette couche, aucun outil néandertalien n’a plus été retrouvé et la plupart des lignées humaines semblent s’être éteintes. Il est donc probable qu’il y ait eu plusieurs vagues d’arrivées d’humains modernes en Europe[9].
À la suite de l’éruption volcanique, la culture aurignacienne s’étend en Europe et s’impose sur tout le continent.

Les cultures paléolithiques avant le dernier maximum glaciaire se caractérisent par des outillages, et des représentations symboliques particulièrement remarquables. Par exemple les peintures pariétales de la grotte Chauvet correspondent à la culture aurignacienne ou encore les « Vénus » paléolithiques sont liées au Gravettien.
Par ailleurs, « les données archéologiques et biomécaniques indiquent que les populations du Paléolithique supérieur ancien étaient mobiles et dispersées de l’Europe méditerranéenne jusqu’aux plaines russes. Les correspondances entre les composantes technologiques, symboliques et stylistiques de leurs cultures suggèrent que ces chasseurs-cueilleurs étaient capables de maintenir des contacts intergroupes et une continuité biologique sur de vastes territoires. Cela mène à considérer l’existence de réseaux d’échange, et d’un haut niveau de flux génétiques, entre des populations très distantes »[10].
Plusieurs haplogroupes semblent présents en Europe depuis le Paléolithique : Pour les lignées patrilinéaires du chromosome Y : L’haplogroupe C1a2, L’haplogroupe I (M170), l’haplogroupe R1 (M173). Pour les lignées matriliénaires de l’ADNmt : Martin Richards et al. ont établi que 15 à 40 % des lignées mitochondriales toujours existantes/actuelles telles U5, HV, I, U4, et H remontaient aux populations paléolithiques.
Dernier maximum glaciaire
Le dernier maximum glaciaire (DMG) a été atteint il y a environ 20 000 ans. La période de glaciation a commencé il y a environ 30 000 ans, menant à une dépopulation de l’Europe du Nord. Selon un modèle qui a prévalu pendant longtemps, les populations auraient migré vers des refuges climatiques[11] :
- l’Ibérie du nord et le sud-ouest de la France qui forment ensemble le refuge « franco-cantabre » ;
- les Balkans ;
- l’Ukraine et plus généralement la côte nord de la mer noire ;
- l’Italie.
Cependant, d'après des études plus récentes, le refroidissement climatique, particulièrement difficile autour de 25 000 ans (période du Gravettien tardif), aurait provoqué l’extinction de 60 % des individus à travers l’Europe, à l’exception des zones les plus au sud comme le Portugal qui sont restées assez stables. Ce phénomène a réduit ainsi l’ensemble de la diversité génétique en Europe. Par exemple, on constate à cette période la disparition définitive de l’haplogroupe mitochondrial M alors qu’il est présent dans les populations d’Asie de l’est actuelles. Selon Andreas Maier et Andreas Zimmerman de l'université de Cologne, il est toutefois possible que certains individus des zones plus au nord se soient aussi dispersés plus largement en Europe centrale[12].
Toutefois, la période ne peut se résumer uniquement à ces refuges. D’après une étude de 2015, les zones d’habitation à cette période y compris au plus fort du DMG n’étaient pas fragmentées et couvraient 36 % de l’Europe. La limite nord se situait globalement au niveau du centre de la France, du sud de l’Allemagne, de l’Ukraine et de la partie européenne de la Russie. Les zones ibériques et méditerranéennes furent néanmoins les lieux les plus favorables pour les chasseurs-cueilleurs[13]. L’Europe s’est repeuplée doucement à partir de 19 000 ans avec la fonte des glaciers.
Pendant longtemps il a été difficile de se représenter clairement les dynamiques des populations pendant cette période glaciaire car seuls quatre individus avaient été étudiés. Une étude de 2016 menée par le laboratoire de David Reich et portant sur 51 individus a permis d’apporter quelques éclaircissements.

D'une part, il a été déterminé que tous les individus anciens, datés entre 37 000 ans et 14 000 ans en Europe, descendaient d’une unique population ancestrale génétiquement isolée (c’est-à-dire qu’elle ne s’est pas croisée avec d’autres populations hors Europe).
Deux populations principales semblent avoir cohabitées avant le DMG et pendant :
- Les individus de la lignée de l’individu Goyet Q116-1 en Belgique (35 000 ans) liés à la culture aurignacienne et magdalénienne. On les retrouve en Belgique, Allemagne, France et Espagne. Goyet Q116-1 est l’un des plus anciens individus de la population ancestrale européenne. Il se relie à la culture aurignacienne (43 000–29 000 ans). Puis sa lignée se retrouve 15 000 ans plus tard, après le DGM, dans le cluster d’El Miron (19 000–14 000 ans) qui correspond aux chasseurs-cueilleurs magdaléniens. On constate donc ici une continuité génétique sur les deux versants du DMG. Il est possible que les individus de la lignée de Goyet 116-1 se soient réfugiés dans le sud-ouest de l’Europe avec le refroidissement climatique.
- Les individus liés à la culture gravettienne se rassemblant dans le cluster de Vestonice. Ces derniers sont proches de Kostenki14 (Russie - 37 000 ans), Buran Kaya III (Crimée – entre 36 000 et 35 000 ans) et l’individu Sunghir3 (Russie 34 000 ans et 33 000 ans)[14],[15].On a retrouvé des individus en République tchèque, Belgique, Autriche, Italie. Malgré leur grande dispersion géographique, ils étaient très proches génétiquement. Depuis l’Europe orientale, ils semblent s’être propagés à l’ouest, repoussant la lignée aurignacienne y compris à Goyet en Belgique.
Tous les individus analysés à partir de 37 000 ans (comme Kostenki14 en Sibérie et Goyet Q116-1 en Belgique) partagent une ancestralité avec les Européens actuels[7].
Il y a au moins 14 000 ans, un changement génétique important s’opère en Europe. En effet, à partir de cette date, tous les individus d'Europe montrent une affinité génétique avec le Proche-Orient. Une migration importante a donc lieu à cette époque en Europe en provenance d'un refuge Sud-Est européen (Grèce, Bulgarie, Balkans), ou Ouest asiatique (Anatolie). Ces individus vont se regrouper génétiquement dans le cluster de Villabruna en Italie (14 000–7 000 ans). Pour le moment il n’a pas été déterminé précisément de quelles populations ces flux de gènes provenaient, l’étude des chasseurs-cueilleurs des Portes de Fer peut néanmoins donner un début d’explication[16].
Mésolithique

On distingue 3 populations importantes de chasseurs-cueilleurs du Mésolithique en Europe :
- Les chasseurs-cueilleurs ouest-européens (West Hunter-gatherers - WHG)
- Les chasseurs-cueilleurs est-européens (East Hunter-gatherers - EHG)
- Les chasseurs-cueilleurs scandinaves (Scandinavian Hunter-gatherers - SHG)
Les chasseurs-cueilleurs ouest-européen (WHG) forment un groupe homogène réparti de l'Atlantique à la Hongrie qui a prospéré pendant 6 000 ans. Ils se caractérisent par une ascendance associée à la lignée du cluster de Ripari Villabruna (en) (Italie). Ce cluster comprend des individus comme Villabruna dans le Nord-Est de l'Italie, daté de 14 000 ans, Loschbour au Luxembourg, Bichon en Suisse, ou encore Oriente C en Sicile[17] et a remplacé une bonne partie des lignées gravettiennes et magdaléniennes en Europe.
Les chasseurs-cueilleurs de la péninsule Ibérique semblent toutefois issus d’un mélange génétique entre des individus de la lignée du cluster de Villabruna et des individus magdaléniens du cluster d’El Mirón[17]. Un tel mélange a été également retrouvé dans des chasseurs-cueilleurs mésolithiques de Charente en France, montrant que l’ascendance magdalénienne a également survécu hors de la péninsule Ibérique pendant le Mésolithique[18]. Les deuc chasseurs-cueilleurs retrouvés en Irlande montre que cette île était à part du reste du continent à cette période bien que liée aux chasseurs cueilleurs de l’ouest et plus spécifiquement ceux d’Italie. Les chasseurs-cueilleurs de Grande-Bretagne, comme « Cheddar man » en revanche se regroupent parfaitement avec ceux du continent ce qui plaide pour l’existence du « Doggerland », région aujourd’hui sous la mer qui rattachait à l’époque la Grande-Bretagne au continent[19]. À ce stade de la recherche, le génome de ces individus indiquent une tendance à arborer une peau sombre et des yeux clairs[20].

Les chasseurs-cueilleurs de l’est (EHG) ont été retrouvés en Russie de l’Oural à la mer Baltique. Plusieurs individus ont été séquencés en Russie : quatre en Carélie (Nord-ouest du pays près de la Finlande) datant de 7 500 à 5 000 avant notre ère, et deux à Samara, dans les steppes près de l’Oural, entre 9 400 et 5 500 avant notre ère[22]. Ces chasseurs-cueilleurs sont affiliés à 70 % aux Nord-Eurasiens primitifs (Ancien North Eurasian dits ANE), chasseur-cueilleur de Sibérie du Paléolithique lié à la lignée du garçon de Mal’ta retrouvé près du lac Baïkal. Les EHG sont notamment porteurs des technologies proprement sibériennes de la poterie et des microlames. Étant situés génétiquement entre les ANE et les WHG, plusieurs hypothèses ont émergé sur leurs origines, notamment que cette population soit le fruit d’un mélange entre les deux populations ou d’individus affiliés à ces deux groupes[23].
À partir de 7 000 ans avant notre ère, on observe une frontière entre les réseaux EHG et WHG dans une zone de mélange génétique entre les deux depuis l’ouest de la Baltique, jusqu’à la Roumanie et l’Ukraine dans la vallée du Dniepr. En effet les cimetières mésolithiques et néolithiques de la vallée du Dniepr contiennent des individus à dominance EHG mais avec une part d'ascendance WHG[24].
Le peuplement de l’Europe du Nord (Scandinavie, Est de la Baltique) n’est advenu qu’après la fonte des glaciers vers 9 000 ans avant notre ère[25]. Les chasseurs-cueilleurs scandinaves (SHG) sont issus d’un mélange génétique entre chasseurs cueilleurs de l’ouest (WHG) et chasseurs cueilleurs de l’est (EHG). Les premiers sont arrivés du sud vers 9 500 avant notre ère, tandis que les seconds sont arrivés de l’est vers 8500 avant notre ère[26].
Des chasseurs-cueilleurs retrouvés en Lituanie, Lettonie ou encore Estonie se recoupent avec les cultures de Kunda pour les plus anciens et de Narva pour les autres. Ils sont proches des WHG et des EHG mais ne semblent pas provenir directement de ces deux groupes, ce qui suggère l’existence d’une méta-population qui n’a pas encore été étudiée[27]. Ces chasseurs-cueilleurs se nourrissaient surtout grâce aux ressources marines et vivaient donc dans des implantations plus permanentes que les autres populations de chasseurs-cueilleurs[25].
Enfin, concernant l’ascendance en provenance du Moyen-Orient qui caractérise les WHG (cluster de Villabruna), les chasseurs-cueilleurs des Portes de Fer (9500 à 5500 avant notre ère) au niveau des actuelles Roumanie et Serbie, peuvent donner un début d’explication. Ces chasseurs-cueilleurs se caractérisent par une ascendance essentiellement liée au WGH (87 %) et aux EHG dans une moindre proportion (13 %), ce qui suggère un mélange entre les deux populations. Cependant, les études ont démontré que ces chasseurs-cueilleurs possèdent également une ascendance chasseur- cueilleur d’Anatolie. Plusieurs hypothèses tentent d’expliquer ce lien : soit un flux de gènes bidirectionnel entre les populations d’Europe du Sud-Est et l’Anatolie de l’ouest il y a plus de 15 000 ans à la fin de l’ère glaciaire ou une dispersion d’une population ancestrale des chasseurs-cueilleurs du sud-est de l’Europe au Moyen-Orient. Cette population ancestrale du sud-est de l’Europe se serait ensuite répandue en Europe centrale, résultant dans l’émergence des chasseurs-cueilleurs de l’ouest après le dernier maximum glaciaire[28],[29].
Néolithique
En Europe, la transition néolithique est caractérisée par une période d'innovations qui fait passer les différentes communautés d'un mode de vie nomade basé sur la chasse et la cueillette en un mode de vie plus sédentaire fondé sur la production alimentaire et la domestication de plantes et d’animaux tels que le blé, l’orge, le seigle, les petits pois, les vaches, les porcs et les moutons. Ce processus, initié dans le Croissant fertile entre 12 900 et 11 700 ans de notre ère, arrive en Anatolie de l’ouest, il y a environ 8 700 ans, avant de se diffuser peu après en Crète et en Grèce, atteignant les Balkans centraux il y a 8 200 ans avant de se répandre dans l’ensemble de l’Europe.
Cette transition s'est effectuée par l'arrivée en Europe d’une nouvelle population qui forme un groupe homogène : des agriculteurs venus d’Anatolie du nord-ouest qui vont constituer en Europe le groupe des fermiers européens du néolithique. Ils vont introduire notamment les haplogroupes G2a et H2[18].
Composition génétique des premiers agriculteurs européens
Cette population de fermiers située originellement dans l’ouest de l’Anatolie (Barcin) descendent directement des chasseurs-cueilleurs d’Anatolie, dont le plus ancien individu séquencé est le chasseur-cueilleur anatolien de Pınarbaşı au sud de l’Anatolie vieux de plus de 15 000 ans. Ce chasseur-cueilleur est génétiquement affilié à 52 % aux WHG et à 48 % aux chasseurs-cueilleurs natoufiens du Levant (qui y vivaient il y a environ 14 000 ans)[30]. Ces derniers étaient chasseurs-cueilleurs mais n’étaient paradoxalement pas nomades. Ce sont les premiers humains à avoir laissé des traces d’habitations durables et des vestiges de grandes structures de pierre et domestiquaient déjà activement les plantes sauvages[9]. Pour le moment les études n’ont pas pu déterminer où vivaient les ancêtres des Natoufiens.
L’agriculture commence à se développer en Anatolie à la période appelée « Néolithique précéramique ou acéramique A » autour de 10 000 à 8 500 ans. Les fermiers anatoliens de cette période dits acéramiques ont une ascendance à 90 % issue des chasseurs-cueilleurs d’Anatolie avec un léger apport d’ascendance du Caucase et d’Iran. Les individus de la période suivante, les « fermiers céramiques d’Anatolie » (autour de 6500 avant notre ère) sont directement issus des fermiers acéramiques d’Anatolie avec un petit apport (21 %) de populations du Levant[29].
Ces résultats montrent la continuité génétique en Anatolie. On peut en conclure que l’agriculture s’est développée dans cette zone par l’adoption de ces nouvelles technologies par les populations locales et non par un changement biologique massif. Aussi, cette population de fermiers anatoliens partie en Europe ne se regroupe pas avec les populations du Proche-orient actuel mais tend clairement vers l’Europe, formant un cluster avec les fermiers européens d’Allemagne, d’Hongrie et d’Espagne[31].
Arrivée de la vague néolithique en Europe

Arrivant en Europe, cette vague néolithique donnera naissance aux cultures de Starčevo, de Vinča dans les Balkans et de Cucuteni – Trypillia entre les Carpates (actuelle Roumanie, Moldavie) et le Dniepr (actuelle Ukraine).
À partir des Balkans, les fermiers anatoliens ont emprunté deux routes distinctes :
- une route par le Danube associée à l’expansion de la culture rubanée ou linéaire. Par cette route, ils sont parvenus jusqu’aux plaines d’Europe centrale, et à partir d’elle jusqu’en Scandinavie. On la retrouve également au nord de la France ;
- une route longeant la Méditerranée jusqu’à la côte atlantique de la péninsule Ibérique et associée à la culture de la céramique imprimée (Albanie, Italie du sud, Sicile, Dalmatie, Ligurie, Languedoc) et à la Céramique cardiale en Espagne et au sud de la France[32].
Schématiquement, les fermiers de l’est du Rhin sont liés au groupe qui a pris la route du Danube, tandis que les fermiers à l’ouest du Rhin sont plus proches des fermiers ayant longé la côte méditerranéenne. Il semble que les groupes de fermiers d’Angleterre, d’Écosse et du Pays de Galles soient également liés au groupe de fermiers néolithiques ayant longé la Méditerranée par l’intermédiaire des fermiers de la côte atlantique, mais aussi des fermiers de nombreuses régions de France (Normandie, région parisienne et Sud de la France).
Les études génétiques ont démontré que ces nouveaux agriculteurs avaient cohabité avec les chasseurs-cueilleurs européens pendant environ 2 000 ans sans mélange significatif, les deux groupes pouvant parfois côtoyer les mêmes lieux tout en gardant chacun leur mode de vie et leur propre diète[33]. Les femelles et mâles agriculteurs ayant migré dans des ratios équilibrés, on peut émettre l'hypothèse de familles entières arrivées ensemble en Europe[34].
.jpg.webp)
Peu à peu, entre 6 000 et 4 500 avant notre ère, l’ascendance chasseur-cueilleur augmente progressivement chez les fermiers, signe d'un mélange génétique entre les deux populations. Les agriculteurs voient leur ascendance de chasseurs-cueilleurs augmenter de 20 % par rapport à leurs prédécesseurs. En revanche, il ne semble pas qu’il y ait eu d’introgression significative des fermiers au sein des lignées chasseurs-cueilleurs. On peut émettre l’hypothèse, à l’aune de l’ethnographie moderne, que dans certaines circonstances des femmes chasseurs-cueilleurs pouvaient aller vivre chez les fermiers, plus rarement pour les hommes, et que les femmes des fermiers n’allaient pas vivre chez les chasseurs-cueilleurs car cela pouvait être considéré comme une rétrogradation sociale[33]. Un individu représentatif de cette population des premiers agriculteurs européens est Ötzi, l’homme des glaces, retrouvé dans les Alpes, 56 % de son génome appartenant à la population des chasseurs-cueilleurs et 44 % aux fermiers anatoliens[34].
En France, l’ascendance chasseur-cueilleur dans les populations d’agriculteurs est plus élevée qu’ailleurs et commence très précocement dès le début du Néolithique dans le sud de la France comme en témoigne les sites de Pendimoun et Les Bréguières. Ces chasseurs-cueilleurs sont des WHG et, pour certains individus comme les Néolithiques de Prissé-la-Charrière et du Bassin parisien, des Magdaléniens. Cela montre que les fermiers néolithiques se sont bien mélangés avec des populations locales[35]. Les Européens d’Allemagne, Espagne, Hongrie et Suède du Néolithique moyen (4 000–3 000 ans avant notre ère) sont situés génétiquement entre les premiers fermiers européens et les chasseurs-cueilleurs ouest-européens[36]. Par exemple, les individus de la fin du néolithique (culture de Wartberg – 3 500-2 800 av. J.-C.) retrouvés dans un site mégalithique à Niedertiefenbach en Allemagne, ont en moyenne 60 % d'ascendance fermier d'Anatolie et 40 % d'ascendance chasseur-cueilleur ouest-européen[37].
L’expansion néolithique atteint la Scandinavie du sud 4 000 ans avant notre ère avec les fermiers de la culture des vases à entonnoir[25]. Toutefois, à partir de 3 500 ans avant notre ère, la culture de la céramique perforée se répand dans le sud de la Scandinavie principalement sur les côtes de Svealand, Götaland, Åland, le Danemark du nord-est et le sud de la Norvège. Cette nouvelle culture est liée à une population majoritairement issue des chasseurs-cueilleurs scandinaves du Mésolithique avec un léger flux de gênes issu des fermiers néolithiques[38].
L’Europe du Nord sur le côté oriental de la Baltique et l’Ukraine n’a pas connu un mélange immédiat avec les fermiers néolithiques puisqu’on retrouve des spécimens de chasseurs-cueilleurs sans trace des premiers fermiers européens jusqu’au milieu du Néolithique. Par ailleurs, l’agriculture n’a pas été adoptée dans ces régions avant la fin du Néolithique et la fin de l'âge du bronze ce qui est cohérent avec ces résultats[27]. Dans les pays baltes, on note au Néolithique une forte augmentation de la proportion de chasseurs-cueilleurs de l'Est correspondant aux individus de la culture de la céramique au peigne[28]. Pourtant l’élevage se développe quand même, et on a retrouvé en Lituanie un burin sculpté à partir d’une chèvre ou d’un mouton domestiqué. Ainsi, soit l’agriculture s’est développée sans présence des fermiers anatoliens ou par des relations entre les chasseurs-cueilleurs baltes et des communautés de fermiers[27].
En Ukraine, on constate également une continuité génétique entre le Mésolithique et le Néolithique, sans trace génétique de fermiers anatoliens[27].
Concernant la Grèce, quatre individus du Péloponnèse ne sont pas issus de la migration des agriculteurs d’Anatolie mais plutôt d’une migration différente, peut-être maritime, depuis la côte du Levant ou du Sud de l'Anatolie d’une population comprenant une plus forte ascendance iranienne que les agriculteurs anatoliens[28].

Globalement, la venue de cette nouvelle population a eu pour conséquence une intensification de l’agriculture, des changements de la poterie, et de la technologie lithique, ainsi que l’érection de mégalithes partout en Europe comme Stonehenge en Angleterre ou encore la construction de métropoles comme celle de Maydanets en Ukraine[39]. Selon l’archéologue Marija Gimbutas, leurs rituels plaçaient les femmes au centre de la scène[9].
Au cours du Néolithique, on verra l’émergence de nombreuses cultures liées à ces populations telles que la culture des gobelets à entonnoir, à amphores globulaires, la culture de Baden, la culture de Grossgartach dans l’est de la France, ou encore la culture de Michelsberg dans le nord de la France.
Âge du bronze

La transition entre le Néolithique final et l'âge du bronze au 3e millénaire avant notre ère est le témoin d'un changement majeur de population et de société en Europe occidentale. Elle inclut notamment une contribution génétique massive des pasteurs des steppes pontiques, les Yamnayas, dans la population locale. Ils sont les porteurs des haplogroupes R1a et R1b qui sont aujourd’hui majoritaires en Europe. Ils sont également les locuteurs d’une langue « indo-européenne » qui donnera la majorité des langues d’Europe.
Cette migration de la population Yamnaya a été deux fois plus rapide que celle des fermiers anatoliens, probablement car elle maîtrisait la technologie de la roue, la domestication du cheval et se déplaçait avec des chars[40].
Composition génétique des Yamnayas
Ces pasteurs sont affiliés à la culture Yamna dont on a retrouvé les représentants dans la région de la Volga en Russie. Cette population est globalement issue d’un mélange de chasseurs-cueilleurs de l’est (EHG) et de chasseurs cueilleurs du Caucase (CHG). Elle comporte également une ascendance liée aux fermiers anatoliens allant de 10 à 18 %.
En effet, la région de la Volga (Samara) est entièrement habitée au Mésolithique par des chasseurs cueilleurs de l’est (EHG), puis une composante caucasienne apparaît à l'époque énéolithique (5200-5400 avant notre ère), représentant autour de 20 %, pour croître progressivement et se stabiliser autour de 47 % à l’âge du bronze. La culture de Khvalynsk (Russie, région de la Volga) pourrait constituer le socle sur lequel se développera la culture Yamna[24]. De fait, trois individus de cette culture, séquencés datant de 4 500 ans avant notre ère sont composés d'un mélange d'ascendances chasseurs-cueilleurs de l’est (EHG) et chasseurs-cueilleurs du Caucase (entre 20 et 30 %) sans aucune trace d'ascendance liée aux fermiers d'Anatolie.
Pour ce qui est de la composante caucasienne, le réseau initial des chasseurs-cueilleurs du Caucase (CHG) se trouvait dans les montagnes du Caucase, à l'est de l'Anatolie et à l'ouest du plateau Iranien. Les chasseurs-cueilleurs retrouvés sur le territoire de l’actuelle Géorgie ont des affinités génétiques avec les populations d’Arménie et d’Iran anciens et actuels. Deux individus ont été séquencés en 2015, l’un venant de la grotte de Satsurblia (daté de 13 300 ans au Paléolithique supérieur), l'autre dans la grotte de Kotias (d’environ 9 700 ans ce qui correspond au milieu du Mésolithique). Il en ressort une continuité génétique du Caucase entre le Paléolithique et le Mésolithique. Les ancêtres de cette population semblent avoir divergé de ceux des chasseurs-cueilleurs ouest-européens il y a 45 000 ans et des ancêtres des fermiers anatoliens il y a 25 000 ans[41].
Au début de l'âge du bronze, le Caucase était en contact avec les steppes notamment via la culture de Maïkop qui a émergé dans la première moitié du quatrième millénaire avant notre ère. Cette culture aurait donc pu contribuer à la formation de la culture Yamna en lui apportant l'ascendance chasseur-cueilleur du Caucase (CHG). En effet, cette civilisation était fortement influencée par des éléments de la Civilisation d'Uruk (Mésopotamie), ce qui pourrait indiquer des mouvements de population et des échanges. Les Yamnayas auraient hérité ainsi de la technologie des chariots, mais également de celle des kourganes[9]. Cependant, cette hypothèse a été remise en cause par une étude de 2018 de Chuan-Chao Wang : elle suggère que l'origine de l'ascendance liée aux fermiers d’Anatolie dans la culture Yamna viendrait directement d'Europe car elle inclut 20 % d'ascendance WHG. Cela suppose par élimination une ascendance caucasienne peu mélangée avec les fermiers d’Anatolie, ce qui ne correspond pas aux individus de la culture de Maïkop qui comportent entre 30 et 40 % d’ascendance fermiers d’Anatolie. Selon ce modèle, la culture de Maïkop n'aurait donc pas contribué génétiquement à la formation de la culture Yamna. Ce serait une population plus ancienne et encore non-déterminée qui serait entrée dans les steppes depuis le nord-ouest de l'Iran et l'Azerbaïdjan au moins 5 000 ans avant notre ère[42],[24].
Arrivée des Yamnayas en Europe

L’expansion de la population Yamnaya en Europe se traduit par l’extension de la céramique cordée. La culture de la céramique cordée s’est étendue du nord-est de la Russie à la Suisse ou la Belgique à la fin du néolithique à partir de 2 900 avant notre ère. Cette culture est peut-être née de la rencontre des Yamnayas et des cultures à céramiques des régions baltiques : en effet les plus anciens sites relié à la culture cordée sont ceux de Kujavia et Malopolska en Pologne (2 880 ans avant notre ère) et peut-être le site letton de Zvejnieki où l’on a retrouvé un individu LN1 d’ascendance entièrement yamnaya[27]. Cette nouvelle culture s’est également étendue en Russie occidentale par la culture de Fatianovo, qui lui est similaire.
Les publications de paléogénétique consacrées à la culture de la céramique cordée indiquent un paradoxe notable : alors que les sépultures de la céramique cordée, en particulier celles datant de 2900 à 2700 av. J.-C., affichent toujours un degré élevé d'ascendance steppique (avec quelques-unes près de 100 %), seule une faible fraction d'entre elles ont jusqu'à présent le chromosome Y typique de Yamnaya, l'haplogroupe d'ADN R1b-Z2103. La majorité des chromosomes Y sont du type R1a distinct (presque tous de M417 et Z282), tandis que R1b est également représenté, mais avec L51 et U106[43].
En Bohême, la découverte d'ascendance de type du nord-est de l'Europe au début de la céramique cordée (CC), en conjonction avec l'absence de partage du chromosome Y entre les premiers mâles de la CC et des populations Yamna, suggère un rôle limité ou indirect des Yamnas connus dans l'origine et la propagation de la CC en Europe centrale. Ces résultats signifieraient une contribution des steppes forestières énéolithiques du nord-est de l'Europe au début de la CC, ou, scénario moins probable, que la diffusion de la CC dans cette région serait liée à une population de steppes jusqu'ici (2021) non échantillonnée[44]. Cette première hypothèse est partagée par le paléogénéticien Volker Heyd pour qui la signature génétiques des premières populations de la céramique cordée correspond le mieux aux populations des régions de steppe forestière immédiatement à l'est des Carpates, entre les rivières Prut/Dniestr et Dniepr[43] Les profils génétiques très divers (à la fois nucléaire et chromosomique Y) des premiers CC suggèrent une organisation sociale différente de ceux des derniers CC et des populations de la culture campaniforme, dont le motif chromosomique Y est révélateur d'une patrilinéarité stricte[44].
La culture de la céramique cordée introduit dans la région l'élevage et l'agriculture dans les steppes boisées. Aussi, la venue des Yamnayas s’est accompagnée d’une baisse des forêts et d'une augmentation des prairies et des pâturages en Europe[40]. Le système de valeur est en rupture brutale avec celui des sociétés néolithiques : l’inhumation individuelle sous tertre prend le dessus sur l’inhumation collective, apparition de stèles anthropomorphes, la figure du guerrier est très valorisée (massues, haches et marteaux retrouvés dans les tombes).
Deux hypothèses expliquent l'implantation de cette population sur ce continent déjà largement occupé. Une hypothèse mentionnée par David Reich serait que les terres exploitables n’étaient pas toutes occupées puisque les champs des agriculteurs étaient souvent entourés de forêts vierges ; il est probable que les pasteurs aient détruit des forêts et remodelé des lieux pour favoriser certaines activités. L'autre hypothèse se fonde sur la propagation des maladies. Dans une étude de 2015, Simon Rassmussen a analysé plusieurs échantillons d’individus d'Europe et des zones steppiques. Il y a retrouvé de l’ADN de Yersinia pestis, bactérie responsable de la peste noire. La population steppique aurait donc pu être immunisée contre la peste et la transmettre aux agriculteurs d’Europe[45].
Ainsi, au moment de leur arrivée, les pasteurs yamnayas ont remplacé quasiment au trois-quarts les populations présentes en Europe centrale[23]. Des études portant sur le centre de l’Allemagne ont suggéré que cette nouvelle génétique avait remplacé environ 75 % du substrat génétique local laissant 25 % d’ascendance néolithique[25]. Au Danemark, l’arrivée des Yamnayas marque le passage à la culture locale des tombes individuelles qui se mêle à des traditions héritées de la culture néolithique des vases à entonnoir, et se caractérise en particulier par la manière dont sont disposés les corps selon le sexe (sur le côté droit pour les hommes et gauche pour les femmes). Ces individus se regroupent génétiquement avec les populations de la culture de la céramique cordée[46].
Plus au nord en Scandinavie, l’arrivée des Yamnayas vers 2800 ans av. J.-C. donne naissance à la culture des haches de combat qui va cohabiter dans un premier temps avec la culture de la céramique perforée. Ainsi, des individus liés au groupe de la culture de la céramique perforée, qui se regroupent génétiquement avec les chasseurs-cueilleurs scandinaves du Mésolithique, vont être enterrés peu à peu avec les caractéristiques de la culture des haches de combat montrant ici une influence culturelle[38]. Dans d’autres régions, l’introgression entre les deux populations semble plus équilibrée avec une persistance du génome des fermiers européens. Cela semble être le cas en France avec les individus de Ciry-Salsogne près de Soissons (datés de 2 500 ans av. J.-C.). Ces derniers possèdent l’haplogroupe R1b et leur ascendance steppique oscille entre 23,6 et 42,1 % pour trois individus analysés[47].
À une époque similaire, se propage également en Europe de l’Ouest la culture campaniforme (entre 2 700 et 1 800 av. J.-C. en Europe de l’Ouest), avec des sites retrouvés sur les îles Britanniques, en Allemagne, en République tchèque, et du Sud de l’Espagne aux Pays-Bas. La plus ancienne poterie campaniforme datant de 2 750 avant notre ère ayant été trouvée en Espagne, on a longtemps pensé que cette culture avait émergé à partir de la péninsule Ibérique. Les études génétiques ont montré que cette culture s’était diffusée à la fois par mouvement de populations mais aussi par simple influence culturelle. La culture campaniforme est produite dans un premier temps par un mouvement des Yamnayas vers l’ouest de l’Europe et de leur rencontre avec les cultures agricoles qui y sont présentes.
Ainsi, par exemple dans le sud-est de la Pologne, les individus de la culture cordée montrent une forte ascendance Yamnaya, notamment avec un haplogroupe-Y R1b caractéristique des Yamnayas, tandis que ceux de la culture campaniforme se rassemblent plus avec les individus néolithiques[48].
En Grande-Bretagne, à partir de 2 500 ans avant notre ère (chalcolithique), les individus de la culture campaniforme continentale, probablement venus des Pays-Bas, prennent l’ascendance sur les locaux, et remplace 90 % de leur génome aussi bien par les hommes que par les femmes[49]. On peut envisager plusieurs hypothèses à ce remplacement, comme des massacres, des maladies, un manque d’adaptation des locaux à un changement de climat, mais rien ne permet d’affirmer ce qu’il s’est produit.
Dans la péninsule Ibérique, le phénomène est différent puisque la vague de population en provenance des steppes pontiques n’était pas encore arrivée au moment où cette culture s’y diffuse. On peut en déduire que cette culture s’est propagée dans un premier temps par transmission d’idées, avant que la population yamnaya n’atteigne ensuite la péninsule Ibérique[50]. Vers 2 000 av. J.-C., la diversité génétique de la population se stabilise autour d'un mélange d'environ 40 % d'ascendance de fermiers ibériques locaux et 60 % de Yamnayas. Cependant les haplogroupes du chromosome Y qu’on retrouve dans la région au Néolithique et au chalcolithique (I2, G2, H) sont remplacés par un unique lignage R1b-M269 durant l'âge du bronze. Ces résultats suggèrent que les Yamnayas venus de l’est se seraient reproduits avec les femmes locales, éliminant peu à peu les hommes ibères. Là encore, on ne peut encore qu'imaginer ce qu’il s’est produit : hommes locaux tués par les nouveaux arrivants ou écartés, maladies, avantage reproductif des nouveaux venus, etc.
La culture d'Unétice en Europe centrale fait suite à la culture campaniforme et préfigure par beaucoup d’aspect les figures proto-celtiques d’Hallstatt et La Tène (Autriche). Les représentants de la culture d'Unétice sont caractérisés par une ascendance 62 % Yamnaya, 33 % de fermiers anatoliens et 5 % de chasseurs-cueilleurs ouest-européen.
En Grèce, deux grandes cultures archéologiques de l’âge du bronze émergent : les Minoens en Crète et leur culture palatiale, utilisant un alphabet linéaire A non-déchiffré à ce jour, et la culture mycénienne en Grèce continentale écrivant avec l'alphabet linéaire B, langue indo-européenne et forme ancienne du grec. Génétiquement, les Mycéniens sont issus d'un mélange génétique entre une population d'anciens fermiers néolithiques et d’une population reliée à celle des steppes. En revanche, les Minoens n'ont pas d’ascendance steppique, ils sont un mélange des fermiers anatoliens et d’une population provenant d’Iran ou du Caucase. Les données de cette étude montrent d'autre part qu'il n'y a pas d'influence égyptienne ou phénicienne chez les Minoens et les Mycéniens[51].
Âge du fer
Les études génétiques concernant le passage à l’âge du bronze à l’âge du fer sont encore rares. Le fer a commencé à être utilisé en Europe occidentale à partir du VIIIe siècle av. J.-C.
En France, cette période renvoie à l’émergence de la culture celtique et aux Gaulois. L'une des hypothèses pour expliquer l'expansion du fer en France était une migration de population celtique en provenance d'Europe de l'Est si on se réfère à la linguistique et à l'apparition des épées de Hallstat en Gaule. Cependant, les études génétiques semblent privilégier l'hypothèse de changements économiques progressifs associés à une continuité biologique et culturelle des populations locales depuis l'âge du bronze.
La nécropole normande d'Urville-Nacqueville a fait notamment l’objet d’une étude génétique sur 45 individus de l’âge du fer. On y constate une continuité au niveau des lignées féminines entre le Néolithique et l’âge du fer[52]. Cela conforte l'hypothèse d'un maintien génétique des populations locales. Une étude plus récente portant sur plusieurs régions de France a confirmé ceci : l’âge du fer en France ne correspond pas à un flux de gènes en provenance de l’est. Les populations gauloises sont donc probablement directement issues des populations locales de la culture campaniforme qui les précédaient[18],[53]. Toutefois, étant donné la grande homogénéité génétique entre les Européens de l’époque, des mouvements ont pu passer inaperçu.
Par ailleurs, on retrouve également les haplogroupes maternels retrouvés à Urville dans des groupes de l’âge du bronze situés en Grande-Bretagne et dans la péninsule ibérique. Cela appuie l’idée d’échanges culturels continuels, documentés par l’archéologie le long de la côte atlantique et à travers la Manche. Des traces de ces échanges ont été retrouvées dans la Manche à travers des épaves, comme le Dover Boat daté de 1 550 ans av. J.-C.[52].
En Espagne, durant l'âge du fer, les auteurs ont enregistré une augmentation constante d'une ascendance liée à l'Europe du Nord et du Centre, sur la côte méditerranéenne, au sud-ouest sur le site de La Angorilla, et plus particulièrement dans le nord de la Péninsule où était parlé la langue celtibère d'origine indo-européenne. À cette période, on retrouve plusieurs langues non-indo-européennes parlées dans la péninsule, dont le basque est le représentant le plus connu, indiquant que l'arrivée d'une ascendance steppique n'a pas forcément été corrélé avec un changement linguistique[54].
Le génome des Étrusques, peuple d'Italie du centre qui sera l'un des socles de la civilisation romaine, a été étudié et indique que ceux-ci étaient proches génétiquement des Ibériques actuels. Bien que leur langue ne soit pas indo-européenne, leur structure génétique ne varie pas du reste des Européens de l'époque, et les individus étrusques présentent 25 % d'ascendance Yamnaya ou 50 % d'ascendance campaniforme d'Europe centrale[55].
De l'Antiquité au Moyen Âge
Espagne
Sur le site d’Empúries en Catalogne, port fondé par les Grecs phocéens puis occupé par les Romains, 24 individus datés entre l’Antiquité et le VIe siècle apr. J.-C. ont été étudiés. Ils se regroupent en deux clusters : certains individus se rapprochant des individus de l’âge du bronze du pourtour de la mer Égée en Grèce, et d’autres se rapprochant des populations de l'âge du fer de la péninsule Ibérique. Cela corrobore la dimension méditerranéenne de la ville.
Des individus du haut Moyen Âge retrouvés sur le site de L’Esquerda dans le nord-est de l’Espagne partagent une partie de leur ascendance avec les populations actuelles de Grèce et d’Italie, ce qui confirme un flux en provenance de ces pays probablement du fait de la présence romaine durant l'Antiquité. Enfin, les Wisigoths du nord-est de l’Espagne affichent une ascendance d’Europe centrale et du nord[54].
Dans le sud-est de la péninsule Ibérique, le génome de 45 individus a été analysé entre le IIIe et le XVIe siècle apr. J.-C. Tous ces individus diffèrent des populations de l'âge du fer et sont caractérisés par une ascendance nord-africaine et levantine qui pourrait refléter une origine juive. En clair, depuis l'époque romaine ou même depuis la période phénicienne, le sud de la péninsule Ibérique a reçu un flux de gènes important nord-africain, qui s’est poursuivi pendant la période islamique. En comparaison, la population actuelle du sud de la péninsule Ibérique comporte bien moins d'ascendance nord-africaine. Cela s’explique très probablement par l’expulsion des morisques, ainsi que par la repopulation de la région depuis le nord de l’Espagne qui ont suivi la Reconquista[54].
Italie
Plusieurs individus de la région de Rome ont été étudiés sur une période allant du Mésolithique au Haut Moyen Âge. Si les populations des périodes préhistoriques jusqu'à l'âge du bronze montrent une évolution similaire au reste de l'Europe, à l'exception de l'apparition d'une composante présente chez les chasseurs-cueilleurs du Caucase, les périodes suivantes témoignent de changements génétiques importants. À l'époque de la République romaine, on note un léger flux de populations méditerranéennes variées, essentiellement des Grecs, mais la population reste à 72 % similaire à celle d'Europe centrale. Sous l'Empire romain, en revanche, les individus se recoupant avec l'Europe centrale chutent à 4 % de la population étudiée, 24 % se recoupent avec les Grecs, 40 % avec Chypre et Malte, 28 % avec les populations du Moyen-Orient et deux individus avec l'Afrique du nord. À la fin de l'Antiquité, un autre basculement se produit avec le retour d'un glissement génétique vers les populations d'Europe centrale. Enfin, au Haut Moyen Âge, la composante moyen-oriental a totalement disparu au sein des individus étudiés, ces derniers étant génétiquement liés à l'Europe centrale (40 %) et à la Grèce (60 %)[56].
Composantes génétiques des Européens actuels
L’étude de 2014 de Lazaridis et aln a déterminé que les Européens descendaient essentiellement de trois populations ancestrales : les chasseurs-cueilleurs ouest-européens du Paléolithique, les agriculteurs néolithiques et les pasteurs yamnayas[57].
La population des agriculteurs est d'ailleurs la raison pour laquelle les Européens ont moins d’ascendance néandertalienne que les asiatiques de l’est. En effet, les fermiers anatoliens étaient dénués de toute trace néandertalienne dans leur patrimoine génétique car ils provenaient d’une population, non-déterminée pour le moment, qui s’est séparée du groupe sorti d'Afrique avant l’introgression avec des Néandertaliens. En moyenne, la population du sud de l’Europe possède plus d’ascendance fermiers néolithiques et les Européens du nord plus d’ascendance issue des Yamnayas et des chasseurs-cueilleurs ouest-européen[58].
France
L’étude de plusieurs individus de l’âge du fer situés en Normandie, au nord de la France, dans le bassin parisien, en Alsace et en Occitanie, a permis de démontrer une certaine continuité génétique entre les Gaulois de l'âge du fer et les populations françaises actuelles[52],[59].
Par ailleurs une étude de 2007 portant sur les haplogroupes mitochondriaux (donc par la lignée maternelle) avait montré que ceux retrouvés en France différaient peu de ses voisins européens. L'haplogroupe le plus fréquent est H avec près de 45 %, suivi par K (8,74 %), U5 (8,30 %), T (8,52 %), J (7,76 %) et V (4,77 %)[60].
En 2019, une étude a porté sur 395 échantillons de la France métropolitaine. Il en ressort que la France métropolitaine affiche une homogénéité globale, avec peu de différence entre les différents clusters. Globalement la structure génétique de la France suit les deux fleuves, la Loire et la Garonne, entre le nord et le sud, ainsi que dans une moindre proportion, l’Adour entre le sud-ouest et le sud[61].
Elle se partitionne en trois principaux groupes génétiques :
- le groupe basque dans le sud-ouest de la France qui rassemble les populations basquophones de France. Un groupe de la région franco-cantabre non-bascophone (les Gascons par exemple) fait office de pont avec le groupe principal[62]. Le Pays basque se distingue notamment par une prééminence particulière de l’haplogroupe H (ADNmt) atteignant presque 60 % comme la région basque espagnole. En revanche les Basques espagnols différent sur certains haplogroupes notamment au niveau de la fréquence de l’haplogroupe J, marqueur de la période néolithique, plus fréquent chez les Basques français ;
- le groupe corse. Cette population est génétiquement plus proche des Italiens du nord et du centre. Les Corses sont caractérisés par une forte proportion d'ascendance des fermiers européens du néolithique (EEF), comme les Italiens, les Espagnols ou les populations des Balkans. Dans la période qui va de la fin de l’Empire romain aux invasions sarrasines, un flux en provenance d’Italie ou d’Espagne a marqué l’île[63] ;
- le groupe principal rassemble des populations de l'ouest, du nord, du centre, du sud et de l'est. En enlevant les deux groupes suscités, on peut distinguer quelques nuances dans ce cluster principal : ainsi les Bretons se séparent légèrement du reste du groupe. La Bretagne se caractérise par des haplogroupes-Y (lignée paternelle) moins variés que le reste du pays, ce qui suggère un possible effet fondateur dû à un certain isolement. Par ailleurs, cette région montre une grande affinité avec les clusters de Grande-Bretagne et d’Irlande probablement expliquées par les migrations de l’Irlande à la Bretagne survenue au IVe siècle apr. J.-C. ainsi que par l’émigration d’irlandais pendant la guerre d’Irlande (1641-1651) dans le Finistère et les Côtes d’Armor.
Italie
Les Italiens sont caractérisés par une proportion importante d'ascendance de fermiers du néolithique ; de 56 à 72 %. Globalement, la variabilité génétique de la population italienne est plus importante que celle de nombreux pays européens.
Deux individus séquencés correspondant aux campaniformes de l’âge du bronze du nord de l'Italie se regroupent avec les Italiens actuels du nord, signalant donc une continuité génétique dans cette zone depuis l’âge du bronze. Les campaniformes de Sicile, en revanche, ne se recoupent pas exactement avec les Italiens du sud actuels. En effet, on retrouve au sein de ces campaniformes une ascendance fermier d'Iran avec un excès d’ascendance de chasseur cueilleur du Caucase qui ne semble pas provenir des Yamnayas. L’origine de ce flux n’est pour le moment pas déterminée mais pourrait remonter au moins à l'âge du bronze. Enfin, la contribution d'Afrique du nord varie de 3,8 % en Italie du centre-sud à 14,5 % en Italie du sud[64].
Les Italiens se regroupent en trois clusters.
- L'Italie du nord et du centre-nord. Le nord de l’Italie se caractérise par une ascendance fermier néolithique plus marquée que le sud de la péninsule, et également par un apport plus important d’ascendance steppique (33 % contre 6 %).
- L'Italie du sud, du centre-sud et la Sicile.
- La Sardaigne se distingue par une ascendance chasseurs-cueilleurs et Yamnayas la moins élevée d’Europe. Les Sardes descendent essentiellement des fermiers anatoliens arrivés au néolithique, probablement d’Italie centrale.
Espagne
Les Basques d'Espagne actuels correspondent aux populations de l'âge du fer de la péninsule Ibérique, affichant donc également une ascendance issue des Yamnayas bien que leur langue ne soit pas indo-européenne[54].
Grèce
Les Grecs modernes partagent une grande partie de leur ADN avec les Mycéniens de l’âge du bronze. Ils ont légèrement moins d’ascendance provenant des fermiers anatoliens que les Mycéniens, ce qui suggère également des mélanges génétiques plus récents[51].
Royaume-Uni
L'étude d'échantillons issus des alentours de Cambridge a a montré que les individus de l'âge du fer et de la période anglo-saxonne (Ve au IXe siècles apr. J.-C.) se rassemblent avec les Britanniques actuels ce qui suggère une continuité génétique depuis ces périodes. Une légère différence existe toutefois entre les individus de l'âge du fer qui tendent plus vers les Anglais et Français actuels et les individus anglo-saxons qui se rapprochent des Écossais et Norvégiens[65].
Le Royaume-Uni affiche peu de distance génétique entre les différents clusters génétiques. On en distingue cinq principaux :
- les îles Orcades situées au nord de l’Écosse forment le groupe qui se distingue le plus particulièrement. En effet, cette île fut longtemps aux mains des Vikings et fit partie de la Norvège jusqu’en 1472. L’ascendance des habitants est donc en partie norvégienne (autour de 25 %) ;
- le Pays de Galles est le groupe le plus proche des chasseurs-cueilleurs ouest-européens ;
- un ensemble composé de l’Écosse, du nord de l’Irlande et du nord de l’Angleterre. La proximité entre le sud de l’Écosse et le nord de l'Irlande peuvent s’expliquer notamment par les plantations britanniques d’Ulster au XVIIe siècle ;
- la Cornouaille au sud de l’Angleterre ;
- enfin, un grand groupe au centre et sud de l’Angleterre. Ce groupe n’est pas structuré en groupes distincts du fait de mouvement de populations depuis l’Antiquité et l’absence de frontières internes. Ce groupe se caractérise par une ascendance germanique d’environ 35 %, ce qui correspond probablement aux migrations saxonnes.
Il semble que les Vikings danois n’aient pas laissé de traces génétiques significatives en Angleterre malgré l’occupation des terres. Enfin, l’étude ne constate pas que les populations brittoniques du Royaume-Uni formeraient un groupe celtique homogène. Le cluster « Cornouaille » est plus proche du groupe du « Devon » et d'« Angleterre centrale » que des Gallois. De même, le groupe du sud du Pays de Galles et le groupe du nord présentent autant de différences génétiques qu’entre les Anglais du centre et les Écossais[66].
Irlande
La majorité de ces clusters irlandais et britanniques partagent une affinité similaire avec l’individu néolithique retrouvé à Ballynahatty (Irlande du nord). On constate une homogénéité globale de l’Irlande : les différences observées entre les différents clusters irlandais sont encore moins marquées qu’entre les clusters de Grande-Bretagne, même en excluant le cluster des îles d’Orcades.
Globalement, les différents clusters se recoupent avec les quatre provinces irlandaises historiques et suivent donc les anciennes frontières politiques du pays : l’Irlande du Nord (Ulster), le centre de l’Irlande (Connacht, Dublin, Leinster), et le sud de l’Irlande (Munster). Il y a eu peu de mouvement récent en Irlande, au moins jusqu’à la moitié du XIXe siècle. Les Irlandais d’Irlande du nord affichent une ascendance irlandaise du nord, écossaise et anglaise du nord. Enfin, les analyses semblent indiquer un niveau assez conséquent d’ascendance norvégienne en Irlande, qui est aussi présent dans les clusters écossais et de l’archipel des Orcades. Cette correspondance peut provenir du commerce d’esclaves irlandais lors de l’époque viking puisqu’on retrouve aujourd’hui 6,8 % d’ascendance irlandaise dans le Norvège actuelle[67].
Notes et références
- (en) Mari Nelis, Tõnu Esko, Reedik Mägi et Fritz Zimprich, « Correction: Genetic Structure of Europeans: A View from the North–East », PLoS ONE, vol. 5, no 3, (ISSN 1932-6203, PMCID PMC2847460, DOI 10.1371/annotation/2849e182-aef5-4e2b-a5ac-0b74b30e5f48, lire en ligne, consulté le ).
- en anglais : European early modern humans ou EEM.
- (en) Melinda A. Yang et Qiaomei Fu, « Insights into Modern Human Prehistory Using Ancient Genomes », Trends in Genetics, vol. 34, no 3, , p. 184–196 (ISSN 0168-9525, PMID 29395378, DOI 10.1016/j.tig.2017.11.008, lire en ligne, consulté le ).
- (en) Mateja Hajdinjak, Qiaomei Fu, Alexander Hübner et Martin Petr, « Reconstructing the genetic history of late Neanderthals », Nature, vol. 555, no 7698, , p. 652–656 (ISSN 1476-4687, PMID 29562232, PMCID PMC6485383, DOI 10.1038/nature26151, lire en ligne, consulté le ).
- (en) Cosimo Posth, Christoph Wißing, Keiko Kitagawa et Luca Pagani, « Deeply divergent archaic mitochondrial genome provides lower time boundary for African gene flow into Neanderthals », Nature Communications, vol. 8, no 1, , p. 16046 (ISSN 2041-1723, PMID 28675384, PMCID PMC5500885, DOI 10.1038/ncomms16046, lire en ligne, consulté le ).
- (en) Qiaomei Fu, Mateja Hajdinjak, Oana Teodora Moldovan et Silviu Constantin, « An early modern human from Romania with a recent Neanderthal ancestor », Nature, vol. 524, no 7564, , p. 216–219 (ISSN 1476-4687, PMID 26098372, PMCID PMC4537386, DOI 10.1038/nature14558, lire en ligne, consulté le ).
- (en) Qiaomei Fu, Cosimo Posth, Mateja Hajdinjak et Martin Petr, « The genetic history of Ice Age Europe », Nature, vol. 534, no 7606, , p. 200–205 (ISSN 1476-4687, PMID 27135931, PMCID PMC4943878, DOI 10.1038/nature17993, lire en ligne, consulté le ).
- (en) Jean-Jacques Hublin, Nikolay Sirakov, Vera Aldeias et Shara Bailey, « Initial Upper Palaeolithic Homo sapiens from Bacho Kiro Cave, Bulgaria », Nature, vol. 581, no 7808, , p. 299–302 (ISSN 1476-4687, DOI 10.1038/s41586-020-2259-z, lire en ligne, consulté le ).
- David Reich, Comment nous sommes devenus ce que nous sommes, Broché, , 380 p. (ISBN 978-2889153084).
- (en) Vincenzo Formicola, « Resource availability and stature decrease in Upper Palaeolithic Europe », Journal of Anthropological Sciences, (lire en ligne).
- (en) Human ecological niches and ranges during the LGM in Europe derived from an application of eco-cultural niche modeling William E. Banks, Francesco d’Errico, A. Townsend Peterson, Marian Vanhaeren, Masa Kageyama, Pierre Sepulchre, Gilles Ramstein, Anne Jost, Daniel Lunt – 5 janvier 2010 https://halshs.archives-ouvertes.fr/halshs-00444132/document
- (en) Andreas Maier et Andreas Zimmermann, « Populations headed south? The Gravettian from a palaeodemographic point of view », Antiquity, vol. 91, no 357, , p. 573–588 (ISSN 0003-598X et 1745-1744, DOI 10.15184/aqy.2017.37, lire en ligne, consulté le ).
- « Human population dynamics in Europe over the LastGlacial Maximum »Miikka Tallavaara, Miska Luoto, Natalia Korhonen, Heikki Järvinen, and Heikki Seppä – 2015 https://www.pnas.org/content/pnas/112/27/8232.full.pdf
- (en) Martin Sikora, Andaine Seguin-Orlando, Vitor C. Sousa et Anders Albrechtsen, « Ancient genomes show social and reproductive behavior of early Upper Paleolithic foragers », Science, vol. 358, no 6363, , p. 659–662 (ISSN 0036-8075 et 1095-9203, DOI 10.1126/science.aao1807, lire en ligne, consulté le )
- (en) E. Andrew Bennett, Sandrine Prat, Stéphane Péan et Laurent Crépin, « The origin of the Gravettians: genomic evidence from a 36,000-year-old Eastern European », (DOI 10.1101/685404, consulté le ), p. 685404.
- (en) Eugenio Bortolini, Luca Pagani, Gregorio Oxilia et Cosimo Posth, « Early Alpine occupation backdates westward human migration in Late Glacial Europe », Current Biology, vol. 31, no 11, , p. 2484–2493.e7 (DOI 10.1016/j.cub.2021.03.078, lire en ligne, consulté le ).
- (en) Vanessa Villalba-Mouco, Marieke S. van de Loosdrecht, Cosimo Posth et Rafael Mora, « Survival of Late Pleistocene Hunter-Gatherer Ancestry in the Iberian Peninsula », Current Biology, vol. 29, no 7, , p. 1169–1177.e7 (ISSN 0960-9822, PMID 30880015, DOI 10.1016/j.cub.2019.02.006, lire en ligne, consulté le ).
- (en) Samantha Brunel, E. Andrew Bennett, Laurent Cardin et Damien Garraud, « Ancient genomes from present-day France unveil 7,000 years of its demographic history », Proceedings of the National Academy of Sciences, vol. 117, no 23, , p. 12791–12798 (ISSN 0027-8424 et 1091-6490, PMID 32457149, PMCID PMC7293694, DOI 10.1073/pnas.1918034117, lire en ligne, consulté le ).
- (en) Lara M. Cassidy, Ros Ó Maoldúin, Thomas Kador et Ann Lynch, « A dynastic elite in monumental Neolithic society », Nature, vol. 582, no 7812, , p. 384–388 (ISSN 1476-4687, PMID 32555485, PMCID PMC7116870, DOI 10.1038/s41586-020-2378-6, lire en ligne, consulté le ).
- Iñigo Olalde, Morten E. Allentoft, Federico Sánchez-Quinto et Gabriel Santpere, « Derived immune and ancestral pigmentation alleles in a 7,000-year-old Mesolithic European », Nature, vol. 507, no 7491, , p. 225–228 (ISSN 0028-0836 et 1476-4687, DOI 10.1038/nature12960, lire en ligne, consulté le ).
- (en) Fan Zhang, Chao Ning, Ashley Scott et Qiaomei Fu, « The genomic origins of the Bronze Age Tarim Basin mummies », Nature, , p. 1–6 (ISSN 1476-4687, DOI 10.1038/s41586-021-04052-7, lire en ligne, consulté le ).
- (en) Lehti Saag, Sergey V. Vasilyev, Liivi Varul et Natalia V. Kosorukova, « Genetic ancestry changes in Stone to Bronze Age transition in the East European plain », (DOI 10.1101/2020.07.02.184507, consulté le ), p. 2020.07.02.184507.
- (en) Wolfgang Haak, Iosif Lazaridis, Nick Patterson et Nadin Rohland, « Massive migration from the steppe was a source for Indo-European languages in Europe », Nature, vol. 522, no 7555, , p. 207–211 (ISSN 0028-0836 et 1476-4687, PMID 25731166, PMCID PMC5048219, DOI 10.1038/nature14317, lire en ligne, consulté le ).
- (en) David Anthony, « Archaeology, Genetics, and Language in the Steppes: A Comment on Bomhard », Journal of Indo-European Studies, (lire en ligne).
- (en) Alissa Mittnik, Chuan-Chao Wang, Saskia Pfrengle et Mantas Daubaras, « The Genetic History of Northern Europe », (DOI 10.1101/113241, consulté le ), p. 113241.
- (en) Natalia Kashuba, Emrah Kirdök, Hege Damlien et Mikael A. Manninen, « Ancient DNA from chewing gums connects material culture and genetics of Mesolithic hunter-gatherers in Scandinavia », (DOI 10.1101/485045, consulté le ), p. 485045.
- (en) Eppie R. Jones, Gunita Zarina, Vyacheslav Moiseyev et Emma Lightfoot, « The Neolithic Transition in the Baltic Was Not Driven by Admixture with Early European Farmers », Current Biology, vol. 27, no 4, , p. 576–582 (ISSN 0960-9822, PMID 28162894, PMCID PMC5321670, DOI 10.1016/j.cub.2016.12.060, lire en ligne, consulté le ).
- (en) Iain Mathieson, Songül Alpaslan-Roodenberg, Cosimo Posth et Anna Szécsényi-Nagy, « The genomic history of southeastern Europe », Nature, vol. 555, no 7695, , p. 197–203 (ISSN 1476-4687, PMID 29466330, PMCID PMC6091220, DOI 10.1038/nature25778, lire en ligne, consulté le ).
- (en) Michal Feldman, Eva Fernández-Domínguez, Luke Reynolds et Douglas Baird, « Late Pleistocene human genome suggests a local origin for the first farmers of central Anatolia », Nature Communications, vol. 10, no 1, , p. 1218 (ISSN 2041-1723, PMID 30890703, PMCID PMC6425003, DOI 10.1038/s41467-019-09209-7, lire en ligne, consulté le ).
- (en) I. Lazaridis « Genomic insights into the origin of farming in the ancient Near East », Nature, juillet 2016.
- (en) Iain Mathieson, Iosif Lazaridis, Nadin Rohland et Swapan Mallick, « Genome-wide patterns of selection in 230 ancient Eurasians », Nature, vol. 528, no 7583, , p. 499–503 (ISSN 1476-4687, PMID 26595274, PMCID PMC4918750, DOI 10.1038/nature16152, lire en ligne, consulté le ).
- (en) Eva Fernández, Alejandro Pérez-Pérez, Cristina Gamba et Eva Prats, « Ancient DNA Analysis of 8000 B.C. Near Eastern Farmers Supports an Early Neolithic Pioneer Maritime Colonization of Mainland Europe through Cyprus and the Aegean Islands », PLOS Genetics, vol. 10, no 6, , e1004401 (ISSN 1553-7404, PMID 24901650, PMCID PMC4046922, DOI 10.1371/journal.pgen.1004401, lire en ligne, consulté le ).
- (en) Ruth Bollongino, Olaf Nehlich, Michael P. Richards et Jörg Orschiedt, « 2000 Years of Parallel Societies in Stone Age Central Europe », Science, vol. 342, no 6157, , p. 479–481 (ISSN 0036-8075 et 1095-9203, DOI 10.1126/science.1245049, lire en ligne, consulté le ).
- (en) Eugene E. Harris, « Demic and cultural diffusion in prehistoric Europe in the age of ancient genomes », Evolutionary Anthropology: Issues, News, and Reviews, vol. 26, no 5, , p. 228–241 (ISSN 1520-6505, DOI 10.1002/evan.21545, lire en ligne, consulté le ).
- (en) Maïté Rivollat, Choongwon Jeong, Stephan Schiffels et İşil Küçükkalıpçı, « Ancient genome-wide DNA from France highlights the complexity of interactions between Mesolithic hunter-gatherers and Neolithic farmers », Science Advances, vol. 6, no 22, , eaaz5344 (ISSN 2375-2548, PMID 32523989, PMCID PMC7259947, DOI 10.1126/sciadv.aaz5344, lire en ligne, consulté le ).
- (en) Cristina Gamba, Eppie R. Jones, Matthew D. Teasdale et Russell L. McLaughlin, « Genome flux and stasis in a five millennium transect of European prehistory », Nature Communications, vol. 5, no 1, , p. 5257 (ISSN 2041-1723, PMID 25334030, PMCID PMC4218962, DOI 10.1038/ncomms6257, lire en ligne, consulté le ).
- (en) Alexander Immel, Federica Pierini, Christoph Rinne et John Meadows, « Genome-wide study of a Neolithic Wartberg grave community reveals distinct HLA variation and hunter-gatherer ancestry », Communications Biology, vol. 4, no 1, , p. 1–10 (ISSN 2399-3642, PMID 33495542, PMCID PMC7835224, DOI 10.1038/s42003-020-01627-4, lire en ligne, consulté le ).
- (en) Alexandra Coutinho, Torsten Günther, Arielle R. Munters et Emma M. Svensson, « The Neolithic Pitted Ware culture foragers were culturally but not genetically influenced by the Battle Axe culture herders », American Journal of Physical Anthropology, vol. 172, no 4, , p. 638–649 (ISSN 1096-8644, DOI 10.1002/ajpa.24079, lire en ligne, consulté le ).
- (en) Marta Dal Corso, Wolfgang Hamer, Robert Hofmann et René Ohlrau, « Modelling landscape transformation at the Chalcolithic Tripolye mega-site of Maidanetske (Ukraine): Wood demand and availability », The Holocene, vol. 29, no 10, , p. 1622–1636 (ISSN 0959-6836 et 1477-0911, DOI 10.1177/0959683619857229, lire en ligne, consulté le ).
- (en) Fernando Racimo, Jessie Woodbridge, Ralph M. Fyfe et Martin Sikora, « The spatiotemporal spread of human migrations during the European Holocene », Proceedings of the National Academy of Sciences, vol. 117, no 16, , p. 8989–9000 (ISSN 0027-8424 et 1091-6490, PMID 32238559, PMCID PMC7183159, DOI 10.1073/pnas.1920051117, lire en ligne, consulté le ).
- (en) Eppie R. Jones, Gloria Gonzalez-Fortes, Sarah Connell et Veronika Siska, « Upper Palaeolithic genomes reveal deep roots of modern Eurasians », Nature Communications, vol. 6, no 1, , p. 8912 (ISSN 2041-1723, PMID 26567969, PMCID PMC4660371, DOI 10.1038/ncomms9912, lire en ligne, consulté le ).
- (en) Chuan-Chao Wang, Sabine Reinhold, Alexey Kalmykov et Antje Wissgott, « The genetic prehistory of the Greater Caucasus », bioRxiv (prépublication), Genomics, (DOI 10.1101/322347, lire en ligne, consulté le ).
- (en) Volker Heyd, Yamnaya, Corded Wares, and Bell Beakers on the move, In: V. Heyd, G. Kulcsár, B. Preda-Bălănică (eds.), Yamnaya Interactions. Proceedings of the International Workshop held in Helsinki, 25–26 April 2019. The Yamnaya Impact on Prehistoric Europe, Vol. 2. Budapest, 2021
- (en) Luka Papac et al., Dynamic changes in genomic and social structures in third millennium BCE central Europe, Science Advances, Vol. 7, no. 35, 25 août 2021, eabi6941, DOI: 10.1126/sciadv.abi6941
- David Reich, Comment nous sommes devenus ce que nous sommes, Broché, , 380 p., p. 147-150.
- (en) Anne Friis-Holm Egfjord, Ashot Margaryan, Anders Fischer et Karl-Göran Sjögren, « Genomic Steppe ancestry in skeletons from the Neolithic Single Grave Culture in Denmark », PLOS ONE, vol. 16, no 1, , e0244872 (ISSN 1932-6203, PMID 33444387, PMCID PMC7808695, DOI 10.1371/journal.pone.0244872, lire en ligne, consulté le ).
- (en) Andaine Seguin-Orlando, Richard Donat, Clio Der Sarkissian et John Southon, « Heterogeneous Hunter-Gatherer and Steppe-Related Ancestries in Late Neolithic and Bell Beaker Genomes from Present-Day France », Current Biology, vol. 31, no 5, , p. 1072–1083.e10 (ISSN 0960-9822, PMID 33434506, DOI 10.1016/j.cub.2020.12.015, lire en ligne, consulté le ).
- (en) Anna Linderholm, Gülşah Merve Kılınç, Anita Szczepanek et Piotr Włodarczak, « Corded Ware cultural complexity uncovered using genomic and isotopic analysis from south-eastern Poland », Scientific Reports, vol. 10, no 1, , p. 6885 (ISSN 2045-2322, PMID 32303690, PMCID PMC7165176, DOI 10.1038/s41598-020-63138-w, lire en ligne, consulté le ).
- (en) Iñigo Olalde, Selina Brace, Morten E. Allentoft et Ian Armit, « The Beaker phenomenon and the genomic transformation of northwest Europe », Nature, vol. 555, no 7695, , p. 190–196 (ISSN 1476-4687, PMID 29466337, PMCID PMC5973796, DOI 10.1038/nature25738, lire en ligne, consulté le ).
- (en) Iain Mathieson, Iosif Lazaridis, Nadin Rohland et Swapan Mallick, « Genome-wide patterns of selection in 230 ancient Eurasians », Nature, vol. 528, no 7583, , p. 499–503 (ISSN 0028-0836 et 1476-4687, PMID 26595274, PMCID PMC4918750, DOI 10.1038/nature16152, lire en ligne, consulté le ).
- (en) Iosif Lazaridis, Alissa Mittnik, Nick Patterson et Swapan Mallick, « Genetic origins of the Minoans and Mycenaeans », Nature, vol. 548, no 7666, , p. 214–218 (ISSN 1476-4687, PMID 28783727, PMCID PMC5565772, DOI 10.1038/nature23310, lire en ligne, consulté le ).
- (en) Claire-Elise Fischer, Anthony Lefort, Marie-Hélène Pemonge et Christine Couture-Veschambre, « The multiple maternal legacy of the Late Iron Age group of Urville-Nacqueville (France, Normandy) documents a long-standing genetic contact zone in northwestern France », PLOS ONE, vol. 13, no 12, , e0207459 (ISSN 1932-6203, PMID 30521562, PMCID PMC6283558, DOI 10.1371/journal.pone.0207459, lire en ligne, consulté le ).
- Claire-Elise Fischer. Apports de l’archéogénétique à l’étude des groupes du Second âge du Fer en France : Approche multi-scalaire. Anthropologie biologique. Université de Bordeaux, 2019. p. 210
- (en) Iñigo Olalde, Swapan Mallick, Nick Patterson et Nadin Rohland, « The genomic history of the Iberian Peninsula over the past 8000 years », Science, vol. 363, no 6432, , p. 1230–1234 (ISSN 0036-8075 et 1095-9203, PMID 30872528, PMCID PMC6436108, DOI 10.1126/science.aav4040, lire en ligne, consulté le ).
- (en) Cosimo Posth, Valentina Zaro, Maria A. Spyrou et Stefania Vai, « The origin and legacy of the Etruscans through a 2000-year archeogenomic time transect », Science Advances, vol. 7, no 39, , eabi7673 (PMID 34559560, PMCID PMC8462907, DOI 10.1126/sciadv.abi7673, lire en ligne, consulté le ).
- (en) Margaret L. Antonio, Ziyue Gao, Hannah M. Moots et Michaela Lucci, « Ancient Rome: A genetic crossroads of Europe and the Mediterranean », Science, vol. 366, no 6466, , p. 708–714 (ISSN 0036-8075 et 1095-9203, PMID 31699931, PMCID PMC7093155, DOI 10.1126/science.aay6826, lire en ligne, consulté le ).
- (en) Iosif Lazaridis, Nick Patterson, Alissa Mittnik et Gabriel Renaud, « Ancient human genomes suggest three ancestral populations for present-day Europeans », Nature, vol. 513, no 7518, , p. 409–413 (ISSN 0028-0836 et 1476-4687, PMID 25230663, PMCID PMC4170574, DOI 10.1038/nature13673, lire en ligne, consulté le ).
- (en) I. Lazaridis et al., « Genomic Insights into the Origin of Farming in the Ancient Near-East », Nature, 536, 2016.
- Claire-Elise Fischer, Apports de l’archéogénétique à l’étude des groupes du Second âge du Fer en France : Approche multi-scalaire, Anthropologie biologique, université de Bordeaux, 2019, p. 233.
- (en) Chrystelle Richard, Chrystelle Richard, Erwan Pennarun et Toomas Kivisild, « An mtDNA perspective of French genetic variation », Annals of Human Biology, vol. 34, no 1, , p. 68–79 (ISSN 0301-4460 et 1464-5033, DOI 10.1080/03014460601076098, lire en ligne, consulté le ).
- (en) Aude Saint Pierre, Joanna Giemza, Isabel Alves et Matilde Karakachoff, « The genetic history of France », European Journal of Human Genetics, vol. 28, no 7, , p. 853–865 (ISSN 1476-5438, PMID 32042083, PMCID PMC7316781, DOI 10.1038/s41431-020-0584-1, lire en ligne, consulté le ).
- (en) Simone Andrea Biagini, Eva Ramos-Luis, David Comas et Francesc Calafell, « Reshaping the Hexagone : the genetic landscape of modern France », bioRxiv (prépublication), Genetics, (DOI 10.1101/718098, lire en ligne, consulté le ).
- (en) Erika Tamm, Julie Di Cristofaro, Stéphane Mazières et Erwan Pennarun, « Genome-wide analysis of Corsican population reveals a close affinity with Northern and Central Italy », Scientific Reports, vol. 9, no 1, , p. 13581 (ISSN 2045-2322, PMID 31537848, PMCID PMC6753063, DOI 10.1038/s41598-019-49901-8, lire en ligne, consulté le ).
- (en) A. Raveane, S. Aneli, F. Montinaro et G. Athanasiadis, « Population structure of modern-day Italians reveals patterns of ancient and archaic ancestries in Southern Europe », Science Advances, vol. 5, no 9, , eaaw3492 (ISSN 2375-2548, PMID 31517044, PMCID PMC6726452, DOI 10.1126/sciadv.aaw3492, lire en ligne, consulté le ).
- (en) Stephan Schiffels, Wolfgang Haak, Pirita Paajanen et Bastien Llamas, « Iron Age and Anglo-Saxon genomes from East England reveal British migration history », Nature Communications, vol. 7, no 1, , p. 10408 (ISSN 2041-1723, PMID 26783965, PMCID PMC4735688, DOI 10.1038/ncomms10408, lire en ligne, consulté le ).
- (en) Stephen Leslie, Bruce Winney, Garrett Hellenthal et Dan Davison, « The fine-scale genetic structure of the British population », Nature, vol. 519, no 7543, , p. 309–314 (ISSN 1476-4687, PMID 25788095, PMCID PMC4632200, DOI 10.1038/nature14230, lire en ligne, consulté le ).
- (en) Edmund Gilbert, Seamus O’Reilly, Michael Merrigan et Darren McGettigan, « The Irish DNA Atlas: Revealing Fine-Scale Population Structure and History within Ireland », Scientific Reports, vol. 7, no 1, , p. 17199 (ISSN 2045-2322, DOI 10.1038/s41598-017-17124-4, lire en ligne, consulté le ).
Bibliographie
- Bertrand Jordan, L'humanité au pluriel : la génétique et la question des races, Paris, Seuil, coll. « Science ouverte », , 227 p. (ISBN 978-2-02-096658-0)
- Luca Cavalli-Sforza et Francesco Cavalli-Sforza (trad. de l'italien), La Génétique des populations : Histoire d'une découverte [« The genetics of human population »], Paris, Éditions Odile Jacob, , 377 p. (ISBN 978-2-7381-2081-6, lire en ligne)
- David Reich, Comment nous sommes devenus ce que nous sommes ["Who we are and how we got here"] (trad. de l'américain), Éditions Broché, 2019, 380 p.
Voir aussi
Articles connexes
- Génétique des populations
- Origine multirégionale de l'homme moderne
- Origine africaine de l'Homme moderne
- Projet génographique
- Histoire du peuplement de la France
- Anthropologie physique et génétique des Russes
- Études génétiques sur les Juifs
- Les Amérindiens
- Les Azéris
- Les Basques
- Les Étrusques
- Les Finnois
- Les Iraniens
- Les Maghrébins
- Génétique de la population marocaine
- Les Peuls
- Les Roms
- Les Sardes
Liens externes
- Le site Eupedia, consacré principalement aux haplogroupes des populations européennes, constitue une excellente introduction à la génétique des populations européennes. Il est en français et est régulièrement mis à jour.
- Trois projets privés tentent de cartographier le génome de l'ensemble des populations du globe et de tracer leurs migrations : Genebase, du projet Genographic de National Geographic et du DNA Ancestry project. Seul le premier site donne accès à une base complète des haplogroupes par populations.
- Portail de la biologie
- Portail de la biologie cellulaire et moléculaire
_PC_analysis.png.webp)