Nitrite d'alkyle
Les nitrites d'alkyle ou esters de nitrite sont une famille de composés organiques a de structure de type R-ONO. Formellement, ce sont les esters d'alkyle de l'acide nitreux. Ce sont des isomères de constitution des composés nitro (R-NO2).
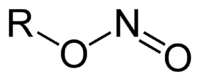
Le nitrite de méthyle et le nitrite d'éthyle sont gazeux à température et pression ambiante, les quelques suivants sont des liquides volatils. Les nitrites d'alkyle ont une odeur distinctive fruitée. Un autre composé courant de cette famille est le nitrite d'amyle.
Synthèse
Les nitrites d'alkyle sont préparés à partir d'alcools et de nitrite de sodium dans une solution d'acide sulfurique. Ils se décomposent lentement, produisant des oxydes d'azote, de l'eau, l'alcool correspondant, et des produits de polymérisation de l'aldéhyde correspondant[1].
Réactions
- En laboratoire, les solutions de nitrite d'alkyle dans l'acide acétique glacial sont parfois utilisées comme agents doux de nitration. Les espèces nitrantes, les nitrates d'acétyle sont générées in situ.
- Le nitrite de n-butyle et l'ammoniac convertissent la phénylhydroxylamine en dérivé nitrosamine, le cupferron[2]. De même, le nitrite d'éthyle permet de convertir la pyrrolidine[3].
- Les nitrites d'alkyle sont aussi utilisés pour la formation d'oximes, grâce à la formation d'un carbanion catalysée par un acide ou une base. Par exemple la réaction entre la butanone, le nitrite d'éthyle et l'acide chlorhydrique forme une oxime, la diméthylglyoxime[4]. Une réaction similaire se produit avec le chlorure de phénacyle[5], ou entre le phénylacétonitrile, le nitrite de méthyle et l'hydroxyde de sodium [6].
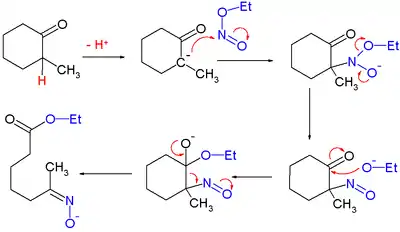
Un cas isolé, mais classique, d'usage de nitrite d'alkyle est la synthèse totale de la quinine de Woodward et Doering[7]:
pour laquelle on a proposé le mécanisme réactionnel :
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Alkyl nitrites » (voir la liste des auteurs).
- n-butyl nitrite Organic Syntheses, Coll. Vol. 2, p.108 (1943); Vol. 16, p.7 (1936). Lien
- Cupferron Organic Syntheses, Coll. Vol. 1, p.177 (1941); Vol. 4, p.19 (1925) Lien
- 2-Pyrrolidinemethanol, α,α-diphenyl-, (±)- Organic Syntheses, Coll. Vol. 6, p.542 (1988); Vol. 58, p.113 (1978) Lien
- Dimethylglyoxime Organic Syntheses, Coll. Vol. 2, p.204 (1943); Vol. 10, p.22 (1930) Lien
- Glyoxylyl chloride, phenyl-, oxime Organic Syntheses, Coll. Vol. 3, p.191 (1955); Vol. 24, p.25 (1944) Lien
- [Benzeneacetonitrile, α-[[(1,1-dimethylethoxy)carbonyl]]carbonyl]oxy]imino]-] Organic Syntheses, Coll. Vol. 6, p.199 (1988); Vol. 59, p.95 (1979) Lien
- The Total Synthesis of Quinine R. B. Woodward and W. E. Doering J. Am. Chem. Soc.; 1945; 67(5) pp 860 - 874; DOI:10.1021/ja01221a051