Phénol (groupe)
En chimie organique, les phénols sont des composés constitués d'un cycle aromatique hydrocarboné (arène) et d'un ou plusieurs groupes hydroxyle –OH qui y sont attachés. Les polyphénols, composés constitués par exemple de plus d'un cycle phénolique, font partie des phénols.
Pour les articles homonymes, voir Phénol.
Certains phénols ont des fonctions biologiques importantes (défense biochimique contre les micro-organismes et champignons chez les végétaux notamment) chez certaines espèces, mais ils peuvent être toxiques pour l'être humain et pour d'autres espèces animales. Quand ils sont anormalement disséminés dans l'environnement, les phénols sont des polluants de l'air, du sol ou de l'eau.
De nombreux phénols sont écotoxiques et toxiques. Certains métiers de l'industrie y sont particulièrement exposés[1].
Nomenclature
Les éléments de base de la famille portent des noms d'usage. Le composé le plus simple de cette famille est nommé « phénol », très utilisé comme base par l'industrie chimique pour la production de nombreux autres composés organiques et produits commercialisés.
Origine et familles
Dans la nature, les phénols sont des alcools aromatiques produits par les végétaux. Les phénols simples, déchets du métabolisme végétal, sont assemblés en polymères ou pseudo-polymères comme la lignine. Les composés phénoliques définissent un ensemble de substances longtemps nommées « matières tannoïques » d’une façon générale et imprécise parce qu’on ne connaissait pas encore la nature de ces substances.
Quatre[réf. souhaitée] principales familles de composés phénoliques se distinguent : les acides-phénols, les flavonoïdes, les anthocyanes et les tanins.
Propriétés acido-basiques
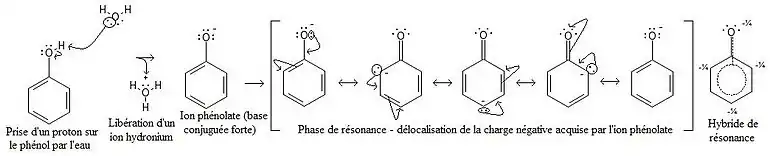
Les phénols sont plus acides que les alcools. Un ion phénolate, base conjuguée d'un phénol, est stabilisé par résonance et est plus stable qu'un ion alcoolate. En effet, lors de la prise du proton du groupe hydroxyle, le doublet électronique est partagé sur trois atomes de carbone ; ainsi la charge est délocalisée, et l'ion est beaucoup plus stable que sur un alcool, où la charge négative serait trop importante et s'approprierait le proton laissé immédiatement après.
Cet acide est toutefois un acide relativement faible.
Les propriétés plus acides des phénols font en sorte qu'ils réagissent avec les bases fortes comme l'hydroxyde de sodium (NaOH), contrairement aux alcools. Cette propriété peut être utilisée pour séparer un mélange d'alcool et de phénol.
Substitutions électrophiles
Le groupe hydroxyle –OH a un effet « activant » qui facilite les substitutions électrophiles.
Le remplacement (substitution) d'un atome d'hydrogène H du cycle benzénique par un autre atome ou groupe d'atomes se porte préférentiellement sur les positions 2, 4 et 6 (par rapport au groupe –OH) de ce cycle :
6 2
4
2
4
Quelques substitutions :
- la nitration du phénol conduit au 2,4,6-trinitrophénol ;
- l'alkylation des phénols.
Exemple : réaction entre deux molécules de phénol et une molécule de méthanal, ou formaldéhyde CH2=O ; dans l'état final de la réaction, le groupe méthylène -CH2- issu du méthanal s'est substitué à un H en position 2, 4 ou 6 de chaque molécule de phénol (position 2 de la première molécule et position 6 de la seconde dans l'illustration ci-dessous). Le groupe méthylène -CH2- unit les deux cycles benzéniques ; on est en présence d'une réaction de condensation avec élimination d'une molécule d'eau.

-H![]() H-
H-
→  - CH2 -
- CH2 -  + H2O
+ H2O
Cette réaction est la première étape d'une polymérisation qui peut se poursuivre grâce à l'existence des trois sites réactifs (ou sites actifs) 2, 4 et 6 sur chaque molécule de phénol (fonctionnalité[2] égale à 3), il se constitue alors un réseau tridimensionnel[3] (voir phénoplaste).
Utilisations
Historiquement, le phénol est le premier antiseptique à avoir été utilisé pour réduire les risques d'infection de plaies ouvertes en chirurgie moderne. Joseph Lister démocratise son utilisation lors des chirurgies à plaie ouverte de 1865 à 1885, réduisant le taux de mortalité à la suite des opérations de 60 % à 25 %.
Le phénol est aujourd'hui utilisé par la chimie organique et industrielle, par exemple pour produire des composés plus complexes (ex. : alkylphénols, caprolactame, acide salicylique, chlorophénols, nitrophénols, acide picrique, acide adipique), eux-mêmes utilisés pour produire des plastifiants, résines, adhésifs, durcisseurs, dissolvants, isolants, explosifs, etc.
Exemples de composés phénoliques
Voici quelques composés phénoliques :
- le phénol, le composé de base du groupe, utilisé comme désinfectant et en synthèse chimique ;
- les benzènediols :
- le pyrocatéchol, phénol substitué par un groupe hydroxyle en position ortho,
- la résorcine, phénol substitué par un groupe hydroxyle en position méta,
- l'hydroquinone, phénol substitué par un groupe hydroxyle en position para ;
- les benzènetriols : pyrogallol, hydroxyquinol et phloroglucinol ;
- les crésols, phénols substitués par un groupe méthyle (trois isomères) ;
- l'acide salicylique, un médicament analgésique, antipyrétique et anti-inflammatoire, précurseur de l'aspirine ;
- les cannabinoïdes, constituants actifs du cannabis ;
- la capsaïcine, un composé (corrosif) du piment du Chili ;
- la tyrosine, un acide aminé ;
- les neurotransmetteurs sérotonine, dopamine, adrénaline et noradrénaline ;
- le levodopa, un médicament qui traite la maladie de Parkinson ;
- l'estradiol et les autres œstrogènes ;
- le diéthylstilbestrol, un œstrogène de synthèse à structure de stilbène ;
- le salicylate de méthyle, le constituant principal du wintergreen (huile aromatique tirée de la gaulthérie couchée) ;
- le gaïacol (2-méthoxyphénol) du café torréfié, du whisky et de la fumée qui a une saveur de fumée et qui, industriellement, est l'intermédiaire de synthèse de la vanilline ;
- les polyphénols comme les flavonoïdes et les tanins ;
- les chlorophénols (dix-neuf isomères) ;
- l'acide picrique, un explosif très utilisé lors de la Première Guerre mondiale ;
- des indicateurs de pH : phénolphtaléine, rouge de phénol, bleu de bromothymol, thymolphtaléine et bleu de bromophénol ;
- les alkylphénols comme le nonylphénol ;
- le carvacrol (se trouve dans les huiles essentielles obtenues notamment à partir de l'origan et du thym).
Dégradation et biodégradation
Certains phénols sont difficilement ou lentement biodégradables[4], ce qui en fait des polluants préoccupants du sol (fréquent dans les friches industrielles) et des nappes phréatiques[5].
Diverses techniques ont été expérimentées pour leur destruction en tant que polluants, in situ ou ex situ, dont par la chaleur (thermolyse) ou des oxydations catalysées et/ou effectuées en conditions dites supercritiques (formes d'oxydation par voie humide)[6]. Ces réactions sont éventuellement dopées par des catalyseurs pluri- ou monométalliques (ex. : platine ou ruthénium supportés sur cérine ou sur « cérine dopée »), il se forme un dépôt carboné tout au long de la réaction, composé d'espèces organiques adsorbées sur toute la surface du catalyseur ; on y trouve « des composés polycycliques aromatiques de la famille des chroménones, des xanthénones et des fluorénones ont pu être extraits et identifiés par des techniques chromatographiques couplées à la spectrométrie de masse. Ces espèces sont issues de la condensation du phénol avec des produits de son oxydation incomplète »[6].
Exposition environnementale
Elle est devenue préoccupante à partir de la seconde moitié du XXe siècle, alors que l'industrie produisait des quantités croissantes de phénols aujourd'hui retrouvés partout, dans l'eau, l'air, les sols, les aliments et les organismes vivant et notamment dans l'environnement du fœtus qui y est exposé à une période où il est très vulnérable.
Cette exposition peut être évaluée via des analyses d'urine, qui bénéficient de progrès techniques permettant de doser avec une précision croissante les phénols, dont par exemple les conjugués de bisphénol A, de 2,5-dichlorophénol ou encore de 2-hydroxy-4-méthoxybenzophénone[7]. Il est toutefois important de veiller à ne pas contaminer les échantillons (qui ne doivent pas par exemple être prélevés ou stockés avec des matériaux contenant des phénols[8]). L'heure de la miction peut aussi avoir une importance pour la teneur en phénols de l'urine.
Toxicologie
De nombreuses substances phénoliques sont écotoxiques et toxiques pour l'être humain par inhalation[9], ingestion ou contact avec la peau[10],[11],[12] (nécessitant une décontamination adéquate[13]). (À titre d'exemple, une crème dermique contaminée par du phénol a pu causer la mort d'un patient[14]). L'intoxication peut être aiguë ou chronique[15]. Le contact avec la peau peut à la fois induire un effet local et systémique (via un passage transcutané)[16]. Il est néphrotoxique et peut conduire à une défaillance rénale mortelle, même après une contamination percutanée[17].
Le phénol peut être toxique seul ou en combinaison avec d'autres molécules (acide sulfurique par exemple[18]) et avec de nombreux effets toxiques[19].
Sa cinétique dans l’organisme, son métabolisme chez l'être humain[20], et les mécanismes de détoxication chez les mammifères sont mieux connus[21], dont chez le lapin de laboratoire[22].
Certains phénols présentent en outre des effets potentialisants, seuls[23] ou en synergie avec d'autres composés[24].
Certains phénols sont très répandus dans l'environnement depuis quelques années (dont le bisphénol A). Même à faible dose[25], certains sont des perturbateurs endocriniens, notamment pour les garçons qui y sont très fréquemment exposés in utero[26], avec alors un risque accru d'anomalies de développement du fœtus[27], de féminisation, de malformations de l'appareil génital mâle[28], et d'obésité quand ils grandiront[29],[30],[31] (comme pour le parabène[32],[33]), dont en France où une étude menée en 2014 a retrouvé des traces de phénols dans les urines de la plupart des femmes enceintes testées et montré qu'au sein d'une population de garçons nouveau-nés, le taux de triclosan[34] urinaire maternel a été associée à une croissance fœtale réduite en fin de grossesse et avec une réduction du périmètre crânien à la naissance. Les parabènes ont au contraire été associés à une augmentation du poids à la naissance, et une association positive a été trouvée entre l'exposition in utero au parahydroxybenzoate de méthyle avec le poids, qui est restée manifeste jusqu'à 36 mois après la naissance[35].
Écotoxicologie
Les capacités des animaux à le métaboliser varient beaucoup selon l'espèce[36], ce qui peut notamment être montré par le suivi du carbone 14[37] (lequel peut aussi être utilisé pour l'étude de sa cinétique environnementale plus globale[38]).
Les phénols sont souvent écotoxiques et se montrent très toxiques chez de nombreuses espèces (toxicité démontrée via l'expérimentation animale notamment[39]), notamment dans le milieu aquatique, en eaux douces[40],[41], et tout particulièrement pour les larves et embryons d'organismes aquatiques[42],[43], ainsi que dans les estuaires[44] et en mer.
Les conditions de milieu, en particulier la température, peuvent renforcer ou diminuer sa toxicité[45].
Notes et références
- Dosemeci M., Blair A., Stewart P.A., Chandeler J. et Trush M.A. (1991), Mortality amoung industrial workers exposed to phenol, Epidemiology, 2, 188-193.
- J.-P. Trotignon et al., Précis de Matières Plastiques, AFNOR, Nathan, 1996, p. 2, 131 (ISBN 2-09-176572-4).
- Paul Arnaud, Cours de chimie organique - Premier cycle universitaire, Dunod, 1994, p. 312, 471 (ISBN 2 04 019716 8). Les positions 2 et 6 (par rapport au groupe –OH) sont parfois encore appelées positions ortho et la position 4, position para.
- Haider K., Jagnow G., Kohnen R. et Lim S.U. (1981), Decomposition of toxic and nontoxic organic compounds in soil, Ann. Arber Science, Mi.
- Delfino J.J. et Dube D.J. (1976), Persistent contamination of ground water by phenol, J. Environ. Sci. Health, 345-355.
- Keav, S., Martin, A., Barbier Jr., J. et Duprez, D. (2010), Nature du dépôt formé au cours de l’oxydation en voie humide catalysée du phénol, Comptes Rendus Chimie, 13 (5), 508-514, résumé.
- Ye X.Y., Zsuzsanna K., Needham L.L. et al. (2005), Quantification of urinary conjugates of bisphenol A, 2,5-dichlorophenol, and 2-hydroxy-4-methoxybenzophenone in humans by online solid phase extraction-high performance liquid chromatography-tandem mass spectrometry, Anal. Bioanal. Chem., 383, 638–644.
- Mortamais M., Chevrier C., Philippat C. et al. (2012), Correcting for the influence of sampling conditions on biomarkers of exposure to phenols and phthalates: a 2-step standardization method based on regression residuals, Environ. Health, 11:29.
- Dalin N.M. et Kristofferson R. (1974), Physiological effects of a sublethal concentration of inhaled phenol on the rat. Ann Zool Fenn, 11, 193-199.
- Conning D.M. et Hayes M.J. (1970), The dermal toxicity of phenol, and investigation of the most effective first-aid measures, Br. J. Ind. Med., 27, 155-159.
- Ersek R.A. (1991), Comparative study of dermabrasion, phenol peel, and acetic acid peel, Anesth. Plast. Surg., 15, 241-243.
- Deichmann W.B., Miller T. et Roberts J.B. (1950), Local and systemic effects following application of dilute solutions of phenol in water and in camphor-liquid petrolatum on the skin of animals, Arch. Ind. Hyg. Occup. Med., 2, 454-461.
- Brown V.K.H., Box V.L. et Simpson B.J. (1975), Decontamination procedures for skin exposed to phenolic substances, Arch. Environ. Health, 30, 1-6.
- Cronin T.D. et Brauer R.O. (1949), Death due to phenol contained in Foille, J. Am. Med. Assoc., 139, 777-779.
- Deichmann W.B., Kitzmiller K.V. et Witherup S. (1944), Phenols studies - VII: Chronic phenol poisoning, with special reference to the effects upon experimental animals of the inhalation of phenol vapour, Am. J. Clin. Pathol., 14, 273-277.
- Deichmann W.B. (1949), Local and systemic effects following skin contact with phenol: a review of the litterature, J. Ind. Hyg. Toxicol., 31, 146-154.
- Foxall P.J.D., Bending M.R., Gartland K.P.R. et Nicholson J.K. (1991), Acute renal failure following accidental cutaneous absorption of phenol. Nephrotoxicity: Mechanism, early diagnosis and therapeutic management (fourth International Symposium in Nephrotoxicity, Guildford, UK, 1989), New York, Basel, Marcel Dekker Inc. P. H. Bach, p. 55-59.
- Bray H.G., Humphris B.G., Thorpe W.V., White K. et Wood P.B. (1952b), Kinetic studies of the metabolism of forein organic compounds. 4. The conjugation of phenol with sulfuric acid, Biochem. J., 52, 419-423.
- Bruce R.M., Santodonato J. et Neal N.W. (1987), Summary review of the health effects associated with phenol, Toxicol. Ind. Health, 3, 4, 535-568.
- Eastmond D.A., Smith M.T., Ruzo L.G. et Ross D. (1986), Metabolic activation of phenol by human myeloperoxidase and horseradish peroxidase, Mol. Pharmacol., 30, 6, 674-679.
- Deichmann W.B. (1944), Phenols studies- V: The distribution detoxification and excretion of phenol in the mammalian body, Arch. Biochem., 2, 345-355.
- Garton G.A. et Williams R.T. (1949), Studies in detoxification 26. The fate of phenol, phenyl sulfuric acids and phenylglucuronide in the rabbit in relation to the metabolism of benzene, Biochem. J., 45, 158-163.
- Itoh M. (1982), Sensitisation potency of some phenolic compounds, J. Dermatol., 9, 3, 223-283.
- Osamura H., Takeuchi Y., Urayama T., Itoh M. et Ishihara M. (1982), Conjugation of some phenolic compounds with amino groups and related sensitization potency, J. Dermatol., juin 1982, 9 (3), 215-22.
- Rubin B.S., Murray M.K., Damassa D.A., King J.C. et Soto A.M., Perinatal exposure to low doses of bisphenol A affects body weight, patterns of estrous cyclicity, and plasma LH levels, Environ. Health Perspect., 2001, 109:675–680.
- Philippat C., Wolff M.S., Calafat A.M. et al., Prenatal exposure to environmental phenols: concentrations in amniotic fluid and variability in urinary concentrations during pregnancy, Environ. Health Perspect., 2013, 121:1225–1231.
- Philippat C., Mortamais M., Chevrier C. et al. (2012), Exposure to phthalates and phenols during pregnancy and offspring size at birth, Environ. Health Perspect., 120, 464–470.
- Chevrier C., Petit C., Philippat C. et al. (2012), Maternal urinary phthalates and phenols and male genital anomalies, Epidemiology, 23, 353–356.
- Masuno H, Iwanami J, Kidani T, Sakayama K, Honda K., Bisphenol a accelerates terminal differentiation of 3T3-L1 cells into adipocytes through the phosphatidylinositol 3-kinase pathway, Toxicol. Sci., 2005, 84, 319–327.
- Valvi D., Casas M., Mendez M.A. et al. (2013), Prenatal bisphenol a urine concentrations and early rapid growth and overweight risk in the offspring, Epidemiology, 24, 791–799.
- Harley K.G., Aguilar Schall R., Chevrier J. et al. (2013), Prenatal and postnatal bisphenol A exposure and body mass index in childhood in the CHAMACOS cohort, Environ. Health Perspect., 121, 514–520, 520e511–516.
- Hu P., Chen X., Whitener R.J. et al., Effects of parabens on adipocyte differentiation, Toxicol. Sci., 2013, 131, 56–70.
- Golden R., Gandy J. et Vollmer G. (2005), A review of the endocrine activity of parabens and implications for potential risks to human health, Crit. Rev. Toxicol., 35, 435–458.
- Paul K.B., Hedge J.M., Bansal R. et al. (2012), Developmental triclosan exposure decreases maternal, fetal, and early neonatal thyroxine: a dynamic and kinetic evaluation of a putative mode-of-action, Toxicology, 300, 31–45.
- Philippat C., Botton J., Calafat A., Ye X. ; Charles M.A. et Slama R. (2014), Prenatal Exposure to Phenols and Growth in Boys, Epidemiology, septembre 2014, vol. 25, no 5, p. 625-635, DOI:10.1097/EDE.0000000000000132.
- Capel I.D., French M.R., Millburn P., Smith R.L. et Williams R.T. (1972a), Species variations in phenol metabolism, Biochem. J., 127, 25-26.
- Capel I.D., French M.R., Millburn P., Smith R.L. et Williams R.T. (1972), The fate of 14C phenol in various species. Xenobiotica, 2, 25-34.
- Freitag D., Ballhorn L., Geyer H. et Korte F. (1985), Environmental hazard profile of organic chemicals. An experimental method for the assessment of the behaviour of organic chemicals in the ecosphere by means of simple laboratory tests with 14C-labeled chemicals, Chemosphere, 14, 1589-1616.
- Deichmann W.B. et Witherup S. (1944), Phenols studies - VI: The acute and comparative toxicity of phenol and o-, m- and p-cresols for experimental animals, J. Pharmacol. Exp. Ther., 80, 233-240.
- Heller V.G. et Pursell L. (1938), Phenol-contaminated waters and their physiological action, J. Pharmacol. Exp. Ther., 69, 99-107.
- Gupta P.K., Mujumdar V.S., Rao P.S. et Durve V.S. (1982), Toxicity of phenol, pentachlorophenol and sodium pentachlorophenolate to a freshwater Teleost, Lebistes reticulatus (Peters), Acta Hydrochim. Hydrobiol., 10, 177-181.
- DeGraeve G.M., Geiger D.L., Meyer J.S. et Bergman H.L. (1980), Acute and embryo-larval toxicity of phenolic compounds to aquatic biota, Arch. Environ. Contam. Toxicol., 9, 5, 557-568.
- Holcombe G.W., Phipps G.L. et Fiandt J.T. (1982), Effects of phenol, 2,4-dimethylphenol, 2,4-dichlorophenol and pentachlorophenol on embryo, larval and early-juvenile fathead minnows (Pimephales promelas), Arch. Environ. Contam. Toxicol., 11, 73-78.
- Hwang H.M., Hodson R.E. et Lee R.F. (1986), Degradation of phenol and chlorophenols by sunlight and microbes in estuarine water, Environ. Sci. Technol., 20, 10, 1002-1007.
- Brown V.M., Jordan D.H.M. et Tiller B.A. (1967), The effect of temperature on the acutetoxicity of phenol to rainbow trout in hard water, Water Res., 1, 587-594.
Voir aussi
Articles connexes
- Phénol (aussi appelé hydroxybenzène, acide phénique ou acide carbolique)
Bibliographie
- Guide de la chimie (1999), Phénol, Paris, CHIMEDIT.
- Farquharson, M. E., Gage, J. C. et Northover, J. (1958), The biological action of chlorophenols, Brit. J. Pharmacol., 13 (1), 20-24.
- Abraham A.J. (1972), A case of carbolic acid gangrene of the thumb, Br. J. Plast. Surg, 25, 282-284.
- Ahlborg, U. G., Thunberg, T. M. et Spencer, H. C. (1980), Chlorinated phenols: occurrence, toxicity, metabolism, and environmental impact, CRC Critical Reviews in Toxicology, 7 (1), 1-35.
- Argus Research Laboratories (1997), Oral (gavage) developmental toxicity study of phenol in rats, Horsham, PA, Protocol number: 916-011 (cité dans US EPA).
- ATSDR (1998), Toxicological Profiles for Phenol, Agency for Toxic Substances and Disease Registry, Atlanta, GA: U.S department of Health and Human Sevices, Public Health Services, [htpp://www.atsdr.cdc.gov/toxpro2.html lire en ligne].
- Baars A.J., Theelen R.M.C., Janssen P.J.C.M., Hesse J.M., van Apeldoorn M.E., Meijerink M.C.M., Verdam L. et Zeilmaker M.J. (2001), Re-evaluation of human-toxicological maximum permissible risk levels RIVM, RIVM (Institut national de la santé publique et de l'environnement), rapport 711 701 025.
- Baker E.L., Bertozzi P.E., Field P.H., Basteyns B.J. et Skinner H.G. (1978), Phenol poisoning due to contaminated drinking water, Arch. Environ. Health, 33, 89-94.
- Bennett I.L., James D.F. et Golden A. (1950), Severe acidosis due to phenol poisoning, Report of two cases, Ann. Intern. Med., 32, 324-327.
- Berman E., Schlicht M., Moser V.C. et MacPhail R.C. (1995), A multidisciplinary approach to toxicological screening: I. Systemic toxicity, J. Toxicol. Environ. Health, 45, 2, 127-143.
- Binet, D. P. (1896), Toxicologie comparée des phénols, Rev. med. suisse rom., 16, 449
- Canton J.H., Van der Heijden C.A. et al. (1986), Criteria document over phenol. RIVM, National Institute of Public Health and the Environment, Bilthoven.
- CE (2000), Risk Assessment - Phenol, Commission européenne, Bruxelles.
- CE (2001), Phenol. Évaluation des risques dans le cadre du règlement CE 793/93 sur les substances existantes, projet, , Commission européenne, Bruxelles.
- CE (2002), Risk Assessment - Phenol, Commission européenne, Bruxelles, .
- Portail de la chimie