Taxinomie et systématique des champignons
La taxinomie et la systématique des champignons sont deux disciplines complémentaires de l'histoire naturelle[1], qui a pour objet de décrire tous les organismes vivants, existants ou ayant existé. « Historiquement, histoire a le sens d'enquête, de description de tout ce qui est visible dans le monde naturel : animal, végétal, minéral[2]. »
Pour cela, elles doivent :
- en faire la description détaillée (anatomique, physiologique, écologique, répartition géographique…) ;
- les circonscrire en les nommant sans ambiguïté, au moyen d'un binôme réputé latin, conformément aux règles de la nomenclature ;
- regrouper les espèces ayant des caractères en commun à l'intérieur d'entités hiérarchisées prédéfinies : genre, famille, ordre, classe, division, règne. De tels groupes hiérarchisés sont appelés taxons et la branche de la systématique qui s'occupe de donner ces noms est la taxinomie.
Comme les végétaux utiles ou vénéneux, les champignons supérieurs sont régis par leurs règles de nomenclature et disposent de plusieurs classifications. Les premières tentatives de classification structurée voient le jour à la Renaissance tardive, alors que la botanique émerge comme discipline scientifique. La taxinomie fongique suit ensuite les avancées et les développements de cette science, y compris l'établissement de la systématique linnéenne au XVIIIe siècle. Pendant longtemps, les botanistes n'ont qu'une compréhension et un intérêt limités pour ces cryptogames au cyle de vie énigmatique. La naissance d'une véritable science mycologique, dotée de son propre langage et de ses codes de classification, s'opère au début du XIXe siècle sur l'influence fondatrice de Persoon, puis de Fries. Les avancées de la microbiologie enrichissent ensuite la discipline de nombreux organismes microscopiques, qui remettent aussi en question la séparation ancestrale du vivant entre végétal et animal. La notion de champignon se confond ainsi souvent avec celle de protiste, et sert parfois à désigner tout ce qui n'entre pas clairement dans une catégorie ou dans l'autre.
À partir de la deuxième moitié du XXe siècle, les approches évolutionnistes puis phylogénétiques s'imposent en systématique. Les biologistes cherchent à établir une classification naturelle des espèces, et entreprennent de réorganiser les ensembles hérités de la phénétique. Dans ce contexte, les champignons se voient enfin attribuer leur propre règne (les Fungi), en regard de leur physiologie et de leur écologie très différente. Il apparaît cependant rapidement que plusieurs groupes d'organismes présentant des caractéristiques proches et qui avaient été historiquement étudiés par les mycologues proviennent en réalité de lignées indépendantes qui les ont développées par convergence évolutive. L'avènement des méthodes d'analyse moléculaire vient confirmer la monophylie des Eumycètes, ou « champignons vrais », mais conduit aussi à une restructuration profonde de la classification interne du nouveau règne. La confusion entraînée par ces bouleversements se prolonge durant les deux premières décennies du XXIe siècle, et si la systématique fongique a retrouvé un peu de cohérence en 2018 à la suite d'une révision taxinomique de grande ampleur, elle reste en évolution permanente.
En héritage de cette histoire complexe, la taxinomie des champignons est régie par le Code international de nomenclature botanique, rebaptisé Code international de nomenclature pour les algues, les champignons et les plantes en 2012. Il comprend un certain nombre de règles spécifiques à la mycologie et s'applique aussi aux taxons qui ont été historiquement considérés comme des champignons. Ces dispositions, prises pour assurer la stabilité des noms, se révèlent problématiques pour la nomenclature des nombreuses lignées de protistes : certains groupes rassemblent en effet dans un même taxon des organismes historiquement traités comme des algues, des champignons ou des protozoaires, chacun obéissant à des règles différentes et incompatibles.
Un nombre grandissant d'espèces et de lignées ne sont connues que par des séquences génétiques provenant de l'environnement. Le nommage et l'intégration de cette « matière noire fongique » dans la classification systématique des champignons constitue un défi majeur pour les taxinomistes du XXIe siècle.
Histoire
Préhistoire, Antiquité et Moyen Âge
La plupart des civilisations faisant usage des champignons ont développé des systèmes pour les nommer et les catégoriser en fonction de leurs couleurs, de leurs goûts ou de leurs effets. La classification des champignons, comme celles des animaux et des plantes, est donc sans doute aussi ancienne que l'humanité.
Durant l'antiquité, les champignons ont principalement un usage alimentaire, artisanal ou médicinal, mais les auteurs anciens ne réunirent que des connaissances éparses et rudimentaires, ne laissant aucun document vraiment scientifique concernant les champignons. Deux auteurs méritent toutefois d'être mentionnés : le philosophe naturaliste romain Pline l'Ancien pour son Historia naturalis, et surtout le médecin botaniste grec Dioscoride pour les usages thérapeutiques de quelques champignons dans De Materia medica. Ces textes, ne mentionnant qu'une vingtaine d'espèces comestibles n'ont toutefois qu'un intérêt archéologique, hormis d'avoir légué à la science des mots comme Amanita, Boletus, Manitaria, Myco ou Tuber et il faut attendre le XVIIe siècle pour voir les premiers travaux scientifiques.
Au début de la Renaissance, l'humaniste vénitien Hermolao Barbaro établit une première classification des champignons en 8 catégories d'après les textes de Pline et de Dioscoride[3].
| Classification de Barbaro (1492)[4] | |
|---|---|
|
 |
Époque moderne
La première compilation moderne des connaissances sur les champignons est établie par le botaniste flamand Charles de L'Écluse en 1601 dans son traité Fungorum in Pannoniis observatorum brevis historia qui contient 86 aquarelles et décrit 105 espèces comestibles et vénéneuses. En 1690, le naturaliste anglais John Ray propose dans son ouvrage Synopsis methodica stirpium Britannicum une classification en cinq catégories combinant des caractéristiques morphologiques et d'habitat. Il y ébauche également le système de nomenclature binomiale repris un demi-siècle plus tard par Carl von Linné et dont l'espèce est la subdivision ultime. Classés parmi les herbes, les champignons constituent le premier genre d'un système qui en comprend 28, avant les algues (Plantae submarinae) et les mousses (Musci). À la même époque, le botaniste français Joseph Pitton de Tournefort utilise la même notion d'espèce, et en décrit 160 réparties en 7 genres dans son traité Éléments de botanique ou méthode pour connaître les plantes publié en 1694. Son système est repris et développé par Pier Antonio Micheli, parfois considéré comme le père de la mycologie moderne, dans une classification illustrée de nombreuses gravures : Nova plantarum genera (1729).
| Classification de Ray (1690)[5] | |
|---|---|
|
 |
Systématique linnéenne
Durant la première moitié du XVIIIe siècle, Carl von Linné popularise le principe d'une classification hiérarchique des espèces par classes, ordres, genres et espèces. Dans la première édition du Systema naturae de 1735, il place les champignons (Fungi) aux côtés des fougères, des mousses et des algues parmi les végétaux cryptogames, c'est-à-dire sans mode de reproduction visible. Sa classification est affinée dans le Species plantarum de 1753, avec 86 espèces décrites, réparties en 11 sections.
| Classification de Linné (1753)[6] | |
|---|---|
|
 |
Fondements de la systématique mycologique au XIXe siècle
La connaissance des champignons fait une avancée fondamentale grâce aux travaux du mycologue sud-africain Christiaan Hendrik Persoon, dont l'essentiel Synopsis methodica fungorum publié en 1801. Il catalogue près de 2 000 espèces (contre une centaine connue de ses prédécesseurs) et crée plus de 70 genres, la plupart étant toujours valides au XXIe siècle. Sa classification, dite naturelle, est fondée sur la forme du champignon, considéré comme une fructification (carpophore), et sur la position des « semences ». C'est Persoon qui introduit la notion d'hyménium pour caractériser le tissu fertile, dont la configuration servira longtemps de base à la classification des espèces.
Codes et nomenclature
-(1912))_(16565218607).jpg.webp)
En raison de l'appartenance traditionnelle des champignons au règne végétal, les règles relatives à leur taxinomie suivent la nomenclature botanique. Celle-ci est formalisée à partir de 1867 par les Lois de la nomenclature botanique de De Candolle, qui ont surtout valeur de recommandations[7]. Elles prennent un caractère obligatoire avec les Règles internationales de nomenclature botanique adoptées au deuxième Congrès international de botanique de Vienne en 1905[8]. Ces règles sont révisées à intervalles réguliers et sont renommées Code International de Nomenclature Botanique en 1952, puis Code international de nomenclature pour les algues, les champignons et les plantes en 2012.
Les champignons font néanmoins l'objet de règles, de précisions et d'exceptions particulières dans les différentes versions du code. Elles s'appliquent à tous les organismes traditionnellement traités comme des champignons, qu'ils soient fossiles ou non, ce qui inclut les chytrides, les oomycètes et les myxomycètes, mais exclut les microsporidies (qui sont désormais classées dans le règne des Fungi)[9].
Point de départ et noms sanctionnés
Énoncées dès 1905, les règles relatives aux points de départ de la nomenclature se veulent une limitation du Principe de Priorité (en). Ainsi, s'il ne peut en théorie exister qu'une seule désignation valable et que celle-ci doit être la plus ancienne, les noms décrits avant la date officielle choisie comme point de départ ne peuvent pas être retenus. En 1910, les dates suivantes sont édictées pour la mycologie[8] :
- 1753 (publication de Species plantarum par Linné) pour les lichens et les myxomycètes ;
- 1801 (publication de Synopsis methodica fungorum par Persoon) pour les rouilles (Uredinales), les charbons (Ustilaginales) et les gastéromycètes ;
- 1821 - 1832 (publications des trois volumes de Systema mycologicum par Fries) pour tous les autres champignons.
Néanmoins, la référence à plusieurs volumes pour Fries donne lieu à de nombreux débats dans la première moitié du XXe siècle. Pour les résoudre, le congrès de 1950 à Stockholm choisit de se référer à des dates arbitraires plutôt qu'à des ouvrages : , et . Mais cette solution crée de nouveaux problèmes, puisqu'elle oblige à chercher la première mention d'un nom dans des ouvrages parfois difficiles à dater, et qui ne sont parfois pas ceux de Persoon ou de Fries. La révision de 1981 à Sydney rétablit la date du pour tous les champignons, et établit la notion de nom sanctionné, qui protège les noms adoptés par Persoon dans le Synopsis et par Fries dans Systema mycologicum et Elenchus Fungorum. Le double point est adopté pour indiquer cette « sanction » dans les citations d'auteurs[10]. Cette option est abandonnée dans la révision adoptée au XIe Congrès international de mycologie tenu à San Juan (Porto Rico) en 2018 : s'il est nécessaire d'indiquer la sanction, seule la mention « nom. sanct. » est recommandée[11].
Exemple : l'espèce Peziza araneosa a été décrite en 1786 par Pierre Bulliard. Comme il s'agit d'un champignon de la catégorie « autres », la priorité revient au nom choisi par Fries. Or celui-ci mentionne l'espèce sous le même nom dans le deuxième volume du Systema, paru en 1822. En fonction des versions du code, le champignon pouvait donc être cité des façons suivantes[10] :
- entre 1910 et 1950 : Peziza araneosa Fr. — l'origine du nom est ainsi éludée ;
- entre 1950 et 1981 : Peziza araneosa St.-Amans — car Saint-Amans cite l'espèce dans sa Flore agenaise de 1821 ;
- entre 1981 et 2018 : Peziza araneosa Bull. : Fr. — l'origine du nom est attribuée à Bulliard, qui est ensuite sanctionné par Fries.
- depuis 2018 : Peziza araneosa Bull., nom. sanct.
Suffixes des taxons
Les noms de taxons supérieurs à l'ordre sont automatiquement typifiés selon des désinences fixes[9] :
- -mycota pour l'embranchement (ou division) — exemple : Basidiomycota ;
- -mycotina pour le sous-embranchement (ou sous-division) — exemple : Agaricomycotina ;
- -mycetes pour la classe ; — exemple : Pezizomycetes ;
- -mycetidea pour la sous-classe — exemple : Phallomycetidae.
- -mycetes pour la classe ; — exemple : Pezizomycetes ;
- -mycotina pour le sous-embranchement (ou sous-division) — exemple : Agaricomycotina ;
Les suffixes pour les rangs inférieurs suivent en revanche les règles générales de la nomenclature botanique[9] :
- -ales pour l'ordre — exemple : Polyporales ;
- -ineae pour le sous-ordre — exemple : Boletineae ;
- -aceae pour la famille — exemple : Russulaceae ;
- -oideae pour la sous-famille — exemple : Leccinoideae ;
- -eae pour la tribu ; — exemple : Panaeoleae ;
- -inae pour la sous-tribu — très rarement utilisé en mycologie.
- -eae pour la tribu ; — exemple : Panaeoleae ;
- -oideae pour la sous-famille — exemple : Leccinoideae ;
- -aceae pour la famille — exemple : Russulaceae ;
- -ineae pour le sous-ordre — exemple : Boletineae ;
Un champignon, un nom
Chaque taxon de champignon reçoit un unique nom correct, préféré par la communauté scientifique. Plusieurs synonymes peuvent y être liés. Le basionyme est historiquement le premier nom donné au taxon. Les synonymes se rapportant au même type biologique que le basionyme sont les « synonymes obligatoires ». Les synonymes se rapportant à d'autres types sont les « synonymes taxinomiques ». Un nom invalide (nom. inval.) a été publié sans respecter le Code international de nomenclature pour les algues, les champignons et les plantes. La base de données MycoBank vise à recenser l'intégralité des noms scientifiques des champignons et précise leur statut taxinomique[12].
Problèmes et controverses
Pour des raisons historiques, la nomenclature des Eucaryotes microbiens a toujours été reléguée au second plan. Il s'agit d'un héritage de la classification traditionnelle du vivant basée sur les formes multicellulaires les plus étudiées (plantes, champignons et animaux)[13]. Les protistes relevaient traditionnellement de la juridiction du CIN s'ils étaient des « algues » ou des « champignons » et de la juridiction du Code international de nomenclature zoologique (CINZ) s'ils étaient des « protozoaires »[14]. Dès l'origine, un certain nombre de groupes ont été décrits en parallèle par des zoologistes et par des botanistes. En mycologie, le principal exemple est constitué des myxomycètes (Myxomycetes G. Winter, 1880 - CIN) ou mycétozoaires (Mycetozoa de Bary, 1873 - CINZ) qui décrivent le même groupe d'organismes plasmodiaux. Chacun de ses rangs inférieurs a reçu une série parallèle de noms indépendamment, pour tenir compte des terminaisons appropriées pour chaque code (classification dite « ambirégnale »)[15].
La situation a été exacerbée à partir des années 1960, car de nombreux genres ont été reclassés pour refléter la découverte de nouveaux taxons. La classification traditionnelle des protozoaires et des algues s'est effondrée au cours des années 1970 et 1980 et de nombreux groupes ont été réorganisés. Par la suite, la phylogénie moléculaire a démontré que les champignons sont un groupe frère des animaux, et les protistes découverts à la base de ces deux clades ont été décrits selon les règles du CINZ[14]. Une situation plus problématique encore se produit lorsque différents stades de vie d'un même organisme peuvent être régis par des codes différents : ainsi, le taxon Hyperamoeba, traditionnellement traité par le CINZ, s'est avéré être le stade solitaire de plusieurs myxomycètes disparates, nommés selon les règles du CIN[13].
L'une des solutions consiste à suivre les recommandations des deux codes pour garantir que l'espèce nouvellement décrite soit valide dans tous les cas. Elle a été suivie par exemple pour les nouveaux taxons d'acrasides, un groupe historiquement rattaché aux myxomycètes (et donc régi par le CIN) mais qui est désormais phylogénétiquement emboîté dans les Excavata (constitué de protozoaires). Il s'agit néanmoins d'un fardeau injuste à supporter pour les chercheurs qui comporte un risque important de non conformité[13]. Et la conséquence la plus grave de cette instabilité nomenclaturale des protistes a été leur omission progressive des manuels de biologie : sans une classification avec des noms stables à enseigner aux étudiants, l'importance de la diversité des protistes pour la communauté biologique s'en est trouvé diminuée[14].
Place des champignons dans la classification du vivant
Prémices historiques : la dichotomie du vivant
Depuis l'antiquité et Aristote, le vivant est divisé en deux groupes : les animaux et les plantes. Cette division est formalisée en deux « règnes » par Linné au XVIIIe siècle : l'animal, qui a le pouvoir de locomotion, et le végétal, qui possède celui de photosynthèse. Bien qu'il ne soient pas photosynthétiques, les champignons sont considérés comme des plantes en raison de leur immobilisme. L'idée qu'ils puissent former un règne séparé est émise dès la fin du XVIIIe siècle par Noël de Necker, qui observe au microscope « des productions artificielles d'animaux, ou si l'on veut des semences qui se changent en animalcules. » Il propose la création d'un règne « mésymale » (moyen ou neutre), qui devra « suivre immédiatement celui du végétal ; alors les champignons formeront le troisième règne, et les minéraux le quatrième[16]. »
Si la proposition de Necker n'est pas suivie, le principe d'un règne intermédiaire est exploré à plusieurs reprises durant le XIXe siècle à la suite des avancées de la microscopie : il est en effet de plus en plus difficile de déterminer la nature animale ou végétale des organismes unicellulaires. En 1866, Ernst Haeckel propose la création d'un règne des protistes pour regrouper ces organismes « inférieurs ». Il y place les bactéries, les algues, les mousses, les amibes, les paramécies, les myxomycètes et même les éponges. Dans la version initiale, les champignons et les lichens restent dans le règne végétal, puis sont eux aussi considérés comme des protistes dans une révision ultérieure[17].
Redéfinitions au XXe siècle : les nouveaux règnes
La création d'un règne séparé pour les champignons n'est finalement concrétisée qu'en 1959 par Robert Harding Whittaker[18], qui propose un système à quatre règnes : plantes (Plantae), champignons (Fungi), animaux (Animalia) et protistes (Protista). Il y ajoute un cinquième règne pour les procaryotes (Monera) en 1969. Son approche se base sur le niveau de complexité des organismes (des unicellulaires procaryotes aux multicellulaires et multinucléés) et le mode de nutrition : ingestion pour les animaux, absorption pour les champignons et photosynthèse pour les plantes[17].
| Classification de Whittaker (1969)[17] | |
|---|---|
|
 Classification du vivant en cinq règnes, basée sur le niveau de complexité et le mode de nutrition (photosynthèse, absorption, ingestion). Bien que polyphylétique, le règne des Fungi regroupait des organismes ayant développé des caractéristiques similaires par convergence évolutive. |
Bien qu'il reconnaisse la valeur de la monophylie en systématique, Whittaker estime que les autres objectifs ne doivent pas nécessairement être sacrifiés pour la suivre à tout prix. Ses trois règnes supérieurs sont ainsi explicitement polyphylétiques, rassemblant à chaque fois une lignée majeure (les Eumycètes, ou « champignons vrais » dans le cas des Fungi) et plusieurs lignées mineures qui ont évolué dans la même direction, mais avec « moins de succès[17] ».
Cette approche est critiquée notamment par Thomas Cavalier-Smith, qui estime que les taxons doivent être monophylétiques et basés sur la structure cellulaire fondamentale plutôt que sur les adaptations nutritionnelles. En 1981, il divise les eucaryotes en neuf groupes, qui forment un système à sept règnes. Celui des Fungi, annoncé comme probablement monophylétique, comprend deux ensembles, les Eufungi et les Ciliofungi. Il en retranche cependant les Pseudofungi (Oomycètes et affines) qu'il assemble avec des diatomées et des algues brunes dans un groupe nommé Heterokonta, partie du nouveau règne des Chromistes (Chromista). Cavalier-Smith redéfinit ainsi le règne fongique comme regroupant les organismes hétérotrophes à paroi cellulaire, dépourvus de plastes, de la capacité de phagotrophie et de poils ciliaires tubulaires, synthétisant la lysine par la voie de l'alpha-aminoadipate et dotés de mitochondries à crêtes plates plutôt que tubulaires[19].
En 1987, le biologiste britannique émet également l'hypothèse que les animaux et les champignons sont étroitement apparentés et partagent un ancêtre commun semblable aux Choanoflagellés actuels. Il propose le nom Opisthokonta (« à flagelle postérieur », principale caractéristique commune) pour le clade unissant ces trois groupes[20]. Les premières études phylogénétiques moléculaires des années 1990 confirment rapidement ce postulat et établissent que la lignée évolutive menant aux champignons et aux animaux exclut les plantes et la grande majorité des protistes[21]. Elles découvrent aussi le lien insoupçonné entre les Fungi et les microsporidies, des parasites intracellulaires considérés auparavant comme des protistes et supposés avoir émergé au tout début du développement des Eucaryotes[22]. À la fin du millénaire, Cavalier-Smith publie une révision complète de son système à six règnes qui intègre les nouvelles données moléculaires. Le règne des Fungi, qui inclut alors les microsporidies, y est divisé en groupes polyphylétiques dont la pertinence sera ultérieurement débattue et qui feront l'objet de multiples réarrangements. Mais les délimitations mêmes du règne restent inchangées depuis[23].
Développements au XXIe siècle : les super-groupes
Bien que la plupart des espèces décrites appartiennent aux groupes d'organismes multicellulaires des animaux, des plantes terrestres et des champignons, il devient de plus en plus évident que ces trois règnes ne représentent qu’une faible proportion de la diversité totale des Eucaryotes. La majeure partie de cette diversité se trouve classée par défaut dans le « taxon poubelle » des protistes, que les avancées phylogénétiques ont rendu aussi artificiel qu'injustifié. La résolution de l'arbre évolutif des Eucaryotes devient ainsi une priorité pour la recherche biologique du troisième millénaire, qui a besoin de cet outil fondamental pour étudier la biologie cellulaire, l'organisation génomique ou l'apparition de la multicellularité[24].
Le modèle qui apparaît au début des années 2000 propose la division des Eucaryotes en « super-groupes ». Cette nouvelle catégorie est plutôt informelle et désigne des assemblages extrêmement larges pour lesquelles il existe des preuves raisonnables de monophylie. Les premières propositions font état de six super-groupes : Opisthokonta (qui comprend notamment les animaux et les champignons), Archaeplastida (ou Plantae), Amoebozoa, Chromalveolata, Rhizaria (ou Cercozoa) et Excavata[25]. Le modèle devient vite très populaire dans la littérature et les manuels grâce à sa simplicité et il s'impose comme le standard descriptif de l'arrangement des Eucaryotes. Les groupes initiaux ont été en grande partie redéfinis ou assemblés entre eux, et la version de 2020 comprend toujours des zones d'ombres et des hypothèses à vérifier[24].
| Eukaryote Tree of Life (eToL, 2020)[24] | |
|---|---|
Place des champignons historiques[26] :
|
.svg.png.webp) Arbre phylogénétique des Eucaryotes, répartis en plusieurs « super-groupes ». Les lignées encadrées comprennent des taxons qui ont parfois été classés comme champignons. |
La position des Fungi au sein du super-groupe des Opisthocontes est peu à peu précisée : leurs parents les plus proches s'avèrent être les Nucléarides (désormais proposés comme le règne des Nucleariae), un groupe énygmatique d'organismes amiboïdes à filopodes rayonnants[27]. Ensemble, les deux règnes forment le clade des Holomycota, qui est lui-même le groupe frère des Holozoa, réunissant les animaux (Metazoa) aux Ichtyosporés (Ichthyosporea) et aux Choanoflagellés (Choanoflagellata)[28]. Les Opisthocontes sont eux-mêmes liés aux Amibozoaires (Amoebozoa), qui regroupent notamment les amibes du genre Amoeba et les mycétozoaires. Le clade Amorphea qui réunit ces deux groupes est solidement soutenu dans la plupart des analyses phylogénomiques[24]. Il est défini comme le plus petit ensemble contenant les descendants de l'ancêtre commun à Homo sapiens (animal), Neurospora crassa (champignon) et Dictyostelium discoideum (mycétozoaire)[28], et comprendrait également deux petites lignées de flagellés hétérotrophes, les Breviates et les Apusomonada[24].
Groupes exclus
Plusieurs groupes d'organismes ont été au cours du temps considérés comme des champignons en raison de caractéristiques morphologiques ou écologiques similaires.
Bactéries
L'ensemble des bactéries est originellement considéré comme des champignons. Le botaniste suisse Karl Wilhelm von Nägeli crée en 1857 la classe des Schizomycètes (ou « champignons à fission ») pour les englober. Si cette perspective est peu à peu abandonnée, certains groupes sont longtemps rapprochés des champignons, comme les Actinomycètes, qui partagent une morphologiqe filamenteuse et un mode de vie tellurique, ou les Planctomycetes.
Champignons amiboïdes
%252C_Gelbe_Lohbl%C3%BCte_(D)%252C_Fleur_de_tan_(F)%252C_Heksenboter_or_Trollbutter_(NL))_with_tiny_snail_at_Warnsborn_forest_-_panoramio.jpg.webp)
Les champignons amiboïdes ou champignons-animaux ne partagent qu'une ressemblance superficielle de leur appareil sporifère avec les autres organismes fongiques[29]. Ils étaient traditionnellement traités comme le groupe des myxomycètes, un taxon aux dimensions variables selon les auteurs et les époques, et qui s'est lui-même révélé polyphylétique. Il regroupait des organismes unicellulaires présentant au cours de leurs cycles de vie une phase pluricellulaire (pseudoplasmode) ou syncitiale (plasmode)[26]. Bien qu'étudiés par usage par les mycologues, les myxomycètes n'ont longtemps pas eu une place consensuelle dans la classification du vivant, certains auteurs les rattachant aux animaux (De Bary, 1887 ; Lister, 1925 ; Olive, 1970) et d'autres aux plantes (MacBride, 1899 ; Martin, 1932 ; Smith, 1955)[30]. La plupart des groupes ont ainsi un nom zoologique (selon le Code international de nomenclature zoologique, CINZ) et un nom mycologique (selon le Code international de nomenclature botanique, CIN)[31]. L'ensemble des myxomycètes a été peu à peu démantelé, et les analyses moléculaires ont confirmé plusieurs lignées indépendantes, très éloignées les unes des autres. Aucune ne fait partie du clade des champignons vrais[26].
Les myxomycètes au sens strict (CIN : Myxomycota / CINZ : Myxogastria) comptent plus d'espèces que tous les autres groupes et se rencontrent dans tous les écosystèmes terrestres[31]. Ils forment un plasmode vrai, c'est-à-dire une unique cellule constituée de très nombreux noyaux. Les études phylogénétiques ont supporté la monophylie du groupe, qui fait partie, avec d'autres mycétozoaires, du super-groupe « protiste » des amibozoaires (Amoebozoa)[32].

Les acrasiomycètes (CIN : Acrasiomycota) sont un groupe polyphylétique qui réunissait les espèces formant un pseudoplasmode, c'est-à-dire une agrégation d'amibes individuelles. Il comprenait traditionnellement trois groupes : les dictyostélides (CIN : Dictyosteliomycetes / CINZ : Dictyostelia), les protostélides (CIN : Protosteliomycetes / CINZ : Protostelia) et les acrasides (CIN : Acrasiales / CINZ : Acrasida). Les deux premiers ont été rapprochés des Myxogastria pour former le groupe des mycétozoaires (Mycetozoa), lui-même polyphylétique[33]. Les études des années 2010 ont démontré l'existence d'un clade monophylétique réunissant les Myxogastria et les dictyostélides[32] et formant l'essentiel de la classe des Eumycetozoa, ou « mycétozoaires vrais »[28]. Les prostélides sont aussi des amibozoaires mais ne constituent pas un groupe homogène[32]. Les acrasides sont en revanche très éloignés dans l'arbre phylogénétique des Eucaryotes : ils appartiennent à un groupe d'amibes à pseudopodes en lobes (Heterolobosea) au sein du clade des Discoba. Cette lignée probablement située en position basale formait avec d'autres le super-groupe des Excavata, dont la monophylie n'est plus soutenue[28]. Enfin, le genre Fonticula dont on ne connait qu'une seule espèce, était traditionnellement rattaché aux acrasiomycètes en raison de sa fructification en forme de volcan par agrégation cellulaire. Les études moléculaires l'ont cependant placé parmi les Opisthokontes à proximité des Nuclearida[34]. La révision taxinomique de 2018 a proposé un nouveau règne regroupant ces deux lignées, les Nucleariae, lesquels forment avec les Fungi le super-règne des Holomycota[35].

Les labyrinthulomycètes (CIN : Labyrinthulomycota / CINZ : Labyrinthulea), également connus sous le nom d'hydromyxomycètes, sont principalement des unicellulaires marins qui forment secondairement des réseaux de cellules (filoplasmodes ou réseaux ectoplasmiques)[26]. Ils sont composés de deux groupes, les labyrinthulides au sens strict (Labyrinthulida) et les thraustochytrides (CIN : Thraustochytridiomycetes / CINZ : Thraustochytrida). Ils font en réalité partie des Straménopiles, comme les Oomycètes[28].
Les plasmodiophoromycètes sont des phytoparasites notamment responsables de l'hernie du chou et de la gale poudreuse. Leur cycle de vie inclut également une forme en plasmode, ce qui a conduit à les rapprocher des myxomycètes[26]. Whittaker classait déjà les Plasmodiophoromycota parmi les protistes, et les études phylogénétiques les ont placés dans le groupe des Cercozoa de la lignée des Rhizaria[28].
Champignons-algues et pseudo-champignons
Les Oomycètes sont des organismes de petite taille à mode de vie aquatique, dont la multiplication asexuée et la reproduction sont assurées par des cellules nageuses munies de deux flagelles dissemblables qui les tirent en avant. Ils présentent un mode de vie typiquement fongique : leur appareil végétatif est filamenteux et constitué de siphons permettant une nutrition par absorbotrophie[29]. En 1858 déjà, le botaniste allemand Nathanael Pringsheim relève les affinités morphologiques de ces structures reproductrices avec celles de l'algue jaune-verte Vaucheria[36]. En 1892, Joseph Schröter crée la classe des Phycomycètes, ou « champignons-algues », qui rassemblent les espèces à cellules flagellées à un stade de leur cycle de vie. Le taxon est longtemps utilisé pour regrouper les Oomycètes, les Hyphochytridiomycètes et les Chytridiomycètes[26].
À partir des années 1960, la nature fongique de ces organismes est remise en question par plusieurs découvertes biochimiques et morphologiques. Les Oomycètes montrent ainsi une voie de biosynthèse de la lysine différente des autres champignons et identique à celle des plantes et des algues vertes[37]. Leur paroi cellulaire est majoritairement composée de glucanes et de cellulose, alors que celle des champignons est à base de chitine[38]. Whittaker inclut en 1969 les Oomycètes dans son règne fongique (division des Oomycota), tout en soulignant qu'ils proviennent d'une lignée évolutive distincte de celle des Eumycètes[17]. Cavalier-Smith entérine cette distinction en créant le groupe des Pseudofungi pour rassembler les Oomycètes, les Labyrinthulomycètes, les Thraustochytridiomycètes et les Hyphochytridiomycètes. Il le place aux côtés des diatomées et des algues brunes dans le nouveau règne des Chromistes[19],[20]. Les analyses moléculaires viennent confirmer ce schisme en démontrant la parenté de ce groupe avec les algues brunes. Bien que les Oomycètes continuent d'être traités dans les manuels de mycologie, il devient généralement admis dans les années 1990 que « Neurospora [ascomycète] est probablement plus étroitement lié au museau d'une vache qu'à Saprolegnia [oomycète] »[39].
Le nouvel ensemble, dont le rang taxinomique exact reste débattu, a été nommé Heterokonta (« à flagelles dissemblables[29] ») par Cavalier-Smith[40], et Stramenopiles (« paille poilue », en référence à l'apparence des flagelles[36]) par Patterson (en)[41]. Il comprend deux clades[42] :
- les Bigyra, qui contiennent les Labyrinthulomycètes ;
- les Gyrista, qui se divisent entre Pseudofungi (Oomycètes et Hyphochytridiomycètes) et Ochrophyta (des algues principalement photosynthétiques).
Autres groupes
Les Ellobiopsidae sont des parasites de crustacés qui ont parfois été rapportés aux champignons en raison de leurs suçoirs ramifiés. Ils sont désormais rattachés aux Alvéolobiontes (Alveolata)[26].
Les Trichomycètes étaient un taxon de parasites vivant a l’extrémité rectale du tube digestif d'arthropodes. Cet assemblage s'est révélé provenir de deux lignées convergentes[26] :
- les Asellariales et les Harpellales appartiennent à la division des Kickxellomycota (issue du démantèlement des zygomycètes), et sont donc des champignons au sens strict[28] ;
- les Eccrinales et les Amoebidiales, font partie des Ichthyosporea, un clade de parasites de poissons et d'arthropodes plus proche des animaux que des champignons[26].
Systématique interne
La classification interne du règne des Fungi a été intensément étudiée et profondément remaniée au cours des deux premières décennies du XXIe siècle. Les analyses moléculaires ont en effet démontré la polyphylie de nombreux groupes hérités de l'approche phénétique[26].
| Divisions classiques | Hibbett et al. (2007)[43] 7 divisions |
Tedersoo et al. (2018)[35] 9 sous-règnes |
|---|---|---|
| (?) Aphelidium | (non traité) | Aphelidiomyceta |
| Microsporidia | Microsporidia | Rozellomyceta |
| Chytridiomycota | (?) Rozella | |
| Blastocladiomycota | Blastocladiomyceta | |
| Neocallimastigomycota | Chytridiomyceta | |
| Chytridiomycota | ||
| (?) Olpidium | Olpidiomyceta | |
| Zygomycota | (?) Basidiobolus | Basidiobolomyceta |
| (?) Entomophthoromycotina | Zoopagomyceta | |
| (?) Kickxellomycotina | ||
| (?) Zoopagomycotina | ||
| (?) Mucoromycotina | Mucoromyceta | |
| Glomeromycota | ||
| Ascomycota | Ascomycota | Dikarya |
| Basidiomycota | Basidiomycota |
Microsporidies et lignées basales
Les microsporidies sont un groupe très diversifié d'eucaryotes unicellulaires, exclusivement composé de parasites intracellulaires obligatoires d'autres eucaryotes. Ces organismes apparemment simples étaient traditionnellement placés parmi les plus primitifs des eucaryotes, mais la phylogénie moléculaire a permis de découvrir qu'il s'agit en réalité de champignons hautement spécialisés[44]. Cette nature fongique est corroborée par des traits communs avec les autres mycètes, comme une mitose « fermée » (l'enveloppe nucléaire reste intacte alors qu'elle se rompt chez les animaux) ou la production de spores contenant de la chitine et du tréhalose[45]. Les microsporidies auraient divergé des autres lignées fongiques à un stade précoce et dériveraient d'un ancêtre endoparasite chytride proche de l'actuel genre Rozella[45].
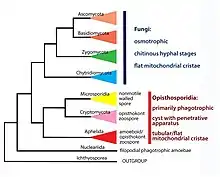
De multiples groupes d'organismes unicellulaires partagent néanmoins cette position basale et leur placement à l'intérieur ou à l'extérieur du règne fongique reste débattue[35]. Un autre groupe d'endoparasites algaires, décrits comme la classe des Aphelidea, ont montré des traits communs avec les champignons primitifs[47]. L'analyse d'ADN environnemental présent dans de nombreux écosystèmes dont le sol, l'eau douce et les sédiments aquatiques, a mis en évidence une branche très diversifiée qui contient Rozella et baptisé Cryptomycota[48]. Le clade formé par ces trois groupes est nommé de manière informelle « ARM » (en reprenant les initiales de ces trois composantes principales : Aphelidea, Rozella, Microsporidia) et il a été proposé d'en faire une super-division, les Opisthosporidia, interprétés comme un groupe frère des champignons vrais[46]. D'autres études ont souligné la grande proximité génomique entre les Cryptomycota et les microsporidies à un niveau basal[49], alors que les Aphelidea auraient divergé plus tardivement. La révision taxinomique de 2018 a proposé le sous-règne Rozellomyceta pour accommoder les microsporidies et les Cryptomycota, et le sous-règne monotypique Aphelidiomyceta pour les Aphelidea (renommées Aphelidomycota pour respecter les standards de la nomenclature fongique)[35].
Chytrides
.png.webp)
Le groupe des chytrides regroupait des champignons principalement aquatiques dont les spores sont flagellées[45]. Ils étaient considérés durant la seconde moitié du XXe siècle comme la plus primitive des quatre divisions de champignons vrais, les autres ayant ensuite perdu leur flagelle pour mener à la diversification des champignons terrestres[17]. Les études phylogénétiques moléculaires des années 2000 ont cependant montré que le regroupement était polyphylétique et ont mis en évidence quatre épisodes distincts de perte de flagelle au cours de l'évolution. Ces pertes ont à chaque fois coïncidé avec le développement d'autres mécanismes de dispersion des spores[45].
Ces informations ont conduit à une réorganisation profonde de la systématique des chytrides en quatre clades[50]. Le premier comprend le cœur de l'ancienne division, appelé groupe des « chytrides vrais ». Il est formé de trois divisions, Chytridiomycota (sens restreint), Monoblepharomycota et Neocallimastigomycota. L'ancien ordre des Blastocladiales a été érigé en division indépendante, les Blastocladiomycota. Malgré leurs spores flagellées, les genres Rozella et Olpidium ne sont pas apparentés directement aux autres groupes et sont issus de lignées indépendantes. Le premier forme un groupe frère des microsporidies, alors que le second est niché dans la phylogénie des zygomycètes[50].
En 2018, ces quatre lignées de champignons chytrides ont servi de base à la création de quatre sous-règnes : Chytridiomyceta (les « chytrides vrais »), Blastocladiomyceta, Rozellomyceta (qui comprend aussi les microsporidies) et Olpidiomyceta[35].
Zygomycètes
Les champignons zygomycètes formaient une division unique décrite en 1954 par Fernand Moreau, les Zygomycota. Ce regroupement était basé sur une reproduction sexuée par des zygospores, une reproduction asexuée fréquente par sporanges, l'absence de sporophores multicellulaires et la production de cénocytes. Il était interprété comme une transition majeure entre les champignons primitifs à zoospores (chytrides et autres) et les formes filamenteuses, non-flagellées et pluricellulaires des Ascomycètes et des Basidiomycètes (sous-règne des Dikarya)[51]. Les études de phylogénie moléculaire ont néanmoins montré que l'asemblage était artificiel, rassemblant des espèces issues de lignées évolutives indépendantes[45]. L'abandon de la division des Zygomycota a été formalisé en 2007, avant que les positions exactes des différents clades ait pu être totalement résolues[43]. Toutes les analyses concordent néanmoins pour définir au moins deux groupes majeurs.
Le premier, appelé de manière informelle « zygomycètes I », est le groupe frère des Dikarya[51]. Depuis 2018, il forme le sous-règne des Mucoromyceta, constitué de quatre divisions[35]. Les Mucoromycota comprennent les genres Mucor, Rhizopus et la majorité des zygomycètes les plus courants et les plus connus. Beaucoup d'entre eux sont des colonisateurs précoces à croissance rapide de substrats riches en carbone et plusieurs espèces sont utilisées dans l'industrie pour la production d'acides organiques. Les Mortierellomycota sont des champignons telluriques assez communs, que l'on retrouve principalement comme endophytes racinaires des plantes ligneuses. Les Glomeromycota forment des endomycorhizes arbusculaires, qui constituent sans doute la symbiose plante-champignon la plus réussie sur Terre. Ils constituent une énigme phylogénétique car on ne leur connaît aucune forme de reproduction sexuée[51]. Les Calcarisporiellomycota contiennent principalement le genre anamorphe Calcarisporiella[35], qui était traditionnellement considéré comme un Ascomycète[52].
_Fresen_204248.jpg.webp)
Le deuxième groupe, les « zygomycètes II », comprend trois divisions rassemblées dans les sous-règnes des Zoopagomyceta[35]. Il est caractérisé par des modes de vie en association (symbiotique ou pathogène) quasiment exclusive avec des animaux ou d'autres champignons, et pratiquement jamais avec des plantes vivantes. Les Entomophthoromycota (« destructeurs d'insectes ») rassemblent des parasites d'insectes et d'acariens, des commensaux de reptiles et d'amphibiens, et des parasites d'algues peu connus. Les Kickxellomycota sont un assemblage très diversifié de champignons associés à l'intestin des arthropodes, d'espèces saprotrophes à large éventail de substrats, et de mycoparasites. Les Zoopagomycota sont constitués de mycoparasites obligatoires et d'agents pathogènes d'invertébrés, notamment des nématodes, des rotifères et des amibes[51].
Enfin, la position du genre Basidiobolus a fait l'objet d'interprétations contradictoires. Certaines phylogénies l'ont placé comme un groupe frère du chytride Olpidium[45], alors que d'autres ont soutenu son appartenance aux Entomophthoromycota[53]. La révision de 2018 en a fait la base d'un sous règne monotypique indépendant, les Basidiobolomyceta[35].
Champignons imparfaits
Sous le nom de « champignons imparfaits » ou deutéromycètes étaient réunies des espèces à reproduction purement asexuée (et donc sans méiose). La plupart de ces champignons sont en réalité des formes conidiennes d'Ascomycètes, plus rarement de Basidiomycètes ou de Zygomycètes. Il s'agit donc d'un ensemble polyphylétique (perte répétée de la sexualité chez des lignées indépendantes) et redondant avec la classification des formes sexuées (dite téléomorphes), qu'on ne peut utiliser que pour qualifier de façon pratique une stratégie de reproduction[26].
Si l'abandon d'un regroupement taxinomique séparé pour les formes aséxuées (dite anamorphes) est accepté depuis longtemps, sa mise en pratique a constitué un défi majeur pour la taxinomie mycologique du XXIe siècle. En effet, il y avait en 1995 environ 15 000 espèces décrites de deutéromycètes, réparties dans plus de 1 500 genres, ce qui en faisait le second groupe de champignons en importance après les Ascomycètes[54]. La règle dite « un champignon, un nom », appliquée depuis le , a aboli la possibilité d'une nomenclature distincte pour les formes téléomorphe et anamorphe d'un même taxon[55]. Mais les débats taxinomiques qu'elle a induits sont particulièrement complexes : par exemple, le genre asexué Aspergillus est associé à 11 genres sexués (Eurotium, Neosartorya, Emericella, etc.)[56].
Champignons dicaryotes
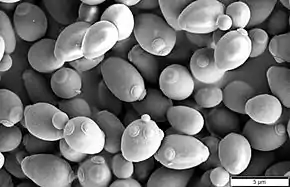
L'immense majorité des espèces fongiques décrites (environ 98% en 2006) appartiennent aux Ascomycota et aux Basidiomycota[45]. Ces deux divisions comprennent également la quasi-totalité des macrochampignons, c'est-à-dire les espèces capables de produire un sporophore multicellulaire complexe[57]. Elles forment ensemble un clade dont la monophylie est solidement attestée et que Thomas Cavalier-Smith avait nommé Neomycota[23]. Ce nom, dont la terminaison indique une division selon le code, a été remplacé par celui de Dikarya, et considéré comme un sous-règne[45]. Il fait allusion à la synapomorphie présumée de la présence d'hyphes dicaryotes (cellules à deux noyaux) à certains stades de développement[43].
Les Ascomycètes sont la plus grande division des champignons et se caractérisent par la production de méiospores (appelées ascospores) dans des sporanges spécialisées en forme de sac (les asques), qui peuvent être formées dans un sporophore (l'ascocarpe)[45]. L'organisation interne de la division a été entièrement revue en 1997 sur la base de critères à la fois morphologiques et moléculaires[58]. Elle comprend trois sous-divisions monophylétiques :
- les Taphrinomycotina sont les premiers à avoir divergé ; ils comprennent des espèces de type levure, comme Pneumocystis, et dimorphes (levures filamenteuses), comme Taphrina[45] ;
- les Saccharomycotina comprennent les « vraies » levures, comme la levure de boulanger (Saccharomyces cerevisiae) et Candida albicans, le pathogène fongique le plus fréquemment rencontré chez l'homme[45] ;
- les Pezizomycotina forment le groupe le plus important et comprennent la grande majorité des espèces filamenteuses productrices de sporophores[45].
.jpg.webp)
Les Basidiomycètes sont caractérisés par des basidiospores situées à l'extérieur de sporanges en forme de massues, les basides[45]. Les relations phylogénétiques entre les différents sous-groupes sont moins certaines que pour les Ascomycètes. Elles ont été formalisées en 2006 en trois sous-divisions[59], auxquelles a été ajoutée une quatrième en 2014 :
- les Pucciniomycotina comprennent les rouilles, qui sont principalement des agents pathogènes des plantes terrestres[45] ;
- les Ustilaginomycotina rassemblent les charbons et des levures, dont la plupart provoquent des infections systémiques chez les Angiospermes[45] ;
- les Agaricomycotina sont en majorité des macromycètes qui montrent une très grande diversité morphologique. Les lignées à divergence précoce comprennent cependant des espèces capables de dimorphisme ou de phases de type levure[45] ;
- les Wallemiomycotina sont un groupe frère des précédents et comprennent notamment le genre Wallemia, une moisissure xérophile[60].
En 2015, une troisième division de champignons dicaryotes a été proposée (Entorrhizomycota) pour accommoder les espèces du genre Entorrhiza, qui forment des galles sur les racines des Cyperaceae et des Juncaceae'[61].
Mise à jour taxinomique de 2018
Constatant que les hypothèses écologiques évolutives sont difficiles à tester en l'absence d'une classification qui applique le même niveau de résolution dans chaque sous-groupe, une équipe de chercheurs de l'Université de Tartu propose en 2018 une révision taxinomique des niveaux supérieurs du règne fongique. En veillant à ce que les différents rangs soient monophylétiques et montrent un temps de divergence comparable, ils présentent une classification jusqu'au niveau de la classe qui introduit un nombre important de nouveaux noms. Selon les auteurs, le règne des Fungi se divise en 9 sous-règnes, 18 divisions et 74 classes[35].
- Opisthokonta
- super-règne Holozoa B.F. Lang et al., 2002
- super-règne Holomycota Y. Liu, 2009
- règne Nucleariae Tedersoo et al., 2018
- règne Fungi R.H. Whittaker, 1959
- I sous-règne Rozellomyceta Tedersoo et al., 2018
- 1 division Rozellomycota Doweld, 2013
- sous-division Rozellomycotina Tedersoo et al., 2018
- classe Microsporidea Corliss & Levine, 1963
- sous-division Rozellomycotina Tedersoo et al., 2018
- 1 division Rozellomycota Doweld, 2013
- II sous-règne Aphelidiomyceta Tedersoo et al., 2018
- 2 division Aphelidiomycota Tedersoo et al., 2018
- sous-division Aphelidiomycotina Tedersoo et al., 2018
- classe Aphelidiomycetes Tedersoo et al., 2018
- sous-division Aphelidiomycotina Tedersoo et al., 2018
- 2 division Aphelidiomycota Tedersoo et al., 2018
- III sous-règne Blastocladiomyceta Tedersoo et al., 2018
- 3 division Blastocladiomycota T. James, 2006
- sous-division Blastocladiomycotina Tedersoo et al., 2018
- classe Blastocladiomycetes T. James, 2006
- classe Physodermatomycetes Tedersoo et al., 2018
- sous-division Blastocladiomycotina Tedersoo et al., 2018
- 3 division Blastocladiomycota T. James, 2006
- IV sous-règne Chytridiomyceta Tedersoo et al., 2018
- 4 division Chytridiomycota M. J. Powell, 2007
- sous-division Chytridiomycotina Tedersoo et al., 2018
- classe Chytridiomycetes Caval.-Sm., 1998[23]
- classe Cladochytriomycetes Tedersoo et al., 2018
- classe Mesochytriomycetes Tedersoo et al., 2018
- classe Lobulomycetes Tedersoo et al., 2018
- classe Polychytriomycetes Tedersoo et al., 2018
- classe Rhizophlyctidomycetes Tedersoo et al., 2018
- classe Rhizophydiomycetes Tedersoo et al., 2018
- classe Spizellomycetes Tedersoo et al., 2018
- classe Synchytriomycetes Tedersoo et al., 2018
- sous-division Chytridiomycotina Tedersoo et al., 2018
- 5 division Monoblepharomycota Doweld, 2001[62]
- sous-division Monoblepharomycotina Tedersoo et al., 2018
- classe Monoblepharidomycetes J. H. Schaffn., 1909
- classe Hyaloraphidiomycetes Doweld, 2001[62]
- classe Sanchytriomycetes Tedersoo et al., 2018
- sous-division Monoblepharomycotina Tedersoo et al., 2018
- 6 division Neocallimastigomycota M. J. Powell, 2007
- sous-division Neocallimastigomycotina Tedersoo et al., 2018
- classe Neocallimastigomycetes M. J. Powell, 2007
- sous-division Neocallimastigomycotina Tedersoo et al., 2018
- 4 division Chytridiomycota M. J. Powell, 2007
- V sous-règne Olpidiomyceta Tedersoo et al., 2018
- 7 division Olpidiomycota Doweld, 2013
- sous-division Olpidiomycotina Doweld, 2013
- classe Olpidiomycetes Doweld, 2013
- sous-division Olpidiomycotina Doweld, 2013
- 7 division Olpidiomycota Doweld, 2013
- VI sous-règne Basidiobolomyceta Tedersoo et al., 2018
- 8 division Basidiobolomycota Doweld, 2001[62]
- sous-division Basidiobolomycotina Tedersoo et al., 2018
- classe Basidiobolomycetes Doweld, 2001[62]
- sous-division Basidiobolomycotina Tedersoo et al., 2018
- 8 division Basidiobolomycota Doweld, 2001[62]
- VII sous-règne Zoopagomyceta Tedersoo et al., 2018
- 9 division Entomophthoromycota Humber, 2012
- sous-division Entomophthoromycotina Humber, 2007
- classe Entomophthoromycetes Humber, 2012
- classe Neozygitomycetes Humber, 2012
- sous-division Entomophthoromycotina Humber, 2007
- 10 division Kickxellomycota Tedersoo et al., 2018
- sous-division Kickxellomycotina Benny, 2007
- classe Kickxellomycetes Tedersoo et al., 2018
- classe Asellariomycetes Tedersoo et al., 2018
- classe Barbatosporomycetes Tedersoo et al., 2018
- classe Dimargaritomycetes Tedersoo et al., 2018
- classe Harpellomycetes Tedersoo et al., 2018
- classe Ramicandelaberomycetes Tedersoo et al., 2018
- sous-division Kickxellomycotina Benny, 2007
- 11 division Zoopagomycota M.E. Smith, Spatafora & Stajich, 2016[51]
- sous-division Zoopagomycotina Benny, 2007
- classe Zoopagomycetes Doweld, 2014
- sous-division Zoopagomycotina Benny, 2007
- 9 division Entomophthoromycota Humber, 2012
- VIII sous-règne Mucoromyceta Tedersoo et al., 2018
- 12 division Mucoromycota Doweld, 2001[62]
- sous-division Mucoromycotina Benny, 2006
- classe Mucoromycetes Doweld, 2001[62]
- classe Endogonomycetes Doweld, 2014
- classe Umbelopsidomycetes Tedersoo et al., 2018
- sous-division Mucoromycotina Benny, 2006
- 13 division Mortierellomycota Tedersoo et al., 2018
- sous-division Mortierellomycotina Kerst. Hoffm., K. Voigt & P.M. Kirk, 2011
- classe Mortierellomycetes Doweld, 2014
- sous-division Mortierellomycotina Kerst. Hoffm., K. Voigt & P.M. Kirk, 2011
- 14 division Calcarisporiellomycota Tedersoo et al., 2018
- sous-division Calcarisporiellomycotina Tedersoo et al., 2018
- classe Calcarisporiellomycetes Tedersoo et al., 2018
- sous-division Calcarisporiellomycotina Tedersoo et al., 2018
- 15 division Glomeromycota C. Walker & A. Schüßler, 2001
- sous-division Glomeromycotina Spatafora & Stajich, 2016[51]
- classe Glomeromycetes Caval.-Sm., 1998[23]
- classe Archaeosporomycetes Sieverd., G.A. Silva, B.T. Goto & Oehl, 2011
- classe Paraglomeromycetes Oehl, G.A. Silva, B.T. Goto & Sieverd, 2011
- sous-division Glomeromycotina Spatafora & Stajich, 2016[51]
- 12 division Mucoromycota Doweld, 2001[62]
- IX sous-règne Dikarya Hibbett, T.Y. James & Vilgalys, 2007[43]
- 16 division Entorrhizomycota R. Bauer, Garnica, Oberw., K. Riess, M. Weiß & Begerow, 2015
- sous-division Entorrhizomycotina Tedersoo et al., 2018
- classe Entorrhizomycetes Begerow, Stoll & R. Bauer, 2006
- sous-division Entorrhizomycotina Tedersoo et al., 2018
- 17 division Basidiomycota R.H. Whittaker ex Moore, 1980
- sous-division Agaricomycotina Doweld, 2001[62]
- classe Agaricomycetes Doweld, 2001[62]
- classe Dacrymycetes Doweld, 2001[62]
- classe Tremellomycetes Doweld, 2001[62]
- sous-division Pucciniomycotina R. Bauer, Begerow, J.P. Samp., M. Weiss & Oberw., 2006[59]
- classe Agaricostilbomycetes R. Bauer, Begerow, J.P. Samp., M. Weiss & Oberw., 2006[59]
- classe Atractiellomycetes R. Bauer, Begerow, J.P. Samp., M. Weiss & Oberw., 2006[59]
- classe Classiculomycetes R. Bauer, Begerow, J.P. Samp., M. Weiss & Oberw., 2006[59]
- classe Cryptomycocolacomycetes R. Bauer, Begerow, J.P. Samp., M. Weiss & Oberw., 2006[59]
- classe Cystobasidiomycetes R. Bauer, Begerow, J.P. Samp., M. Weiss & Oberw., 2006[59]
- classe Microbotryomycetes R. Bauer, Begerow, J.P. Samp., M. Weiss & Oberw., 2006[59]
- classe Mixiomycetes R. Bauer, Begerow, J.P. Samp., M. Weiss & Oberw., 2006[59]
- classe Pucciniomycetes R. Bauer, Begerow, J.P. Samp., M. Weiss & Oberw., 2006[59]
- classe Spiculogloeomycetes Q.M. Wang, F.Y. Bai, M. Groenew. & Boekhout, 2015
- classe Tritirachiomycetes Aime & Schell, 2011
- sous-division Ustilaginomycotina R. Bauer, Begerow, J.P. Samp., M. Weiss & Oberw., 2006[59]
- classe Exobasidiomycetes Begerow, M. Stoll, R. Bauer, 2006
- classe Malasseziomycetes Boekhout, Q.M. Wang & F.Y. Bai, 2014
- classe Moniliellomycetes Q.M. Wang, F.Y. Bai & Boekhout, 2014
- classe Ustilaginomycetes R. Bauer, Oberw. & Vánky, 1997
- sous-division Wallemiomycotina Doweld, 2014
- classe Geminibasidiomycetes H.D.T. Nguyen & Seifert, 2015
- classe Wallemiomycetes Zalar, de Hoog & Schroers, 2005[60]
- sous-division Agaricomycotina Doweld, 2001[62]
- 18 division Ascomycota R.H. Whittaker, 1959
- sous-division Pezizomycotina O.E. Erikss. & Winka, 1997[58]
- classe Arthoniomycetes O.E. Erikss. & Winka, 1997[58]
- classe Collemopsidiomycetes Tedersoo et al., 2018
- classe Coniocybomycetes M. Prieto & Wedin, 2013
- classe Dothideomycetes O.E. Erikss. & Winka, 1997[58]
- classe Eurotiomycetes O.E. Erikss. & Winka, 1997[58]
- classe Geoglossomycetes Zheng Wang, C.L. Schoch & Spatafora, 2009
- classe Laboulbeniomycetes Engl., 1897
- classe Lecanoromycetes O.E. Erikss. & Winka, 1997[58]
- classe Leotiomycetes O.E. Erikss. & Winka, 1997[58]
- classe Lichinomycetes Reeb, Lutzoni & Cl. Roux, 2004
- classe Orbiliomycetes O.E. Erikss. & Baral, 2003
- classe Pezizomycetes O.E. Erikss. & Winka, 1997[58]
- classe Sordariomycetes O.E. Erikss. & Winka, 1997[58]
- classe Xylonomycetes R. Gazis & P. Chaverri, 2012
- sous-division Taphrinomycotina O.E. Erikss. & Winka, 1997[58]
- classe Archaeorhizomycetes Rosling & T. James, 2011
- classe Neolectomycetes O.E. Erikss. & Winka, 1997[58]
- classe Pneumocystidomycetes O.E. Erikss. & Winka, 1997[58]
- classe Schizosaccharomycetes O.E. Erikss. & Winka, 1997[58]
- classe Taphrinomycetes O.E. Erikss. & Winka, 1997[58]
- sous-division Saccharomycotina O.E. Erikss. & Winka, 1997[58]
- classe Saccharomycetes O.E. Erikss. & Winka, 1997[58]
- sous-division Pezizomycotina O.E. Erikss. & Winka, 1997[58]
- 16 division Entorrhizomycota R. Bauer, Garnica, Oberw., K. Riess, M. Weiß & Begerow, 2015
- I sous-règne Rozellomyceta Tedersoo et al., 2018
Défis et perspectives
Matière noire fongique
Le développement des méthodes moléculaires depuis la fin du XXe siècle s'est accompagné de la création d'une importante « matière noire fongique » : des taxons connus uniquement par des séquences provenant de l'environnement (le sol, le bois et l'eau, mais aussi les engins spatiaux, les tumuli et les zones résidentielles), sans qu'aucun spécimen ne soit collecté. Comme ils n'ont pas d'identité taxinomique, ils sont régulièrement ignorés dans de nombreux contextes importants, par exemple dans la législation ou le dénombrement des espèces[63].
La plupart des champignons aquatiques, dont la diversité pourrait être bien plus importante qu'estimé précédemment, ne sont connus qu'au travers de cette matière noire. Ils sont présents dans toutes les régions marines, et leur rôle écologique reste mal compris[64].
Annexes
Notes
- Le signe (?) indique les taxons dont la position n'était pas résolue (incertae sedis).
Références
- Synonyme de « sciences naturelles », renommées « sciences de la vie » ou « biologie » au XXe siècle.
- Site officiel du Muséum national d'histoire naturelle
- Paul Vuillemin, Les champignons : essai de classification, O. Doin, , 425 p. (lire en ligne), p. 14.
- (it) Luigi Morandi et Elio Baldacci, I funghi : vita, storia, leggende, Garzanti, , 633 p. (lire en ligne), p. 14.
- (la) John Ray, Synopsis methodica stirpium Britannicarum : Tum Indigenis, tum in Agris cultis Locis suis dispositis ; Additis Generum Characterisiticis, Specierum Descriptionibus & Virium Epitome. ; Editio Tertia Multis locis Emendata, & quadringentis quinquaginta circiter Speciebus noviter detectis aucta. Cum Iconibus, Londres, Impensis Gulielmi & Joannis Innys Regiae Societatis Typographorum, in Area Occidentali D. Pauli, , 3e éd., 482 p. (lire en ligne), p. 1-28.
- (la) Carl von Linné, Species plantarum, vol. 2, Holmiae (Stockholm), Impensis Laurentii Salvii, , 1re éd. (lire en ligne), p. 1061-1186.
- Alphonse de Candolle, Lois de la nomenclature botanique adoptées par le Congrès international de botanique tenu à Paris en août 1867, Genève et Bâle, H. Georg, , 64 p. (lire en ligne).
- John Briquet, Règles internationales de la nomenclature botanique adoptées par le Congrès international de botanique de Vienne, 1905, Iéna, Gustav Fischer, , 2e éd. (1re éd. 1905) (DOI 10.5962/bhl.title.33717, lire en ligne).
- (en) Nicholas J. Turland, John H. Wiersema, Fred R. Barrie, Werner Greuter et al., International Code of Nomenclature for algae, fungi, and plants (Shenzhen Code) adopted by the Nineteenth International Botanical Congress Shenzhen, China, July 2017, vol. 159, Glashütten, Koeltz Botanical Books, coll. « Regnum Vegetabile », , 254 p. (ISBN 978-3-946583-16-5, DOI 10.12705/code.2018, lire en ligne), chap. F (« Names of organisms treated as fungi »).
- (en) Richard P. Korf, « Sanctioned epithets, sanctioned names, and cardinal principles in ": Pers." and ": Fr." citations », Mycotaxon, vol. 16, no 2, , p. 341–352 (lire en ligne).
- (en) Tom W. May, Scott A. Redhead, Konstanze Bensch, David L. Hawksworth, James Lendemer, Lorenzo Lombard et Nicholas J. Turland, Chapter F of the International Code of Nomenclature for algae, fungi, and plants as approved by the 11th International Mycological Congress, San Juan, Puerto Rico, July 2018, vol. 10, (ISSN 2210-6359, DOI 10.1186/s43008-019-0019-1, lire en ligne), p. 21.
- (en) « MYCOBANK Database : Fungal Databases, Nomenclature & Species Banks », sur www.mycobank.org (consulté le )
- (en) Daniel J. G. Lahr, Enrique Lara et Edward A. D. Mitchell, « Time to regulate microbial eukaryote nomenclature: Microbial Eukaryote Nomenclature », Biological Journal of the Linnean Society, vol. 107, no 3, , p. 469–476 (DOI 10.1111/j.1095-8312.2012.01962.x, lire en ligne, consulté le ).
- (en) Sina M. Adl, Brian S. Leander, Alastair G. B. Simpson, John M. Archibald et al., « Diversity, Nomenclature, and Taxonomy of Protists », Systematic Biology, vol. 56, no 4, , p. 684–689 (ISSN 1076-836X et 1063-5157, DOI 10.1080/10635150701494127, lire en ligne, consulté le ).
- (en) John O. Corliss, « The ambiregnal protists and the codes of nomenclature: a brief review of the problem and of proposed solutions », The Bulletin of zoological nomenclature., vol. 52, , p. 11–17 (ISSN 0007-5167, DOI 10.5962/bhl.part.6717, lire en ligne, consulté le ).
- de Necker Natalis Joseph, Traité sur la Mycitologie ou discours historique sur les Champignons en général, Mannheim, Mathias Fontaine, , 133 p. (lire en ligne), p. 104.
- (en) Robert H. Whittaker, « New Concepts of Kingdoms of Organisms », Science, vol. 163, no 3863, , p. 150–160 (ISSN 0036-8075 et 1095-9203, DOI 10.1126/science.163.3863.150, lire en ligne, consulté le ).
- (en) Thomas Cavalier-Smith, « What are Fungi? », dans David J. McLaughlin, Esther G. McLaughlin & Paul A. Lemke, Systematics and Evolution, vol. 7A, Berlin et Heidelberg, Springer, (ISBN 978-3-642-08193-4, DOI 10.1007/978-3-662-10376-0_1, lire en ligne), p. 3–37.
- (en) Thomas Cavalier-Smith, « Eukaryote kingdoms: Seven or nine? », Biosystems, vol. 14, nos 3-4, , p. 461–481 (DOI 10.1016/0303-2647(81)90050-2, lire en ligne, consulté le ).
- (en) Thomas Cavalier-Smith, « The origin of fungi and pseudofungi », dans A. D. M. Rayner, C. M. Brasier & D. Moore, Evolutionary biology of the fungi, Cambridge, Cambridge University Press, , p. 339–353.
- (en) Sandra L. Baldauf et Jeffrey D. Palmer, « Animals and fungi are each other's closest relatives: congruent evidence from multiple proteins. », Proceedings of the National Academy of Sciences, vol. 90, no 24, , p. 11558–11562 (ISSN 0027-8424 et 1091-6490, PMID 8265589, PMCID PMC48023, DOI 10.1073/pnas.90.24.11558, lire en ligne, consulté le ).
- (en) Agnès Germot, Hervé Philippe et Hervé Le Guyader, « Evidence for loss of mitochondria in Microsporidia from a mitochondrial-type HSP70 in Nosema locustae1Note: Nucleotide sequence data reported in this paper has been submitted to the GenBank™ data base under the accession number U97520.1 », Molecular and Biochemical Parasitology, vol. 87, no 2, , p. 159–168 (DOI 10.1016/S0166-6851(97)00064-9, lire en ligne, consulté le ).
- (en) Thomas Cavalier-Smith, « A revised six-kingdom system of life », Biological Reviews of the Cambridge Philosophical Society, vol. 73, no 3, , p. 203–266 (DOI 10.1017/S0006323198005167, lire en ligne, consulté le ).
- (en) Fabien Burki, Andrew J. Roger, Matthew W. Brown et Alastair G.B. Simpson, « The New Tree of Eukaryotes », Trends in Ecology & Evolution, vol. 35, no 1, , p. 43–55 (DOI 10.1016/j.tree.2019.08.008, lire en ligne, consulté le ).
- (en) Alastair G.B Simpson et Andrew J Roger, « Eukaryotic Evolution: Getting to the Root of the Problem », Current Biology, vol. 12, no 20, , R691–R693 (DOI 10.1016/S0960-9822(02)01207-1, lire en ligne, consulté le ).
- Marc-André Selosse et Guy Durrieu, « Une classification mycologique phylogénétique francophone (en 2003) », Acta Botanica Gallica, vol. 151, no 1, , p. 73–102 (ISSN 1253-8078 et 2166-3408, DOI 10.1080/12538078.2004.10516022, lire en ligne, consulté le ).
- (en) Yu Liu, Emma T Steenkamp, Henner Brinkmann, Lise Forget, Hervé Philippe et B. Franz Lang, « Phylogenomic analyses predict sistergroup relationship of nucleariids and fungi and paraphyly of zygomycetes with significant support », BMC Evolutionary Biology, BMC et Springer Science+Business Media, vol. 9, no 1, , p. 272 (ISSN 1471-2148, OCLC 47657384, PMID 19939264, PMCID 2789072, DOI 10.1186/1471-2148-9-272)
- (en) Sina M. Adl, David Bass, Christopher E. Lane, Julius Lukeš et al., « Revisions to the Classification, Nomenclature, and Diversity of Eukaryotes », Journal of Eukaryotic Microbiology, , jeu.12691 (ISSN 1066-5234 et 1550-7408, PMID 30257078, PMCID PMC6492006, DOI 10.1111/jeu.12691, lire en ligne, consulté le ).
- Philippe Bouchet, Jean-Louis Guignard, Yves-François Pouchus et Jean Villard, Les champignons : mycologie fondamentale et appliquée, Issy-les-Moulineaux, Masson, , 2e éd., 191 p. (ISBN 2-294-02116-9 et 978-2-294-02116-9, OCLC 70811760, lire en ligne).
- (en) O. P. Sharma, Textbook of fungi, New Delhi, Tata McGraw-Hill Pub. Co, , 365 p. (ISBN 0-07-460329-9 et 978-0-07-460329-1, OCLC 51355371, lire en ligne), chap. 4 (« Myxomycota »).
- (en) Martin Schnittler, Yuri Novozhilov, Maria Romeralo, Matthew Brown et Frederick Spiegel, « Myxomycetes and myxomycete-like organisms », dans Wolfgang Frey, Englers Syllabus of Plant Families, Borntraeger, , 13e éd. (lire en ligne), p. 40-88.
- (en) Christina Schilde et Pauline Schaap, « The Amoebozoa », Methods in molecular biology, Humana Press, vol. 983, , p. 1–15 (ISBN 978-1-62703-301-5, PMID 23494299, PMCID PMC4037983, DOI 10.1007/978-1-62703-302-2_1, lire en ligne, consulté le ).
- (en) Anna Maria Fiore-Donno, Sergey I. Nikolaev, Michaela Nelson, Jan Pawlowski, Thomas Cavalier-Smith et Sandra Baldauf, « Deep Phylogeny and Evolution of Slime Moulds (Mycetozoa) », Protist, vol. 161, no 1, , p. 55–70 (DOI 10.1016/j.protis.2009.05.002, lire en ligne, consulté le ).
- (en) M. W. Brown, F. W. Spiegel et J. D. Silberman, « Phylogeny of the "Forgotten" Cellular Slime Mold, Fonticula alba, Reveals a Key Evolutionary Branch within Opisthokonta », Molecular Biology and Evolution, vol. 26, no 12, , p. 2699–2709 (ISSN 0737-4038 et 1537-1719, DOI 10.1093/molbev/msp185, lire en ligne, consulté le ).
- (en) Leho Tedersoo, Santiago Sánchez-Ramírez, Urmas Kõljalg, Mohammad Bahram, Markus Döring, Dmitry Schigel, Tom May, Martin Ryberg et Kessy Abarenkov, « High-level classification of the Fungi and a tool for evolutionary ecological analyses », Fungal Diversity, vol. 90, no 1, , p. 135–159 (ISSN 1560-2745 et 1878-9129, DOI 10.1007/s13225-018-0401-0, lire en ligne, consulté le ).
- (en) C. André Lévesque, « Fifty years of oomycetes—from consolidation to evolutionary and genomic exploration », Fungal Diversity, vol. 50, no 1, , p. 35–46 (ISSN 1560-2745 et 1878-9129, DOI 10.1007/s13225-011-0128-7, lire en ligne, consulté le ).
- (en) Henry J. Vogel, « Distribution of Lysine Pathways Among Fungi: Evolutionary Implications », The American Naturalist, vol. 98, no 903, , p. 435-446 (JSTOR 2459146).
- (en) Salomon Bartnicki-Garcia, « Cell wall differentiation in the phycomycetes », Phytopathology, vol. 59, no 8, , p. 1065–1071 (ISSN 0031-949X, PMID 5822692, lire en ligne, consulté le ).
- (en) Nicholas P. Money, « Why oomycetes have not stopped being fungi », Mycological Research, vol. 102, no 6, , p. 767–768 (DOI 10.1017/S095375629700556X, lire en ligne, consulté le ).
- (en) Thomas Cavalier-Smith, « The kingdom Chromista: origin and systematics », dans F. E. Round & D. J. Chapman, Progress in Phycological Research, vol. 4, Bristol, UK, BioPress Ltd., , p. 309–347.
- (en) David J. Patterson, « Stramenopiles: Chromophytes from a protistan perspective », dans J.C. Green, B.S.C. Leadbeater & W.L. Diver, The chromophyte algae: Problems and perspectives, Clarendon Press, , 429 p. (ISBN 978-0198577133, lire en ligne).
- (en) Romain Derelle, Purificación López-García, Hélène Timpano et David Moreira, « A Phylogenomic Framework to Study the Diversity and Evolution of Stramenopiles (=Heterokonts) », Molecular Biology and Evolution, vol. 33, no 11, , p. 2890–2898 (ISSN 0737-4038 et 1537-1719, PMID 27512113, PMCID PMC5482393, DOI 10.1093/molbev/msw168, lire en ligne, consulté le ).
- (en) David S. Hibbett, Manfred Binder, Joseph F. Bischoff, Meredith Blackwell et al., « A higher-level phylogenetic classification of the Fungi », Mycological Research, vol. 111, no 5, , p. 509–547 (DOI 10.1016/j.mycres.2007.03.004, lire en ligne, consulté le ).
- (en) Patrick J. Keeling et Naomi M. Fast, « Microsporidia: Biology and Evolution of Highly Reduced Intracellular Parasites », Annual Review of Microbiology, vol. 56, no 1, , p. 93–116 (ISSN 0066-4227 et 1545-3251, DOI 10.1146/annurev.micro.56.012302.160854, lire en ligne, consulté le ).
- (en) Timothy Y. James, Frank Kauff, Conrad L. Schoch, P. Brandon Matheny et al., « Reconstructing the early evolution of Fungi using a six-gene phylogeny », Nature, vol. 443, no 7113, , p. 818–822 (ISSN 0028-0836 et 1476-4687, DOI 10.1038/nature05110, lire en ligne, consulté le ).
- (en) Sergey A. Karpov, Maria A. Mamkaeva, Vladimir V. Aleoshin, Elena Nassonova, Osu Lilje et Frank H. Gleason, « Morphology, phylogeny, and ecology of the aphelids (Aphelidea, Opisthokonta) and proposal for the new superphylum Opisthosporidia », Frontiers in Microbiology, vol. 5, (ISSN 1664-302X, PMID 24734027, PMCID PMC3975115, DOI 10.3389/fmicb.2014.00112, lire en ligne, consulté le ).
- (en) Sergey A. Karpov, Kirill V. Mikhailov, Gulnara S. Mirzaeva, Iskandar M. Mirabdullaev, Kira A.Mamkaeva, Nina N.Titova et Vladimir V.Aleoshin, « Obligately Phagotrophic Aphelids Turned out to Branch with the Earliest-diverging Fungi », Protist, vol. 164, no 2, , p. 195–205 (DOI 10.1016/j.protis.2012.08.001, lire en ligne, consulté le ).
- (en) Meredith D. M. Jones, Irene Forn, Catarina Gadelha, Martin J. Egan, David Bass, Ramon Massana et Thomas A. Richards, « Discovery of novel intermediate forms redefines the fungal tree of life », Nature, vol. 474, no 7350, , p. 200–203 (ISSN 0028-0836 et 1476-4687, DOI 10.1038/nature09984, lire en ligne, consulté le ).
- (en) Timothy Y. James, Adrian Pelin, Linda Bonen, Steven Ahrendt, Divya Sain, Nicolas Corradi et Jason E. Stajich, « Shared Signatures of Parasitism and Phylogenomics Unite Cryptomycota and Microsporidia », Current Biology, vol. 23, no 16, , p. 1548–1553 (DOI 10.1016/j.cub.2013.06.057, lire en ligne, consulté le ).
- (en) Timothy Y. James, Peter M. Letcher, Joyce E. Longcore et Sharon E. Mozley-Standridge, « A molecular phylogeny of the flagellated fungi (Chytridiomycota) and description of a new phylum (Blastocladiomycota) », Mycologia, vol. 98, no 6, , p. 860–871 (ISSN 0027-5514 et 1557-2536, DOI 10.1080/15572536.2006.11832616, lire en ligne, consulté le ).
- (en) Joseph W. Spatafora, Ying Chang, Gerald L. Benny, Katy Lazarus et al., « A phylum-level phylogenetic classification of zygomycete fungi based on genome-scale data », Mycologia, vol. 108, no 5, , p. 1028–1046 (ISSN 0027-5514 et 1557-2536, PMID 27738200, PMCID PMC6078412, DOI 10.3852/16-042, lire en ligne, consulté le ).
- (en) Dai Hirose, Yousuke Degawa, Sigeki Inaba et Seiji Tokumasu, « The anamorphic genus Calcarisporiella is a new member of the Mucoromycotina », Mycoscience, vol. 53, no 4, , p. 256–260 (DOI 10.1007/S10267-011-0160-1, lire en ligne, consulté le ).
- (en) Richard A. Humber, « Entomophthoromycota: a new phylum and reclassification for entomophthoroid fungi », Mycotaxon, vol. 120, no 1, , p. 477–492 (DOI 10.5248/120.477, lire en ligne, consulté le ).
- (en) Josep Guarro, Josepa Gené et Alberto M. Stchigel, « Developments in fungal taxonomy », Clinical Microbiology Reviews, vol. 12, no 3, , p. 454–500 (ISSN 0893-8512, PMID 10398676, PMCID PMC100249, lire en ligne, consulté le ).
- (en) David Hawksworth, « A new dawn for the naming of fungi: impacts of decisions made in Melbourne in July 2011 on the future publication and regulation of fungal names », MycoKeys, vol. 1, , p. 7–20 (ISSN 1314-4049 et 1314-4057, DOI 10.3897/mycokeys.1.2062, lire en ligne, consulté le ).
- (en) John W. Taylor, Markus Göker et John I. Pitt, « Choosing one name for pleomorphic fungi: The example of Aspergillus versus Eurotium , Neosartorya and Emericella », Taxon, vol. 65, no 3, , p. 593–601 (ISSN 0040-0262, DOI 10.12705/653.10, lire en ligne, consulté le ).
- (en) László G. Nagy, Gábor M. Kovács et Krisztina Krizsán, « Complex multicellularity in fungi: evolutionary convergence, single origin, or both? », Biological Reviews, vol. 93, no 4, , p. 1778–1794 (DOI 10.1111/brv.12418, lire en ligne, consulté le ).
- (en) Ove E. Eriksson et Katarina Winka, « Supraordinal taxa of Ascomycota », Myconet, vol. 1, , p. 1-16 (ISSN 1403-1418, lire en ligne).
- (en) Robert Bauer, Dominik Begerow, José Paulo Sampaio, Michael Weiβ et Franz Oberwinkler, « The simple-septate basidiomycetes: a synopsis », Mycological Progress, vol. 5, no 1, , p. 41–66 (ISSN 1617-416X et 1861-8952, DOI 10.1007/s11557-006-0502-0, lire en ligne, consulté le ).
- (en) Polona Zalar, G. Sybren de Hoog, Hans-Josef Schroers, John Michael Frank et Nina Gunde-Cimerman, « Taxonomy and phylogeny of the xerophilic genus Wallemia (Wallemiomycetes and Wallemiales, cl. et ord. nov.) », Antonie van Leeuwenhoek, vol. 87, no 4, , p. 311–328 (ISSN 0003-6072 et 1572-9699, DOI 10.1007/s10482-004-6783-x, lire en ligne, consulté le )
- (en) Robert Bauer, Sigisfredo Garnica, Franz Oberwinkler, Kai Riess, Michael Weiß et Dominik Begerow, « Entorrhizomycota: A New Fungal Phylum Reveals New Perspectives on the Evolution of Fungi », PLOS ONE, vol. 10, no 7, , e0128183 (ISSN 1932-6203, PMID 26200112, PMCID PMC4511587, DOI 10.1371/journal.pone.0128183, lire en ligne, consulté le ).
- (en) Alexander Doweld, Prosyllabus tracheophytorum : tentamen systematis plantarum vascularium (Tracheophyta), Moscou, GEOS, , 200 p. (ISBN 5-89118-283-1 et 978-5-89118-283-7, OCLC 52273150, lire en ligne).
- (en) Martin Ryberg et R. Henrik Nilsson, « New light on names and naming of dark taxa », MycoKeys, vol. 30, , p. 31–39 (ISSN 1314-4049 et 1314-4057, PMID 29681731, PMCID PMC5904500, DOI 10.3897/mycokeys.30.24376, lire en ligne, consulté le ).
- (en) Nathan Chrismas et Michael Cunliffe, « Marine fungal dark matter in the global ocean », Access Microbiology, vol. 1, no 1A, (ISSN 2516-8290, DOI 10.1099/acmi.ac2019.po0055, lire en ligne, consulté le ).
- Portail de la mycologie