Phaeophyceae
Les algues brunes, aussi nommées Phaeophyceae ou Phéophycées, sont une classe d'algues de l'embranchement des Ochrophyta. Ce sont des algues qui utilisent comme pigment collecteur de lumière principalement de la chlorophylle c combinée à un pigment brun, la fucoxanthine. Leur taille varie de l'échelle microscopique à plusieurs dizaines de mètres[2].

| Empire | Eukaryota |
|---|---|
| Règne | Chromista |
| Embranchement | Ochrophyta |

On désigne aussi parfois comme « algues brunes » des algues filamenteuses de couleur brune qu'il ne faut en aucun cas confondre avec les phaeophycées. Ce sont en réalité des colonies de cyanobactéries, notamment responsables de flocs bactériens (aussi dits brown slime dans les pays anglophones).
Il existe environ 1 500 espèces de Phaeophyceae. Elles sont abondantes dans les mers tempérées et froides (ainsi en Bretagne[3]) en particulier sur l'estran.
Les algues brunes sont devenues une matière première industrielle importante, l'algoculture d'algues brunes est une activité très importante en Extrême-Orient et s'étend à d'autres régions. Les algues brunes sont les algues les plus cultivées.
Diverses espèces introduites hors de leur aire de répartition sont devenues envahissantes, éliminant ou menaçant d'autres espèces notamment sur des récifs coralliens de Polynésie française[4]. Inversement plusieurs espèces de macroalgues brunes sont en forte régression dans leur habitat naturel.
Étymologie
Phaeophyceae vient du grec φαιός / faiós, « brun, sombre », et φύκοσ / phûkos, « algue, plante marine ».
Description
La morphologie générale des phaeophycées est celle des algues, c'est-à-dire celle d'êtres vivants aquatiques utilisant la photosynthèse et incapables de se soutenir hors de l'eau. Leur couleur varie du vert olive au brun[5].


Organisation générale
_holdfast.jpg.webp)
Comme les autres algues, les phaeophycées ne possêdent pas de tissus aussi bien différenciés que les plantes vasculaires ni de parties que l'on puisse qualifier de racines, troncs ou feuilles. L'ensemble de l'organisme développé est appelé thalle. Néanmoins les algues brunes, plus que les autres algues, ont développé des organes spécialisés :
- des crampons composés d'haptères (rhizoïdes) permettant la fixation
- des pneumatocystes (flotteurs) assurant le maintien de l'algue près de la surface
- un stipe (fausse tige), très développé chez les laminariales, présentant un début de différentiation tissulaire il permet le transfert de nutriments
- des frondes (ou lames) évoquant des feuilles
Cycle des générations et reproduction
Le cycle des générations alterne des formes d'organisation différentes.
- Gamètes mâles et spores possèdent deux flagelles différents (caractéristique des hétérokontes)
- chez les algues de petite taille : le thalle est un filament ramifié, le cycle isomorphe, la fécondation par isogamie. Exemple : Ectocarpus.
- chez les algues de grande taille : le thalle est un agrégat de filaments de grande taille, le cycle hétéromorphe, diplophasique. La fécondation se fait par oogamie. Exemples : Laminaria, Fucus.
Anatomie cellulaire

Chloroplastes
Les chloroplastes (organites sièges de la photosynthèse) comportent quatre membranes. ils ne contiennent pas de nucléomorphe (noyau vestigial) mais un chromosome circulaire (comme certaines bactéries).
Certaines algues brunes comme l'Ectocarpus possêdent des chloroplastes à pyrénoïdes (amas d'enzymes responsables de la photosynthèse)
Les complexes pigments-protéines qui assurent la collecte de l'énergie lumineuse, y compris dans l'infrarouge, chez les algues brunes sont tous « intramembranaires »[6]. les pigments sont :
- Chlorophylle a, Chlorophylle c1 et Chlorophylle c2[6]
- fucoxanthine (caroténoïde de couleur brune)[6]
- β-carotène
Paroi
- Il y a peu de cellulose, les parois sont surtout formées de fucanes sulfatés (polymères de fucose) et d'alginate (acide mannuronique ou acide alginique, polymère de mannose et de gulose)
- La paroi est constituée de deux couches : la couche intérieure contient de la cellulose, la couche extérieure fucanes et alginates[7]
- L’algine recouvre la paroi cellulaire. C'est un polysaccharide non soluble dans l’eau qui forme un mucilage à la surface des algues brunes. Grâce à cette particularité, les algues brunes survivent dans des milieux et conditions climatiques extrêmes et s’adaptent aux remous provoqués par les vagues. L'algine protège de la dessication les thalles lors des marées plus basses[8].
Origine
L’origine et le développement des algues brunes sont des sujets de recherche qui ont permis de comprendre certains mécanismes de l’évolution. Les algues brunes font partie des stramenopiles (aussi appelé : Hétérokontes) et sont des organismes multicellulaires (eucaryotes)[10]. Ce sont les algues qui ont l’anatomie multicellulaire la plus complexe (début de différentiation du thalle en tissus et en « organes »). Elles ont de nombreuses caractéristiques innovantes en ce qui concerne leur biologie cellulaire[8].
Phylogénie
Une étude réalisée sur les séquences d’acides nucléiques des algues brunes a permis de résoudre certaines de leurs relations phylogénétiques. Une de ces relations qui soulevait beaucoup de questions était le sujet des premières divergences des algues brunes. C'est l'étude des ARNr 18S et 28S qui a été utile. La séquence de ces gènes est utilisée en analyse moléculaire dans le but de reconstruire l'histoire évolutive des organismes.
Les séquences d’ADN codant les ARNr 18S et 28S ainsi que celles du gène chloroplastique rbc-L ont permis de construire les premières phylogénies complètes des Phaeophyceae[11].
- Grâce à ces études, on se rend compte que le genre Choristocarpus fut le premier à diverger.
- Par la suite, suivaient les ordres des Dictyotales, celui des Sphacelariales et celui des Syringodermatales.
- Les autres lignées constituent un large clade nommé « clade A » qui comprend les représentants des autres ordres : Fucales, Laminariales, Ectocarpales... Les gènes observés ont permis de confirmer le caractère monophylétique de la majorité des ordres[11]. Ce groupe d'algues brunes contient donc l'espèce souche dont descendent tous les membres. Cependant ces marqueurs moléculaires n’ont pas permis de résoudre les relations entre les ordres à l’intérieur du clade A, donc les différences entre les différentes algues brunes connues de nos jours.
Évolution des algues
La plupart des scientifiques supposent que les algues brunes auraient évolué à partir d’un ancêtre unicellulaire hétérotrophe, qui serait devenu photosynthétique en faisant l’acquisition de plastides par endosymbiose d'un autre eucaryote unicellulaire. (Le plastide est un organite cellulaire, ici à double membrane et siège de la fonction chlorophyllienne, présent dans les cellules végétales.)
L’endosymbiose primaire mitochondriale et les endosymbioses secondaires multiples ont généré de très nombreuses lignées d’algues à partir de phagotrophes, aboutissant à plusieurs groupes apparentés se nourrissant soit par phagotrophie, soit par photosynthèse ou encore des deux manières[12]. La multicellularité complexe a évolué au moins trois fois : chez les algues rouges (Rhodophyta), chez les algues vertes (Viridiplantae) puis chez les algues brunes (Phaeophyta)[13]. On a ensuite déterminé que les cellules photosynthétiques des chloroplastes des algues brunes proviennent d’une endosymbiose secondaire. L’origine commune du génome chloroplastique de toutes les algues complique les analyses phylogénétiques, car il y a migration de certains gènes chloroplastiques vers le génome nucléaire. Des comparaisons à grande échelle des séquences d’ADN chez les algues brunes, rouges et vertes confirment un lien de parenté plus étroit entre algues rouges et vertes alors que les algues brunes seraient plus éloignées[14].
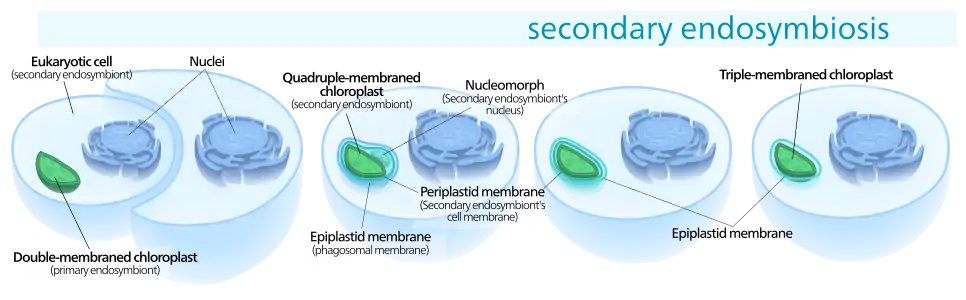 Schéma d'une endosymbiose secondaire
Schéma d'une endosymbiose secondaire

Une des conséquences de la grande distance phylogénétique qui sépare les straménopiles des autres groupes plus étudiés (les animaux, les champignons et les plantes vertes) est que les organismes modèles développés pour ces derniers groupes ont une pertinence limitée pour la biologie des algues brunes. Dans ce contexte, l'utilisation d'Ectocarpus comme organisme modèle a eu un impact important sur l'avancement des recherches sur les algues brunes.
Les plus anciens fossiles qui peuvent être attribués avec certitude aux algues brunes proviennent de la diatomite de Monterey (Californie) datée du Miocène, ces algues étant difficilement fossilisables[15].
Développement
Le développement embryonnaire des algues brunes se fait par multicellularité non agrégative[13], C’est un type de multicellularité qui peut résulter de plusieurs mécanismes différents. Par contre, dans tous les cas, elle résulte de la cohésion de cellules résultant de la même cellule ancestrale. Si toutes les cellules dérivent d’une seule cellule mère, elles sont dites génétiquement homogènes.

La croissance se fait par division dichotomique des filaments généralement au niveau de l'extrémité des thalles chez la plupart des algues brunes, n'importe où chez certaines algues comme l'Ectocarpus. La croissance des laminariales est la plus rapide de toutes les algues[16].
Cycle développemental
Les algues multicellulaires présentent divers cycles de développement. Les algues brunes possèdent 2 types de sporocystes (un sporocyste est une structure végétale qui produit et contient des spores) qui suivent soit la voie de la reproduction sexuée, soit la voie de la reproduction asexuée.
- Le premier type de sporocyste, le sporocyste pluriloculaire comprend plusieurs cellules souches produisant des zoospores diploïdes (2n chromosomes) qui vont par la suite germer en sporophytes. C’est la voie de la multiplication asexuée[17].
- Le second type, le sporocyste uniloculaire, comprend une seule cellule souche qui, par méiose, va produire 4 zoospores haploïdes (n chromosomes) germant en gamétophytes. On est en présence ici de la voie de la reproduction sexuée[17].
Dans le détail, les cycles de vie les plus complexes se caractérisent par l’alternance de générations[8]. L’alternance de générations signifie qu’il y a une succession des formes haploïdes (n) et des formes diploïdes (2n). Ce terme d’alternance s’applique seulement lorsqu’on est en présence de cycles dans lesquels les stades haploïdes et diploïdes sont multicellulaires. Les algues brunes comportent différents types avec des cycles de reproduction spécifiques.
- Tout d’abord, les algues brunes de type Laminaria fournissent un bon exemple du cycle de développement complexe d’alternance de générations. En présence de Laminaria, c’est un cycle haplo-diplophasique qu’on observe, donc on devrait avoir un cycle qui possède des phases autant sous la forme haploïde (n) que la forme diploïde (2n).


- Voici les étapes détaillées de la figure ci-haut du cycle de développement haplo-diplophasique des Laminaria[8]:
- Tout d’abord, le cycle débute avec un individu diploïde (2n) qu’on nomme le sporophyte. Le sporophyte des Laminariales vit normalement juste en dessous de la ligne des marées et il est fixé aux roches aquatiques par un crampon ramifié.
- Au début du printemps, la plus grosse partie de la croissance se termine et les cellules qui sont à la surface deviennent des sporocystes. Ce sont des structures qui produisent et qui contiennent des formes de multiplication asexuée.
- Ensuite, les sporocystes produisent des zoospores par méiose. Les zoospores sont identiques structuralement mais environ la moitié vont produire les gamétophytes mâles, et l’autre moitié les gamétophytes femelles. Les gamétophytes sont, chez les végétaux responsables de la génération qui produit les gamètes, donc la partie sexuée du cycle.
- Le gamétophyte mâle libère les gamètes mâles ou anthérozoïdes et le gamétophyte femelle libère les gamètes femelles ou oosphères. Les gamètes sont des organismes haploïdes (n).
- Les oosphères restent sur le gamétophyte femelle et libèrent une substance chimique qui attirent les anthérozoïdes de la même espèce, ce qui permet d’avoir un meilleur taux de fécondation dans l’océan, puisque l'eau a tendance à les disperser et à rendre la fécondation très difficile.
- Il y a finalement fécondation de l’oosphère par le gamète mâle et formation du zygote qui est un organisme diploïde (2n).
- Pour terminer, le zygote va devenir un nouveau sporophyte et recommencer son cycle de vie, c'est une boucle. Dans ce cas-ci, les deux générations sont hétéromorphes, c’est-à-dire, que le sporophyte et le gamétophyte ont une structure différente et ne se ressemblent pas. D’autres algues présentent une alternance de générations isomorphes, ce qui signifie que le sporophyte et le gamétophyte semblent identiques morphologiquement, mais ne possèdent pas le même nombre de chromosomes.

- Un autre exemple de type d’algues fréquemment rencontré est le type Fucus. Ce type présente un cycle complexe encore une fois, mais ici c’est un cycle diplophasique. Ce qui signifie que la forme diploïde (2n) domine la majorité du cycle. En voici les principales étapes:
- Ici le cycle débute avec un individu diploïde qu’on nomme le sporophyte. Le sporophyte se développe et une partie permet de former le réceptacle diploïde (2n). Chez les algues brunes, c’est la portion du thalle où sont rassemblés et regroupés les conceptacles. Le conceptacle est diploïde (2n) et il représente une cavité contenant les organes de reproduction.
 Figure au microscope d'un conceptacle (organe reproducteur) chez Fucus.
Figure au microscope d'un conceptacle (organe reproducteur) chez Fucus. - Si on est en présence d’un individu mâle, celui-ci produira des anthéridies (conceptacle des gamètes mâles) qui vont libérer après méiose des spores haploïdes qu’on appelle anthérozoïdes.
- Si au contraire on est en présence d’un individu femelle, celui-ci va produire des oogones (conceptacle des gamètes femelles), pour après méiose libérer des spores haploïdes ou oosphères .
- Lorsque les oosphères rencontrent les anthérozoïdes, il y a fécondation puis apparition du zygote diploïde (2n).
- Le zygote subit ensuite plusieurs mitoses et se développe en sporophyte, pour recommencer le cycle de vie par la suite. Les fucus ont donc un cycle qui ne passe pas par une forme gamétophytique comme les laminariales ci-haut.
Patron de développement
Au niveau des algues multicellulaires, le développement commence toujours par une division asymétrique du zygote en deux cellules différenciées, comme mentionné plus haut. Lors d’une expérience de microchirurgie au laser, des embryons à deux cellules différentes de l'algue Fucus ont été disséqués[18].
- En les disséquant, on s'est rendu compte que dans le premier cas, l'élimination des protoplasmes de la paroi cellulaire induit la dédifférenciation (c'est-à-dire, le retour des cellules ou des tissus à un état moins différencié, donc plus proche de l'état embryonnaire). Par contre, les cellules isolées dans les parois, elles, ont suivi leur destinée initiale.
- Ensuite, on s'est rendu compte que le contact d'un type de cellule (A) avec la paroi cellulaire isolée de l'autre type de cellule (B) a provoqué le changement de son destin. La conclusion est donc que la paroi cellulaire maintient l'état différencié et dirige le destin de différenciation des cellules dans le développement des algues[18].
Développement identifié par transport d'auxine
Le transport de l'auxine (l'hormone de l'augmentation de la taille des cellules jeunes au moment où la paroi est encore souple) a été impliqué dans le contrôle du développement de l'embryon dans les plantes terrestres.
Des études ont été faites, dans le but de déterminer si le transport de l'auxine est important dans les premiers stades de développement des embryons des algues brunes. L'expérience a été faite sur une algue de type Fucus. “L'acide indole-3-acétique (IAA) a été identifié dans des embryons et des tissus matures de Fucus distichus par chromatographie en phase gazeuse-spectroscopie de masse[19].
- Tel qu'expliqué dans les résultats de l'expérience : «Les embryons de ce Fucus accumulent du IAA ce qui suggère la présence d'un complexe protéinique d'efflux semblable à celui des plantes terrestres.» [19]
- Les embryons de Fucus Distichus normal (type sauvage) se développent normalement avec un seul rhizoïde.
- Ceux influencés par la croissance sur IAA, on voit la formation de multiples rhizoïdes ramifiés.

Les résultats de cette étude suggèrent que l'auxine agit donc dans la formation de motifs basaux dans le développement embryonnaire de cette espèce de Fucus. On voit que l'auxine se déplace de l'apex de l'organisme vers la base et on voit un allongement des rhizoïdes, ainsi que de leur niveau de ramifications.
Mécanismes développementaux identifiés par une molécule de type vitronectine
Les molécules d’adhérence cellulaire comme la vitronectine sont des glycoprotéines transmembranaires qui jouent un rôle important au cours du développement du zygote. Dans une expérience, on regarde la cellule rhizoïde chez le zygote de l'algue brune Fucus.[20]
- On remarque que la cellule rhizoïde est structurellement et fonctionnellement différenciée de la cellule thalle. Les rhizoïdes ressemblent à des racines ou des petits poils, et leur rôle principal est surtout le soutien et l'adhésion de l'algue aux rochers. D'un autre côté, le thalle est plutôt le corps végétatif non différencié de l'algue.
- La présence de Vn-F dans les algues brunes suggère un degré élevé de conservation évolutive de ses caractéristiques structurelles et fonctionnelles. Vn-F est une glycoprotéine de type vibronectine retrouvée dans des extraits de zygotes d'algues brunes de type Fucus[20].
Les algues brunes sont donc caractérisées par un haut degré de conservation évolutive.
Écologie
À cause de l'importance des formations végétales qu'elles constituent, les algues brunes ont probablement un rôle important et positif sur notre environnement.
Mode de vie
Presque toutes les Phaeophyceae sont marines : elles occupent les rivages marins jusqu'à plusieurs dizaines de mètres de profondeur et les côtes rocheuses à faible profondeur, parfois émergées à marée basse (zone intertidale). Le genre Sargassum présent en chaînes dérivant en haute mer est une exception notable.

En de rares occasions certaines algues brunes se sont adaptées aux eaux douces[21].
Certaines comme l'Ectocarpus peuvent se comporter en épiphytes sur d'autres algues.
Ce sont les algues les plus abondantes des mers tempérées et froides (elles sont abondantes en Bretagne). Les macro-algues brunes sont plutôt typiques de l'estran bien que quelques espèces (Cystoseira zosteroides par exemple ou encore un laminaire tropical : Ecklonia muratii jusqu'à 40 m au Sénégal et en Mauritanie) sont trouvées en profondeur, formant un empilement de ceintures étagées en fonction des espèces, ceintures fortement marquées par la marée dans les régions où elles se manifestent. Dans les estuaires, certaines algues brunes supportent de très importantes variations biquotidiennes de salinité, température et lumière (fucaceae). Certaines espèces sont confinées à des aires géographiques et climatiques assez précises ; ainsi 90 % de ces espèces de Cystoseira ne vivent qu'en Méditerranée.
.jpg.webp)
Formations végétales notables à bases d'algues brunes


Les laminariales (appelées kelp en anglais) peuvent atteindre de très grandes tailles, jusqu'à 60 m, et former des forêts sous-marines abritant une grande diversité d'espèces.
Certaines sargassaceae atteignent aussi de grandes tailles, parfois 12 m, en étant fixées ou dérivantes et peuvent former des bancs importants. Elles sont à l'origine de l'ancienne légende (?) de la Mer des Sargasses.
Les fucales sont très présentes sur l'estran en particulier dans l'Atlantique nord. Elles sont un des constituants majeurs du varech.
De riches biotopes
Ces formations abritent des biotopes variés. Sur les côtes Nord du Pacifique le kelp est brouté par des oursins et des ormeaux (Haliotis) dont se nourrissent les loutres de mer qui sont la proie d'animaux plus gros. La Rhytine de Steller, (vache de mer) disparue depuis la fin du XVIIIe siècle se nourrissait de kelp sur les côtes du Pacifique Nord[22].

Dans les sargasses dérivantes de l'Atlantique se cachent de nombreux animaux comme le Poisson-Grenouille des Sargasses qui pratique une sorte de biomimétisme.
Régression de certaines espèces
Si certaines espèces sont devenues envahissantes hors de leur milieu naturel, d'autres sont en régression pour des raisons encore mal comprises, qui pourraient inclure le dérèglement climatique, les effets de la pollution par les antifoolings (peintures marines biocides) et les pesticides en général, ou localement une surexploitation de la ressource. Les fucus et les laminaires notamment lorsqu'ils sont récoltés sur le littoral (le goémon traditionnel) ou en mer sont concernés.
Accumulation d'iode
Plusieurs mécanismes des laminariales jouent un rôle essentiel dans le cycle bio-géochimique de l’iode sur Terre et dans la destruction de l’ozone dans la basse atmosphère[23].
La plupart des algues brunes sont des algues marines. Une de leurs caractéristiques importantes est qu'elles sont riches en glucides (les polysaccharides mentionnés plus haut) et en iode[24]. L'iode est peu soluble dans l'eau, mais ses sels eux le sont. De nombreuses algues brunes sont capables d'accumuler de fortes concentrations d'iodure dans l'eau de mer. Cependant la forme chimique et le rôle biologique de l’iode dans les algues représentaient une énigme[23].
Plusieurs études menées par divers groupes de scientifiques amènent à penser que les Laminariales sont les accumulateurs d’iode les plus performants sur terre et ont un impact important sur la chimie de l’atmosphère :
- Quand les laminariales subissent des stress, elles génèrent des radicaux libres à partir de l’oxygène et elles relâchent rapidement de grandes quantités d’iode dans l’atmosphère[23]. Elles utilisent de l'iode apoplastique comme antioxydant et c'est donc ce système qui permet l’émission d’iode.
- Ce mécanisme serait à l'œuvre lorsque les laminariales sont exposées à l'air durant les marées basses. C'est à ce moment que l’iodure de l'eau de mer accumulée par les algues, détoxifie l’ozone et d’autres formes d’oxydants à l’extérieur des cellules, permettant ainsi de protéger l’algue des dommages cellulaires[23].
- L'analyse du génome de l'Ectocarpus, qui a eu un rôle majeur dans la découverte des mécanismes d'accumulation d'iode, a permis d’identifier les enzymes impliquées dans ce système.
- Cette analyse génomique a permis de découvrir un certain nombre de déhalogénases (enzymes spécifiques des liaisons carbone-halogène). Ces enzymes peuvent aider l'Ectocarpus à se développer épiphytiquement sur d'autres algues brunes. Un développement épiphytique est un développement ou des organismes non parasitaires poussent en se servant d'autres organismes comme support sans leur nuire. Ce processus permet à l’algue brune de se défendre contre les molécules halogénées qui lui sont toxiques, en utilisant les enzymes comme des molécules de défense[24].
Production
Les algues brunes sont les macro-algues les plus cultivées, la première étant saccharina japonica, le konbu (autrefois laminaria japonica), et la seconde Undaria pinnatifida, le wakamé. La production de l'aquaculture essentiellement réalisée en Extrême-Orient, dépasse très largement celle de la cueillette[25]. Ces algues sont aujourd'hui aussi cultivées sur le littoral breton[26].
Ce sont les algues les plus cultivées dans le monde avec plus de 8 millions de tonnes par an dont 5,14 millions de tonne (à 86 % en Chine) pour le konbu en 2010[27].
Utilisations
Usages agricoles
Le goémon ou varech est principalement composé d'algues brunes : laminaires et fucales (fucus et ascophyllum). Il a été régulièrement utilisé comme amendement organique sans doute depuis le Haut-Moyen-Âge[28]. Ses teneurs en éléments principaux sont faibles : NPK = 2-0,2-2 (fumier de bovin : NPK = 4-1-5). Les teneurs en éléments secondaires (calcium, magnésium, soufre) sont intéressantes ainsi que les teneurs en oligo-éléments (manganèse, cuivre, fer, zinc...), (source : engrais du commerce[29]). Les teneurs élevées en sodium, chlore, iode, brome ne sont généralement pas un problème pour les principales cultures agricoles ni pour les prairies. On conseille cependant de ne pas dépasser 20-30 tonnes d'algues sèches par hectare et par épandage, à réaliser en tête de rotation par exemple[28].
La molice (moliço (en)), un mélange d'algues et d'herbes aquatiques abondamment récolté depuis des petits bateaux dits moliceiros, par exemple dans la Ria d'Aveiro au Portugal pouvait contenir des sargasses. Il était utilisé pour la fumure des terres environnantes[30].
Des préparations sont parfois vendues comme activateur de croissance des cultures, ce que l'on justifie par les hautes teneurs des algues brunes en hormones de croissance végétales et mannitol. On peut cependant constater que chaque plante synthétise elle-même les hormones et les sucres dont elle a besoin. En agriculture biologique on utilise des purins d'algues.
Les algues brunes ont parfois été utilisées comme aliment du bétail, leur exploitation est de nouveau envisagée[31].
Usages industriels

Les algues brunes calcinées ont servi de source de carbonate de sodium au XVIIe siècle et XVIIIe siècle puis d'iode au XIXe siècle[28] et depuis, d'alginates. Ce sont des substances gélifiantes utilisées comme émulsifiant, stabilisant, additif alimentaire… dans les industries alimentaires, cosmétiques et pharmaceutiques. Les alginates sont essentiellement fabriqués à partir de laminaires et d'ascophyllum.[32]
Les algues brunes sont utilisées depuis 2015 pour fabriquer des polymères biodégradables susceptibles de remplacer les plastiques d'origine pétrolière dans un grand nombre d'applications. L'Algopack est ainsi fabriqué seulement à partir d'algues[33].
En Bretagne, les algues utilisées sont des laminaires souvent cultivées en mer. Il existe un projet pour utiliser les sargasses qui prolifèrent aux Antilles[34].
Usages alimentaires
Outre les alginates utilisés comme adjuvants alimentaires, on utilise certaines algues brunes comme « légumes » : ainsi Himanthalia elongata (haricot ou spaghetti de mer) se cuisine de la même façon que les haricots verts.


Le Konbu (genre laminaria) est traditionnellement consommé au Japon, en Chine et en Corée.
Le Wakamé (Alariaceae) est l'un des ingrédients de la soupe Miso populaire au Japon.
Autres usages
Les algues brunes séchées ont servi comme combustible[28].
Les algues brunes font l'objet d'utilisations diverses : décors d'étals de poissonniers, conditionnement des expéditions de crustacés, de coquillages ou d'appâts vivants à poissons
Risques de régression liés à des récoltes outrancières
.jpg.webp)
La collecte non organisée constituant une part importante de l'approvisionnement en algues brunes, leurs formations peuvent régresser localement[35].
Objet de recherche
Les algues brunes présentent de nombreux potentiels industriels, médicaux, alimentaires[36] ou comme alicament[37], ressource biotechnologique, etc. On a montré qu'elles peuvent être surexploitées et que leur valeur biochimique (pour leur teneur en lipides par exemple) varie fortement selon les saisons, les sites et les conditions du milieu[38].
Pour ces raisons, elles font l'objet de nombreux travaux de recherche concernant notamment :
- l'évaluation de leur biomasse et de leur répartition spatiotemporelle dans la nature (en particulier pour les "champs d'algues brunes")[39] (éventuellement à partir de l'imagerie satellitaire multispectrale[40]) , et corrélativement à leur valeur dans le cycle du carbone[40]. On a montré qu'il existe chez les algues brunes un processus de fixation obscure du carbone, c'est-à-dire dans le noir (photosynthèse infrarouge), mais qu'il est peu important (1,2% de la fixation photosynthétique)[41].
- leurs origines, leur phylogénie[42],[43], dont en utilisant les outils de la Phylogénie moléculaire[44]. Leurs processus de spéciation et d'hybridation sont également explorés[45]
- leur mise en culture in vitro[46] et in situ et leur valorisation économique ;
- leur biologie des populations[47], leur écologie, leurs rôles écosystémiques (ainsi de grands laminaires détachés par les tempêtes peuvent transporter sur de grandes distances des épiphytes et divers invertébrés benthiques, par exemple entre l'Afrique du Sud et Sainte-Hélène[48]).
Les scientifiques s'interrogent aussi sur la régression récente de certaines espèces[49], leur physiologie[50], leur métabolisme[51] et leur métabolites[52] ; Fucus serratus, fucale intertidale des mers froides (ici de la Mer Blanche)
Fucus serratus, fucale intertidale des mers froides (ici de la Mer Blanche) - leurs capacités de transport interne de nutriments[53], et d'éventuels contaminants (bioconcentration ; ainsi Fucus serratus peut, après seulement un mois d'exposition, bioconcentrer jusqu'à 1000 fois et plus un radionucléide selon des tests faits avec un radioélément (technétium)[54]),
- les possibilités de valoriser commercialement ou industriellement certaines espèces d'algues brunes invasives[4], ou leurs sous-produits, en particulier des polysaccharides [55],[56]...
- leur contenu en métabolites secondaires bioactifs comme les phlorotanins, fucoxanthines, fucoidanes et fucostéroles ont de potentiels intérêts pharmaceutiques[57],[58]. Parmi les phlorotanins, le fucodiphloroethol G, une molécule inhibitrice de la maltase et de la protéine tyrosine phosphatase représente une piste d'outil thérapeutique pour normaliser le métabolisme du glucose chez le patient atteint de diabète de type 2[59]. Le phloroglucinol, un autre phlorotanin inhibe de manière non spécifique l'ACE et permettrait de limiter les risques de développement du diabète de type 2 et ses complications au long terme notamment au niveau vasculaire[60],[61].
Liste des ordres
Selon AlgaeBase (12 août 2017)[1] :
- Phaeophyceae ordo incertae sedis
- ordre des Stschapoviales H.Kawai
- sous-classe des Discosporangiophycidae Silberfeld, F. Rousseau & Reviers
- ordre des Discosporangiales O.C.Schmidt
- sous-classe des Ishigeophycidae Silberfeld, F. Rousseau & Reviers
- ordre des Ishigeales G.Y.Cho & S.M.Boo
- sous-classe des Dictyotophycidae Silberfeld, F.Rousseau & Reviers
- ordre des Dictyotales Bory
- ordre des Onslowiales Draisma & Prud'homme van Reine
- ordre des Sphacelariales Migula
- ordre des Syringodermatales E.C.Henry
- sous-classe des Fucophycidae Cavalier-Smith
- ordre des Ascoseirales Petrov
- ordre des Asterocladales T.Silberfeld, M.-F.Racault, R.L.Fletcher, A.F.Peters, F.Rousseau & B.de Reviers
- ordre des Desmarestiales Setchell & Gardner
- ordre des Ectocarpales Bessey
- ordre des Fucales Bory
- ordre des Laminariales Migula
- ordre des Nemodermatales M.Parente, R.L.Fletcher, F.Rousseau & N.Phillips
- ordre des Phaeosiphoniellales Silberfeld, F.Rousseau & Reviers
- ordre des Ralfsiales Nakamura ex P.-E.Lim & H.Kawai
- ordre des Scytothamnales A.F.Peters & M.N.Clayton
- ordre des Sporochnales Sauvageau
- ordre des Tilopteridales Bessey
Selon World Register of Marine Species (31 juillet 2021)[62][63] :
- Classe Phaeophyceae
- Ordre Ascoseirales
- Ordre Asterocladales
- Ordre Choristocarpales (inclus dans les Discosporangiales)
- Ordre Cutleriales
- Ordre Desmarestiales
- Ordre Dictyosiphonales (en)
- Ordre Discosporangiales
- Ordre Ectocarpales
- Ordre Ishigeales
- Ordre Laminariales
- Ordre Nemodermatales
- Ordre Onslowiales
- Ordre Phaeothamniales
- Ordre Pleurochloridellales
- Ordre Ralfsiales
- Ordre Scytosiphonales
- Ordre Scytothamnales
- Ordre Sporochnales
- Ordre Syringodermatales
- Ordre Tilopteridales
- Sous-classe Fucophycidae
- Sous-classe Dictyotophycidae
- Ordre Dictyotales
- Ordre Sphacelariales
Notes et références
- Guiry, M.D. & Guiry, G.M. AlgaeBase. World-wide electronic publication, National University of Ireland, Galway. https://www.algaebase.org, consulté le 12 août 2017
- Selosse M.A (2006) Animal ou végétal ? Une. Pour la science, (350), 66.
- Braud J.P & Perez R (1974) Les grandes populations d'algues brunes de la Bretagne méridionale-1974. Science et Pêche, 242, 1-3 (résumé).
- Zubia M (2003) La valorisation industrielle des algues brunes invasives (Fucales) de Polynésie française: étude prospective pour lutter contre leur prolifération et contribuer à la gestion durable de l’environnement récifal. thèse de doctorat, non publiée, Université de la Polynésie française, Tahiti.
- Constantine John Alexopoulos et Theodore Delevoryas, Morphology of plants and fungi, Harper & Row, (ISBN 0-06-040839-1, 978-0-06-040839-8 et 0-06-350197-X, OCLC 13762074, lire en ligne)
- Caron l, Douady D, De Martino A & Quinet M (2001) Light harvesting in brown algae. Cahiers de biologie marine, 42(1-2), 109-124.
- O. P. Sharma, Textbook of algae, Tata McGraw-Hill, (ISBN 0-07-451928-X et 978-0-07-451928-8, OCLC 56258737, lire en ligne)
- Neil A. Campbell; Jane B. Reece, Biologie, Québec, ERPI, , 1334 p. (ISBN 978-2-7613-1783-2), p. 606-608
- Connan, S. (2004). Étude de la diversité spécifique des macroalgues de la Pointe de Bretagne et analyse des composés phénoliques des Phéophycées dominantes (Thèse de Doctorat, Brest) (Lien-résumé).
- (en) Kjellman, F.R., « Phaeophyceae (Fucoideae) », sur algaebase.org, (consulté le )
- « Étude de l'évolution des algues brunes au moyen de phylogénies moléculaires Renaud Burrowes; sous la direction de Bruno de Reviers » [1 vol. (117-[19] p.) : ill. ; 30 cm], sur Bibliotheques.mnhn.fr, (consulté le )
- (en) « The New Higher Level Classification of Eukaryotes with Emphasis on theTaxonomy of Protists », sur onlinelibrary.wiley.com, (consulté le )
- Philippe Silar, Protistes Eucaryotes : Origine, Évolution et Biologie des Microbes Eucaryotes, Californie, Creative Commons, , 472 p. (ISBN 978-2-9555841-0-1, lire en ligne), p.40-51
- Raven et al. (trad. de l'anglais), Biologie Végétale 3e édition, S.l./Bruxelles/Paris, De Boeck, , 880 p. (ISBN 978-2-8041-8156-7)
- (en) Hoek, C. van den (Christiaan) et Jahns, Hans Martin., Algae : an introduction to phycology, Cambridge/New York/Melbourne, Cambridge University Press, , 623 p. (ISBN 0-521-30419-9, 9780521304191 et 0521316871, OCLC 28182088, lire en ligne)
- Charles Baxter, Kelp forests, Monterey Bay Aquarium Foundation, (ISBN 1-878244-01-9 et 978-1-878244-01-7, OCLC 20391894, lire en ligne)
- Philippe Silar, Protistes Eucaryotes : Origine, Évolution et Biologie des Microbes Eucaryotes, Creative Commun, , 472 p. (ISBN 978-2-9555841-0-1), p. 309-321
- (en) Frederic Berger, Alison Taylor and Colin Brownlee., « Cell Fate Determination by the Cell Wall in Early Fucus Development », sur Science Mag, (consulté le )
- (en) Swati Basu, Haiguo Sun, Leigh Brian, Ralph L. Quatrano and Gloria K. Muday, « Early Embryo Development in Fucus distichus Is Auxin Sensitive », sur ncbi.nlm.nih.gov, (consulté le )
- (en) V.T. Wagner, L. Brian, R. S. Quatrano, « Role of a vitronectin-like molecule in embryo adhesion of the brown alga Fucus. » [PDF], sur pnas.org, (consulté le )
- (en) « Transitions between marine and freshwater environments provide new clues about the origins of multicellular plants and algae. », US National Library of Medicine National Institutes of Health, (consulté le )
- Bruno Corbara, « Les forêts de "kelp" au temps des rhytines », ESpèces, , p. 82-85
- Philippe Potin et Laetitia Louis, « L'iodure accumulé dans les grandes algues brunes influence le climat côtier », sur cnrs.fr, (consulté le )
- (en) Susana M. Coelho, Delphine Scornet, Sylvie Rousvoal, Nick T. Peters,Laurence Dartevelle, Akira F. Peters and J. Mark Cock., « Ectocarpus: A Model Organism for the Brown Algae » [pdf.], sur cshprotocols.cshlp.org, (consulté le )
- « Production de l'aquaculture », sur fao (consulté le )
- « Ingrédients naturels pour l'alimentaire et la cosmétique », sur C-weed aquaculture (consulté en )
- « aquaculture », sur ifremer, (consulté le )
- Tristan Arbousse-Bastide, « Savoir-faire anciens et exploitation des Algues en Bretagne », sur Civam-Bretagne, (consulté le )
- « Caractéristiques techniques des algues en poudre pour jardin », sur Comptoir des jardins (consulté le )
- (pt) « Moliço », sur educalingo (consulté le )
- Sarah Le Blé, « Algues et nutrition animale : un océan d’opportunités », La Revue de l'Alimentation animale, (lire en ligne)
- La carraghénane et l'agar-agar autres gélifiants très utilisés sont obtenus à partir d'algues rouges (Rhodophyta)
- Xavier Remongin, « Des algues pour réduire la dépendance au plastique », sur Ministère de l'agriculture et de l'alimentation, (consulté le )
- « Innovation. Algopack transforme les sargasses en plastique à Saint-Malo », sur Ouest-France, (consulté le )
- (en) Mh Oróstica, Ma Aguilera, Ga Donoso et Ja Vásquez, « Effect of grazing on distribution and recovery of harvested stands of Lessonia berteroana kelp in northern Chile », Marine Ecology Progress Series, vol. 511, , p. 71–82 (ISSN 0171-8630 et 1616-1599, DOI 10.3354/meps10931, lire en ligne, consulté le )
- Marfaing H & Lerat Y (2007) Les algues ont-elles une place en nutrition ?. Phytothérapie, 5(1), 2-5.
- Paradis, M. E., Couture, P., & Lamarche, B. (2011). A randomised crossover placebo-controlled trial investigating the effect of brown seaweed (Ascophyllum nodosum and Fucus vesiculosus) on postchallenge plasma glucose and insulin levels in men and women. Applied Physiology, Nutrition, and Metabolism, 36(6), 913-919.
- Pellegrini, L., Valls, R., & Pellegrini, M. (1997). Chimiotaxonomie et marqueurs chimiques dans les algues brunes. Lagascalia, 19(1), 145-164.
- ex : Perez, R., Audouin, J., Braud, J. P., & Uhm, K. B. (1973). Répartition des grands champs d'algues brunes sur les côtes françaises de la Manche Occidentale entre l'Ile grande et l'Ile de Siec. Science et Pêche, 226, 1-12.
- Bajjouk, T. (1996). Évaluation qualitative et quantitative des macroalgues à partir d'imagerie multispectrale : application à l'étude de la production de carbone dans la région de Roscoff (Doctoral dissertation) (Notice Inist-CNRS)
- Penot M, Dumay J & Pellegrini M (1985) Contribution à l'étude de la fixation et du transport du 14C chez Cystoseira nodicaulis (Fucales, Cystoseiraceae). Phycologia, 24(1), 93-102 ().
- ex : Peters A.F & Ramírez M.E (2001) Molecular phylogeny of small brown algae, with special reference to the systematic position of Caepidium antarcticum (Adenocystaceae, Ectocarpales). Cryptogamie algologie, 22(2), 187-200.
- CHO G.Y & BOO S.M (2006) Phylogenetic position of Petrospongium rugosum (Ectocarpales, Phaeophyceae): insights from the protein-coding plastid rbcL and psaA gene sequences. Cryptogamie. Algologie, 27(1), 3-15 (résumé).
- Rousseau F (1999) Phylogénie moléculaire des Fucales et tendances évolutives au sein des algues brunes (Thèse de doctorat) (résumé)
- Billard E (2007) Évolution des systèmes de reproduction et leur implication dans les processus de spéciation et hybridation chez les algues brunes du genre Fucus (Thèse de doctorat, Paris 6).
- Pourriot R. (1963). Biologie-utilisation des algues brunes unicellulaires pour l'élevage des rotifères. Comptes rendus hebdomadaires des séances de l'académie des sciences, 256(7), 1603.
- Stiger, V. (1997) Contribution à l'étude de la biologie des populations de deux grandes algues brunes Turbinaria ornata et Sargassum mangarevense, proliférant sur les récifs de polynésie française (Thèse de doctorat) (notice Inist-CNRS).
- Arnaud F, Arnaud P.M, Intès A & Le Loeuff P (1976) Transport d'invertébrés benthiques entre l'Afrique du Sud et Sainte-Hélène par les laminaires (Phaeophyceae) ; Bulletin du Museum National d’Histoire Naturelle Paris Séries, 3(384), 49-55.
- Le Roux, A. (2005). Les patelles et la régression des algues brunes dans le Morbihan. Penn ar Bed, 192, 1-22.
- ex : De Reviers B, Marbeau, S & Kloarec B. (1983) Essai d'interprétation de la structure des fucoidanes en liaison avec leur localisation dans la paroi des Phéophycées. Cryptogamie. Algologie, 4(1-2), 55-62 (résumé)
- Quillet, M. (1954). Sur le métabolisme glucidique des algues brunes - présence de fructose chez Laminaria flexicaulis en survie dans l'eau de mer chloroformée. Comptes rendus hebdomadaires des séances de l'académie des sciences, 238(8), 926-928.
- Valls R (1993) Séparation, identification, étude spectroscopique de métabolites secondaires d'algues brunes(Cystoseiracées). Dosage- Variations- Chimiotaxonomie (Doctoral dissertation)
- Floc'h J.Y (1979) Étude du transport à longue distance des éléments minéraux dans le thalle des algues brunes (Doctoral dissertation).
- Masson, M., Aprosi, G., Laniece, A., Guegueniat, P., & Belot, Y. (1981). Approches expérimentales de l'étude des transferts du technétium à des sédiments et à des espèces marines benthiques. Impacts of radionuclide releases into the marine environment, 341-59.
- Colliec, S., Tapon-Bretaudiere, J., Durand, P., Fischer, A. M., Jozefonvicz, J., Kloareg, B., & Boisson, C. (1989). Polysaccharides sulfates, agent anticoagulant et agent anticomplémentaire obtenus à partir de fucanes d'algues brunes et leur procédé d'obtention. French Patent N°, 89, 07857.
- Blondin, C., Sinquin, C., Durand, P., & Jozefonvicz, J. (1991). Activités anticoagulante et anticomplémentaire de fucanes extraits d'algues brunes. Biofutur, 106, 51-51.
- (en) Thilina L. Gunathilaka, Kalpa Samarakoon, Pathmasiri Ranasinghe et L. Dinithi C. Peiris, « Antidiabetic Potential of Marine Brown Algae—a Mini Review », Journal of Diabetes Research, vol. 2020, , e1230218 (ISSN 2314-6745, PMID 32377517, PMCID PMC7197011, DOI 10.1155/2020/1230218, lire en ligne, consulté le )
- (en) Bertoka Fajar Surya Perwira Negara, Jae Hak Sohn, Jin-Soo Kim et Jae-Suk Choi, « Effects of Phlorotannins on Organisms: Focus on the Safety, Toxicity, and Availability of Phlorotannins », Foods, vol. 10, no 2, , p. 452 (ISSN 2304-8158, PMID 33669572, PMCID PMC7922789, DOI 10.3390/foods10020452, lire en ligne, consulté le )
- (en) Joo Young Lee, Sang Min Kim, Woo-Suk Jung et Dae-Geun Song, « Phlorofucofuroeckol-A, a potent inhibitor of aldo-keto reductase family 1 member B10, from the edible brown alga Eisenia bicyclis », Journal of the Korean Society for Applied Biological Chemistry, vol. 55, no 6, , p. 721–727 (ISSN 2234-344X, DOI 10.1007/s13765-012-2169-3, lire en ligne, consulté le )
- (en) Giuseppe Mancia, Rita Facchetti, Michele Bombelli et Hernan Polo Friz, « Relationship of Office, Home, and Ambulatory Blood Pressure to Blood Glucose and Lipid Variables in the PAMELA Population », Hypertension, vol. 45, no 6, , p. 1072–1077 (ISSN 0194-911X et 1524-4563, DOI 10.1161/01.HYP.0000165672.69176.ed, lire en ligne, consulté le )
- World Register of Marine Species, consulté le 31 juillet 2021
- WoRMS - Phaeophyceae : lire en ligne
- WoRMS - Fucales : lire en ligne
Références taxinomiques
- (en) Référence AlgaeBase : classe Phaeophyceae (consulté le )
- (en) Référence Catalogue of Life : Phaeophyceae (consulté le )
- (fr+en) Référence ITIS : Phaeophyceae (consulté le )
- (en) Référence NCBI : Phaeophyceae (taxons inclus) (consulté le )
- (en) Référence Paleobiology Database : Phaeophyceae (consulté le )
- (en) Référence uBio : Phaeophyceae (consulté le )
- (en) Référence World Register of Marine Species : taxon Phaeophyceae Kjellman, 1891 (+ liste ordres + liste familles) (consulté le )
Voir aussi
Lien externe
- Présentation illustrée (en anglais) de la zone des algues brunes (macroalgues et filamenteuses)
- http://www.lapresse.ca/vivre/gourmand/201704/19/01-5089819-les-algues-sortent-de-leur-ghetto.php
- http://www.passeportsante.net/fr/Nutrition/EncyclopedieAliments/Fiche.aspx?doc=algue_nu
- https://www.thoughtco.com/brown-algae-phaeophyta-2291972
- Vidéo explicatif des cycles de vie des algues: https://www.youtube.com/watch?v=lA8ylWTifYQ
- http://www.plantscience4u.com/2014/04/characteristics-of-phaeophyceae-brown.html
Bibliographie
- Augier M (1965) Biochimie et taxinomie chez les Algues. Bulletin de la Société Botanique de France, 112(sup1), 8-15.
- Combaut, G., Bruneau, Y., Jeanty, G., Francisco, C., Teste, J., & Codomier, L. (1976). Contribution chimique à l'étude de certains aspects biologiques d'une Phéophycée de profondeur Cystoseira zosteroïdes (Turn) C. Ag.*. Phycologia, 15(3), 275-282.
- Floc'h, J. Y., & Penot, M. (1972). Transport du 32P et du 86Rb chez quelques algues brunes: orientation des migrations et voies de conduction. Physiologie végétale (résumé).
- Floc'h, J. Y. (1976). Appels de blessure et transport a longue distance d'éléments mineraux chez deux algues brunes. Physiologie Vegetale.
- Francisco, C., Combaut, G., Teste, J., & Maume, B. F. (1977). Étude des sterols d'algues brunes du genre cystoseira: Identification par chromatographie gaz-liquide couplée à la spectrométrie de masse. Biochimica et Biophysica Acta (BBA)-Lipids and Lipid Metabolism, 487(1), 115-121 (résumé).
- Kloareg, B. (1984). Composition chimique et propriétés d'échange des parois cellulaires des Algues Brunes (Thèse de doctorat).
- Marfaing H & Lerat Y (2007) Les algues ont-elles une place en nutrition ?. Phytothérapie, 5(1), 2-5.
- Pellegrini, L., Valls, R., & Pellegrini, M. (1997). Chimiotaxonomie et marqueurs chimiques dans les algues brunes. Lagascalia, 19(1), 145-164.
- Ricard, P. (1930). Les cocnstituants glucidiques des algues brunes. (Doctoral dissertation, Ed. Blondel La Rougery).
- Silva, P. C., & de Reviers, B. (2000). Ordinal names in the Phaeophyceae. Cryptogamie Algologie, 21(1), 49-58.
- Sauvageau, C. (1917). Sur un nouveau type d'alternance des générations chez les algues brunes (Dictyosiphon foeniculaceus). Comptes rendus hebdomadaires des séances de l’académie des sciences, Paris, 164, 829-831.
- Takagi, T., Asahi, M., & Itabashi, Y. (1985). Fatty acid composition of twelve algae from Japanese waters Yukagaku, 34(12), 1008-1012 (résumé).
- Portail du monde maritime
- Portail de la phycologie
