Cet article a été rédigé avec la collaboration de nos éditeurs(trices) et chercheurs(euses) qualifiés(es) pour garantir l'exactitude et l'exhaustivité du contenu.
L'équipe de gestion du contenu de wikiHow examine soigneusement le travail de l'équipe éditoriale afin de s'assurer que chaque article est en conformité avec nos standards de haute qualité.
Il y a 7 références citées dans cet article, elles se trouvent au bas de la page.
Cet article a été consulté 29 301 fois.
En chimie, les équations ioniques nettes sont très utiles dans la mesure où elles décrivent les faits essentiels des réactions. Elles sont fréquemment utilisées pour rendre compte des réactions d'oxydoréduction, les réactions de remplacement double (ou substitutions couplées) et les neutralisations acidobasiques [1] . Pour établir une équation ionique nette, il faut souvent en passer par trois étapes : équilibrer l'équation moléculaire, la transformer en équation ionique (c'est-à-dire déterminer les espèces qui se retrouvent dans la solution) et enfin, établir l'équation ionique nette.
Étapes
Partie 1
Partie 1 sur 2:Comprendre les différents éléments d'une équation ionique
-
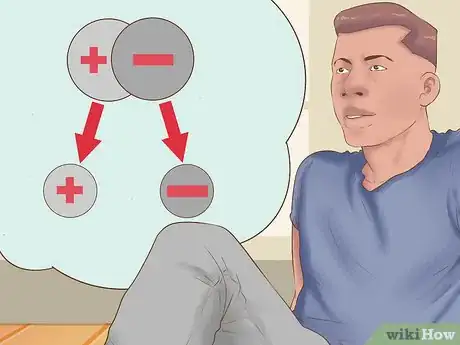
1Faites la différence entre les composés moléculaires et ioniques. Avec une équation ionique, la première chose à faire est de repérer les composés ioniques. Ce sont ceux qui s'ioniseront dans une solution aqueuse (solution ionique), ils présenteront donc une charge [2] . Les composés moléculaires sont électriquement neutres. Ils sont généralement constitués d’au moins deux non-métaux et sont parfois nommés « composés covalents [3] ».
- Les composés ioniques apparaissent à la suite de la réaction entre un métal et un non-métal, entre un métal et des ions polyatomiques, ou entre des ions polyatomiques.
- Si vous n'êtes pas très sûr de la nature d'un composé, regardez dans un tableau des éléments périodiques les éléments qui le composent [4] .
-
2Identifiez la solubilité du composé. Les composés ioniques ne sont pas tous solubles dans une solution aqueuse, ils resteront tels quels et ne libèreront aucun ion. Il vous faut identifier la solubilité de chaque composé avant de faire quoi que ce soit au niveau de l'équation chimique. Vous trouverez ci-après quelques règles de solubilité. Pour plus de détails sur la solubilité, consultez un tableau qualitatif de la solubilité [5] .
- Retenez quelques-unes des règles qui régissent les sels suivants :
- tous les sels Na+, K+ et NH4+ sont solubles,
- tous les sels NO3-, C2H3O2-, ClO3- et ClO4- sont solubles.
- tous les sels Ag+, Pb2+ et Hg22+ sont insolubles,
- tous les sels Cl-, Br- et I- sont solubles,
- tous les sels CO32-, O2-, S2-, OH-, PO43-, CrO42-, Cr2O72- et SO32- sont insolubles (sauf exception),
- tous les sels SO42- sont solubles (sauf exception).
-
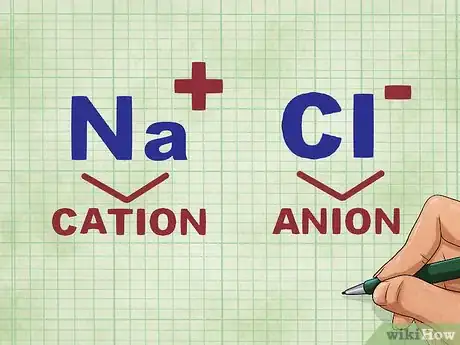
3Déterminez le cation et l'anion d'un composé. Les cations sont les ions positifs d'un composé et appartiennent généralement à la famille des métaux. Les anions sont des ions négatifs, non métalliques. Si certains non-métaux peuvent parfois donner des cations, seuls les métaux en donneront systématiquement [6] .
- Ainsi, avec NaCl, Na est chargé positivement, c'est le cation, car c'est l'élément métallique. Par contre, Cl a une charge négative, c'est l'anion, car c'est l'élément non métallique de la molécule.
-
4Sachez reconnaitre les ions polyatomiques dans une réaction. Ce sont des molécules électriquement chargées dont les liaisons sont extrêmement difficiles à rompre lors d'une réaction chimique. Il est important de savoir les reconnaitre, chacun ayant une charge spécifique. Ils ne se décomposeront pas en éléments qui les composent. Les ions polyatomiques peuvent être chargés positivement (cations polyatomiques) ou négativement (anions polyatomiques).
- Au lycée, selon le niveau, on vous demandera de retenir certains des ions polyatomiques les plus fréquemment rencontrés.
- Les ions polyatomiques les plus fréquemment rencontrés en chimie sont les suivants : CO32-, NO3-, NO2-, SO42-, SO32-, ClO4- et ClO3-.
- Il y en a beaucoup d'autres, vous les trouverez groupés par catégories de charges dans votre livre de chimie ou sur Internet [7] .
Publicité
Partie 2
Partie 2 sur 2:Établir une équation ionique nette
-
1Équilibrez l'équation moléculaire. Avant de pouvoir écrire l'équation ionique nette, il faut vous assurer que l'équation de la réaction chimique de départ est équilibrée. Pour cela, vous devez avoir autant d'atomes de chaque sorte d'un côté et de l'autre de l'équation. C'est pourquoi il est souvent nécessaire de mettre des coefficients (à droite ou à gauche) à tel ou tel élément pour que la réaction soit équilibrée.
- Prenons la réaction : Cr + NiCl2 --> CrCl3 + Ni. Faites le décompte du nombre d'atomes de tous les éléments de chaque côté de l'équation. Les atomes Cr et Ni sont équilibrés.
- Équilibrez les atomes de chlore (Cl). Il y en a deux à gauche et trois à droite. Pour équilibrer, il faut ajouter un 3 à gauche et un 2 à droite, Cr et Ni sont alors déséquilibrés.
- Équilibrez les atomes de nickel à droite (3Ni).
- Équilibrez les atomes de chrome à gauche (2Cr).
- Vérifiez que le nombre d'atomes est le même de part et d'autre de l'équation.
- Ainsi, Cr + NiCl2 --> CrCl3 + Ni devient 2Cr + 3NiCl2 --> 2CrCl3 + 3Ni.
-
2Identifiez les états physiques de chaque composé. Ils devront apparaitre dans l'équation. Assez souvent, le libellé de l'exercice donne des indications sur l'état de tel ou tel composé, ceux de départ tout au moins. Si les états physiques ne vous sont pas donnés, il y a d'autres moyens de les trouver.
- Si l'état de matière d'un élément ne vous est pas donné, récupérez-le dans le tableau des éléments périodiques.
- Si un composé est qualifié de « solution », à coup sûr, vous pouvez indiquer la mention « aq » (pour « aqueux »).
- Si la réaction se déroule en présence d'eau, vérifiez dans un tableau qualitatif de solubilité que le composé ionique se dissoudra [8] . S'il est hautement soluble, le composé sera aqueux (aq), sinon il vous faudra porter la mention « s » pour solide.
- S'il n'y a pas d'eau dans l'équation, le composé ionique est à l'état solide (s).
- Si l'exercice mentionne un acide ou une base, le composé sera aqueux (aq).
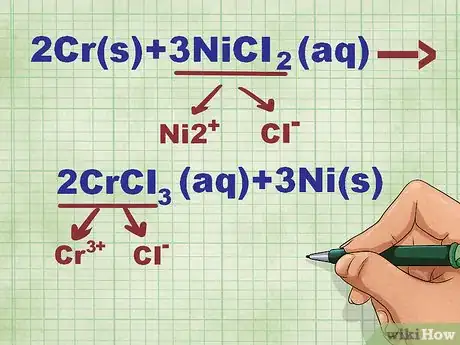
- Prenons un exemple : 2Cr + 3NiCl2 --> 2CrCl3 + 3Ni. Sous leurs formes élémentaires, Cr et Ni sont solides. NiCl2 et CrCl3 sont des composés ioniques solubles, donc aqueux. On peut donc récrire l'équation ainsi : 2Cr(s) + 3NiCl2(aq) --> 2CrCl3(aq) + 3Ni(s)
-
3Déterminez les espèces chimiques qui se dissocient. Dans une solution, il y a toujours des composés qui se dissocient (en cations et en anions). Quand une espèce ou un composé se dissocie, elle ou il se sépare en ions positifs (cations) et négatifs (anions). L'équilibre électrique devra alors être rétabli, c'est ce qui est fait dans l'équation ionique nette.
- Les solides, les liquides, les gaz, les composés moléculaires, les composés ioniques à faible solubilité, les ions polyatomiques et les acides faibles ne se dissocient pas.
- Les composés ioniques à forte solubilité (à vérifier sur le tableau de solubilité) et les acides forts s'ionisent en totalité : HCl(aq), HBr(aq), HI(aq), H2SO4(aq), HClO4(aq) et HNO3(aq) [9] .
- Sachez cependant que si les ions polyatomiques ne se dissocient pas, ils se détacheront, sans s'altérer, du composé dans lequel ils se trouvent.
-
4Calculez la charge de chaque ion dissocié. Rappelez-vous que les métaux donnent systématiquement des cations, tandis que la plupart des non-métaux donneront des anions. Utilisez le tableau des éléments périodiques pour connaitre la charge de chaque élément. Vous devrez ensuite équilibrer les charges de chaque ion au sein du composé.
- Reprenons notre exemple. NiCl2 va donner d'un côté Ni2+ et Cl-, pendant que CrCl3 se dissociera en Cr3+ et Cl-.
- Si l'ion nickel (Ni) a une charge de 2+, cette charge est compensée par les deux ions chlore qui ont chacun une seule charge négative (1-). De même, l'ion chrome (Cr) a une charge de 3+, c'est pourquoi il y a trois ions négatifs de chlore.
- Souvenez-vous que les ions polyatomiques ont une charge spécifique.
-
5Récrivez l'équation. Récrivez-la en indiquant tous les composés ioniques de la solution obtenue, désormais décomposés en ions. Tout ce qui doit se dissocier ou s'ioniser (acides forts) se séparera en deux ions distincts. L'état de la matière restera le même (aq), il ne restera qu'à vérifier que l'équation reste équilibrée.
- Les solides, les liquides, les gaz, les acides faibles et les composés ioniques à faible solubilité ne vont pas changer d'état ou se dissocier en ions : vous devez donc les laisser inchangés.
- Les substances moléculaires se dissoudront dans la solution, ce qui fait que l'état deviendra aqueux (aq). Il y a cependant trois exceptions à cette règle : CH4(g), C3H8(g) et C8H18(l) ne se retrouveront pas sous forme aqueuse.
- Reprenons notre exemple. L'équation ionique est désormais la suivante : 2Cr(s) + 3Ni2+(aq) + 6Cl-(aq) --> 2Cr3+(aq) + 6Cl-(aq) + 3Ni(s). Lorsqu'il n'est pas un élément d'un composé, le chlore n'est pas diatomique. C'est pourquoi on a multiplié son coefficient par le nombre d'atomes présents dans le composé, ce qui donne 6 ions Cl de chaque côté de l'équation.
-
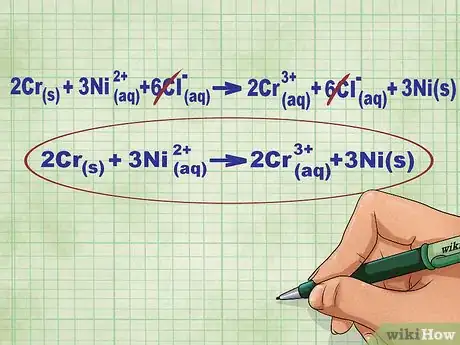
6Éliminez les ions spectateurs. Ce sont des ions qui ne réagissent pas au cours de la réaction. On peut donc les éliminer de chaque côté de l'équation. La seule limite est qu'on ne peut éliminer que des ions identiques (en charge et en indice). Récrivez l'équation sans ces ions spectateurs.
- Dans l'exemple que nous avons pris, il y a 6 ions spectateurs Cl- de chaque côté. Ils n'ont pas réagi, on peut les faire disparaitre de l'équation. Votre équation ionique nette est donc la suivante : 2Cr(s) + 3Ni2+(aq) --> 2Cr3+(aq) + 3Ni(s)
- Pour vérifier que vous avez bien travaillé, la charge totale des réactifs (à gauche de l'équation ionique nette) doit être égale à celle des produits (à droite).
Publicité
Conseils
- Dans vos équations, indiquez toujours les états de la matière de chaque espèce. On vous enlèvera des points dans une copie si vous ne les mentionnez pas.
Références
- ↑ http://www.chemteam.info/Equations/Net-Ionic-Equation.html
- ↑ http://www.chemteam.info/Equations/Net-Ionic-Equation.html
- ↑ http://www.chemteam.info/Equations/Net-Ionic-Equation.html
- ↑ http://www.ptable.com/
- ↑ http://chemistry.bd.psu.edu/jircitano/soluble.html
- ↑ http://study.com/academy/lesson/cation-definition-examples-quiz.html
- ↑ http://hrsbstaff.ednet.ns.ca/benoitn/sciences%2010%20enrichi/chimie/ions_polyatomiques_communs.htm
- ↑ http://chemistry.bd.psu.edu/jircitano/soluble.html
- ↑ http://www.chemteam.info/AcidBase/Strong-Weak-AcidBase.html


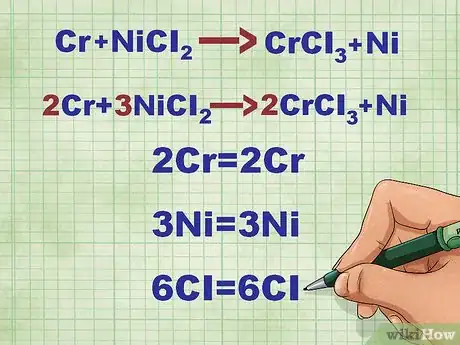
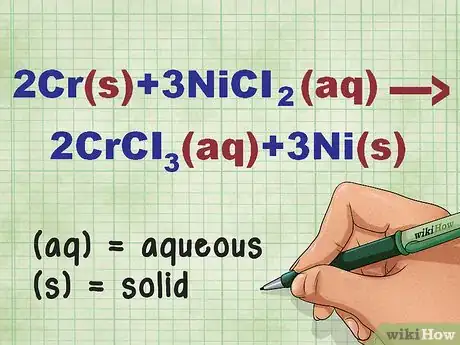
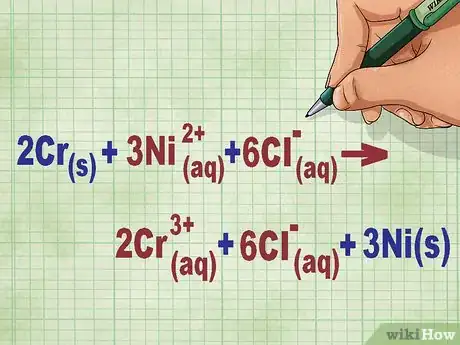


















L'équipe de gestion du contenu de wikiHow examine soigneusement le travail de l'équipe éditoriale afin de s'assurer que chaque article est en conformité avec nos standards de haute qualité. Cet article a été consulté 29 301 fois.