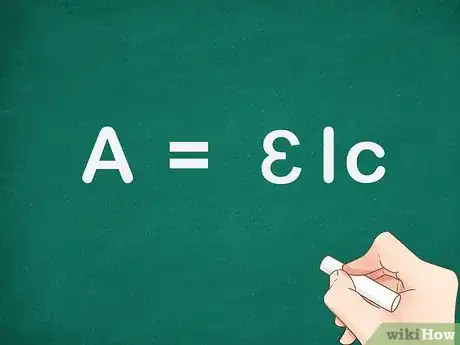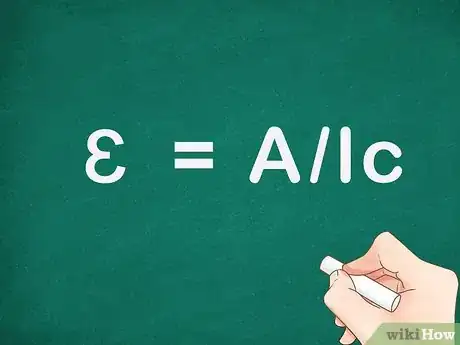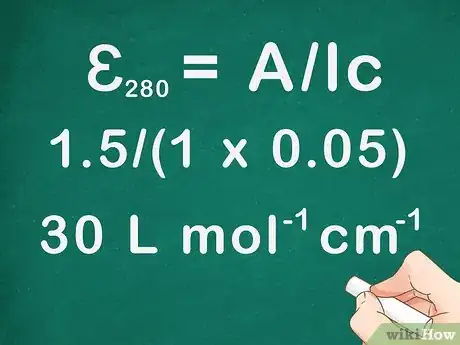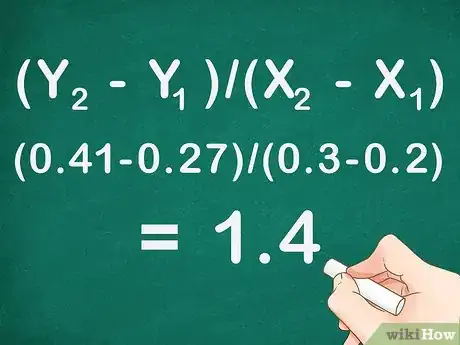Cet article a été coécrit par Bess Ruff, MA. Bess Ruff est doctorante en géographie à l'université d'État de Floride. Elle a obtenu un master en sciences et gestion de l'environnement à l'université de Californie, Santa Barbara, en 2016. Elle a aussi mené des enquêtes pour des projets de planification des espaces marins dans les Caraïbes et a contribué à la recherche en tant que boursière d'études supérieures pour Sustainable Fisheries Group.
Cet article a été consulté 25 112 fois.
L'absorptivité molaire, que l'on désigne également sous le nom de coefficient d'extinction molaire, sert à mesurer la capacité d'une espèce chimique à absorber une longueur d'onde de lumière donnée. Elle permet aussi d'établir des comparaisons entre diverses espèces chimiques sans tenir compte des différences de concentration ou de longueur de la solution traversée lors de la mesure [1] . Il s'agit d'une notion couramment utilisée en chimie qui ne doit pas être confondue avec le coefficient d'extinction qui est plutôt utilisé en physique. L'unité de mesure de l'absorption molaire est le litre par mole par centimètre (L mol-1cm-1 [2] ).
Étapes
Méthode 1
Méthode 1 sur 2:Calculer l'absorptivité molaire avec une équation
-
1Comprenez la loi sur l'absorbance. Il s'agit de la loi de Beer-Lambert, qui s'écrit A = ɛlc, A étant la quantité de lumière absorbée par l'échantillon pour une longueur d'onde donnée, ɛ étant l'absorptivité molaire et c la concentration de l'espèce absorbante par unité de volume [3] .
- On peut aussi calculer l'absorbance en faisant le rapport entre l'intensité d'un échantillon de référence et celle d'un échantillon pour lequel elle est inconnue. Pour cela, l'équation sera A = log10(Io/I [4] ).
- L'intensité se mesure à l'aide d'un spectrophotomètre.
- L'absorbance d'une solution est variable selon la longueur d'onde de la lumière qui la traverse. En fonction de la composition de la solution, il se peut que certaines longueurs d'onde soient moins absorbées que d'autres. N'oubliez pas que vous devez toujours préciser quelle est la longueur d'onde utilisée pour faire vos calculs [5] .
-
2Réécrivez l'équation de Beer-Lambert. Vous cherchez l'absorptivité molaire. Pour avoir celle-ci du côté gauche de l'équation, divisez l'absorbance par la longueur de la solution et par la concentration : ɛ= A/lc. Vous pouvez dès lors vous servir de cette équation simple pour calculer l'absorptivité molaire pour une longueur d'onde donnée.
- D'une mesure à l'autre, l'absorbance varie, en raison de la concentration de la solution et de la forme du récipient dans lequel elle se trouve. L'absorptivité molaire permet de corriger ces variations [6] .
-
3Trouvez des valeurs grâce à la spectrophotométrie. Les valeurs mesurées seront par la suite intégrées dans l'équation. Le spectrophotomètre est une machine qui fait passer de la lumière à une longueur d'onde spécifique à travers une substance et qui détecte ensuite la quantité de lumière qui en ressort. Une partie de la lumière est absorbée par la solution, le reste la traverse et va nous servir à connaitre son absorbance.
- Préparez une solution dont la concentration c est connue pour l'analyser. La concentration doit être molaire, c'est-à-dire exprimée en moles/litre [7] .
- Pour avoir l, mesurez la longueur de la cuvette. La longueur de la solution doit être exprimée en centimètres.
- Obtenez ensuite A, la mesure de l'absorbance à une longueur d'onde donnée, à l'aide du spectrophotomètre. Normalement, les longueurs d'onde doivent être en mètres, mais la grande majorité d'entre elles sont si petites qu'elles sont en fait exprimées en nanomètres (nm [8] ). Il n'y a aucune unité pour l'absorbance.
-
4Intégrez les valeurs dans l'équation. Il ne vous reste plus qu'à la résoudre. Prenez les valeurs que vous avez trouvées pour A, c et l et placez-les dans l'équation ɛ = A/lc. Multipliez l par c, puis divisez A par le résultat pour arriver à l'absorptivité molaire.
- Prenons un exemple. Vous vous servez d'une cuvette de 1 cm pour mesurer l'absorbance d'une solution titrée à 0,05 mol/L. Avec une longueur d'onde de 280 nm, l'absorbance était de 1,5. Quelle sera l'absorptivité molaire de cette solution ?
- ɛ280 = A/lc = 1,5/(1 x 0,05) = 30 L mol-1 cm-1.
Publicité - Prenons un exemple. Vous vous servez d'une cuvette de 1 cm pour mesurer l'absorbance d'une solution titrée à 0,05 mol/L. Avec une longueur d'onde de 280 nm, l'absorbance était de 1,5. Quelle sera l'absorptivité molaire de cette solution ?
Méthode 2
Méthode 2 sur 2:Calculer l'absorptivité molaire grâce à une courbe d'étalonnage
-
1Réalisez les mesures. Mesurez l'intensité de lumière qui traverse la cuvette avec différentes concentrations de la solution. Préparez trois à quatre échantillons de votre solution à des concentrations différentes. Servez-vous du spectrophotomètre pour mesurer l'absorbance de la solution à une concentration donnée et pour une longueur d'onde donnée. Commencez toujours par l'échantillon le plus dilué pour terminer par le plus concentré. L'ordre dans lequel vous procédez n'a pas tellement d'importance, mais vous devez veiller à noter soigneusement à quelle concentration chaque absorbance se rapporte.
-
2Faites un graphique. Vous allez y reporter l'absorbance en fonction de la concentration. Servez-vous des résultats connus grâce au spectrophotomètre pour tracer un graphique linéaire. Pour chaque valeur mesurée, reportez la concentration sur l'axe des X et l'absorbance sur l'axe des Y [9] .
- Tracez une droite pour relier tous les points. Si vous avez fait vos mesures dans les règles de l'art et conformément à la loi de Beer-Lambert, les points forment une ligne droite parfaite qui indique que la concentration et l'absorbance sont proportionnelles [10] .
-
3Déterminez la pente. Vous devez calculer la pente de la droite d'étalonnage en vous servant des points qui la composent. Il faut pour cela que vous divisiez la variation de l'ordonnée par la variation de l'abscisse. Choisissez deux points dont vous connaissez les valeurs, soustrayez les X et les Y correspondants, puis divisez la variation des Y par celle des X.
- L'équation qui décrit la pente ou le coefficient directeur d'une droite est (Y2 - Y1)/(X2 - X1). Le point qui est désigné par le 2 est celui qui est le plus haut sur la courbe, celui qui est le plus bas est désigné par le 1.
- Utilisons un exemple pour lequel l'absorbance est de 0,27 à une concentration molaire de 0,2 et de 0,41 à une concentration molaire de 0,3. Les valeurs de l'absorbance sont reportées sur l'axe des Y, tandis que les concentrations sont reportées sur l'axe des X. On applique l'équation qui nous donne le coefficient directeur de la droite : (Y2 - Y1)/(X2 - X1) = (0,41-0,27)/(0,3-0,2) = 0,14/0,1 = 1,4. Notre droite a une pente de 1,4.
-
4Divisez la pente par la longueur du pas. La longueur du pas équivaut à la largeur de la cuvette. Pour trouver l'absorptivité molaire, il faut que vous divisiez la pente par la largeur de la cuvette dont vous vous êtes servie dans le spectrophotomètre.
- Continuons avec le même exemple : si la pente est de 1,4 et que la longueur du pas est de 0,5 cm, alors l'absorptivité molaire est 1,4/0,5 = 2,8 L mol-1 cm-1.
Publicité
Références
- ↑ http://www.chemguide.co.uk/analysis/uvvisible/beerlambert.html
- ↑ http://www.chm.davidson.edu/vce/spectrophotometry/beerslaw.html
- ↑ http://www.chemguide.co.uk/analysis/uvvisible/beerlambert.html
- ↑ http://www.chemguide.co.uk/analysis/uvvisible/beerlambert.html
- ↑ http://www.chm.davidson.edu/vce/spectrophotometry/beerslaw.html
- ↑ http://www.chemguide.co.uk/analysis/uvvisible/beerlambert.html
- ↑ http://teaching.shu.ac.uk/hwb/chemistry/tutorials/molspec/beers1.htm
- ↑ http://www.bbc.co.uk/bitesize/standard/physics/telecommunications/communication_using_waves/revision/5/
- ↑ http://teaching.shu.ac.uk/hwb/chemistry/tutorials/molspec/beers1.htm