بيفلوريد البوتاسيوم
بيفلوريد البوتاسيوم هو مركب كيميائي لاعضوي من عناصر البوتاسيوم والفلور والهيدروجين، وله الصيغة الكيميائية KHF2، ويكون على شكل صلب عديم اللون، وله رائحة حمضية خفيفة.
| بيفلوريد البوتاسيوم | |
|---|---|
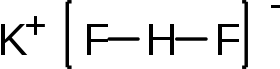 بيفلوريد البوتاسيوم | |
| الاسم النظامي (IUPAC) | |
Potassium bifluoride | |
| أسماء أخرى | |
Potassium hydrogen difluoride | |
| المعرفات | |
| رقم CAS | 7789-29-9 |
| بوب كيم (PubChem) | 11829350 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | KHF2 |
| الكتلة المولية | 78.10 غ/مول |
| المظهر | صلب عديم اللون |
| الكثافة | 2.37 غ/سم3 |
| نقطة الانصهار | 238.7 °س |
| نقطة الغليان | يتفكك |
| الذوبانية في الماء | 27.6 غ/100 مل ماء (عند 20 °س) |
| الذوبانية | ينحل في الإيثانول |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
التحضير
تحضر بلورات بيفلوريد البوتاسيوم كناتج من محلول فلوريد البوتاسيوم مع كمية فائضة من حمض هيدروفلوريك؛ كما يمكن التحضير من تفاعل البوتاس الكاوي (محلول مركز من هيدروكسيد البوتاسيوم) أو كربونات البوتاسيوم مع حمض هيدروفلوريك.
الخواص
يتفكك مركب بيفلوريد البوتاسيوم بالتسخين لدرجات حرارة فوق 400 °س إلى فلوريد البوتاسيوم وفلوريد الهيدروجين:[2]
يرتبط الهيدروجين والفلور في أنيون بيفلوريد −HF2 برابطة كيميائية قوية، يبلغ طولها 114 بيكومتر (pm)،[3] ووطاقة ذات مقدار أعلى من 155 كيلوجول/مول.[4]
الاستخدامات
استخدمت طريقة التحليل الكهربائي لمزيج من بيفلوريد البوتاسيوم وفلوريد الهيدروجين في عزل عنصر الفلور لأول مرة من قبل هنري مواسان.
تستخدم أملاح البيفلوريد على العموم كصهارة في صناعات التعدين، كما تستخدم كمادة لتحضير حمض الهيدروفلوريك في الموقع.
اقرأ أيضاً
المراجع
- وصلة : مُعرِّف "بَب كِيم" (PubChem CID) — الرخصة: محتوى حر
- G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 236-7.
- Greenwood, Norman N.؛ Earnshaw, Alan (1997)، Chemistry of the Elements (ط. الثانية)، Butterworth-Heinemann، ISBN 0-08-037941-9.
- Emsley, J. (1980) Very strong hydrogen bonds, Chemical Society Reviews, 9, 91-124.
- بوابة الكيمياء