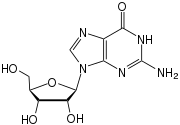
فيروس
الفيروسات أو الحُمَات. مفردها فيروس أو حُمَة[1] (باللاتينية: Virus) وتعني فيروس في اليونانية «ذيفان» أو «سم» وهو عامل ممرض صغير لا يمكنه التكاثر إلا داخل خلايا كائن حي آخر. الفيروسات صغيرة جدًا ولا يمكن مشاهدتها بالمجهر الضوئي. تصيب الفيروسات جميع أنواع الكائنات الحية، من الحيوانات والنباتات اٍلى البكتيريا والعتائق.[2] على الرغم من أن هناك الملايين من الأنواع المختلفة،[3] لم يتم وصف إلا حوالي 5.000 من الفيروسات بالتفصيل،[4] وذلك منذ الاٍكتشاف الأولي لفيروس تبرقش التبغ من قبل مارتينوس بيجيرينك عام 1898.[5] الفيروسات موجودة تقريبًا في كل النظم الإيكولوجية على الأرض، وتعتبر هذه الهياكل الدقيقة (الفيروسات) الكيان البيولوجي الأكثر وفرة في الطبيعة.[6][7] دراسة الفيروسات معروفة بعلم الفيروسات، وهو تخصص فرعي في علم الأحياء الدقيقة.
اضغط هنا للاطلاع على كيفية قراءة التصنيف الفيروسات | |
|---|---|
 | |
| المرتبة التصنيفية | نطاق |
| تصنيف الفيروسات | |
| المجموعة: | I–VII |
| الاسم العلمي | |
| Virus | |
| المجموعات | |
| I: فيروسات ذات الدنا ثنائي السلسلة II: فيروسات ذات الدنا أحادي السلسلة | |
خلافا للبريونات وأشباه الفيروسات، تتكون الفيروسات من جزأين أو ثلاثة: كل الفيروسات لها مورثات مكونة من الدنا أو الرنا، (جزيئات طويلة تحمل المعلومات الجينية) كما لها غلاف بروتيني يحمي هذه الجينات، وبعضها محاطة بغلاف دهني يحيط بها عندما تكون خارج الخلية المضيفة. أشباه الفيروسات لا تملك غلافًا بروتينيًا والبريونات ليس لها دنا أو رنا.
تختلف أشكال الفيروسات من بسيطة كاللولبية وعشرونية الوجوه، اٍلى بُنَى معقدة جدًا. معظم الفيروسات أصغر من البكتيريا المتوسطة بحوالي مائة مرة. يبقى أصل الفيروسات في تاريخ تطور الحياة غير واضح، بعضها ربما تطور من البلازميدات (جزيئات من الدنا يمكنها الاٍنتقال من خلية لأخرى) في حين يمكن لأخرى أن تكون تطورت من البكتيريا. في التطور الفيروسات عامل مهم في نقل الجينات الأفقي، مما يزيد التنوع الجيني.[8]
تنتشر الفيروسات بالعديد من الطرق: فيروسات النبات تنتقل من نبات إلى آخر غالبًا عن طريق الحشرات التي تتغذى على النسغ، مثل المن، في حين أن فيروسات الحيوان يمكن أن يحملها دم الحشرات الماصة (مثل البعوض) المعروفة باسم النواقل. فيروس الاٍنفلونزا ينتشر عن طريق السعال والعطس.
الفيروسة العجلية المسببة لالتهاب المعدة والأمعاء الفيروسي تنتقل عبر الطريق الفموي الشرجي وتنتقل كذلك من شخص إلى آخر عن طريق الاتصال، وتدخل الجسم مع الطعام أو الماء.
فيروس نقص المناعة البشرية هو واحد من الفيروسات المنقولة عن طريق الجنس، أو التعرض لدم مصاب بالعدوى (مثلًا عن طريق الحقن).
العدوى الفيروسية لدى الحيوانات تثير الاستجابة المناعية التي عادة ما تقضي على هذا الفيروس المعدي. هذه الاستجابة المناعية يمكن أيضًا أن تكون ناتجة عن اللقاحات والتي تمنح حصانة ضد الإصابة بفيروس معين. ومع ذلك، بعض الفيروسات مثل فيروس نقص المناعة البشرية وتلك التي تسبب الاٍلتهاب الكبدي الفيروسي يمكنها التملص من هذه الاستجابة المناعية، وتسبب التهابات مزمنة. الكائنات المجهرية أيضا تملك دفاعات ضد العدوى الفيروسية، مثل نظم تعديل القيد.
لا يوجد للمضادات الحيوية أي تأثير على الفيروسات لذا تم تطوير بضعة أدوية مضادة للفيروسات، نظرًا لوجود عدد قليل من الأهداف لهذه العقاقير لتتداخل معه فهي قليلة نسبيًا. هذا لأن الفيروس يعيد برمجة خليته المضيفة لإنتاج فيروسات جديدة، وجعل تقريبًا كل البروتينات المستعملة في هذه العملية جزء طبيعي من الذات، مع عدد قليل فقط من البروتينات الفيروسية.
أصل التسمية
الكلمة من اللاتينية virus تشير إلى سم قاتل وغيره من المواد الضارة، أول اٍستعمال لها في الاٍنجليزية كان سنة 1392.[9] أما معناها «العامل المسبب للأمراض المعدية» فاستعمل لأول مرة سنة 1728،[9] وذلك قبل اكتشاف الفيروسات من قبل ديمتري إيفانوفسكي في عام 1892. في الأخير صفة viral (فيروسي) تعود لعام 1948.[10]
مصطلح virion (فيريون) يستخدم أيضا للدلالة على الجسم الفيروسي المعدي الوحيد. ومجموعها فيروسات.
تاريخ علم الفيروسات

اكتشفت الفيروسات صدفة في أثناء إجراء العالم أدولف ماير سنة 1883 بحوثًا على تبرقش أوراق التبغ، فتوصل إلى وجود دقائق أصغر من البكتيريا تسبب المرض. عام 1884، قام عالم الأحياء الدقيقة الفرنسي شارل شمبرلند باختراع مصفاة (تعرف اليوم بمصفاة شمبرلند أو مصفاة شمبرلند-باستور) مع مسام أصغر من البكتيريا. وبالتالي، يمكنه تمرير محلول يحتوي على البكتيريا وتصفيته وإزالتها تمامًا منه.[11]
تمكن العالم الروسي ديمتري إيفانوفسكي سنة 1892م من تصفية عصارة أوراق التبغ المصابة باستخدام مرشحات خاصة لا تسمح للبكتيريا بالمرور، ومسح بها اوراق غير مصابة فلاحظ إصابتها. وهو أول من أطلق عليها اسم فايرس (ويعني باللاتينية السم وهي عبارة عن جزيئات بسيطة وصغيرة في الحجم)، أظهرت تجاربه أن أوراق نبات التبغ المصابة بعد سحقها ما زالت معدية بعد الترشيح. اقترح ايفانوفسكي أنه قد يكون سبب العدوى مادة سامة تنتجها البكتيريا لكنه لم يتابع هذه الفكرة.[12] في ذلك الوقت كان يعتقد أنه يمكن الإبقاء على جميع العوامل المعدية فوق المصافي وتنميتها على أوساط غذائية (كان هذا جزء من النظرية الجرثومية للمرض).[5] في عام 1898، كرر عالم الجراثيم الهولندي مارتينوس بيجيرينك التجارب وأصبح على قناعة بأن المحلول الناتج عن التصفية يضم شكلًا جديدًا من العوامل المعدية[13] ولاحظ أن هذا العامل أصاب فقط الخلايا التي في منطقة التبرقش، لكن تجاربه لم تظهر له أنه مكون من جسيمات لذا قام بتسميته العامل الجرثومي الذائب (contagium vivum fluidum) ثم عاد واستخدم اسم فيروس فيما بعد.[12] بيجيرينك ساند نظرية كون الفيروسات سائلة في الطبيعة وهي نظرية فقدت مصداقيتها في وقت لاحق من قبل وندل ستانلي الذي أثبت وجود جسيمات.[12] في نفس السنة اكتشف كل من العالمان فريدريك لوفلر وبول فروش أول فيروس يصيب الحيوان وهو فيروس الحمى القلاعية.[14]
مع مطلع القرن 20 اكتشف عالم الجراثيم الإنجليزي فريدريك توارت مجموعة من الفيروسات تصيب البكتيريا، تسمى الآن العاثيات[15] وقد وصفها عالم الجراثيم الكندي-الفرنسي فيليكس دهيريل بأنها الفيروسات التي عند إضافتها إلى البكتيريا على أغار تنتج مناطق من البكتيريا الميتة واكتشف أن أعلى التخفيفات من هذه الفيروسات (أقل تركيز للفيروس) بدلًا من قتل جميع البكتيريا يشكل مناطق منفصلة من الكائنات الميتة. قام فيليكس بحساب عدد هذه المناطق وضربه في معامل التخفيف ما سمح له بحساب عدد الفيروسات في المحلول الأصلي المخفف.[16] وقد بشر بالعاثيات كعلاج محتمل للأمراض مثل التيفوئيد والكوليرا لكن هذه البشارة نسيت مع تطوير البنسلين. دراسة العاثيات أعطت إشارات حول تبديل وإيقاف الجينات واعتبرت آلية مفيدة لإدخال جينات أجنبية إلى البكتيريا.
بحلول نهاية القرن 19، تم تعريف الفيروسات من حيث العدوى وقدرة تصفيتها وكذا حاجتها لمضيف حي. وقد نمت الفيروسات فقط في النباتات والحيوانات. في عام 1906، ابتكر روس جرانفيل هاريسون طريقة لزراعة الأنسجة في اللمف وفي عام 1913 استخدم إ. ستينهاردت وزملائه هذه الطريقة لتنمية فيروس الوقس في أجزاء من أنسجة قرنية خنزير غينيا.[17] في عام 1928 قام هـ. ب. ميتلاند وم. س. ميتلاند بتنمية فيروس الوقس في معلق كلى الدجاج المفروم، لم تعتمد طريقتهم على نطاق واسع حتى 1950 حيث كانت تزرع الفَيْروسَةِ السِّنْجابِيَّة أو ما يعرف بفيروس شلل الأطفال (الفيروس المسبب لشلل الأطفال) على نطاق واسع لإنتاج اللقاحات.[18]
في عام 1931 جاءت انطلاقة أخرى عندما قام عالم الأمراض الأمريكي أرنست وليام غودباستير بتنمية الأنفلونزا وفيروسات عدة أخرى في بيض الدجاج المخصب.[19] عام 1949 قام كل من جون إندرز وتوماس ولر وفردريك روبنز بتنمية فيروس شلل الأطفال في خلايا الجنين البشري، ليكون أول فيروس نمى دون استخدام أنسجة صلبة لحيوانات أو بيض. مكن هذا العمل يوناس سولك من تقديم لقاح فعال ضد شلل الأطفال.[20]
تم الحصول على الصور الأولى للفيروسات بعد اختراع المجهر الإلكتروني في عام 1931 من قبل المهندسين الألمانيين إرنست روسكا وماكس كنول.[21] في عام 1935 قام عالم الفيروسات والكيمياء الحيوية الأميركي وندل ستانلي بدراسة فيروس تبرقش التبغ ووجد أنه يتألف في معظمه من البروتين[22]، بعد ذلك بوقت قصير، تم فصل هذا الفيروس إلى جزئين (بروتين ورنا).[23] كان فيروس تبرقش التبغ أول فيروس تتم بلورته وأمكن بالتالي أن تكون بنيته واضحة بالتفصيل. تم الحصول على أول صور حيود الأشعة السينية للفيروس المبلور من قبل برنال وفانكيشين عام 1941. على أساس صورها، اكتشفت روزاليند فرانكلين بنية الدنا الكامل للفيروس في عام 1955.[24] في نفس السنة بين هاينز فرانكل كونرات وروبلي كوك وليامز أن رنا فيروس تبرقش التبغ النقي ومعطفه البروتيني يمكن أن يجتمعا بحد ذاتهما لتشكيل فيروسات فعالة، مما يوحي بأن هذه الآلية البسيطة ربما كانت الوسائل التي تم إنشاؤها من قبل الفيروسات داخل الخلايا المضيفة.[25]
كان النصف الثاني للقرن العشرين العصر الذهبي لاكتشاف الفيروسات حيث عثر على 2000 نوع وهي معظم الفيروسات المعترف بها لدى الحيوان والنبات والبكتيرية خلال هذه السنوات.[26][27] عام 1957 تم اكتشاف الفيروس الشرياني الخيلي ومسبب الإسهال الفيروسي عند الأبقار (الحمة الطاعونية). تم اكتشاف فيروس الالتهاب الكبدي الوبائي ب من قبل باروخ بلومبرغ في عام 1963[28]، وصف هوارد تيمن أول فيروس قهقري عام 1965.
الانزيم المفتاح للفيروسات القهقرية (المنتسخة العكسية) والذي يستخدم لترجمة رناها إلى دنا وصف لأول مرة عام 1970 بشكل مستقل من قبل هوارد تيمن وديفيد بلتيمور.[29] في عام 1983 عزل فريق لوك مونتانييه من معهد باستير في فرنسا لأول مرة الفيروس القهقري المعروف الآن بفيروس نقص المناعة البشرية.[30]
واكتشف العالمان ولتر ريد وجيمس كارول أول فيروس يصيب الإنسان وهو فيروس الحمى الصفراء.[31][32]
تعتبر الفيروسات إحدى أهم المعضلات التي تواجه التصنيف الحيوي فهي لا تمثل كائنات حية لذلك توصف غالبًا بالجسيمات المعدية لكنها بالمقابل تبدي بعض خصائص الحياة مثل القدرة على التضاعف والتكاثر بالاستعانة بخلايا المضيف التي تم السيطرة عليها. تقوم الفيروسات بالاستعانة بآليات الخلايا الحيوية عن طريق دس الدنا أو الرنا الفيروسي ضمن المادة الوراثية للخلايا الحية. لكن بالمقابل الفيروسات لا تتحرك ولا تقوم بعمليات استقلاب أو تحلل من تلقاء نفسها، إنها في منطقة وسطى بين الحياة واللاحياة (يبقى تعريف الحياة نفسه غير محدد بدقة، فبعض الجسيمات مثل ريكتسيا تبدي مظاهر الحياة واللاحياة أيضاً).
الأصل والمنشأ
قد تكون الفيروسات موجودة منذ تطور الخلايا الحية الأولى فهي توجد حيث وجدت الحياة.[33] إلا أن أصلها غير واضح لأنها لم تشكل حفريات، لذلك فالتقنيات الجزيئية كانت وسيلة مفيدة للغاية للتحقيق في كيفية نشوئها.[34] هذه التقنيات تعتمد على توافر الدنا أو الرنا الفيروسي القديم، لكن لسوء الحظ فإن معظم الفيروسات التي تم حفظها وتخزينها في المختبرات تعود لأقل من 90 عاما.[35][36] هناك ثلاث فرضيات رئيسية تحاول تفسير نشأة الفيروسات:[37][38]
فرضية التقهقر
وتنص على أنه ربما كانت الفيروسات خلايا صغيرة تتطفل على الخلايا الأكبر. بمرور الوقت، فقدت الجينات التي لا تحتاج إليها في التطفل. يدعم هذه الفرضية بكتيريا الريكتسيا والكلاميديا التي هي خلايا حية يمكنها التكاثر فقط داخل خلية مضيفة مثل الفيروسات. واعتمادها على التطفل من المحتمل أن يكون هو سبب خسارة الجينات التي تمكنها من البقاء على قيد الحياة خارج الخلية. هذا ما يسمى أيضًا فرضية الانحطاط.[39][40]
أي أن الفيروسات نشأت نتيجة تطور رجعي لكائنات دقيقة كانت تعيش معيشة حرة، فأصبحت كائنات متطفلة على الحياة الخلوية وتطورت رجعيًا لتفقد أشكالها وتراكيبها الأصلية ثم أصبحت جزيئات متطفلة إجباريًا على كائنات أخرى (فيروسات).
فرضية المنشأ الخلوي
و تنص على أن بعض الفيروسات قد تطورت من أجزاء «ناجية» من الدنا أو الرنا لجينات وراثية لكائنات أكبر. الدنا الناجي يمكن أن يأتي من العناصر الوراثية المتحركة مثل البلازميدات أو الينقولات[41]، سميت أولًا «جينات القفز»، اٍكتشفت في الذرة من قبل بربرة مكلنتوك عام 1950.[42] وهذا مايسمى أحيانًا فرضية التشرد.[39][43]
فرضية التطور المشترك
وتنص على أنه قد تكون الفيروسات تطورت من جزيئات معقدة من البروتين والأحماض النووية في نفس الوقت الذي ظهرت للمرة الأولى الخلايا على سطح الأرض واٍعتمدت على الحياة الخلوية لعدة ملايين من السنين.
أشباه الفيروسات هي جزيئات الرنا التي لا تصنف على أنها فيروسات لأنها تفتقر لغشاء بروتيني، ومع ذلك، لديها الخصائص التي تشترك فيها العديد من الفيروسات وغالبًا ما تسمى عوامل شبه فيروسية.[44]
تعتبر أشباه الفيروسات المسبب الرئيسي للأمراض لدى النباتات،[45] لكنها لا تشفر للبروتينات بل تتفاعل مع الخلايا المضيفة وتستعمل آلية المضيف من أجل تكرارها (تكاثرها).[46] فيروس التهاب الكبد د البشري له جينوم رنا مماثل لأشباه الفيروسات لكن له غشاء بروتيني مشتق من فيروس التهاب الكبد ب، اٍذا فهو فيروس معيب ولا يمكنه التكرار اٍلا بمساعدة فيروس التهاب الكبد ب.[47] بالمثل، الفيروس الآكل 'سبوتنيك' يعتمد على الفيروس المحاكي، الذي يصيب أوالي الشوكميبة الكاستيلانية.[48] هذه الفيروسات التي تعتمد على وجود أنواع أخرى من الفيروسات في الخلايا المضيفة تسمى توابع وربما تمثل مرحلة تطورية وسيطة بين أشباه الفيروسات والفيروسات.[49][50]
في الماضي كانت هناك مشكلات مع كل هذه الفرضيات: فرضية التقهقر لم تفسر لماذا حتى أصغر الطفيليات الخلوية لا تشبه الفيروسات في أي شكل من الأشكال. فرضية النجاة (فرضية المنشأ الخلوي) لا تفسر القفيصة المعقدة وغيرها من البنى على جزيئات الفيروس. فرضية الفيروس الأولى تتعارض مع تعريف الفيروسات في أنها تتطلب خلايا مضيفة[51] فمن المتعارف عليه الآن أن الفيروسات لها أصول تسبق تاريخ مختلف أشكال الحياة في النطاقات الثلاثة[52] وقد أدى هذا الاكتشاف إلى إعادة علماء الفيروسات المعاصرين النظر في تقييم هذه الفرضيات الكلاسيكية الثلاثة.[52]
الدليل على عالم سلفي من خلايا الرنا[53] والتحليل الحاسوبي لتسلسل دنا الفيروس والمضيف أعطت فهم أفضل للعلاقات التطورية بين أنواع مختلفة من الفيروسات ويمكنها أن تساعد بذلك على تحديد أسلاف الفيروسات الحديثة. حتى الآن لم تثبت هذه التحليلات صحة أي من هذه الفرضيات.[53] مع ذلك يبدو من غير المحتمل أن جميع الفيروسات المعروفة حاليا لها سلف مشترك فربما تكون نشأت على مراحل في الماضي من قبل آلية معينة أو أكثر.[54]
البريونات هي جزيئات بروتين معدية لا تحتوي على دنا أو رنا[55] تسبب عدوى في الأغنام تسمى الراعوش واعتلال الدماغ الاسفنجي البقري لدى الأبقار، لدى الإسان تسبب داء كورو ومرض كروتزفيلد جاكوب وداء غيرستمان-ستراوس.[56] يمكن للبريونات التكرار لأن بعض البروتينات يمكن أن توجد في شكلين مختلفين والبريون يغير الشكل الطبيعي لبروتين المضيف إلى شكل البريون وهذا يطلق سلسلة من ردود الفعل حيث كل بروتين بريون يحول العديد من بروتينات المضيف إلى بريونات جديدة وهذه البريونات الجديدة تعمل على تحويل المزيد من البروتينات إلى بريونات. على الرغم من أنها تختلف اختلافا جوهريا عن الفيروسات وأشباه الفيروسات أعطى اكتشاف البريونات مصداقية لفكرة أن الفيروسات يمكن أن تكون قد تطورت من التكرار الذاتي للجزيئات.[57]
الميكروبيولوجيا وخصائص الفيروسات
خصائص الحياة (الخصائص البيولوجية)
اٍختلفت الآراء حول كون الفيروسات كائنات حية أو بنى عضوية تتفاعل معها. فتم وصفها ب الكائنات على حافة الحياة،[58] نظرًا لأنها تشبه الكائنات الحية باٍمتلاكها جينات وتتطور عن طريق الانتقاء الطبيعي،[59] وتتكاثر عن طريق اٍنشاء نسخ متعددة لنفسها بواسطة التجميع الذاتي. على الرغم من أن لها جينات اٍلا أنها لا تملك بنية الخلية، التي غالبًا ما ينظر إليها على أنها الوحدة الأساسية للحياة. ليس للفيروسات أيض خاص بها، بل تتطلب خلية مضيفة لاٍنتاج مواد جديدة. لذلك لا يمكن استنساخها خارج الخلية المضيفة (أنواع من البكتيريا مثل الكلاميديا والركتسيات تعتبر كائنات حية رغم كونهما يشتركان مع الفيروسات في هذه الخاصية). أشكال الحياة المقبولة تستخدم الانقسام الخلوي للتكاثر، في حين أن الفيروسات تتجمع عفويا داخل الخلايا. تختلف عن النمو الذاتي للبلورات لأنها ترث طفرات جينية في حين تخضع للاٍنتقاء الطبيعي. التجميع الذاتي للفيروس داخل الخلية المضيفة له تأثير على دراسة أصل الحياة، فهو يضفي مزيدًا من المصداقية على الفرضية القائلة بأن الحياة قد بدأت بتجميع ذاتي لجزيئات عضوية.[2]
زرع الفيروسات
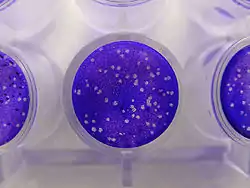
من الضروري زراعة الفيروسات والتي يمكن أن تتكاثر فقط داخل الخلايا الحية من أجل فهم أفضل لتكوينها البيولوجي، تضاعفها ودورة تكاثرها وخاصة من أجل تحضير اللقاحات. تزرع الفيروسات التي تصيب الخلايا حقيقية النواة في مزارع خلوية تم الحصول عليها من أنسجة حيوانية أو نباتية. يتم استزراع الخلايا في إناء من الزجاج أو البلاستيك ثم يتم إصابتها بالفيروس المراد دراسته، يمكن زراعة الفيروًسات الحيوانية في البيض الحامل وأحيانا في الحيوانات عندما تكون الزراعة مستحيلة في المختبر. يمكن زراعة الفيروسات البكتيرية في مزارع بكتيريا حساسة لها. يمكن أيضا أن تنمو الفيروسات النباتية على أنسجة نباتية أُحادِيُّة الطَّبَقَة، معلقات خلوية أو على النباتات بأكملها.
يمكن قياس الفيروس كميًّا بطرق مختلفة، يمكن عدهم مباشرة بفضل المجهر الإلكتروني. في حالة الفيروسات البكتيرية يتم استخدام تقنية اللوحات (النطاقات) لتقدير عدد الفيروسات في المعلق. يتم إضافة معلق مخفف للفيروس على معلق بكتيري ثم يتم تقسيم الكل على علب بتري. بعد الزرع تظهر نطاقات (مناطق شفافة) على سطح الأغار نتيجة تدمير بكتيريا والبكتيريا المجاورة لها بواسطة الفريون.
يمكن عزل الفيروسات بطرق مختلفة للكيمياء الحيوية (تَنْبيذٌ تَفْريقِيّ، الترسيب، التمسيخ، الهضم الأنزيمي).
البنية

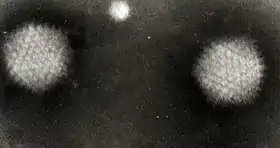
تتألف الفيروسات من مجموعة واسعة من الأشكال والأحجام، تسمى المورفولوجيا. عموما الفيروسات أصغر بكثير من البكتيريا. معظم الفيروسات التي خضعت للدراسة يتراوح قطرها بين 10 و 300 نانومتر. بعض الفيروسات الخيطية لها طول اٍجمالي يصل إلى 1400 نانومتر; أقطارها حوالي 80 نانومتر.[60] لا يمكن رؤية الفيروسات بالمجهر الضوئي لذا اٍستخدم المجهر الإلكتروني لرؤيتها.[61]
لزيادة التباين بين الفيروسات والخلفية، تستخدم كثافة الاٍلكترون. هذه هي حلول أملاح المعادن الثقيلة، مثل تنجستن الذي يبعثر الاٍلكترونات من المناطق المغطات بالتلوين. تبقى التفاصيل الدقيقة غامضة عندما تغطى الفيروسات بالتلوين (التلوين الاٍيجابي). التلوين السلبي يتغلب على هذه المشكلة بتلوين الخلفية فقط.[62]
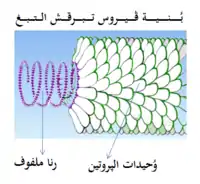
جزيء الفيروس الكامل يعرف باٍسم فيريون، يتكون من حمض نووي محاط بغلاف واقي بروتيني يسمى القفيصة، هذه الأخيرة مكونة من وحدات بروتينية متماثلة تسمى القسيمات القفيصية.[63] الفيروسات يمكن أن يكون لها «غلاف» دهني مستمد من غشاء الخلية المضيفة. القفيصة مصنوعة من البروتينات المشفرة بواسطة الجينوم الفيروسي وشكلها يستعمل كأساس للتمييز المورفولوجي بين الفيروسات.[64][65] الوحدات البروتينية المشفرة فيروسيًا تتجمع ذاتيا لتشكيل القفيصة، عموما تتطلب وجود الجينوم الفيروسي. مركب فيروسي يشفر البروتينات التي تساعد في بناء القفيصة. البروتينات المرتبطة بالأحماض النووية تعرف بالبروتينات النووية، والاٍرتباط بين بروتينات القفيصة الفيروسية والحمض النووي الفيروسي تسمى القفيصة المنواة. يمكن دراسة القفيصة وكافة بنية الفيروس شكليا باٍستعمال مجهر الطاقة الذرية.[66][67] عموما، هناك أربعة أنواع رئيسية لمورفولوجية الفيروس:
_Virus_PHIL_1878_lores.jpg.webp)
حلزونية هذه الفيروسات مكونة من نوع وحيد من القسيمات القفيصية المكدسة حول محور مركزي لتشكل بنية حلزونية، قد يكون لها تجويف مركزي، أو بشكل أنبوب مجوف. هذا الترتيب ينتج فيريونات بشكل قضيبي أو خيطي: يمكن أن تكون قصيرة وصلبة أو طويلة ومرنة للغاية. المادة الوراثية، عموما رنا وحيد السلسلة لكن الدنا أحادي السلسلة في بعض الأحيان ينضم للبروتين الحلزوني الشكل بواسطة التفاعلات بين الحمض النووي السلبي والبروتين الموجب. اٍجمالا، طول القفيصة الحلزونية مرتبط بطول الحمض النووي بداخلها وطولها يعتمد على حجم وترتيب القسيمات القفيصية. ودراسة فيروس تبرقش التبغ هو مثال على الفيروسات الحلزونية.[68]
عشرونية الوجوه معظم فيروسات الحيوانات عشرونية الوجوه أو شبه كروية مع تناظر عشروني الوجوه. عشروني الوجوه العادي هو السبيل الأمثل لتشكيل هيكل مغلف من الوحدات المتطابقة. الحد الأدنى لعدد القسيمات القفيصية المطلوب هو اٍثنا عشر، وكل واحدة مكونة من 5 تحت وحدات متطابقة. العديد من الفيروسات، مثل فيروس الروتا، له أكثر من 12 قسيم قفيصي ويبدو كرويا. القسيم القفيصي في القمم تحيط به خمسة قسيمات قفيصية أخرى تسمى بنتونات. القسيم القفيصي على وجوهه الثلاثة محاط ب 6 قسيمات قفيصية أخرى تسمى هيكسونات
مغلفة بعض الأنواع من الفيروسات تغلف نفسها بأحد الأغشية الخلوية المعدلة، اٍما الغشاء الخرجي المحيط بالخلية المصابة أو الأغشية الداخلية مثل الغشاء النووي والشبكة الهيولية، هذا ما يكسبها طبقة دهنية ثنائية خارجية تعرف بالغلاف الفيروسي. هذا الغشاء مرصع ببروتينات مشفرة بواسطة جينوم الفيروس وجينوم الخلية المضيفة; الغشاء الدهني وكل الكربوهيدرات تنبع من المضيف. فيروس الإنفلونزا وفيروس نقص المناعة البشرية يستخدمان هذه الإستراتيجية. معظم الفيروسات المغلفة تعتمد على الغلاف لنقل العدوى.[69]
معقدة هذه الفيروسات تمتلك قفيصة ليست محض حلزونية ولا محض عشرونية الوجوه، قد تمتلك هياكل إضافية مثل الذيول البروتينية أو جدار خارجي معقد. بعض العواثي مثل عاثية الأمعاء T4 لها بنية معقدة مكونة من رأس عشروني الوجوه وذيل حلزوني، التي قد يكون لها قاعدة لوحة سداسية مع ألياف ذيل بروتينية بارزة. عمل بنية الذيل هذه تشبه حقنة جزيئية (الاٍرتباط بالبكتيريا ومن ثم حقن الجينوم الفيروسي داخل الخلية).[70]
الفيروسات الجدرية كبيرة، معقدة ولها مورفولوجيا غير عادية. الجينوم الفيروسي مرتبط ببروتينات داخل بنية قرص مركزي يعرف بالنوواني. النوواني محاط بغشاء وجسيمين جانبيين مجهولي الوظيفة. الفيروس له غشاء خارجي مرصع بطبقة سميكة من البروتينات على سطحه. الفيريون عموما له شكل معوج قليلا، يتراوح من الشكل البيضوي اٍلى شكل اللبنة.[71]
الفيروسات المحاكية هي أكبر الفيروسات المعروفة، يبلغ قطر قفيصتها 400 نانومتر. طول خيوط البروتين 100 نم، تبدو تحت المجهر الاٍلكتروني سداسية الشكل لذلك فالقفيصة على الأرجح عشرونية الوجوه.[72]
بعض الفيروسات التي تصيب العتائق لها بنى معقدة غير مرتبطة بأي شكل من أشكال الفيروسات، مع طائفة واسعة من الأشكال غير العادية، تتباين من هياكل مغزلية الشكل حتى الفيروسات التي تشبه قضبان التوصيل، القطرة أو القارورة. فيروسات عتائق أخرى تشبه العواثي المذيلة، ويمكن أن يكون لها هياكل متعددة للذيل.[73]
الجينوم
| صفة | المعلمات |
|---|---|
| الحمض النووي |
|
| الشكل |
|
| السلسلة |
|
| الاتجاه |
|
يمكن أن نرى التنوع الكبير للهياكل الجينومية من خلال الأنواع الفيروسية؛ فهي كمجموعة تحتوي على تنوع جينومي هيكلي أكبر من النباتات، الحيوانات، العتائق أو البكتيريا. هناك الملايين من أنواع الفيروسات المختلفة؛[3] فقط حوالي 5,000 منها وصفت بالتفصيل.[4] تحتوي الفيروسات اٍما على دنا أو رنا وتسمى فيروسات الدنا أو فيروسات الرنا على التوالي. حتى الآن معظم الفيروسات هي ذات رنا. الفيروسات النباتية تميل لاٍمتلاك رنا أحادي السلسلة والعواثي تميل لاٍمتلاك دنا ثنائي سلسلة.[74]
جينومات الفيروسات يمكن أن تكون حلقية كما هو الحال في الفيروسات التورامية، خطية كما في الفيروسات الغدانية. نوع الحمض النووي لا صلة له بشكل الجينوم.
بين فيروسات الرنا، الجينوم في كثير من الأحيان مقسم إلى أجزاء منفصلة داخل الفيريون ويسمى مجزأ، عموما كل جزء يشفر بروتين واحد وعادة ما تكون (الأجزاء) موجودة في قفيصة واحدة معا. مع ذلك ليس من الضروري تواجد جميع الجزيئات في نفس الفيريون ليكون الفيروس معدي والمثال على ذلك فيروس بروم الفسيفسائي والعديد من الفيروسات النباتية الأخرى.[60]
بغض النظر عن نوع الحمض النووي للفيروس، الجينوم يكون دائما إما أحادي أو ثنائي السلسلة. الجينوم أحادي السلسلة يتألف من أحماض نووية مفردة وله شكل يشبه نصف سلم مقسوم إلى نصفين متساويين في حين الجينوم ثنائي السلسلة يتألف من زوجين متكاملين من الأحماض النووية وله شكل السلم. بعض عائلات الفيروسات مثل الفيروسات الكبدية لها جينوم ثنائي السلسلة جزئياً وأحادي السلسلة في الباقي.[74]
بالنسبة لمعظم الفيروسات مع جينوم الرنا وبعض الفيروسات ذات الجينوم دنا أحادي السلسلة، يقال أن السلسلة الأحادية تكون إما موجبة أو سالبة الاتجاه اعتمادا على كونها مكملة لمرسال الحمض الريبي النووي (mRNA) الفيروسي أو لا. الرنا الفيروسي موجب الاتجاه يكون في نفس اتجاه مرسال الحمض الريبي النووي الفيروسي وبالتالي يمكن فوراً ترجمت جزء منه على الأقل من قبل الخلية المضيفة. الرنا الفيروسي السالب الاتجاه يكمل مرسال الحمض الريبي النووي الفيروسي وبالتالي يجب تحويله إلى رنا موجب الاتجاه بواسطة الرنا المعتمدة على بوليميراز الرنا قبل الترجمة. تسمية دنا الفيروسات ذات الجينوم أحادي السلسلة تشبه تسميات الرنا وفيها يكون الطرف المشفر لمرسال الحمض الريبي النووي (mRNA) مكمل له (-) والطرف غير المشفر نسخة منه (+).[74] مع ذلك هناك عدة أنواع من الدنا والرنا الفيروسي أحاديي السلسلة تمر بمراحل ثنائية السلسلة أثناء تكرارها والأمثلة على ذلك الفيروسات التوأمية (فيروس نباتي أحادي سلسلة الدنا) والفيروسة الرملية (فيروس حيواني أحادي سلسلة الرنا).[75]

يختلف حجم الجينوم اختلافا كبيرا بين الأنواع فأصغر جينوم فيروسي يشفر لاثنين فقط من البروتينات وحجم الجينوم فقط 2 كيلو قاعدة (الفيروسات الحلقية) في حين أكبرها حجم جينومه أكثر من 1.2 ميجا قاعدة ويشفر لأكثر من 1000 بروتين (الفيروس المحاكي).[76] فيروسات الرنا عموما لها جينوم أصغر حجما من فيروسات الدنا بسبب معدل خطأ أعلى عند التكرار وحد أقصى أعلى معلوم للحجم.[77] فوق هذا الأخطاء في الجينوم عند التكرار تجعل الفيروس غير مجدي أو غير قادر على المنافسة. لتعوض ذلك تمتلك فيروسات الرنا غالباً جينوم مجزأ (جينوم مقسم إلى جزيئات أصغر) وهذا بالتالي يقلل فرص عجز الجينوم بأكمله عند حدوث خطأ في جزء واحد من الجينوم. في المقابل لدى فيروسات الدنا عموما جينوم أكبر بسبب الدقة العالية لإنزيمات تكرارها.[78] الفيروسات ذات الدنا أحادي السلسلة تشكل استثناء لهذه القاعدة فمعدل الطفرات لهذه الجينومات يمكن أن يقارب حالة الرنا أحادي السلسلة.[79]
يخضع التغيير الوراثي للفيروسات لآليات عدة تشمل عملية تسمى الانحراف الوراثي حيث تتحول القواعد الفردية في الدنا أو الرنا إلى قواعد أخرى. معظم نقاط الطفرات هته هي «صامتة» (لا تغير البروتين الذي يشفر له الجين) ولكن يمكن لأخرى أن تمنح مزايا تطورية مثل مقاومة للعقاقير المضادة للفيروسات.[80] الزيحان المستضدي يحدث عندما يكون هناك تغيير كبير في الخريطة الجينية للفيروس وهذا يمكن ان يكون نتيجة للتأشيب الجيني أو إعادة تشكيل الفيروس. عندما يحدث هذا مع فيروسات الإنفلونزا، قد تنتج جوائح.[81] فيروسات الرنا موجودة في كثير من الأحيان كشبه-أنواع أو أسراب من الفيروسات من نفس النوع ولكن مع اختلافات قليلة في تسلسل نوكليوزيدات الجينوم. تمثل هذه الشبه-أنواع هدفاًً رئيسيا للانتقاء الطبيعي.[82]
الجينوم المجزأ يمنح مزايا تطورية إذ يمكن لسلالات مختلفة من الفيروس ذات الجينوم المجزأ خلط ودمج الجينات لإنتاج سلالة فيروسات أو (نسل) لها خصائص فريدة من نوعها. وهذا ما يسمى إعادة التشكيل أو الجنس الفيروسي.[83]
التأشيب الجيني هي العملية التي يتم بفضلها اقتطاع سلسلة من الدنا ومن ثم تضم إلى نهاية جزيء دنا مختلف، وهذا يمكن أن يحدث عندما تصيب الفيروسات الخلايا في وقت واحد ولقد أظهرت دراسة تطور الفيروسات أن التأشب انتشرت في الأنواع التي شملتها الدراسة.[84] والتأشب مشترك في كل من فيروسات الرنا والدنا.[85][86]
دورة النسخ
لا تتكاثر الفيروسات عن طريق الاٍنقسام الخلوي، لأنها كائنات لا خلوية. بدلا من ذلك تستخدم التمثيل الغذائي للخلية المضيفة لإنتاج نسخ متعددة، وتقوم بتجميعها داخل الخلية.
دورة حياة الفيروس تختلف بشكل كبير بين الأنواع لكن هناك 6 مراحل قاعدية لدورة حياة الفيروسات:[87]
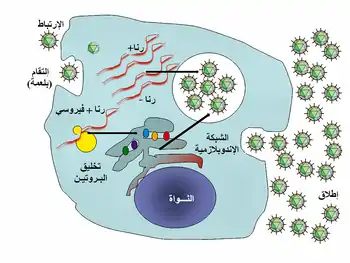
- الارتباط هو تثبت خاص بين بروتينات قفيصة الفيروس ومستقبلات خاصة على سطح الخلايا المضيفة (هذا التخصيص يجعل للفيروس نطاق محدد من المضيفات). مثلاً فيروس نقص المناعة البشرية يصيب فقط الخلاية التائية لأن بروتيناته السطحية gp120 يمكنها التفاعل مع CD4 والمستقبلات الغشائية للخلية التائية. لقد تطورت هذه الآلية لتجعل من هذه الفيروسات قادرة على إصابة الخلايا التي يمكنها التكرار داخلها فقط. الارتباط بالمستقبلات يمكن أن يحدث تغيرات في الغلاف البروتيني للفيروس والذي ينتج عنه اندماج الأغشية الخلوية والفيروسية.
- الاختراق يسمى غالباً دخول الفيروس. تختلف عدوى الخلايا النباتية عن الخلايا الحيوانية، النباتات لها جدار خلوي صلب من السليلوز ولا يمكن للفيروسات الولوج داخل الخلايا إلا بعد صدمة لجدار الخلية.[88] يمكن للفيروسات مثل فيروس تبرقش التبغ التنقل مباشرة داخل النباتات، من خلية إلى أخرى، من خلال المسام والذي يسمى الخيوط البلازمية.[89] مثل النباتات للبكتيريا جدار صلب يتوجب على الفيروسات اختراقه لإصابة الخلية. طورت بعض الفيروسات آليات لحقن جينومها إلى داخل الخلية البكتيرية في حين تبقى قفيصتها في الخارج.[90]
- نزع المعطف هي العملية التي يتم خلالها تحليل قفيصة الفيروس بواسطة إنزيمات الفيروس أو إنزيمات الخلية وبالتالي تحرير الحمض النووي الفيروسي.
- التنسُّخ يشمل تصنيع الرنا الرسول الفيروسي للفيروس باستثناء فيروسات الرنا اٍيجابية السلسلة، تخليق البروتينات الفيروسية وتجميعها وتكرار الجينوم الفيروسي.
- تجميع جزيئات الفيروس يتم تجميع البروتينات الفيروسية المصنعة لتكوين الفيروسات الجديدة التي يتم تحريرها فيما بعد من الخلية المضيفة.[91]
- تحرير الفيروسات يتم عن طريق التحلل وهو ألآلية التي تؤدي إلى مقتل الخلية بعد تفجر غشائها. بعض الفيروسات تخضع لدورة المستذيب حيث يتم دمج جينوم الفيروس باستخدام التأشيب الجيني ضمن مكان محدد من كروموزوم الخلية المضيفة. يسمى جينوم الفيروس ب طليعة الفيروس وفي حال العاثية يسمى طليعة العاثية.[92] كلما انقسمت الخلية يتضاعف الجينوم الفيروسي معها أيضا، غالباً يكون جينوم الفيروس هاداً داخل المضيف، يمكن لطليعة العاثية أو طليعة الفيروس أن تعطي فيروسات نشطة تقوم بتحليل الخلايا المضيفة.[93] الفيروسات المغلفة (مثلاً فيروس HIV) يتم تحريرها من الخلية المضيفة عنطريق التبرعم، خلال هذه العملية يكتسب الفيروس غلافه والذي هو جزء من الغشاء الخلوي.[94]
التأثيرات على الخلية المضيفة للفيروسات مجموعة واسعة النطاق من الآثار البنيوية والبيوكيميائية على الخلية المضيفة[95] يطلق عليها تأثير الاعتلال الخلوي.[96] تؤدي معظم حالات العدوى بالفيروس في النهاية إلى وفاة الخلية المضيفة، تشمل أسباب الوفاة تحلل الخلية، تعديلات على سطح غشاء الخلية والاستماتة.[97] يتسبب كبح البروتينات الخاصة بالفيروس إلى وقف الأنشطة العادية للخلية مما يؤدي غالبا إلى موتها.[98]
بعض الفيروسات لا تسبب أي تغييرات ظاهرة على الخلية المصابة. الخلايا التي بها فيروس كامن أوغير نشط تظهر علامات قليلة للعدوى وكثيرا ما تعمل بشكل طبيعي،[99] هذا يسبب التهابات مستمرة يكون الفيروس نائماً خلالها لعدة شهور أو سنوات وهذا هو الحال غالبا مع فيروسات الهربس.[100][101] يمكن لبعض الفيروسات مثل فيروس إبشتاين-بار أن تحفز الخلايا على التكاثر دون التسبب في خباثة،[102] في حين وضعت أخرى مثل فيروسات الأورام الحليمية ضمن أسباب السرطان.[103]
نطاق المضيف حتى الآن الفيروسات هي الطفيليات الأكثر وفرة على سطح الأرض ولقد أثبت أنها تصيب جميع أنواع الحياة الخلوية بما في ذلك الحيوانات والنباتات والبكتيريا. مع ذلك، لا يمكن لأنواع مختلفة من فيروسات أن تصيب سوى مجموعة محدودة من المضيفين والعديد من الأنواع محددة-المضيفين مثلاً فيروس الجدري يمكن أن يصيب فقط نوع واحد وهو في هذه الحالة البشر، ويقال أن لديه مجموعة ضيقة من المضيفين. يمكن لفيروسات أخرى مثل فيروس داء الكلب أن يصيب أنواع مختلفة من الثدييات ويقال ان لديه مجموعة واسعة النطاق من المضيفين.
الفيروسات التي تصيب النباتات غير مؤذية للحيوانات في حين أغلب الفيروسات التي تصيب الحيوانات الأخرى غير مؤذية للبشر. ويقتصر نطاق استضافة بعض العواثي على سلالة واحدة من البكتيريا ويمكن استخدامها لتتبع مصدر تفشي العدوى بواسطة طريقة تسمى تَنْميطٌ عاثَوِيّ.
تصنيف الفيروسات
يسعى التصنيف لوصف تنوع الفيروسات عن طريق تسميتها وتقسيمها اٍلى مجموعات على أساس التشابه. عام 1962 أندريه لووف، روبرت هورني وبول تورنيي كانوا أول من وضع وسائل لتصنيف الفيروسات، اٍستنادا على نظام التسلسل الهرمي.[104] هذا النظام يستند في تصنيفه على الشعبة، الطائفة، الرتبة، الفصيلة، الجنس والنوع. صنفت الفيروسات وفقا لخصائصها المشتركة (ليس تلك المتعلقة بمضيفيهم) ونوع الحمض النووي المشكل لجينومها.[105] فيما بعد أسست اللجنة الدولية لتصنيف الفيروسات.
تصنيف اللجنة الدولية لتصنيف الفيروسات
طورت اللجنة الدولية لتصنيف الفيروسات نظام التصنيف الحالي وكتبت المبادئ التوجيهية التي ركزت على بعض خصائص الفيروسات للحفاظ على وحدة الفصيلة. تم وضع التصنيف الموحد (نظام عالمي لتصنيف الفيروسات) في التقرير السابع للجنة الدولية لتصنيف الفيروسات للمرة الأولى وأعتبرت الأنواع الفيروسية أدنى مرتبة في التصنيف الهرمي الفيروسات.[106] ومع ذلك فقط جزء صغير من مجموع الفيروسات تمت دراسته، التحاليل التي أجريت على عينات من البشر وجدت أن حوالي 20% من متواليات الفيروسات المسترجعة لم تر من قبل. في حين عينات من البيئة، مثل مياه البحر ورواسب المحيطات، وجدت أن الأغلبية العظمى من المتواليات جديدة تماما.[107]
الهيكل العام للتصنيف هو على النحو التالي:
في تصنيف عام 2008 للجنة الدولية لتصنيف الفيروسات وضعت خمس رتب هي الفيروسات الذنبية، الفيروسات الهربسية، الفيروسات السلبية الأحادية، الفيروسات العشية والفيروسات البيكورناوية. اللجنة الرسمية لم تميز بين التحت أنواع، السلالات والعزلات. في المجموع هناك 5 رتب، 82 فصيلة، 11 تحت فصيلة، 307 جنس، 2,083 نوع وحوالي 3,000 نوع غير مصنفة بعد.[108][109]
تصنيف بلتيمور

ابتكر ديفيد بلتيمور العالم البيولوجي الحائز على جائزة نوبل نظام تصنيف بلتيمور.[29][110] نظام تصنيف اللجنة الدولية لتصنيف الفيروسات يستعمل بالموازاة مع تصنيف بلتيمور في تصنيف الفيروسات الحديث.[111][112][113]
يعتمد نظام تصنيف بلتيمور على طريقة صنع الرنا المرسال. الفيروسات يجب أن تولد رنا رسول من جينومها لإنتاج البروتينات وتكرار نفسها، لكن تُستخدم آليات مختلفة لتحقيق هذا في كل عائلة من الفيروسات. الجينوم الفيروسي يمكن أن يكون أحادي أو ثنائي سلسلة الدنا أو الرنا، ويمكن أن تستخدم أو لا المنسخة العكسية. بالإضافة لذلك، الفيروسات أحادية سلسلة الرنا إما أن يكون اتجاهها (+) أو معاكس للإتجاه (-). هذا التصنيف يضع الفيروسات في سبع مجموعات:
- فيروسات ذات الدنا ثنائي السلسلة (فيروسات غدانية، فيروسات هربسية، فيروسات جدرية)
- فيروسات ذات الدنا أحادي السلسلة (فيروسات صغيرة)
- فيروسات ذات الرنا ثنائي السلسلة (فيروسات جرمية)
- فيروسات إيجابية ذات الرنا أحادي السلسلة (فيروسات بيكورناوية، فيروسات طخائية)
- فيروسات سلبية ذات الرنا أحادي السلسلة (أورثوميكسوفيريداي، فيروسات ربدية)
- فيروسات النسخ العكسي ذات الرنا أحادي السلسلة (فيروس قهقري)
- فيروسات النسخ العكسي ذات الدنا ثنائي السلسلة (فيروسات كبدية)
كمثال على تصنيف الفيروسات، فيروس الحماق والفيروس النطاقي الحماقي، ينتميان لرتبة الفيروسات الهربسية، عائلة الفيروسات هربسية.
الفرق بين الفيروسات والبكتيريا والأوليات
في الجدول التالي نلاحظ بعض الفروق والاختلافات بين الفيروسات والكائنات بدائيات النواة مثل البكتيريا والحقيقية النواة مثل الأوالي.
| وجه المقارنة | الفيروسات | البكتيريا | الأوالي |
|---|---|---|---|
| متوسط الحجم (ميكرومتر) | 0,001 | 1 | 1000 |
| القدرة على تخليق البروتين باستعمال الريبوزومات والرنا النقال (tRNA) | لا يوجد | يوجد | يوجد |
| تعقيدات الكروموسوم (وجود هستون وسنترومير والقدرة على الانقسام) | لا يوجد | لا يوجد | يوجد |
| وجود الغشاء النووي والعضيات الخلوية المعقدة (مثل : ميتوكندريا - شبكة إندوبلازمية -...) | لا يوجد | لا يوجد | يوجد |
الفرق بين الفيروسات والكائنات الحية الدقيقة غير مميزة النواة (تفصيل)
بشكل أكبر يصف الجدول التالي الاختلاف بين الفيروسات وكل من البكتيريا والريكتسيا والكلاميديا والميكوبلازما
| صفة المقارنة | فيروسات | بكتيريا | ميكوبلازما | ريكيتسيا | كلامديا |
|---|---|---|---|---|---|
| قطرها أكبر من 300 نانومتر | غير متحقق | متحقق | متحقق | متحقق | متحقق |
| الانقسام الثنائي | غير متحقق | متحقق | متحقق | متحقق | متحقق |
| وجود الرنا والدنا معاً | غير متحقق | متحقق | متحقق | متحقق | متحقق |
| وجود ريبوزومات | غير متحقق | متحقق | متحقق | متحقق | متحقق |
| وجود الأيض | غير متحقق | متحقق | متحقق | متحقق | متحقق |
| الحساسية للمضادات الحيوية | غير متحقق | متحقق | متحقق | متحقق | متحقق |
| النمو على وسط غير حي | غير متحقق | متحقق | متحقق | غير متحقق | غير متحقق |
| وجود حامض نووي معدي بمفرده | متحقق | غير متحقق | غير متحقق | غير متحقق | غير متحقق |
الفيروسات وأمراض الإنسان
من بين أشهر الأمراض الفيروسية التي تصيب الإنسان الزكام، الإنفلونزا، الحماق والهربس. الكثير من الأمراض الخطيرة مثل إيبولا، الإيدز، إنفلونزا الطيور والسارس تسببها فيروسات. القدرة النسبية للفيروسات في تسبيب المرض موضحة في اللفظ فوعة. أمراض أخرى يجري التحقيق في ما إذا كان لديها أيضا فيروس مسبب للمرض مثل العلاقة الممكنة بين الفيروس الهربسي البشري 6 (HHV6) وأمراض عصبية مثل مرض التصلب اللويحي ومتلازمة التعب المزمن. هناك جدل حول قدرة فيروس بورنا، الذي كان يعتقد في السابق أنه يسبب الأمراض العصبية لدى الخيول، يمكن أن يكون مسؤول عن الأمراض النفسية عند البشر.[114]
للفيروسات آليات مختلفة لكي تسبب المرض في كائن ما، ويعتمد ذلك بشكل كبير على نوع الفيروس. على المستوى الخلوي الآليات في المقام الأول تتمثل بتحلل الخلية وموتها. في عديدات الخلايا إذا مات ما يكفي من الخلايا فإن الكائن الحي بأكمله سيبدأ بمعانات الآثار.
يمكن للفيروسات أن توجد داخل الجسم دون أن تكون مؤذية مع أنها في الأصل تسبب اضطرابات الاستتباب الصحي المؤدي إلى الأمراض. على سبيل المثال نأخذ بعين الاعتبار قدرة فيروس الحلأ البسيط الذي يسبيب القرحة الزكامية على البقاء كامنا داخل جسم الإنسان. وهذا يسمى الكمون[115] وهو ميزة لكل فيروسات الحلأ بما في ذلك فيروس إبشتاين-بار الذي يسبب الحمى الغدية والفيروس النطاقي الحماقي الذي يسبب الحماق. معظم الناس أصيبوا بعدوى واحدة على الأقل من هذه الأنواع من فيروسات الهربس.[116] ومع ذلك، قد تكون الفيروسات الكامنة مفيدة في بعض الأحيان، لأن وجود هذا الفيروس يمكن أن يزيد من المناعة ضد مسببات الأمراض البكتيرية مثل اليرسينية الطاعونية.[117] من ناحية أخرى الحماق الكامن يمكن أن يعود في الحياة اللاحقة كمرض يسمى القوباء المنطقية.
يمكن لبعض الفيروسات أن تسبب التهابات مزمنة (مدى الحياة) حيث يستمر تكرارها في الجسم على الرغم من آليات دفاع المضيف.[118] هذا الأمر شائع في التهابات الكبد الوبائي ب والتهابات الكبد الفيروسي ج. يعرف الأشخاص المصابين إصابة مزمنة بالناقلين لأنهم يعملون بمثابة خزانات للفيروسات المعدية.[119] في مجتمع به نسبة عالية من الناقلين يقال إن المرض متوطنا.[120]
الوبائية
علم الأوبئة الفيروسي هو فرع من العلوم الطبية يتعامل مع الانتقال والسيطرة على العدوى الفيروسية بين البشر. يمكن أن يكون انتقال الفيروسات عمودي وذلك من الأم إلى الطفل أو أفقي من شخص لآخر. من أمثلة الانتقال العمودي التهاب الكبد الوبائي ب وفيروس نقص المناعة البشرية حيث يولد الطفل مصابا بالفيروس فعلياً.[121] مثال آخر أكثر ندرة هو الفيروس النطاقي الحماقي الذي وعلى الرغم من تسببه في التهابات خفيفة نسبيا لدى البشر إلا أنه يمكن أن يكون قاتل للجنين والطفل المولود حديثاً.[122]
الانتقال الافقي هو الآلية الأكثر شيوعا لانتشار الفيروسات في المجتمعات ويمكن أن تحدث عندما يتم تبادل سوائل الجسم أثناء النشاط الجنسي مثل فيروس نقص المناعة البشرية؛ عن طريق نقل الدم الملوث أو تقاسم الإبر على سبيل المثال التهاب الكبد ج؛ ولادة طفل من أم مصابة مثل التهاب الكبد ب؛ تبادل اللعاب عن طريق الفم مثل فيروس إبشتاين-بار؛ تناول الطعام أو الماء الملوث على سبيل المثال النوروفيروس؛ استنشاق الالرذاذ المحمل بالفيريونات مثل فيروس الأنفلونزا؛ الحشرات الناقلة للأمراض مثل البعوض الذي يخترق جلد المضيف على سبيل المثال حمى الضنك. معدل أو سرعة انتقال العدوى الفيروسية يعتمد على عوامل تشمل كثافة السكان، عدد الأفراد المعرضين للإصابة (أولائك الذين ليسوا في مأمن)،[123] نوعية الرعاية الصحية والطقس.[124]
يستخدم علم الأوبئة لكسر سلسلة العدوى في المجتمعات خلال تفشي الأمراض الفيروسية.[125] تدابير الرقابة التي تستخدم تستند على معرفة كيفية انتقال الفيروس فمن المهم العثور على مصدر أو مصادر العدوى وتحديد الفيروس المسبب. بمجرد التعرف على الفيروس يمكن في بعض الأحيان كسر سلسلة العدوى بواسطة اللقاحات، عندما لا تتوفر لقاحات يمكن للتطهير الصحي أ يكون فعالاً. غالباً يتم عزل المصابين عن بقية المجتمع بالإضافة للذين تعرضوا للفيروس الموضوع بالحجر الصحي.[126]
تم ذبح الآلاف من الماشية للسيطرة على تفشي مرض الحمى القلاعية في بريطانيا عام 2001. أكثر العدوات الفيروسية لدى البشر والحيوانات الأخرى تمر بفترات حضانة لا تسبب خلالها أي علامات أو أعراض.[127] فترات حضانة الأمراض الفيروسية تتراوح من بضعة أيام إلى عدة أسابيع وهي معروفة في معظم حالات العدوى،[128] بالرغم من التداخلات إلا أنه بعد فترة الحضانة تأتي فترة العدوى وخلالها يصبح الفرد أو الحيوان مصاب ويمكنه أن يعدي شخص آخر أو حيوان.[129] هاتين الفترتين (الحضانة، الإصابة) معلومتين في الكثير من الإصابات الفيروسية وطولهما مهم في السيطرة على تفشي المرض.[130] عندما تسبب عدوى نسبة عالية من حالات الإصابة وبشكل غير عادي في السكان تسمى المنطقة أو المجتمع بالموبوء أما إذا تفشي انتشار العدوى في جميع أنحاء العالم فتدعى بالجائحة.[131]
الأوبئة والجوائح
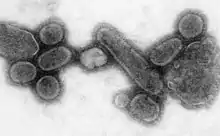
دمرت الأمراض المعدية السكان الأصليين لأمريكا وبوجه خاص الجدري الذي جلبه المستعمرون الأوروبيون إلى الأمريكتين. يبقى من غير الواضح كم من الهنود هلكوا بسبب الأمراض الخارجية بعد وصول كولومبوس إلى الأمريكتين ولكن تم تقدير النسبة لتكون قريبة من 70% من السكان الأصليين. ساعدت الأضرار التي سببها هذا المرض بشكل كبير في محاولات الأوروبيين لتهجير وقهر السكان الأصليين.[132]
الجائحة هي وباء ينتشر على مستوى العالم بأكمله. جائحة انفلونزا عام 1918 المعروفة باسم الإنفلونزا الأسبانية صنفت كجائحة من الفئة 5 ونجمت عن فيروس انفلونزا أ قاتل وحاد بشكل غير معتاد. كان الضحايا في الغالب من الشباب الأصحاء على النقيض من معظم تفشيات الإنفلونزا السابقة التي أثرت في الغالب على المرضى الأحداث وكبار السن أو ضعاف الصحة.[133]
استمرت جائحة الإنفلونزا الأسبانية من 1918 حتى 1919 وتقول أقدم التقديرات انها قتلت 40 إلى 50 مليون شخصاً[134] في حين بحوث حديثة تشير إلى أنه ربما يكون قد قتل ما يصل إلى 100 مليون شخص أو ما يقدر ب 5% من سكان العالم في عام 1918.[135]
معظم الباحثين يعتقدون أن فيروس نقص المناعة البشرية الذي نشأ في أفريقيا جنوب الصحراء الكبرى خلال القرن 20؛[136] يمثل الآن جائحة مع ما يقدر بنحو 38.6 مليون شخص يعيشون مع المرض في جميع أنحاء العالم.[137] قدر برنامج الأمم المتحدة المشترك لفيروس نقص المناعة البشرية/الإيدز (UNAIDS) ومنظمة الصحة العالمية (WHO) أن الإيدز أودى بحياة أكثر من 25 مليون شخص منذ أن تم التعرف عليه لأول مرة في 5 حزيران 1981 مما يجعلها واحدة من أكثر الأوبئة المدمرة في التاريخ المسجل.[138] في عام 2007 كان هناك 2,7 مليون إصابة جديدة بفيروس نقص المناعة البشرية و 2 مليون حالة وفاة ذات الصلة به.[139]
العديد من مسببات الأمراض الفيروسية شديدة الفتك تنتمي لعائلة الفيروسات الخيطية وهي هي فيروسات شبه-خيطية تسبب الحمى النزفية الفيروسية،[140] وتشمل الإيبولا وفيروسات ماربورغ. جذبت اهتمام واسع النطاق فيروس ماربورغ الصحافة في أبريل 2005 لتفشي هذا المرض في أنغولا. أثار فيروس ماربورغ اهتمام واسع النطاق في الصحافة العالمية في أبريل 2005 إثر تفشي هذا المرض في أنغولا. بدأت في أكتوبر 2004 واستمرت حتى عام 2005 وكانت الوباء الأسوأ في العالم للحمى النزفية الفيروسية.[141]
السرطان
الفيروسات هي أحد أسباب نشوء السرطان لدى الإنسان والأنواع أخرى. السرطانات الفيروسية المنشأ لا تحدث إلا في أقلية من الأشخاص (أو الحيوانات) المصابين بالفيروس. الفيروسات السرطانية تأتي من مجموعة من عائلات الفيروسات، تضم كل من فيروسات الدنا وفيروسات الرنا، ولذا لا يوجد نوع واحد من الفيروسات الورمية (مصطلح يستعمل في الأصل للتحويلات الحادة للفيروسات القهقرية). تطور السرطان يتحدد بمجموعة متنوعة من العوامل مثل مناعة المضيف[142] والطفرات التي تحدث لديه.[143] تبين أن الفيروسات تسبب السرطانات البشرية وتشمل بعض الأنماط الجينية من فيروس الورم الحليمي البشري، فيروس التهاب الكبد الفيروسي ب، فيروس التهاب الكبد الفيروسي ج فيروس إبشتاين-بار وسرطان كابوزيس-المرتبط بفيروس الهربس. وآخر ما اكتشف من الفيروسات المسرطنة لدى البشر هو الفيروس التورامي (فيروس خلية ميركل التورامي) الذي يسبب معظم حالات الشكل النادر من سرطان الجلد المسمى سرطان خلية ميركل.[144] فيروسات التهاب الكبد يمكن أن تتطور إلى عدوى فيروسية مزمنة تؤدي إلى سرطان الكبد.[145][146] الإصابة بفيروس تي- الليمفاوي البشري تتطور إلى الخزل السفلي التشنجي المداري والأبيضاض التائي الخلايا في البالغين.[147]فيروسات الأورام الحليمية البشرية هي مسبب نشوء سرطان عنق الرحم، الجلد، الشرج والقضيب.[148] بما في ذلك الفيروسات الهربسية، سرطان كابوزيس-المرتبط بفيروس الهربس تسبب سرطان كابوزيس وليمفوما تجويف الجسم، وفيروس إبشتاين-بار يسبب ورم بوركيتس اللمفي، لمفومة هودجكين، مرض التكاثر الليمفاوي البائي والسرطانة الأنفية البلعومية.[149] فيروس خلية ميركل التورامي يتصل اتصالا وثيقا بSV40 وفيروسات الفئران التورامية قد استخدمت كنماذج حيوانية لفيروسات مرض السرطان لأكثر من 50 عاما.[150]
آليات دفاع المضيف
خط دفاع الجسم الأول ضد الفيروسات هو نظام المناعة الطبيعية ويضم الخلايا وغيرها من الآليات التي تدافع ضد العدوى بطريقة غير محددة. هذا يعني أن خلايا نظام المناعة الطبيعية تتعرف، وتستجيب لمسببات الأمراض بصورة عامة، لكن بعكس المناعة المتكيفة لا تمنح المناعة الطبيعية وقاية أو مناعة طويلة الأمد للمضيف.[151]
تداخل الرنا هو أحد أهم وسائل الدفاع الفطري ضد الفيروسات.[152] العديد من الفيروسات لديها إستراتيجية نسخ تنظوي على الحمض الريبي النووي المتماثل (dsRNA). عندما يصيب مثل هذا الفيروس خلية فإنه يقوم بتحرير جزيئ أو جزيئات الرنا الخاصة به والتي ترتبط مباشرة بمعقد بروتيني يسمى الدايسر والذي يعمل على تقطيع الرنا إلى أجزاء أصغر. يتم تنشيط ممر بيوكيميائي يدعى معقد RISC والذي يحلل مرسال الرنا الفيروسي وبذلك تنجو الخلية من العدوى. الفيروسات العجلية تتفادى هذه الآلية بواسطة خلع المحفظة المغلفة للمادة الوراثية للفيروس جزئياً داخل الخلية وتحرير مرسال الرنا المنتج حديثاً من خلال مسام الجسيمات الداخلية للقفيصة. يظل الرنا المزدوج الجينومي محمي داخل جسم الفيريون.[153][154]
عندما يواجه الجهاز المناعي التكيفي للفقاريات فيروساً ينتج أجسام مضادة خاصة والتي ترتبط بهذا الفيروس وتجعله غير معدي وتسمى هذه المناعة بالمناعة الخلطية. هناك نوعين مهمين من الأجسام المضادة:
- الأولى : تدعى الغلوبيلينات المناعية IgM وهي فعالة بصفة كبيرة في تحييد الفيروسات لكنها تنتج من قبل خلايا الجهاز المناعي فقط لبضعة أسابيع.
- الثانية : تدعى الغلوبيلينات المناعية IgG ويتم إنتاجها بشكل غير محدود.
يستخدم تواجد الغلوبولين المناعي IgM في دم المصاب كدليل على العدوى الحادة، في حين IgG يشير إلى وجود عدوى في الماضي.[155] يتم قياس الأجسام المضادة IgG عندما تتم اختبارات الحصانة.[156]
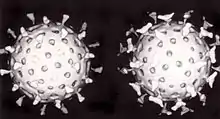
يسمى الدفاع الثاني للفقاريات ضد الفيروسات بالمناعة الخلوية وينطوي على الخلايا المناعية المعروفة باسم الخلايا التائية. تعرض خلايا الجسم باستمرار أجزاء قصيرة من البروتينات على سطحها الخلوي وإذا تعرفت الخلية التائية على جزء فيروسي مشبوه هناك يتم تدمير الخلية المضيفة عن طريق الخلايا التائية القاتلة ثم تتكاثر الخلايا التائية الخاصة بالفيروس. بعض الخلايا مثل البلاعم مختصة في تجلية المستضد.[157]
إنتاج الانترفيرون هو أحد أهم آليات دفاع المضيف وهو هرمون يفرزه الجسم عندما يتعرض للفيروسات، دوره في المناعة معقد. يوقف تكاثر الفيروسات عن طريق قتل الخلايا المصابة والخلايا المجاورة لها.[158]
لا تنتج كل عدوى فيروسية رد فعل مناعي بهذا الشكل ففيروس نقص المناعة البشرية مثلاً يتجنب جهاز المناعة من خلال تغيير تسلسل الأحماض الأمينية للبروتينات الغشائية للفيريون باستمرار. هذه الفيروسات تتهرب باستمرار من الرقابة المناعية عن طريق العزل، حصار تجلية المستضد، مقاومة السيتوكين، التهرب من الخلاية الفاتكة الطبيعية، الهروب من الاستماتة والتحول المستضدي.[159] فيروسات أخرى تسمى الفيروسات الموجهة للعصب تنتشر عبر الامتدادات العصبية حيث يكون الجهاز المناعي غير قادر على الوصول إليها.
الوقاية والعلاج
بما أن الفيروسات تستخدم المسارات الأيضية الحيوية داخل الخلايا المضيفة من أجل تكرارها فالقضاء عليها يكون صعب من دون استخدام عقاقير تتسبب في آثار سامة للخلايا المضيفة بصفة عامة. النهج الطبي الأكثر فعالية ضد الأمراض الفيروسية هو التلقيح من أجل توفير الحصانة ومضادات الفيروسات التي تتدخل بشكل انتقائي مع تكاثر الفيروس.
اللقاحات

التطعيم هو وسيلة رخيصة وفعالة للوقاية من عدوى الفيروسات. لقد تم استخدام القاحات لمنع العدوى الفيروسية قبل وقت طويل من اكتشاف الفيروسات الفعلية، أدى استخدامها إلى انخفاض كبير في معدلات الاعتلال (المرض) والوفيات المرتبطة بالعدوى الفيروسية مثل شلل الأطفال[160] والحصبة والنكاف والحصبة الألمانية.[161] لقد تم استئصال الجدري.[162] القاحات متوافرة لمنع العدوى الفيروسية للبشر أكثر من ثلاثة عشر[163] وتستخدم بشكل أوسع لمنع العدوى الفيروسية لدى الحيوانات.[164]
يمكن للقاحات أن تتكون من فيروسات حية موهنة، ميتة أو بروتينات فيروسية (مستضدات).[165] اللقاحات التي تحتوي على نماذج حية ضعيفة من الفيروس لا تسبب المرض لكنها مع ذلك تمنح الحصانة وتسمى هذه الفيروسات بالفيروسات الموهنة. يمكن أن تكون اللقاحات الحية خطرة عندما تعطى لأشخاص يعانون من ضعف جهازهم المناعي، لأن الفيروس الموهن قد يسبب المرض الأصلي.[166]
تستخدم تقنيات الهندسة الوراثية والتكنولوجيا الحيوية لإنتاج لقاحات الوحيدات، هذه اللقاحات تستخدم فقط بروتينات قفيصة الفيروس. لقاح التهاب الكبد الوبائي (ب) هو مثال على هذا النوع من اللقاح.[167] لقاحات الوحيدات آمنة للأشخاص الذين يعانون من ضعف جهازهم المناعي وذلك لأنها غير قادرة على التسبب بالمرض.[168] لقاح فيروس الحمى الصفراء هو سلالة حية موهنة تدعى 17D ربما يكون القاح الأكثر أمانا والأكثر فعالية الذي تم توليده على الإطلاق.[169]
العقارات المضادة للفيروسات
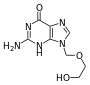
على مدى السنوات العشرين الماضية، شهد تطور العقاقير المضادة للفيروسات زيادة سريعة. وكان الدافع وراء هذا انتشار وباء الإيدز. العقاقير المضادة للفيروسات في كثير من الأحيان هي مضاهئات نوكليوزيد (لبنات دنا زائفة) والتي تدمجها الفيروسات في جينومها خلال تكرارها، دورة حياة الفيروس تتوقف بسبب عدم نشاط الدنا الذي تم تصنيعه حديثا وذلك لأن هذه المضاهئات تفتقر لمجموعات الهيدروكسيد والتي ترتبط جنبا إلى جنب مع ذرات الفوسفور لتشكيل قوة جزيء الدنا. وهذا يسمى إنهاء سلسلة الدنا.[170]
الآسيكلوفير هو مثال على نظائر النيكليوزيد فعال ضد عدوى فيروس الحلأ البسيط وعدوى فيروس التهاب الكبد الوبائى ب وهو من أقدم وأكثر مضادات الفيروسات وصفا.[171] الأدوية الأخرى المضادة للفيروسات تستهدف في استخدامها مراحل مختلفة من دورة الحياة الفيروسية. فيروس نقص المناعة البشرية يعتمد على إنزيم حال للبروتين يسمى بروتياز فيروس نقص المناعة البشرية-1 لكي يصبح معديا جيد، هناك فئة واسعة من الأدوية تسمى مثبطة بروتياز تعمل على تعطيل هذا الانزيم.
التهاب الكبد الفيروسي ج يسببه فيروس رنا. 80% من حالات الإصابة هي إصابات مزمنة، وفي حال عدم تلقي العلاج فأنهم سيبقون مصابين للفترة المتبقية من حياتهم. مع ذلك، هناك الآن علاج فعال يستخدم عقارات نظير نيكليوزيد ريبافيرين مجتمعة مع الإنترفيرون.[172] تم تطوير علاج للحالات المزمنة لفيروس الالتهاب الكبد الوبائى ب باستخدام استراتجية مماثلة مستعملين (بالإنجليزية: lamivudine) لاميفيدين.[173]
العدوى في أنواع أخرى
النباتات

هناك العديد من الأنواع من فيروسات النباتات، ليس من الجدي اقتصاديا محاولة السيطرة عليها لأنها تسبب غالبا خسارة عائد الإنتاج الزراعي فقط،[174] تنتقل فيروسات النباتات غالبا من نبات لآخر عن طريق كائنات حية معروفة باسم النواقل والتي عادة ما تكون حشرات، لكن تبين أن بعض الفطور والديدان الأسطوانية والأوالي هي نواقل أيضاً. على سبيل المثال، لدى الفاكهة المعمرة تكون السيطرة على العدوى الفيروسية النباتية مجدية اقتصاديا لدى تتركز الجهود على قتل الناقل وإزالة المضيف البديل مثل الأعشاب الضارة.[175] فيروسات النباتات غير ضارة للبشر والحيوانات وغيرها لأنها يمكن أن تتكاثر فقط في الخلايا النباتية.[176]
طورت النباتات آليات دفاع ضد الفيروسات. واحد من أكثر الطرق فعالية هو وجود ما يسمى مقاومة (R) الجينات. كل جين R يعطي مناعة لفيروس معين عن طريق إثارة مجموعة من الخلايا الميتة حول الخلية المصابة، والتي يمكن مشاهدتها بالعين المجردة كبقع كبيرة. هذا يوقف انتشار العدوى.[177] تداخل الرنا هو أحد آليات دفاع النباتات.[178] عندما تكون مصابة، غالبا ما تنتج النباتات مطهرات قاتلة للفيروسات، مثل حمض ساليسيليك، أحادي أكسيد النيتروجين وأنواع الأكسجين التفاعلية.[179]
البكتيريا
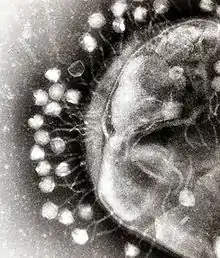
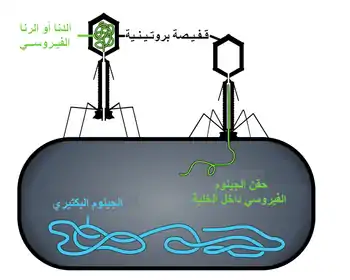
العواثي هي مجموعة مشتركة ومتنوعة من الفيروسات، هي الأكثر وفرة من بين الكيانات البيولوجية في البيئات المائية. هناك ما يفوق بأكثر من عشر مرات من هذه الفيروسات في المحيطات من البكتيريا.[180] تصل لمستوى 250.000.000 عاثية في مليلتر واحد من ماء البحر.[181] تصيب هذه الفيروسات بكتيريا خاصة وذلك بالارتباط بالمستقبلات الغشائية ومن ثم الدخول إلى الخلية. في غضون فترة زمنية قصيرة، في بعض الحالات دقائق فقط، بوليميراز البكتيري يبدأ بترجمة الرنا الفيروسي إلى بروتين. هذه البروتينات تصبح فيريونات داخل الخلية، البروتينات المساعدة، التي تساعد على تجميع الفيريونات، أو البروتينات المشاركة في تحلل الخلية. الأنزيمات الفيروسية تساعد على هدم جدار الخلية، في حالة عاثية T4، بعد عشرين دقيقة بقليل من الحقن يمكن تحرير ثلاثمئة عاثية.[182]
الطريقة الأكبر التي تدافع بها البكتيريا عن نفسها من العواثي هي إنتاج أنزيمات مدمرة للدنا الأجنبي. هذه الأنزيمات، تسمى إنزيمات الاقتطاع، تقطع الدنا الذي تحقنه العواثي داخل الخلايا البكتيرية.[183] البكتيريا تحتوي أيضا على نظام يستخدم متواليات كريسبر (CRISPR) للإبقاء على أجزاء من جينومات الفيروسات التي كان للبكتيريا تماس معها في الماضي، مما يسمح لها بمنع الفيروس من التكرار من خلال شكل من تداخل الرنا.[184][185] هذا النظام يوفر للبكتيريا مناعة مكتسبة ضد العدوى.
العتائق
بعض الفيروسات تتكاثر داخل العتائق: هي فيروسات غير عادية ذات الدنا ثنائي السلسلة وأحيانا بأشكال فريدة.[6][73] هذه الفيروسات درست بتفصيل أكثر في العتائق المحبة للحرارة، لا سيما رتبتي سيلفولوبل (Sulfolobales) والمستحرات المتقلبة (الاسم العلمي: Thermoproteales). ا.[186] المناعة ضد هذه الفيروسات تستعمل تداخل الرنا من تكرار سلسلة الدنا داخل جينوم العتيقة المرتبط بجينات الفيروس.[187][188]
التطبيقات
الطب وعلم الأحياء

الفيروسات هامة لدراسة البيولوجيا الجزيئية والخلوية لأنها توفر أنظمة بسيطة يمكن اٍستخدامها في التحقيق في وظائف الخلايا.[189] وقد وفرت دراسة واستخدام الفيروسات معلومات قيمة حول جوانب البيولوجيا الخلوية.[190] على سبيل المثال، أفادة الفيروسات في دراسة علم الوراثة وساعدة في فهمنا للآليات الأساسية لعلم الوراثة الجزيئي، مثل تنسخ الدنا، النسخ، معالجة الرنا، الترجمة، نقل البروتين والمناعة.
يستعمل علماء الوراثة الفيروسات كنواقل لاٍدخال الجينات للخلايا التي يقومون بدراستها. وهذا مفيد لجعل خلايا تنتج مادة غريبة أو لدراسة تأثير إدخال جينات جديدة في الجينوم. بطريقة مماثلة، العلاج بالفيروسات يستخدم الفيروسات كنواقل لعلاج أمراض مختلفة، لأنها يمكن أن تستهدف بشكل خاص الخلايا والدنا. وتظهر استخدامات واعدة في علاج السرطان والعلاج الجيني. اٍستخدم علماء أوروبا الشرقية العلاج بالعاثية كبديل للمضادات الحيوية لبعض الوقت، ويزداد الاٍهتمام بهذا النهج بسبب اٍرتفاع مستوى المقاومة للمضادات الحيوية لدى بعض البكتيريا الممرضة.[191]
علم المواد والتكنولوجيا النانوية
الاتجاهات الحالية في تكنولوجيا النانو تعد بجعل استخدامات الفيروسات أكثر تنوعا. من وجهة نظر علماء المواد، يمكن اعتبار الفيروسات عضويات نانوية. تحمل الفيروسات على سطحها أدوات خاصة مصممة لعبور حواجز الخلايا المضيفة. حجم وشكل الفيروسات، وعدد وطبيعة المجموعات الوظيفية على سطحها، معرفة على وجه التحديد. يشيع استخدام الفيروسات في علم المواد كسقالات لتساهم بالتعديلات السطحية المرتبطة. هناك نوعية معينة من الفيروسات يمكن أن تكون مصممة من التطور الموجه. والتقنيات القوية التي وضعتها العلوم الأحيائية أصبحت أساس الأساليب الهندسية نحو المواد النانوية (متناهية الصغر)، كما فتحت مجالات واسعة من التطبيقات أمام البيولوجيا والطب.[192]
وبسبب حجمها وشكلها، وكذلك هياكلها الكيميائية المحددة، استخدمت الفيروسات كقوالب لتنظيم المواد على مقياس النانو. وتشمل الأمثلة الأخيرة العمل بمختبر بحوث البحرية بواشنطن العاصمة، استخدمت جزيئات فيروس تبرقش اللوبيا لتضخيم الإشارات في أجهزة استشعار مصفوفة الدنا الدقيقة. في هذا التطبيق، تفصل جزيئات الفيروس الأصبغة الفلورية المستعملة للإشارة إلى منع تشكيل ثنائيات الوحدات غير الفلورية والتي تكون بمثابة مخمدات.[193] مثال آخر هو استخدام فيروس تبرقش اللوبيا كلوح مقياس نانوي للإلكترونيات الجزيئية.[194]
الأسلحة

قدرة الفيروسات على خلق أوبئة مدمرة في المجتمعات البشرية أدت إلى القلق من استخدامها لصنع اسلحة بيولوجية. علاوة على القلق بعد إعادة التخليق الناجحة في المختبر لفيروس أنفلونزا 1918 المشين.[195] فيروس الجدري دمر العديد من المجتمعات على مر التاريخ قبل استئصاله. رسميا هناك مركزين فقط في العالم تبقي على مخزونات فيروس الجدري المختبر الروسي للنواقل ومراكز الولايات المتحدة للسيطرة على الأمراض.[196] لكن المخاوف من أنها يمكن أن تستخدم كسلاح لا أساس لها على الإطلاق.[196] لقاح الجدرى ليس آمن—خلال سنوات قبل استئصال مرض الجدري أصبح المزيد من الناس مصابين جديا نتيجة التطعيم[197]—والتطعيم ضد الجدري لم يعد يمارس عالميا.[198] وبالتالي، فإن الكثير من البشر الحديثين (المولودين بعد استئصال المرض) يكادون لا يملكون أي مناعة ضد مرض الجدري.[196]
انظر أيضا
المراجع
- قاموس المورد الحديث لمنير البعلبكي ود.رمزي البعلبكي دار العلم للملايين لبنان طبعة 2013 ص 1314
- Koonin EV, Senkevich TG, Dolja VV (2006)، "The ancient Virus World and evolution of cells"، Biol. Direct، 1: 29، doi:10.1186/1745-6150-1-29، PMC 1594570، PMID 16984643، مؤرشف من الأصل في 09 أبريل 2020، اطلع عليه بتاريخ 14 سبتمبر 2008.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Breitbart M, Rohwer F (يونيو 2005)، "Here a virus, there a virus, everywhere the same virus?"، Trends Microbiol، 13 (6): 278–84، doi:10.1016/j.tim.2005.04.003، PMID 15936660.
- Dimmock p. 49
- Dimmock p. 4
- Lawrence CM, Menon S, Eilers BJ؛ وآخرون (مايو 2009)، "Structural and functional studies of archaeal viruses"، J. Biol. Chem.، 284 (19): 12599–603، doi:10.1074/jbc.R800078200، PMID 19158076، مؤرشف من الأصل في 09 أبريل 2020.
{{استشهاد بدورية محكمة}}: Explicit use of et al. in:|مؤلف=(مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Edwards RA, Rohwer F (يونيو 2005)، "Viral metagenomics"، Nat. Rev. Microbiol.، 3 (6): 504–10، doi:10.1038/nrmicro1163، PMID 15886693.
- Canchaya C, Fournous G, Chibani-Chennoufi S, Dillmann ML, Brüssow H (أغسطس 2003)، "Phage as agents of lateral gene transfer"، Curr. Opin. Microbiol.، 6 (4): 417–24، doi:10.1016/S1369-5274(03)00086-9، PMID 12941415.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - "virus"، The Online Etymology Dictionary، مؤرشف من الأصل في 16 أغسطس 2017، اطلع عليه بتاريخ 12 سبتمبر 2008.
- "viral, a."، The Oxford English Dictionary — Online، مؤرشف من الأصل في 12 مارس 2011، اطلع عليه بتاريخ 12 سبتمبر 2008.
- Shors pp. 76–77
- Collier p. 3
- Dimmock p.4–5
- جوجل الكتب فيروس الحمى القلاعية تأليف بريان.و وماهي.ج نسخة محفوظة 21 سبتمبر 2014 على موقع واي باك مشين.
- Shors p. 589
- Publications Service (2007)، "On an invisible microbe antagonistic toward dysenteric bacilli: brief note by Mr. F. D'Herelle, presented by Mr. Roux"، Research in Microbiology، 158 (7): 553–4، doi:10.1016/j.resmic.2007.07.005، PMID 17855060.
- Steinhardt؛ Israeli؛ Lambert (1913)، "Studies on the cultivation of the virus of vaccinia"، J. Inf Dis.، 13 (2): 294–300، doi:10.1093/infdis/13.2.294.
- Collier p. 4
- Goodpasture؛ Woodruff؛ Buddingh (1931)، "The cultivation of vaccine and other viruses in the chorioallantoic membrane of chick embryos"، Science، 74 (1919): 371–372، doi:10.1126/science.74.1919.371، PMID 17810781.
- Rosen (2004)، "Isolation of poliovirus—John Enders and the Nobel Prize"، New England Journal of Medicine، 351 (15): 1481–83، doi:10.1056/NEJMp048202، PMID 15470207.
- From Nobel Lectures, Physics 1981–1990, (1993) Editor-in-Charge Tore Frängsmyr, Editor Gösta Ekspång, World Scientific Publishing Co., Singapore.
- In 1887, Buist visualised one of the largest, Vaccinia virus, by optical microscopy after staining it. Vaccinia was not known to be a virus at that time. (Buist J.B. Vaccinia and Variola: a study of their life history Churchill, London)
- Stanley؛ Loring (1936)، "The isolation of crystalline tobacco mosaic virus protein from diseased tomato plants"، Science، 83 (2143): 85، doi:10.1126/science.83.2143.85، PMID 17756690.
- Stanley؛ Lauffer (1939)، "Disintegration of tobacco mosaic virus in urea solutions"، Science، 88 (2311): 345–347، doi:10.1126/science.89.2311.345، PMID 17788438.
- Isis Creager AN, Morgan GJ After the double helix: Rosalind Franklin's research on Tobacco mosaic virus volume=99, issue=2, pages=239–72, year=2008, pmid=18702397, doi=10.1086/588626
- Dimmock p. 12
- Arch. Virol journal Norrby E Nobel Prizes and the emerging virus concept, volume=153, issue=6, pages=1109–23, year=2008, pmid=18446425, doi=10.1007/s00705-008-0088-8
- ICTV قائمة فيروسات المكتشفة والمكتشفين نسخة محفوظة 11 نوفمبر 2009 على موقع واي باك مشين.
- Collier p. 745
- Adv. Virus Res Journal Temin HM, Baltimore D RNA-directed DNA synthesis and RNA tumor viruses, volume=17, pages=129–86, year=1972, pmid=4348509, doi=10.1016/S0065-3527(08)60749-6
- Barré-Sinoussi, F.؛ وآخرون (1983)، "Isolation of a T-lymphotropic retrovirus from a patient at risk for acquired immune deficiency syndrome (AIDS)"، Science، 220 (4599): 868–871، doi:10.1126/science.6189183، PMID 6189183.
{{استشهاد بدورية محكمة}}: Explicit use of et al. in:|مؤلف=(مساعدة) - موقع مقبرة أرلينغتون الوطنية جيمس كارول نسخة محفوظة 06 أكتوبر 2017 على موقع واي باك مشين.
- موقع مقبرة أرلينغتون الوطنية ولتر ريد نسخة محفوظة 25 يناير 2017 على موقع واي باك مشين.
- Iyer LM, Balaji S, Koonin EV, Aravind L (أبريل 2006)، "Evolutionary genomics of nucleo-cytoplasmic large DNA viruses"، Virus Res.، 117 (1): 156–84، doi:10.1016/j.virusres.2006.01.009، PMID 16494962، مؤرشف من الأصل في 11 ديسمبر 2018، اطلع عليه بتاريخ 14 سبتمبر 2008.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Liu Y, Nickle DC, Shriner D, et al. (2004). "Molecular clock-like evolution of human immunodeficiency virus type 1". Virology. 10;329(1):101–8, ببمد 15476878
- Shors p. 16
- Collier pp. 18–19
- Shors pp. 14–16
- Collier pp. 11–21
- Dimmock p. 16
- Collier p. 11
- Shors p. 574
- McClintock, B. (يونيو 1950)، "The origin and behavior of mutable loci in maize"، Proc Natl Acad Sci U S A.، 36 (6): 344–55، doi:10.1073/pnas.36.6.344، PMID 15430309.
- Collier pp. 11–12
- Dimmock p. 55
- Shors 551–3
- Tsagris EM, de Alba AE, Gozmanova M, Kalantidis K (سبتمبر 2008)، "Viroids"، Cell. Microbiol.، 10 (11): 2168، doi:10.1111/j.1462-5822.2008.01231.x، PMID 18764915، اطلع عليه بتاريخ 19 سبتمبر 2008.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link)[وصلة مكسورة] - Shors p. 492–3
- La Scola B, Desnues C, Pagnier I, Robert C, Barrassi L, Fournous G, Merchat M, Suzan-Monti M, Forterre P, Koonin E, Raoult D (سبتمبر 2008)، "The virophage as a unique parasite of the giant mimivirus"، ، 455 (7209): 100–4، doi:10.1038/nature07218، PMID 18690211.
{{استشهاد بدورية محكمة}}: الوسيط|access-date=بحاجة لـ|url=(مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Collier p. 777
- Dimmock p. 55–7
- Mahy WJ & Van Regenmortel MHV (eds) (2009)، Desk Encyclopedia of General Virology، Oxford: Academic Press، ص. 24، ISBN 0-12-375146-2.
{{استشهاد بكتاب}}:|مؤلف=has generic name (مساعدة) - Mahy WJ & Van Regenmortel MHV (eds) (2009)، Desk Encyclopedia of General Virology، Oxford: Academic Press، ص. 28، ISBN 0-12-375146-2.
{{استشهاد بكتاب}}:|مؤلف=has generic name (مساعدة) - Mahy WJ & Van Regenmortel MHV (eds) (2009)، Desk Encyclopedia of General Virology، Oxford: Academic Press، ص. 26، ISBN 0-12-375146-2.
{{استشهاد بكتاب}}:|مؤلف=has generic name (مساعدة) - Dimmock pp. 15–16
- Liberski PP (2008)، "Prion diseases: a riddle wrapped in a mystery inside an enigma"، Folia Neuropathol، 46 (2): 93–116، PMID 18587704.
- Dimmock pp. 57–58
- Lupi O, Dadalti P, Cruz E, Goodheart C (2007)، "Did the first virus self-assemble from self-replicating prion proteins and RNA?"، Med. Hypotheses، 69 (4): 724–30، doi:10.1016/j.mehy.2007.03.031، PMID 17512677.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Rybicki EP (1990) "The classification of organisms at the edge of life, or problems with virus systematics." S Aft J Sci 86:182–186
- Holmes EC (أكتوبر 2007)، "Viral evolution in the genomic age"، PLoS Biol.، 5 (10): e278، doi:10.1371/journal.pbio.0050278، PMC 1994994، PMID 17914905، مؤرشف من الأصل في 21 أبريل 2020، اطلع عليه بتاريخ 13 سبتمبر 2008.
- Collier pp. 33–55
- Collier pp. 33–37
- Kiselev NA, Sherman MB, Tsuprun VL (1990)، "Negative staining of proteins"، Electron Microsc. Rev.، 3 (1): 43–72، doi:10.1016/0892-0354(90)90013-I، PMID 1715774.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Collier p. 40
- Caspar DL, Klug A (1962)، "Physical principles in the construction of regular viruses"، Cold Spring Harb. Symp. Quant. Biol.، 27: 1–24، PMID 14019094.
- Crick FH, Watson JD (1956)، "Structure of small viruses"، Nature، 177 (4506): 473–5، doi:10.1038/177473a0، PMID 13309339.
- Falvo, M.R. (مارس 1997)، "Manipulation of individual viruses: friction and mechanical properties"، Biophysical Journal، 72 (3): 1396–1403، doi:10.1016/S0006-3495(97)78786-1، مؤرشف من الأصل في 09 أبريل 2020، اطلع عليه بتاريخ 8 مايو 2009.
{{استشهاد بدورية محكمة}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - Kuznetsov, Yu. G. (01 سبتمبر 2001)، "Imaging of viruses by atomic force microscopy"، J Gen Virol، 82 (9): 2025–2034، مؤرشف من الأصل في 16 مايو 2015، اطلع عليه بتاريخ 19 أبريل 2009.
{{استشهاد بدورية محكمة}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - Collier p. 37
- Collier pp. 42–43
- Rossmann MG, Mesyanzhinov VV, Arisaka F, Leiman PG (أبريل 2004)، "The bacteriophage T4 DNA injection machine"، Curr. Opin. Struct. Biol.، 14 (2): 171–80، doi:10.1016/j.sbi.2004.02.001، PMID 15093831.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Long GW, Nobel J, Murphy FA, Herrmann KL, Lourie B (سبتمبر 1970)، "Experience with electron microscopy in the differential diagnosis of smallpox"، Appl Microbiol، 20 (3): 497–504، PMC 376966، PMID 4322005.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Suzan-Monti M, La Scola B, Raoult D (2006)، "Genomic and evolutionary aspects of Mimivirus"، Virus Research، 117 (1): 145–155، doi:10.1016/j.virusres.2005.07.011، PMID 16181700.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Prangishvili D, Forterre P, Garrett RA (2006)، "Viruses of the Archaea: a unifying view"، Nat. Rev. Microbiol.، 4 (11): 837–48، doi:10.1038/nrmicro1527، PMID 17041631.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Collier pp. 96–99
- Saunders, Venetia A.; Carter, John (2007)، Virology: principles and applications، Chichester: John Wiley & Sons، ص. 72، ISBN 0-470-02387-2.
{{استشهاد بكتاب}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Van Etten JL, Lane LC, Dunigan DD (2010)، "DNA viruses: the really big ones (giruses)"، Annual Review of Microbiology، 64: 83–99، doi:10.1146/annurev.micro.112408.134338، PMC 2936810، PMID 20690825.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Sanjuán R, Nebot MR, Chirico N, Mansky LM, Belshaw R (أكتوبر 2010)، "Viral mutation rates"، Journal of Virology، 84 (19): 9733–48، doi:10.1128/JVI.00694-10، PMC 2937809، PMID 20660197.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Pressing؛ Reanney (1984)، "Divided genomes and intrinsic noise"، J Mol Evol، 20 (2): 135–46، doi:10.1007/BF02257374، PMID 6433032.
- Duffy S, Holmes EC (2009)، "Validation of high rates of nucleotide substitution in geminiviruses: phylogenetic evidence from East African cassava mosaic viruses"، The Journal of General Virology، 90 (Pt 6): 1539–47، doi:10.1099/vir.0.009266-0، PMID 19264617.
- Pan XP, Li LJ, Du WB, Li MW, Cao HC, Sheng JF (2007)، "Differences of YMDD mutational patterns, precore/core promoter mutations, serum HBV DNA levels in lamivudine-resistant hepatitis B genotypes B and C"، J. Viral Hepat.، 14 (11): 767–74، doi:10.1111/j.1365-2893.2007.00869.x، PMID 17927612.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Hampson AW, Mackenzie JS (2006)، "The influenza viruses"، Med. J. Aust.، 185 (10 Suppl): S39–43، PMID 17115950.
- Metzner KJ (2006)، "Detection and significance of minority quasispecies of drug-resistant HIV-1"، J HIV Ther، 11 (4): 74–81، PMID 17578210.
- Goudsmit, Jaap. Viral Sex. Oxford Univ Press, 1998.(ردمك 978-0-19-512496-5) ISBN 0-19-512496-0
- Worobey M, Holmes EC (1999)، "Evolutionary aspects of recombination in RNA viruses"، J. Gen. Virol.، 80 (Pt 10): 2535–43، PMID 10573145.
- Lukashev AN (2005)، "Role of recombination in evolution of enteroviruses"، Rev. Med. Virol.، 15 (3): 157–67، doi:10.1002/rmv.457، PMID 15578739.
- Umene K (1999)، "Mechanism and application of genetic recombination in herpesviruses"، Rev. Med. Virol.، 9 (3): 171–82، doi:10.1002/(SICI)1099-1654(199907/09)9:3<171::AID-RMV243>3.0.CO;2-A، PMID 10479778.
- Collier pp. 75–91
- Dimmock p. 70
- Boevink P, Oparka KJ (أغسطس 2005)، "Virus-host interactions during movement processes"، Plant Physiol.، 138 (4): 1815–21، doi:10.1104/pp.105.066761، PMC 1183373، PMID 16172094، مؤرشف من الأصل في 09 أبريل 2020.
- Dimmock p. 71
- Barman S, Ali A, Hui EK, Adhikary L, Nayak DP (2001)، "Transport of viral proteins to the apical membranes and interaction of matrix protein with glycoproteins in the assembly of influenza viruses"، Virus Res.، 77 (1): 61–9، doi:10.1016/S0168-1702(01)00266-0، PMID 11451488.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Shors pp. 60, 597
- Dimmock, Chapter 15, Mechanisms in virus latentcy, pp.243–259
- Dimmock 185–187
- Collier pp. 115–146
- Collier p. 115
- Roulston A, Marcellus RC, Branton PE (1999)، "Viruses and apoptosis"، Annu. Rev. Microbiol.، 53: 577–628، doi:10.1146/annurev.micro.53.1.577، PMID 10547702.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Alwine JC (2008)، "Modulation of host cell stress responses by human cytomegalovirus"، Curr. Top. Microbiol. Immunol.، 325: 263–79، doi:10.1007/978-3-540-77349-8_15، PMID 18637511.
- Sinclair J (2008)، "Human cytomegalovirus: Latency and reactivation in the myeloid lineage"، J. Clin. Virol.، 41 (3): 180–5، doi:10.1016/j.jcv.2007.11.014، PMID 18164651.
- Jordan MC, Jordan GW, Stevens JG, Miller G (1984)، "Latent herpesviruses of humans"، Ann. Intern. Med.، 100 (6): 866–80، PMID 6326635.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Sissons JG, Bain M, Wills MR (2002)، "Latency and reactivation of human cytomegalovirus"، J. Infect.، 44 (2): 73–7، doi:10.1053/jinf.2001.0948، PMID 12076064.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Barozzi P, Potenza L, Riva G, Vallerini D, Quadrelli C, Bosco R, Forghieri F, Torelli G, Luppi M (2007)، "B cells and herpesviruses: a model of lymphoproliferation"، Autoimmun Rev، 7 (2): 132–6، doi:10.1016/j.autrev.2007.02.018، PMID 18035323.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Subramanya D, Grivas PD (2008)، "HPV and cervical cancer: updates on an established relationship"، Postgrad Med، 120 (4): 7–13، doi:10.3810/pgm.2008.11.1928، PMID 19020360.
- Lwoff A, Horne RW, Tournier P (1962)، "A virus system"، C. R. Hebd. Seances Acad. Sci. (باللغة الفرنسية)، 254: 4225–7، PMID 14467544.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Lwoff A, Horne R, Tournier P (1962)، "A system of viruses"، Cold Spring Harb. Symp. Quant. Biol.، 27: 51–5، PMID 13931895.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Fields p. 27
- As defined therein, "a virus species is a polythetic class of viruses that constitute a replicating lineage and occupy a particular ecological niche". A “polythetic" class is one whose members have several properties in common, although they do not necessarily all share a single common defining one. Members of a virus species are defined collectively by a consensus group of properties. Virus species thus differ from the higher viral taxa, which are “universal” classes and as such are defined by properties that are necessary for membership.
- Delwart EL (2007)، "Viral metagenomics"، Rev. Med. Virol.، 17 (2): 115–31، doi:10.1002/rmv.532، PMID 17295196.
- Virus Taxonomy 2008. International Committee on Taxonomy of Viruses. Retrieved on September 15, 2008. نسخة محفوظة 21 ديسمبر 2016 على موقع واي باك مشين. [وصلة مكسورة]
- ICTV Master Species List 2008
- This Excel file contains the official ICTV Master Species list for 2008. This spreadsheet lists all approved virus taxa and supersedes the previous taxonomy published as a part of the ICTV VIIIth Report. Produced by the International Committee on Taxonomy of Viruses. Retrieved on September 15, 2008 نسخة محفوظة 16 يونيو 2009 على موقع واي باك مشين.
- Baltimore D (1974)، "The strategy of RNA viruses"، Harvey Lect.، 70 Series: 57–74، PMID 4377923.
- van Regenmortel MH, Mahy BW (2004)، "Emerging issues in virus taxonomy"، Emerging Infect. Dis.، 10 (1): 8–13، PMID 15078590.
- Mayo MA (1999)، "Developments in plant virus taxonomy since the publication of the 6th ICTV Report. International Committee on Taxonomy of Viruses"، Arch. Virol.، 144 (8): 1659–66، doi:10.1007/s007050050620، PMID 10486120.
- de Villiers EM, Fauquet C, Broker TR, Bernard HU, zur Hausen H (2004)، "Classification of papillomaviruses"، Virology، 324 (1): 17–27، doi:10.1016/j.virol.2004.03.033، PMID 15183049.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Chen C, Chiu Y, Wei F, Koong F, Liu H, Shaw C, Hwu H, Hsiao K (1999)، "High seroprevalence of Borna virus infection in schizophrenic patients, family members and mental health workers in Taiwan"، Mol Psychiatry، 4 (1): 33–8، doi:10.1038/sj.mp.4000484، PMID 10089006.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Margolis TP, Elfman FL, Leib D؛ وآخرون (أكتوبر 2007)، "Spontaneous reactivation of herpes simplex virus type 1 in latently infected murine sensory ganglia"، J. Virol.، 81 (20): 11069–74، doi:10.1128/JVI.00243-07، PMC 2045564، PMID 17686862، مؤرشف من الأصل في 09 أبريل 2020، اطلع عليه بتاريخ 13 سبتمبر 2008.
{{استشهاد بدورية محكمة}}: Explicit use of et al. in:|مؤلف=(مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Whitley RJ, Roizman B (مايو 2001)، "Herpes simplex virus infections"، Lancet، 357 (9267): 1513–8، doi:10.1016/S0140-6736(00)04638-9، PMID 11377626.
- Barton ES, White DW, Cathelyn JS؛ وآخرون (مايو 2007)، "Herpesvirus latency confers symbiotic protection from bacterial infection"، Nature، 447 (7142): 326–9، doi:10.1038/nature05762، PMID 17507983.
{{استشهاد بدورية محكمة}}: Explicit use of et al. in:|مؤلف=(مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Bertoletti A, Gehring A (2007)، "Immune response and tolerance during chronic hepatitis B virus infection"، Hepatol. Res.، 37 Suppl 3: S331–8، doi:10.1111/j.1872-034X.2007.00221.x، PMID 17931183.
- Rodrigues C, Deshmukh M, Jacob T, Nukala R, Menon S, Mehta A (2001)، "Significance of HBV DNA by PCR over serological markers of HBV in acute and chronic patients"، Indian journal of medical microbiology، 19 (3): 141–4، PMID 17664817.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Nguyen VT, McLaws ML, Dore GJ (2007)، "Highly endemic hepatitis B infection in rural Vietnam"، Journal of Gastroenterology and Hepatology، 22 (12): 2093، doi:10.1111/j.1440-1746.2007.05010.x، PMID 17645465.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Fowler MG, Lampe MA, Jamieson DJ, Kourtis AP, Rogers MF (2007)، "Reducing the risk of mother-to-child human immunodeficiency virus transmission: past successes, current progress and challenges, and future directions"، Am. J. Obstet. Gynecol.، 197 (3 Suppl): S3–9، doi:10.1016/j.ajog.2007.06.048، PMID 17825648.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Sauerbrei A, Wutzler P (2000)، "The congenital varicella syndrome"، Journal of perinatology : official journal of the California Perinatal Association، 20 (8 Pt 1): 548–54، PMID 11190597.
- Garnett GP (2005)، "Role of herd immunity in determining the effect of vaccines against sexually transmitted disease"، J. Infect. Dis.، 191 Suppl 1: S97–106، doi:10.1086/425271، PMID 15627236.
- Platonov AE (2006)، "(The influence of weather conditions on the epidemiology of vector-borne diseases by the example of West Nile fever in Russia)"، Vestn. Akad. Med. Nauk SSSR (باللغة الروسية) (2): 25–9، PMID 16544901.
- Shors p. 198
- Shors pp. 199, 209
- Shors p. 126
- Shors pp. 193–194
- Shors pp. 193–94
- Shors p. 194
- Shors pp. 192–193
-
- Ranlet P (2000)، "The British, the Indians, and smallpox: what actually happened at Fort Pitt in 1763?"، Pa Hist، 67 (3): 427–41، PMID 17216901.
{{استشهاد بدورية محكمة}}: الوسيط|access-date=بحاجة لـ|url=(مساعدة) - Van Rijn K (2006)، ""Lo! The poor Indian!" colonial responses to the 1862–63 smallpox epidemic in British Columbia and Vancouver Island"، Can Bull Med Hist، 23 (2): 541–60، PMID 17214129.
{{استشهاد بدورية محكمة}}: الوسيط|access-date=بحاجة لـ|url=(مساعدة) - Patterson KB, Runge T (2002)، "Smallpox and the Native American"، Am. J. Med. Sci.، 323 (4): 216–22، doi:10.1097/00000441-200204000-00009، PMID 12003378.
- Sessa R, Palagiano C, Scifoni MG, di Pietro M, Del Piano M (1999)، "The major epidemic infections: a gift from the Old World to the New?"، Panminerva Med، 41 (1): 78–84، PMID 10230264.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Bianchine PJ, Russo TA (1992)، "The role of epidemic infectious diseases in the discovery of America"، Allergy Proc، 13 (5): 225–32، doi:10.2500/108854192778817040، PMID 1483570، مؤرشف من الأصل في 09 أبريل 2020، اطلع عليه بتاريخ 16 سبتمبر 2008.
- Hauptman LM (1979)، "Smallpox and American Indian; Depopulation in Colonial New York"، N Y State J Med، 79 (12): 1945–9، PMID 390434.
- Fortuine R (1988)، "Smallpox decimates the Tlingit (1787)"، Alaska Med، 30 (3): 109، PMID 3041871.
{{استشهاد بدورية محكمة}}: الوسيط|access-date=بحاجة لـ|url=(مساعدة)
- Ranlet P (2000)، "The British, the Indians, and smallpox: what actually happened at Fort Pitt in 1763?"، Pa Hist، 67 (3): 427–41، PMID 17216901.
- Collier pp. 409–415
- Patterson KD, Pyle GF (1991)، "The geography and mortality of the 1918 influenza pandemic"، Bull Hist Med.، 65 (1): 4–21، PMID 2021692، مؤرشف من الأصل في 26 أبريل 2022.
- Johnson NP, Mueller J (2002)، "Updating the accounts: global mortality of the 1918–1920 "Spanish" influenza pandemic"، Bull Hist Med، 76 (1): 105–15، doi:10.1353/bhm.2002.0022، PMID 11875246، مؤرشف من الأصل في 31 مايو 2022.
-
Gao F, Bailes E, Robertson DL؛ وآخرون (1999)، "Origin of HIV-1 in the Chimpanzee Pan troglodytes troglodytes"، Nature، 397 (6718): 436–441، doi:10.1038/17130، PMID 9989410.
{{استشهاد بدورية محكمة}}: Explicit use of et al. in:|مؤلف=(مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Shors p. 447
- Mawar N, Saha S, Pandit A, Mahajan U (2005)، "The third phase of HIV pandemic: social consequences of HIV/AIDS stigma & discrimination & future needs" (PDF)، Indian J. Med. Res.، 122 (6): 471–84، PMID 16517997، مؤرشف من الأصل (PDF) في 30 يونيو 2019، اطلع عليه بتاريخ 13 سبتمبر 2008.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - "Status of the global HIV epidemic" (PDF)، UNAIDS، 2008، مؤرشف من الأصل (PDF) في 01 أكتوبر 2018، اطلع عليه بتاريخ 15 سبتمبر 2008.
- الحمى النزفية الفيروسية إدارة الصحة نورث داكوتا نسخة محفوظة 04 مارس 2016 على موقع واي باك مشين. [وصلة مكسورة]
- Towner JS, Khristova ML, Sealy TK؛ وآخرون (2006)، "Marburgvirus genomics and association with a large hemorrhagic fever outbreak in Angola"، J. Virol.، 80 (13): 6497–516، doi:10.1128/JVI.00069-06، PMC 1488971، PMID 16775337.
{{استشهاد بدورية محكمة}}: Explicit use of et al. in:|مؤلف=(مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Einstein MH, Schiller JT, Viscidi RP, Strickler HD, Coursaget P, Tan T, Halsey N, Jenkins D (يونيو 2009)، "Clinician's guide to human papillomavirus immunology: knowns and unknowns"، The Lancet Infectious Diseases، 9 (6): 347–56، doi:10.1016/S1473-3099(09)70108-2، PMID 19467474.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Shuda M, Feng H, Kwun HJ, Rosen ST, Gjoerup O, Moore PS, Chang Y (أكتوبر 2008)، "T antigen mutations are a human tumor-specific signature for Merkel cell polyomavirus"، Proceedings of the National Academy of Sciences of the United States of America، 105 (42): 16272–7، doi:10.1073/pnas.0806526105، PMC 2551627، PMID 18812503.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Pulitzer MP, Amin BD, Busam KJ (مايو 2009)، "Merkel cell carcinoma: review"، Advances in Anatomic Pathology، 16 (3): 135–44، doi:10.1097/PAP.0b013e3181a12f5a، PMID 19395876.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Koike K (2007)، "Hepatitis C virus contributes to hepatocarcinogenesis by modulating metabolic and intracellular signalling pathways"، J. Gastroenterol. Hepatol.، 22 Suppl 1: S108–11، doi:10.1111/j.1440-1746.2006.04669.x، PMID 17567457.
- Hu J, Ludgate L (2007)، "HIV-HBV and HIV-HCV coinfection and liver cancer development"، Cancer Treat. Res.، 133: 241–52، doi:10.1007/978-0-387-46816-7_9، PMID 17672044.
- Bellon M, Nicot C (2007)، "Telomerase: a crucial player in HTLV-I-induced human T-cell leukemia"، Cancer genomics & proteomics، 4 (1): 21–5، PMID 17726237.
- Schiffman M, Castle PE, Jeronimo J, Rodriguez AC, Wacholder S (2007)، "Human papillomavirus and cervical cancer"، Lancet، 370 (9590): 890–907، doi:10.1016/S0140-6736(07)61416-0، PMID 17826171.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Klein E, Kis LL, Klein G (2007)، "Epstein-Barr virus infection in humans: from harmless to life endangering virus-lymphocyte interactions"، Oncogene، 26 (9): 1297–305، doi:10.1038/sj.onc.1210240، PMID 17322915.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - zur Hausen H (يوليو 2008)، "Novel human polyomaviruses—re-emergence of a well known virus family as possible human carcinogens"، International Journal of Cancer. Journal International Du Cancer، 123 (2): 247–50، doi:10.1002/ijc.23620، PMID 18449881.
- Alberts, Bruce (2002)، Molecular Biology of the Cell; Fourth Edition، New York and London: Garland Science، ISBN 0-8153-3218-1، مؤرشف من الأصل في 18 سبتمبر 2009، اطلع عليه بتاريخ 15 سبتمبر 2008.
{{استشهاد بكتاب}}: الوسيط author-name-list parameters تكرر أكثر من مرة (مساعدة) - Ding SW, Voinnet O (2007)، "Antiviral immunity directed by small RNAs"، Cell، 130 (3): 413–26، doi:10.1016/j.cell.2007.07.039، PMC 2703654، PMID 17693253.
- Patton JT, Vasquez-Del Carpio R, Spencer E (2004)، "Replication and transcription of the rotavirus genome"، Curr. Pharm. Des.، 10 (30): 3769–77، doi:10.2174/1381612043382620، PMID 15579070.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Jayaram H, Estes MK, Prasad BV (2004)، "Emerging themes in rotavirus cell entry, genome organization, transcription and replication"، Virus Res.، 101 (1): 67–81، doi:10.1016/j.virusres.2003.12.007، PMID 15010218.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Greer S, Alexander GJ (1995)، "Viral serology and detection"، Baillieres Clin. Gastroenterol.، 9 (4): 689–721، doi:10.1016/0950-3528(95)90057-8، PMID 8903801.
- Matter L, Kogelschatz K, Germann D (1997)، "Serum levels of rubella virus antibodies indicating immunity: response to vaccination of subjects with low or undetectable antibody concentrations"، J. Infect. Dis.، 175 (4): 749–55، doi:10.1086/513967، PMID 9086126.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Cascalho M, Platt JL (2007)، "Novel functions of B cells"، Crit. Rev. Immunol.، 27 (2): 141–51، PMID 17725500.
- Le Page C, Génin P, Baines MG, Hiscott J (2000)، "Interferon activation and innate immunity"، Rev Immunogenet، 2 (3): 374–86، PMID 11256746.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Hilleman MR (2004)، "Strategies and mechanisms for host and pathogen survival in acute and persistent viral infections"، Proc. Natl. Acad. Sci. U.S.A.، 101 Suppl 2: 14560–6، doi:10.1073/pnas.0404758101، PMC 521982، PMID 15297608.
- منظمة الصحة العالمية لقاحات شلل الأطفال والتمنيع ضد شلل الأطفال في حقبة ما قبل استئصال هذا المرض: ورقة موقف منظمة الصحة العالمية نشرت في 4 حزيران/ يونيو 2010 في السجل الوبائي الأسبوعي نسخة محفوظة 01 نوفمبر 2013 على موقع واي باك مشين.
- Asaria P, MacMahon E (2006)، "Measles in the United Kingdom: can we eradicate it by 2010?"، BMJ، 333 (7574): 890–5، doi:10.1136/bmj.38989.445845.7C، PMC 1626346، PMID 17068034.
- Lane JM (2006)، "Mass vaccination and surveillance/containment in the eradication of smallpox"، Curr. Top. Microbiol. Immunol.، 304: 17–29، doi:10.1007/3-540-36583-4_2، PMID 16989262.
- Arvin AM, Greenberg HB (2006)، "New viral vaccines"، Virology، 344 (1): 240–9، doi:10.1016/j.virol.2005.09.057، PMID 16364754.
- Pastoret PP, Schudel AA, Lombard M (2007)، "Conclusions—future trends in veterinary vaccinology"، Rev. – Off. Int. Epizoot.، 26 (2): 489–94, 495–501, 503–9، PMID 17892169.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Palese P (2006)، "Making better influenza virus vaccines?"، Emerging Infect. Dis.، 12 (1): 61–5، PMID 16494719.
- Thomssen R (1975)، "Live attenuated versus killed virus vaccines"، Monographs in allergy، 9: 155–76، PMID 1090805.
- McLean AA (1986)، "Development of vaccines against hepatitis A and hepatitis B"، Rev. Infect. Dis.، 8 (4): 591–8، PMID 3018891.
- Casswall TH, Fischler B (2005)، "Vaccination of the immunocompromised child"، Expert review of vaccines، 4 (5): 725–38، doi:10.1586/14760584.4.5.725، PMID 16221073.
- Barnett ED, Wilder-Smith A, Wilson ME (2008)، "Yellow fever vaccines and international travelers"، Expert Rev Vaccines، 7 (5): 579–87، doi:10.1586/14760584.7.5.579، PMID 18564013.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Magden J, Kääriäinen L, Ahola T (2005)، "Inhibitors of virus replication: recent developments and prospects"، Appl. Microbiol. Biotechnol.، 66 (6): 612–21، doi:10.1007/s00253-004-1783-3، PMID 15592828.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Mindel A, Sutherland S (1983)، "Genital herpes — the disease and its treatment including intravenous acyclovir"، J. Antimicrob. Chemother.، 12 Suppl B: 51–9، PMID 6355051.
- Witthöft T, Möller B, Wiedmann KH؛ وآخرون (نوفمبر 2007)، "Safety, tolerability and efficacy of peginterferon alpha-2a and ribavirin in chronic hepatitis C in clinical practice: The German Open Safety Trial"، J. Viral Hepat.، 14 (11): 788–96، doi:10.1111/j.1365-2893.2007.00871.x، PMC 2156112، PMID 17927615.
{{استشهاد بدورية محكمة}}: Explicit use of et al. in:|مؤلف=(مساعدة)، الوسيط|access-date=بحاجة لـ|url=(مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Rudin D, Shah SM, Kiss A, Wetz RV, Sottile VM (نوفمبر 2007)، "Interferon and lamivudine vs. interferon for hepatitis B e antigen-positive hepatitis B treatment: meta-analysis of randomized controlled trials"، Liver Int.، 27 (9): 1185–93، doi:10.1111/j.1478-3231.2007.01580.x (غير نشط 13 يوليو 2009)، PMC 2156150، PMID 17919229.
{{استشهاد بدورية محكمة}}: الوسيط|access-date=بحاجة لـ|url=(مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) صيانة CS1: وصلة دوي غير نشطة منذ 2009 (link) - أهم الأمراض الفيروسية الشائعة على الباتات د.محمد عبد الرحمان الوكيل أستاذ أمراض النبات بكلية الزراعة جامعة المنصورة نسخة محفوظة 10 يناير 2017 على موقع واي باك مشين.
- Shors p. 584
- Shors pp. 562–587
- Dinesh-Kumar SP, Wai-Hong Tham, Baker BJ (2000). "Structure—function analysis of the tobacco mosaic virus resistance gene N". PNAS 97, 14789-94 ببمد 11121079
- Shors pp. 573–576
- Soosaar JL, Burch-Smith TM, Dinesh-Kumar SP (2005). "Mechanisms of plant resistance to viruses". Nat. Rev. Microbiol. 3, pp. 789–98 ببمد 16132037
- Wommack KE, Colwell RR (مارس 2000)، "Virioplankton: viruses in aquatic ecosystems"، Microbiol. Mol. Biol. Rev.، 64 (1): 69–114، doi:10.1128/MMBR.64.1.69-114.2000، PMC 98987، PMID 10704475، مؤرشف من الأصل في 09 أبريل 2020.
- Bergh O, Børsheim KY, Bratbak G, Heldal M (أغسطس 1989)، "High abundance of viruses found in aquatic environments"، Nature، 340 (6233): 467–8، doi:10.1038/340467a0، PMID 2755508.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Shors pp. 595–97
- Bickle TA, Krüger DH (يونيو 1993)، "Biology of DNA restriction"، Microbiol. Rev.، 57 (2): 434–50، PMC 372918، PMID 8336674، مؤرشف من الأصل في 09 أبريل 2020.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|day=تم تجاهله (مساعدة) - Barrangou R, Fremaux C, Deveau H؛ وآخرون (مارس 2007)، "CRISPR provides acquired resistance against viruses in prokaryotes"، Science (journal)، 315 (5819): 1709–12، doi:10.1126/science.1138140، PMID 17379808.
{{استشهاد بدورية محكمة}}: Explicit use of et al. in:|مؤلف=(مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Brouns SJ, Jore MM, Lundgren M؛ وآخرون (أغسطس 2008)، "Small CRISPR RNAs guide antiviral defense in prokaryotes"، Science (journal)، 321 (5891): 960–4، doi:10.1126/science.1159689، PMID 18703739.
{{استشهاد بدورية محكمة}}: Explicit use of et al. in:|مؤلف=(مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Prangishvili D, Garrett RA (2004)، "Exceptionally diverse morphotypes and genomes of crenarchaeal hyperthermophilic viruses"، Biochem. Soc. Trans.، 32 (Pt 2): 204–8، doi:10.1042/BST0320204، PMID 15046572، مؤرشف من الأصل في 18 أبريل 2006.
- Mojica FJ, Díez-Villaseñor C, García-Martínez J, Soria E (2005)، "Intervening sequences of regularly spaced prokaryotic repeats derive from foreign genetic elements"، J. Mol. Evol.، 60 (2): 174–82، doi:10.1007/s00239-004-0046-3، PMID 15791728، مؤرشف من الأصل في 28 مارس 2022.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Makarova KS, Grishin NV, Shabalina SA, Wolf YI, Koonin EV (2006)، "A putative RNA-interference-based immune system in prokaryotes: computational analysis of the predicted enzymatic machinery, functional analogies with eukaryotic RNAi, and hypothetical mechanisms of action"، Biol. Direct، 1: 7، doi:10.1186/1745-6150-1-7، PMID 16545108، مؤرشف من الأصل في 10 مايو 2013.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Collier p.8
- Lodish, Harvey; Berk, Arnold; Zipursky, S. Lawrence; Matsudaira, Paul; Baltimore, David; Darnell, James.Viruses:Structure, Function, and Uses Retrieved on September 16, 2008 نسخة محفوظة 9 أبريل 2020 على موقع واي باك مشين.
- Matsuzaki S, Rashel M, Uchiyama J؛ وآخرون (2005)، "Bacteriophage therapy: a revitalized therapy against bacterial infectious diseases"، J. Infect. Chemother.، 11 (5): 211–9، doi:10.1007/s10156-005-0408-9، PMID 16258815.
{{استشهاد بدورية محكمة}}: Explicit use of et al. in:|مؤلف=(مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Fischlechner؛ Donath (2007)، "Viruses as Building Blocks for Materials and Devices"، Angewandte Chemie International Edition، 46 (18): 3184، doi:10.1002/anie.200603445، PMID 17348058.
{{استشهاد بدورية محكمة}}: الوسيط|مؤلف=و|مؤلف-الأخير1=تكرر أكثر من مرة (مساعدة) - Soto CM, Blum AS, Vora GJ؛ وآخرون (أبريل 2006)، "Fluorescent signal amplification of carbocyanine dyes using engineered viral nanoparticles"، J. Am. Chem. Soc.، 128 (15): 5184–9، doi:10.1021/ja058574x، PMID 16608355.
{{استشهاد بدورية محكمة}}: Explicit use of et al. in:|مؤلف=(مساعدة)صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Blum AS, Soto CM, Wilson CD, et al. (2005). "An Engineered Virus as a Scaffold for Three-Dimensional Self-Assembly on the Nanoscale". Small, 7, 702.
- Shors p. 331
- Artenstein AW, Grabenstein JD (أكتوبر 2008)، "Smallpox vaccines for biodefense: need and feasibility"، Expert Review of Vaccines، 7 (8): 1225–37، doi:10.1586/14760584.7.8.1225، PMID 18844596، مؤرشف من الأصل في 09 أبريل 2020، اطلع عليه بتاريخ 12 يوليو 2009.
- Aragón TJ, Ulrich S, Fernyak S, Rutherford GW (2003)، "Risks of serious complications and death from smallpox vaccination: a systematic review of the United States experience, 1963–1968"، BMC public health، 3: 26، doi:10.1186/1471-2458-3-26، PMID 12911836.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Weiss MM, Weiss PD, Mathisen G, Guze P (2004)، "Rethinking smallpox"، Clin. Infect. Dis.، 39 (11): 1668–73، doi:10.1086/425745، PMID 15578369.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link)
وصلات خارجية
- نطاق فيروسي المعهد السويسري لموارد المعلوماتية الحيوية حول كل عائلات الفيروسات، يوفر المعلومات العامة، الجزيئية والوبائية.
- الفيروسات مواضيع ووثائق جامعة الملك سعود بن عبد العزيز للعلوم الصحية
- بوابة طب
- بوابة تمريض
- بوابة علم الأحياء الدقيقة
- بوابة علم الفيروسات
- بوابة علم الأحياء
- بوابة علم الأحياء التطوري
- بوابة علوم