2-clorohexano
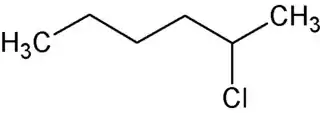
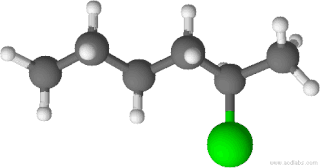
El 2-clorohexano, también llamado cloruro de 2-hexilo, es un compuesto orgánico de fórmula molecular C6H13Cl. Es un haloalcano lineal de seis carbonos con un átomo de cloro unido al carbono 2 de la cadena. Este carbono es asimétrico, por lo que existen dos enantiómeros de este compuesto.[2][3][4]
| 2-clorohexano | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| 2-clorohexano | ||
| General | ||
| Otros nombres | Cloruro de 2-hexilo | |
| Fórmula semidesarrollada | CH3-(CH2)3-CHCl-CH3 | |
| Fórmula molecular | C6H13Cl | |
| Identificadores | ||
| Número CAS | 638-28-8[1] | |
| ChemSpider | 12004 | |
| PubChem | 12521 | |
|
CCCCC(C)Cl
| ||
| Propiedades físicas | ||
| Apariencia | Líquido incoloro | |
| Densidad | 870 kg/m³; 0,87 g/cm³ | |
| Masa molar | 12 062 g/mol | |
| Punto de fusión | −75 °C (198 K) | |
| Punto de ebullición | 122,5 °C (396 K) | |
| Presión de vapor | 15 mmHg | |
| Índice de refracción (nD) | 1,412 | |
| Propiedades químicas | ||
| Solubilidad en agua | 110 mg/L | |
| log P | 3,44 | |
| Familia | Haloalcano | |
| Peligrosidad | ||
| Punto de inflamabilidad | 298 K (25 °C) | |
| Compuestos relacionados | ||
| cloroalcanos |
2-cloropentano 2-cloroheptano | |
| dicloroalcanos | 1,6-diclorohexano | |
| policloroalcanos | 1,1,1,3-tetracloro-4-metilpentano | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Propiedades físicas y químicas
A temperatura ambiente, el 2-clorohexano es un líquido incoloro[5] que tiene su punto de ebullición a 122,5 °C y su punto de fusión a -75 °C (valor estimado). Posee una densidad inferior a la del agua, ρ = 0,870 g/cm³, y en estado gaseoso es 4,16 veces más denso que el aire.[2] El valor del logaritmo de su coeficiente de reparto, logP = 3,44, indica que es más soluble en disolventes apolares que en disolventes polares. Su solubilidad en agua, muy baja, es de aproximadamente 110 mg/L.[3]
Síntesis
El 2-clorohexano se obtiene por hidrocloración de 1-hexeno con cloruro de hidrógeno, utilizando cloruro de hierro (III), cloruro de estaño (IV) o cloruro de zinc como catalizador; cuando el catalizador es pentacarbonilo de hierro también aparece como subproducto 3-clorohexano.[6] En esta misma línea, el uso de clorotrimetilsilano permite alcanzar un rendimiento del 78%.[7]
Otra forma de obtener este haloalcano es por cloración de hexano con tetraclorometano. En función del catalizador empleado y del tiempo de reacción, varía la proporción de los isómeros de clorohexano resultantes; así, empleando cloruro de manganeso (II) durante 10 horas, la proporción de 2-clorohexano llega al 88%, si bien el rendimiento es de solo el 30%.[8]
También puede prepararse 2-clorohexano por hidrogenación de 5-cloro-1-hexeno utilizando un catalizador de rodio sobre alúmina. La reacción se lleva a cabo a 52 °C y 32 atm de presión con hidrógeno gaseoso, consiguiéndose un rendimiento del 92%.[9]
Usos
La conversión de 2-clorohexano a 2-bromohexano se realiza con bromuro de litio y cloruro de litio/cloruro de metil(trioctil)amonio. El rendimiento alcanza el 80%.[10]
Este cloroalcano también aparece como intermediario en la síntesis de α-olefinas y alcoholes primarios a partir de alcanos lineales.[11][12]
Véase también
Los siguientes compuestos son isómeros del 2-clorohexano:
Referencias
- Número CAS
- 2-Chlorohexane (PubChem)
- 2-Chlorohexane (ChemSpider)
- 2-Chlorohexane (Chemical Book)
- 2-Chlorohexane (Fisher Scientific)
- Velichko, F.K.; Vinogradova, L.V. (1970). «The addition of hydrogen chloride to alk-1-enes in the presence of dicyclohexyl peroxydicarbonate, iron pentacarbonyl, and ferric chloride». Bulletin of the Academy of Sciences of the USSR 19 (7): 1530-1533. Consultado el 31 de diciembre de 2019.
- Roy, K.-M. (2007). «35.1.1.8.5.1 Variation 1: Synthesis with Aqueous Hydrogen Chloride». Science of Synthesis 35: 107. Consultado el 31 de diciembre de 2019.
- Khusnutdinov, R.I.;Shchadneva, N.A.; Bayguzina, A.R.; Oshnyakova, T.M.; Mayakova, Yu.Yu.; Dzhemilev, U.M. (2013). «Chlorination of hydrocarbons with CCl4 catalyzed by complexes of Mn, Mo, V, Fe». Russian Journal of Organic Chemistry 49 (11): 1557-1566. Consultado el 31 de diciembre de 2019.
- Ulrich, H. (2007). «35.1.1.9.2.1 Variation 1: By Hydrogenation». Science of Synthesis 35: 117. Consultado el 31 de diciembre de 2019.
- Braun, M. (2007). «35.2.1.4.2.3 Variation 3: Reactions of Chloroalkanes with Metal Bromides and a Phase-Transfer Catalyst». Science of Synthesis 35: 317. Consultado el 31 de diciembre de 2019.
- Process to convert linear alkanes into alpha olefins (2005) Fong, H.; Trevino, L.; Murray, B.; Cano, M. Patente US7462752B2
- Process to convert linear alkanes into primary alcohols (2005) Fong, H.; Trevino, L.; Murray, B.; Cano, M. Patente US7091387B2