Histoire évolutive de la lignée humaine
Histoire de l'Homme
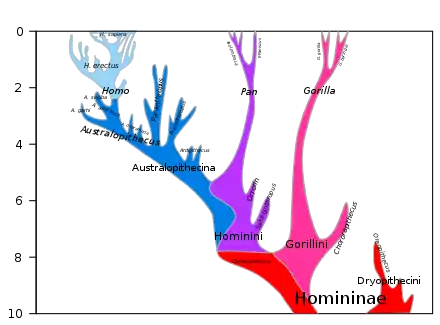
L'histoire évolutive de la lignée humaine (Hominina) est le processus évolutif conduisant à l'apparition du genre Homo, puis à celle d'Homo sapiens et de l'Homme moderne.
L'histoire évolutive des primates conduit à l'apparition de la famille des hominidés (grands singes), qui aurait divergé de celle des hylobatidés (gibbons) il y a quelque 20 millions d'années (Ma). Puis la sous-famille des homininés (gorilles, chimpanzés, et humains) se sépare de celle des ponginés (orang-outans) il y a environ 16 millions d'années[1]. Ces groupes s'étendent et se diversifient en Afrique et en Eurasie tout au long du Miocène moyen et jusqu'au début du Miocène supérieur[2],. On assiste à l'apparition des Hominina (ou hominines) en Afrique à la fin du Miocène, il y a environ 7 millions d'années.
La bipédie est le caractère le plus frappant de la sous-tribu des Hominina, Les deux plus anciens hominines connus sont Sahelanthropus tchadensis (7 millions d'années) et Orrorin tugenensis (6 Ma).
Le premier représentant documenté du genre Homo est Homo rudolfensis, qui apparaît il y a environ 2,4 millions d'années en Afrique de l'Est[3]. Avec Homo habilis, on a longtemps pensé qu'il s'agissait des deux premières espèces à avoir utilisé des outils de pierre. Cependant, une découverte de 2012 au Kenya montre que les outils lithiques existaient dès 3,3 millions d'années, et pourraient avoir été maniés par des Australopithèques[4].
L'étude de l'évolution humaine fait intervenir de nombreuses disciplines scientifiques : l'anthropologie physique, la primatologie, l'archéologie, la paléontologie, l'éthologie, la linguistique, la psychologie évolutionniste, l'embryologie et la génétique[5].
Lignée humaine
Le mot Homo est le nom du genre biologique qui regroupe toutes les espèces humaines. Elles sont toutes éteintes à l'exception d’Homo sapiens.
Le terme Homo, humain en latin, dérive d'une racine de l'Indo-européen commun *dʰǵʰm̥mō (« [chose / fils] de la terre »)[6].
Il a été choisi par Carl von Linné, dans sa méthode de classification de la nature, Systema naturae (édition de 1758). L'homme y est décrit sous le nom d’homo sapiens[7].
Classification phylogénétique
La classification phylogénétique permet de classer les différentes familles de singes et les différents genres actuels d'hominidés selon des relations de parenté plus ou moins proche.
Phylogénie des familles de singes, d'après Perelman et al. (2011)[8] et Springer et al. (2012)[9] :
| Simiiformes |
| ||||||||||||||||||||||||||||||

Phylogénie des genres actuels d'hominidés, d'après Shoshani et al. (1996)[10] et Springer et al. (2012)[11] :
| Hominidae |
| ||||||||||||||||||
Étapes de l'évolution humaine
Les mammifères connaissent une radiation évolutive dès le début du Cénozoïque : de nombreuses espèces différentes apparaissent et occupent des milieux variés. Des mammifères arboricoles apparaissent, les primates. Parmi eux, un grand nombre sont frugivores, ce qui favorise la vision en couleur, pour le repérage des fruits mûrs[alpha 1],[12].

Singes
En Asie orientale apparaissent il y a environ 45 millions d'années les premiers singes, ou Simiiformes, appartenant à la famille archaïque des Eosimiidae, représentée en Chine et en Asie du Sud-Est par différentes espèces de petite taille. Les premiers singes africains sont datés de 39 millions d'années, en Libye. On les trouve un peu plus tard en Égypte, dans la dépression du Fayoum. Les singes ont connu une importante radiation évolutive en Afrique et en Asie durant l'Éocène supérieur.
Aegyptopithecus zeuxis[12], daté d'environ 30 millions d'années, trouvé dans la dépression du Fayoum, est l'un des premiers Catarrhiniens incontestables. Les singes occupent alors toutes les niches écologiques des arbres et vivent en groupes sociaux se nourrissant de feuilles, de fruits et d'insectes[12].
Plusieurs familles de Catarrhiniens basaux se développent en Afrique et en Eurasie, avant qu'apparaissent en Afrique il y a environ 25 millions d'années les deux super-familles actuelles que sont les Cercopithecoidea (singes à queue) et les Hominoidea (singes sans queue)[13].
Hominoïdes
Apparus à la fin de l'Oligocène, les hominoïdes se sont fortement diversifiés en Afrique. On trouve au Miocène inférieur des espèces fossiles de petite taille, tel les Micropithecus pesant quelques kilogrammes, et des espèces plus imposantes pouvant peser jusqu'à cinquante kilogrammes[alpha 2]. Leurs crânes et leurs dents robustes sont adaptés à une alimentation composée de feuilles, de fruits et d'insectes. Leur locomotion est essentiellement quadrupède, même si certains des plus grands individus commencent à se déplacer en se suspendant aux branches des arbres, tel le Morotopithecus[13].
Les Hominoidea se subdivisèrent en plusieurs familles, notamment, il y a environ 20 millions d'années :
- les Hylobatidae (gibbons), qui se répandirent en Asie de l'Est et qui pratiquent la brachiation. On ne les trouve plus aujourd'hui qu'en Asie du Sud-Est ;
- les Hominidae, de plus grande taille, restés dans un premier temps en Afrique.
Hominidés
Vers 17 millions d'années, à la faveur de la collision des plaques africaine et arabique avec la plaque eurasiatique, et de l'optimum climatique du Miocène qui vit l'extension vers le Nord des forêts tropicales et tempérées chaudes, les hominidés commencèrent à se disperser hors d'Afrique. Le Griphopithèque est un hominidé d'Europe, attesté à partir de 16 millions d'années. Un hominidé européen tardif, l'Oréopithèque, pratiquait en Toscane vers 8 millions d'années une bipédie différente de celle qui vit le jour un peu plus tard en Afrique.
Les hominidés africains comprennent notamment Kenyapithecus (en) vers 14 millions d'années et, peut-être, Samburupithecus vers 9 millions d'années[13].
Il y a environ 16 millions d'années, selon les estimations fondées sur l'horloge moléculaire, les Hominidae se subdivisèrent en deux sous-familles principales : les Ponginae et les Homininae
Les ponginés se développèrent en Asie méridionale, de la Turquie jusqu'à la Chine. Le Sivapithèque, découvert en Inde et au Pakistan, est peut-être l'ancêtre du plus grand singe ayant jamais existé, le Gigantopithèque, qui vivait en Chine du Sud et au Viêt Nam. Ce dernier disparut vers la fin du Pléistocène moyen, ne laissant subsister que les orang-outans en Asie du Sud-Est[13].
Homininés

À partir de 13 millions d'années, plusieurs espèces d'Homininae sont connues en Europe, qui bénéficie au Miocène moyen d'un climat chaud et humide favorisant l'extension des forêts. Ces espèces forment le groupe des Dryopithèques (ou tribu des Dryopithecini). Ces singes se déplaçaient toujours à quatre pattes, mais se suspendaient aussi aux arbres et occasionnellement se dressaient sur deux pieds[13].
Dans une zone regroupant l'Anatolie et les Balkans (Turquie, Grèce, Bulgarie) se développèrent au Miocène supérieur des genres de grands singes, comme l'Ouranopithèque[13]. Cependant, après avoir prospéré pendant quelque 8 millions d'années, les homininés européens disparurent peu à peu du continent, à la suite du refroidissement et de l'assèchement climatiques de la fin du Miocène entraînant le recul des forêts[13].
Une espèce fossile d'Homininae identifiée en Grèce et en Bulgarie, Graecopithecus freybergi, datée de 7,2 millions d'années, suscite le débat parmi les chercheurs. L'examen au scanner d'une mandibule fragmentaire trouvée en Grèce a révélé une fusion des racines de deux prémolaires, caractère que l'on retrouve principalement chez les Hominina et rarement chez les Chimpanzés. De plus, l'emplacement vide des canines de la mandibule laisse supposer une taille de canine réduite, ce qui est l'un des caractères définissant les Hominina. Ces deux éléments combinés suggèrent que Graecopithecus pourrait faire partie des Hominini, voire des Hominina. Dans cette dernière hypothèse, il deviendrait le plus ancien ancêtre de la lignée humaine, devançant Toumaï, découvert en 2001 au Tchad et daté de 7 millions d'années[14],[15]. Cette étude renforce la thèse de ceux qui voient l'origine des Homininae, puis des Hominini, en Europe plutôt qu'en Afrique, compte tenu des nombreux fossiles de grands singes du Miocène moyen et supérieur trouvés jusqu'à présent en Europe[16], alors que seules deux espèces fossiles rattachées aux Homininae ont été décrites à ce jour en Afrique, sur la base de fossiles très fragmentaires, Nakalipithecus et Chororapithecus, datées entre 10 et 8 millions d'années. Leur lien éventuel avec les Homininae européens n'est pas connu.
Phylogénie des genres actuels et fossiles d'Homininés :
| Homininae |
| ||||||||||||||||||||||||||||||||||||
Hominines

La lignée humaine regroupe le genre Homo et tous les genres fossiles ayant une parenté plus proche avec les humains qu'avec les chimpanzés, espèce actuelle la plus proche de l'Homme.
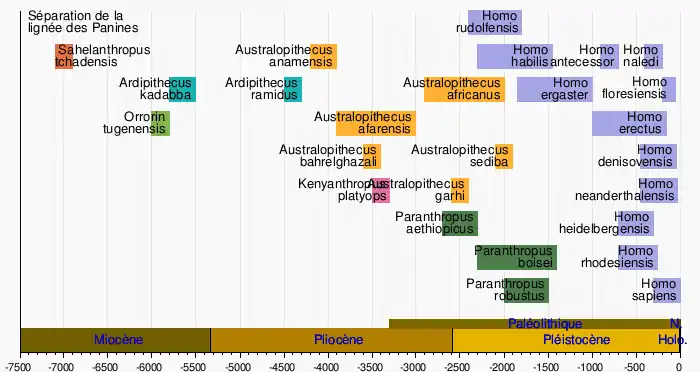
Au Miocène, entre 9 et 7 millions d'années avant le présent, se produisit la séparation entre la sous-tribu des Panina (lignée des chimpanzés) et la sous-tribu des Hominina (lignée humaine). Toutefois cette période a livré peu de fossiles et le statut de pré-humain ou de pré-chimpanzé est souvent difficile à départager.
Sahelanthropus tchadensis, daté de 7 millions d'années, a été découvert au Tchad en 2001. Le crâne fossile présente les caractères faciaux et dentaires généralement associés aux hominines et le trou occipital avancé propre aux espèces bipèdes. Cette espèce est admise par la majeure partie de la communauté scientifique comme le plus ancien représentant connu des hominines.
Le genre Australopithèque apparait en Afrique il y a environ 4,2 millions d'années. Il forme de nombreuses espèces en Afrique orientale et australe jusqu'au début du Pléistocène. Huit espèces d'australopithèques ont déjà été décrites à ce jour. Ce genre semble céder ensuite la place aux Paranthropes, dont trois espèces sont connues, mais qui s'éteignent en Afrique avant 1 million d'années.
De 3 à 2 millions d’années avant le présent (AP), une évolution climatique entraîne en Afrique de l'Est une baisse des précipitations et réduit les espaces arborés, qui laissent la place à des savanes ouvertes. À partir de 2,7 millions d’années, les documents fossiles révèlent l'existence concomitante en Afrique de plusieurs genres d’hominines. Une divergence évolutive semble s’être produite dans la lignée des Australopithèques, un premier segment évoluant vers le genre Homo et aboutissant finalement à Homo sapiens, un autre segment donnant le genre Paranthropus, qui finira par s’éteindre sans descendance. Ce dernier comprend les espèces Paranthropus robustus, en Afrique australe, Paranthropus aethiopicus et Paranthropus boisei, en Afrique de l'Est. L’hypothèse généralement avancée est que les deux lignées ont recouru à des solutions adaptatives divergentes face à l’aridité croissante. Les Paranthropes diffèrent des Australopithèques par l'ampleur de leurs molaires, de leurs mâchoires et de leurs muscles masticateurs, qui laissent supposer un régime alimentaire spécialisé orienté vers des végétaux coriaces. Ils s’éteignent il y a un peu plus d'un million d’années. Les représentants du genre Homo (Homo habilis, Homo rudolfensis, Homo gautengensis, Homo naledi) incluent à l'inverse de plus en plus de viande dans leur alimentation, probablement acquise principalement par charognage. Leur denture s'affine, leur volume cérébral s’accroît et ils commencent à utiliser un outillage en pierre taillée[17].
L'arbre de descendance jusqu'aux espèces récentes n'étant pas fixé à ce jour parmi les spécialistes, il est d'usage de présenter les différentes espèces fossiles connues sous la forme d'un tableau chronologique sans lien entre les espèces, tel que le tableau suivant :
Émergence du genre Homo


L'apparition du genre Homo est souvent interprétée comme le résultat d'une divergence phylogénétique sous la pression de l'environnement. À partir de 3 millions d'années, la tendance globale au refroidissement et à l'assèchement du climat, avec réduction du couvert forestier et accroissement des habitats ouverts, auraient poussé des Hominina à exploiter de nouvelles niches écologiques, comprenant un complément de ressources alimentaires à base de viande et de graisse. Obtenue par le charognage ou la chasse de petits animaux, cette alimentation plus riche aurait notamment favorisé un début d'accroissement du volume cérébral[19]. Le paléoanthropologue français Yves Coppens a constaté cet assèchement du climat dans la stratigraphie de la vallée de l'Omo, au sud de l'Éthiopie, sur la période allant de 3 à 2 millions d'années (transition Plio-Pléistocène). Il en a tiré la théorie dite de l'Événement de l'(H)Omo, qui succède depuis les années 2000 à la précédente version de sa théorie, dite de l'East Side Story[20].
Le genre Homo se définit par une capacité crânienne plus forte (supérieure à 550 cm3) que celle des australopithèques, une réduction de l'appareil masticateur et du prognathisme, une réduction de la denture, une descente progressive du larynx, et une bipédie quasi exclusive.
D'après ses membres supérieurs, Homo habilis était encore partiellement adapté à la vie arboricole. Cependant, les empreintes visibles sur les os de sa boite crânienne prouvent qu'il existait déjà une asymétrie entre les cerveaux droit et gauche, ce qui suggère une plus grande capacité cognitive que chez les Australopithèques. Il est réputé être l'auteur de certains des premiers galets taillés découverts en Afrique de l'Est (industrie oldowayenne). Il disparait d'Afrique vers 1,4 Ma.
Homo rudolfensis, apparu en Afrique vers 2,4 Ma, était probablement plus corpulent qu'Homo habilis. On n'en connait aucun fossile post-crânien, mais il présente un plus gros volume endocrânien et des mâchoires plus puissantes que ce dernier, peut-être liées à un régime alimentaire plus végétarien. Ses fossiles les plus récents sont datés de 1,8 Ma.
Contemporain des Homo habilis et des Paranthropes, Homo ergaster apparait il y a 2 Ma et possède des caractéristiques qui le rapprochent de l'Homme moderne : taille plus élevée, bipédie exclusive, plus forte capacité crânienne (supérieure à 750 cm3). Ses outils sont plus sophistiqués : bifaces, hachereaux, bolas, etc. (industrie acheuléenne).
Sa bonne adaptation à la marche bipède et à la course lui permet de parcourir de grandes distances à la poursuite de ses proies. Aidé de ses nouvelles armes et outils, il adopte un régime alimentaire contenant plus de viande obtenue par la chasse. Il va progressivement occuper une partie de l'ancien monde (Asie et Europe), dès 1,5 Ma, probablement par simple expansion démographique. Enfin, il est peut-être doté d'un premier langage articulé (qui serait déjà esquissé chez Homo habilis).
Formes humaines archaïques
Homo antecessor est attesté en Espagne vers 850 000 ans avant le présent. C'est la première espèce humaine identifiée en Europe. Peut-être descend-elle d'une population d'Homo ergaster sortie d'Afrique il y a plus d'un million d'années.
Homo heidelbergensis apparaît en Europe à partir de 700 000 ans, doté de l'industrie acheuléenne. Il est peut-être l'ancêtre de l'Homme de Néandertal, dont les plus anciens représentants connus sont les fossiles de la Sima de los Huesos, en Espagne, datés de 430 000 ans. L'Homme de Néandertal est robuste, lourd et trapu, ce qui lui permet de mieux résister au froid des cycles glaciaires successifs.
En Asie, Homo erectus est connu à Java à partir de 1 Ma, et en Chine à partir de 800 000 ans. Il descend peut-être d'une population d'Homo ergaster sortie d'Afrique dans la première moitié du Calabrien. Homo erectus a un squelette robuste, avec une capacité crânienne de 900 à 1 200 cm3 et une face réduite. Il adopte une industrie lithique évoquant l'Acheuléen à partir de 800 000 ans. Les derniers Homo erectus connus sont datés d'environ 110 000 ans : il s'agit de l'Homme de Solo, à Java.
L'Homme de Florès n'est attesté qu'à Florès, où il serait arrivé il y a au moins 800 000 ans, franchissant nécessairement un bras de mer depuis une terre proche. Ses derniers fossiles connus auraient environ 60 000 ans.
Phylogénie des espèces récentes du genre Homo, d'après Strait, Grine & Fleagle (2015)[21], et Meyer & al. (2016)[22] :
| Homo |
| |||||||||||||||||||||||||||||||||
Origines de l'homme moderne
Homo rhodesiensis est connu en Afrique à partir de 600 000 ans. Il est peut-être l'ancêtre d'Homo sapiens, dont les plus anciens fossiles connus sont ceux de Djebel Irhoud, au Maroc, datés en 2017 de 300 000 ans[23]. Ces fossiles augmentent de plus de 100 000 ans l'ancienneté de l'espèce Homo sapiens, précédemment fondée sur deux crânes datés en 2005 de 195 000 ans, Omo Kibish 1 et Omo Kibish 2, trouvés en 1967 en Éthiopie.
Les plus anciens restes d'Homo sapiens connus hors d'Afrique ont été découverts en 2002 dans la grotte de Misliya, sur le mont Carmel, en Israël, et ont été datés en 2018 de 185 000 ans[24].
À partir d'au moins 120 000 ans, Homo neanderthalensis et Homo sapiens ont alterné au Proche-Orient, probablement en fonction des variations climatiques de la dernière période glaciaire. Homo sapiens arrive il y a environ 48 000 ans en Europe, où l'Homme de Néandertal s'éteint vers 30 000 ans, après plusieurs milliers d'années de cohabitation.
Changements anatomiques
L'évolution de la lignée humaine est caractérisée par un certain nombre de changements morphologiques, de développements physiologiques et comportementaux qui ont eu lieu depuis le dernier ancêtre commun des humains et des chimpanzés.
Les plus importantes de ces adaptations sont la bipédie, l'augmentation de la taille du cerveau, la croissance postnatale ralentie et une diminution du dimorphisme sexuel. La relation entre ces changements fait l'objet de débats[25]. D'autres changements morphologiques importants comprennent la précision et la puissance de la préhension, changement survenu dès le premier Homo ergaster[26], et la descente du larynx, libérant la capacité de moduler des sons articulés.
Bipédie
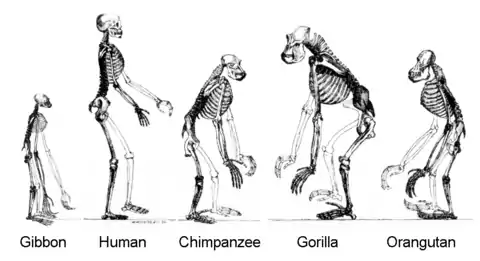
La bipédie est l'adaptation première de la lignée des Hominina. Le premier hominine probablement bipède est Sahelanthropus tchadensis[27], il y a environ 7 millions d'années, suivi par Orrorin tugenensis, il y a 6 millions d'années. À partir de 4,2 millions d'années se déploient les Australopithèques, à la bipédie incontestable.
Il existe plusieurs théories concernant les avantages de la bipédie. Il est possible qu'elle ait été favorisée car elle libère les mains pour atteindre et transporter la nourriture[28]. Elle élève le champ de vision. Elle peut éviter l'hyperthermie en réduisant la surface exposée aux rayons du soleil. Toutes ces théories se basent principalement sur l'adaptation à un nouvel environnement de type prairie ou savane plutôt que le type forestier précédent[29],[30]. Sur de longues distances, marcher sur deux jambes dépense moins d'énergie que la marche quadrupède des chimpanzés[31],[32]
Anatomiquement, l'évolution vers la bipédie est la principale cause d'une série de changements du squelette partagés par tous les hominines bipèdes, non seulement pour les jambes et le bassin, mais aussi pour la colonne vertébrale, les pieds, les chevilles et le crâne[33]. La bipédie permanente entraîne des changements dans le pied, la cheville, la jambe et l’articulation au bassin (pelvis). Le pied perd sa capacité préhensile, le gros orteil s’aligne avec les autres doigts, ce qui le conduit à supporter le poids du corps pendant la marche et aide à la locomotion. Les articulations de la cheville et du genou se renforcent pour supporter à présent en permanence tout le poids du corps. Le fémur prend une position légèrement plus angulaire, ce qui entraîne un déhanchement plus fluide lors de la marche et ramène les articulations du genou et de la cheville sous le centre de gravité du corps.
Plus haut, la bipédie et la station verticale entraînent également des changements tout au long de la colonne vertébrale. Avec la station verticale, les hommes acquièrent des fesses : en effet, le muscle grand glutéal se développe et devient le plus puissant des muscles humains, permettant de maintenir en permanence le torse en position verticale et de garder un centre de gravité stable pendant la marche et la course. Conséquence de ce redressement du buste et de la tête, la colonne vertébrale acquiert deux courbures secondaires (concavité vers l'arrière), au niveau des vertèbres cervicales et des vertèbres lombaires. Les vertèbres lombaires, qui supportent à présent tout le poids du haut du corps, deviennent plus courtes et plus larges. L’attache du crâne se déplace, le trou occipital se positionnant sous le crâne, permettant une position horizontale de la tête[34].
Les changements les plus importants interviennent dans la ceinture pelvienne, qui assure l’articulation entre la colonne vertébrale et les membres inférieurs. Chez les grands singes, les os iliaques sont longs et dirigés vers le bas. Avec la station verticale, le bassin supérieur devient plus large et évasé, sa plus grande surface fournit la meilleure attache à présent nécessaire au grand glutéal. Le bassin ne s’évase cependant que dans sa partie supérieure ; l’articulation de la hanche devant au contraire rester sur un plan vertical, pour conserver une amplitude suffisante aux mouvements du fémur et ne pas gêner le mouvement de marche normal[28]. Entre ces deux régions apparait une ligne arquée, marquant la transition entre la partie supérieure du bassin, en forme de coupe, et le « petit bassin » plus cylindrique.
Le petit bassin devient soumis à des exigences contradictoires : pour faciliter la marche, il doit être le plus étroit possible, afin de mettre l’articulation des fémurs à l’aplomb du centre de gravité du corps ; mais il doit en même temps rester suffisamment large pour permettre le passage du fœtus pendant l’accouchement. Ces contraintes ont eu des effets significatifs sur le processus de mise au monde, qui est beaucoup plus difficile chez Homo sapiens que chez les autres primates. Le petit diamètre du canal de naissance devient un obstacle à l’augmentation régulière de la taille du cerveau chez les premiers humains, provoquant un raccourcissement de la période de gestation, et un accouchement précoce donnant naissance à des enfants immatures[30]. Le petit bassin du mâle, qui n’est pas soumis à cette contrainte, prend une forme plus triangulaire et étroite que celui des femelles, plus arrondie. Les hanches plus larges donnent à la femelle une moins bonne adaptation à la marche et à la course de longue durée.
Les bras et avant-bras se raccourcissent par rapport aux jambes qui s’allongent, facilitant l'équilibre pendant la course à pied. La main n’est plus impliquée dans la locomotion et peut gagner en précision ce qu’elle va perdre en force.
Encéphalisation
L'espèce humaine a développé un cerveau beaucoup plus grand que celui des autres primates, en moyenne 1 330 cm3 chez les humains modernes, soit trois fois et demi la taille de celui d'un chimpanzé[35]. Le modèle de l'encéphalisation commence avec Homo habilis qui, avec 600 cm3 environ, avait un cerveau légèrement plus grand que celui des Australopithèques. Elle continue avec l'Homo ergaster (750 à 1 050 cm3), atteignant un maximum chez les Néandertaliens avec une taille moyenne de 1 550 cm3, plus grand encore que chez Homo sapiens.
L'encéphalisation a été mise en relation, selon l'hypothèse des tissus coûteux en énergie (en)[alpha 3], avec une augmentation de la part de la viande dans l'alimentation[36],[37] ou avec le développement de la cuisson[38].
L'augmentation de volume du cerveau pourrait être due à une mutation génétique, le remplacement de la cytosine C par la guanine G à un certain endroit d'un gène : amputé de 55 nucléotides par rapport à sa version originale[alpha 4], ce gène ne code plus pour une protéine régulant la croissance de filaments d'actine dans les neurones, mais pour une autre qui stimule la division des neurones à partir des cellules progénitrices dans les ventricules[39],[40].
Le modèle de neurodéveloppement postnatal du cerveau humain diffère de celui des autres grands singes (Hétérochronie) et permet de longues périodes d'acquisition du langage et d'apprentissage social chez les enfants humains.
Les différences entre les structures du cerveau humain et ceux d'autres singes sont plus importantes encore que les différences de volume[41],[42],[43],[44]. L'augmentation du volume au fil du temps a affecté inégalement les zones du cerveau. Les lobes temporaux, qui contiennent des centres de traitement du langage, ont augmenté de manière disproportionnée, de même que le cortex préfrontal qui est lié à la prise de décision et modélise le comportement social complexe[35].
L'augmentation du volume du néocortex a également entraîné une augmentation de la taille du cervelet. Les grands singes, y compris les humains et leurs ascendants, ont un développement plus marqué du cervelet par rapport au néocortex que les autres primates. Traditionnellement, le cervelet est associée à un paléocervelet, un archéocervelet ainsi qu'à un néocervelet. Sa fonction est généralement associée à l'équilibre, au contrôle de la motricité fine et, dans une moindre mesure, à la parole et la cognition. En raison de sa fonction de contrôle sensori-moteur et d'assistance à l'apprentissage des séquences d'actions musculaires complexes, le cervelet a peut-être favorisé l'évolution des adaptations technologiques de l'homme, y compris la préadaptation à la parole[45],[46],[47],[48].

Les principales évolutions du crâne humain sont les suivantes :
- la mandibule rétrécit et devient parabolique (au lieu d'être en U comme chez les chimpanzés et les gorilles).
- les os du crâne s'amincissent, ce qui accroit la place dévolue au cerveau à volume extérieur constant ;
- la capacité crânienne passe de 450 cm3 (chez les Australopithèques) à 1 400 cm3. Par comparaison celle des chimpanzés est de l'ordre de 380 cm3 ;
- la forme du crâne s'accentue vers les côtés (légèrement) et le haut, redessinant la région occipitale de manière plus arrondie ;
- la face s'aplatit avec la disparition du prognathisme : l'angle facial augmente, le front devient plus haut, les bourrelet sus-orbitaires régressent et les arcades zygomatiques s'effacent ;
- le menton se dessine chez le seul Homo sapiens.
Évolution technique et sociale
Activités culturelles
- Production d'outils et maîtrise de la taille de la pierre, réalisation d'un outillage diversifié (bifaces, grattoirs...) ;
- Outils complexes, réutilisables, transmissibles avec industrialisation donc apprentissage et spécialisation, répartition des tâches ;
- Maitrise du feu ;
- Rites funéraires ;
- Art (peintures, sculptures...) ;
- Langage articulé.
Art préhistorique
Depuis les années 2000 et 2010, de nombreuses théories sur les origines de l'art préhistorique ont émergé et des découvertes sur la création artistique ancienne sur parois et dalles rocheuses ont eu lieu. Elles concernent notamment celles du continent australien où des parois des abris apparaissent quelque dix millénaires avant la grotte Chauvet[49], et en Afrique où les plus anciennes expressions artistiques apparaissent quelque 50 000 ans avant les merveilles de la grotte ornée paléolithique française[50]. Il existe même, sur le continent africain, un art mobilier modeste, très sporadique depuis 75 000 ans[49].
Tableau récapitulatif de l'évolution humaine
Liste des fossiles d'hominines
Les nombreux fossiles d'hominines et d'humains découverts sur tous les continents sont listés dans l'article dédié :
Notes et références
Notes
- Les chiens ou les ruminants ont une perception des couleurs bien moindre que celle des primates.
- L'absence de chimpanzés ou de gorilles fossiles peut s'expliquer par leur habitat forestier. Les sites fossilifères africains connus ne documentent en effet que des milieux de savane ou, au mieux, de forêt-galerie, mais pas de forêt équatoriale où vivent ces grands singes. Or, ce couvert forestier donne des sols acides qui empêchent, avec la forte érosion qui leur est associée, la fossilisation. Cependant les paléosols montrent souvent « l'existence d'une mosaïque d'habitats allant de la forêt humide à la savane sèche », ce qui suggère « que les restes des grands singes sont sans doute représentés parmi les nombreux fossiles non identifiés provenant d'Afrique orientale ». Cf Jean-Jacques Jaeger, Les mondes fossiles, Odile Jacob, , p. 233.
- Selon cette hypothèse du tissu cher, les organes les plus coûteux en énergie chez les primates sont le cœur, le foie, les reins, l'estomac, l'intestin et le cerveau, ce dernier ne représentant chez l'homme que 2 % du poids du corps, mais coutant à lui seul 20 % de la dépense énergétique basale. Les trois premiers sont fortement contraints par la masse du corps, et donc l'ajustement de la dépense énergétique s'effectuerait par un compromis sur les deux derniers. Dans ce modèle, le coût d'un cerveaux volumineux est compensé par une augmentation de la qualité du régime alimentaire et une réduction correspondante de la taille du tractus intestinal. Cf (en) Aiello LC, Wheeler P. « The expensive-tissue hypothesis: the brain and the digestive-system in human and primate evolution », Curr Anthropol, 36, 1995, p.199-221.
- Le remplacement de C par G à cet endroit précis transforme un triplet CTA en GTA, lequel est interprété comme un signal de coupure : le reste du gène n'est pas transcrit dans l'ARN messager.
Références
- « Find Time of Divergence : Hominidae versus Hylobatidae », sur TimeTree (consulté le )
- Dawkins 2004
- Pallab Ghosh, « 'First human' discovered in Ethiopia », BBC News, London, BBC, (lire en ligne, consulté le )
- Thibault Panus, « Les outils précèdent l'homme », La Recherche hors-série dossier, no 17,
- Henry H. Q. Heng, « The genome-centric concept: resynthesis of evolutionary theory », BioEssays, Hoboken, NJ, John Wiley & Sons, vol. 31, no 5, , p. 512–525 (ISSN 0265-9247, PMID 19334004, DOI 10.1002/bies.200800182)
- American Heritage Dictionaries (editors) 2006
- Pascal Picq, [2005], p. 22-24
- (en) P. Perelman, W. E. Johnson et al., « A molecular phylogeny of living primates », PLoS Genetics, vol. 7, no 3, , e1001342 (PMID 21436896, PMCID 3060065, DOI 10.1371/journal.pgen.1001342, lire en ligne)
- (en) Mark S. Springer, Robert W. Meredith et al., « Macroevolutionary Dynamics and Historical Biogeography of Primate Diversification Inferred from a Species Supermatrix », PLoS ONE, vol. 7, no 11, , e49521 (ISSN 1932-6203, PMID 23166696, PMCID 3500307, DOI 10.1371/journal.pone.0049521, lire en ligne)
- (en) J. Shoshani, C. P. Groves, E. L. Simons et G. F. Gunnell, « Primate phylogeny : morphological vs. molecular results », Molecular Phylogenetics and Evolution, vol. 5, no 1, , p. 102-54 (PMID 8673281, lire en ligne)
- (en) Mark S. Springer, Robert W. Meredith et al., « Macroevolutionary Dynamics and Historical Biogeography of Primate Diversification Inferred from a Species Supermatrix », PLoS ONE, vol. 7, no 11, , e49521 (ISSN 1932-6203, PMID 23166696, PMCID 3500307, DOI 10.1371/journal.pone.0049521, lire en ligne)
- Pascal Picq, [2005], p. 81-86
- Pascal Picq, [2005], p. 90-100
- (en) Jochen Fuss, Nikolay Spassov, David Begun et Madelaine Böhme, « Potential hominin affinities of Graecopithecus from the Late Miocene of Europe », PLoS ONE, vol. 12, no 5, (DOI 10.1371/journal.pone.0177127, lire en ligne)
- (en) Madelaine Böhme, Nikolay Spassov, M. Ebner, Denis Geraads, L. Hristova, U. Kirscher et al., « Messinian age and savannah environment of the possible hominin Graecopithecus from Europe », PLoS ONE, vol. 12, no 5, (DOI 10.1371/journal.pone.0177347, lire en ligne)
- (en) David R. Begun, The real Planet of the Apes : A new Story of human Origins, Princeton University Press, (lire en ligne)
- Jean-Paul Demoule, Dominique Garcia, Alain Schnapp, Une histoire des civilisations : comment l'archéologie bouleverse nos connaissances, Paris, Éditions La Découverte, , 601 p. (ISBN 978-2-7071-8878-6, présentation en ligne), p. 57
- (en) Alan Walker et Richard Leakey, The Nariokotome Homo erectus Skeleton, Berlin/Heidelberg/London, Harvard University Press, , 457 p. (ISBN 3-540-56301-6, présentation en ligne)
- (en) Peter B. deMenocal, « African climate change and faunal evolution during the Pliocene-Pleistocene », Earth and Planetary Science Letters, vol. 220, nos 1-2, , p. 3-24 (DOI 10.1016/S0012-821X(04)00003-2).
- Yves Coppens, L'événement de l'(H)Omo, Dossiers du CNRS, lire en ligne.
- [Strait, Grine & Fleagle 2015] (en) David Strait, Frederick Grine et John Fleagle, « Analyzing Hominin Phylogeny : Cladistic Approach », dans Winfried Henke & Ian Tattersall, Handbook of Paleoanthropology, (ISBN 9783642399787, lire en ligne), p. 1989-2014.
- [Meyer et al. 2016] (en) Matthias Meyer et al., « Nuclear DNA sequences from the Middle Pleistocene Sima de los Huesos hominins », Nature, vol. 531, no 7595, , p. 504-507 (DOI 10.1038/nature17405, résumé).
- (en) Jean-Jacques Hublin, Abdelouahed Ben-Ncer, et al., « New fossils from Jebel Irhoud, Morocco and the pan-African origin of Homo sapiens », Nature, vol. 546, no 289, , p. 289–292 (DOI 10.1038/nature22336)
- (en) Israel Hershkovitz et al., « The earliest modern humans outside Africa », Science, vol. 359, no 6374, , p. 456-459 (DOI 10.1126/science.aap8369)
- Boyd et Silk 2003
- Brues et Snow 1965, p. 1–39
- Michel Brunet et al., « A new hominid from the Upper Miocene of Chad, Central Africa », Nature, London, Nature Publishing Group, vol. 418, no 6894, , p. 145–151 (ISSN 0028-0836, PMID 12110880, DOI 10.1038/nature00879, lire en ligne)
- Srivastava 2009, p. 87
- DeSalle et Tattersall 2008, p. 146
- Curry 2008, p. 106–109
- « Study Identifies Energy Efficiency As Reason For Evolution Of Upright Walking », ScienceDaily, Rockville, MD, ScienceDaily, LLC, (lire en ligne, consulté le )
- « Study identifies energy efficiency as reason for evolution of upright walking », sur UANews, Tucson, AZ, The University of Arizona Office of University Communications, (consulté le )
- Michael D. Sockol, David A. Raichlen et Herman Pontzer, « Chimpanzee locomotor energetics and the origin of human bipedalism », Proc. Natl. Acad. Sci. U.S.A., Washington, D.C., National Academy of Sciences, vol. 104, no 30, , p. 12265–12269 (ISSN 0027-8424, PMID 17636134, PMCID 1941460, DOI 10.1073/pnas.0703267104)
- Aiello et Dean 1990
- Kondo 1985
- P. Thomas Schoenemann, « Evolution of the Size and Functional Areas of the Human Brain », Annual Review of Anthropology, Palo Alto, CA, Annual Reviews, vol. 35, , p. 379–406 (ISSN 0084-6570, DOI 10.1146/annurev.anthro.35.081705.123210)
- Patricia McBroom, « Meat-eating was essential for human evolution, says UC Berkeley anthropologist specializing in diet », Berkeley, CA, University of California, Berkeley, (consulté le )
- Neil Mann, « Meat in the human diet: An anthropological perspective », Nutrition & Dietetics, Hoboken, NJ, Wiley-Blackwell, vol. 64, no Supplement s4, , S102–S107 (ISSN 1747-0080, DOI 10.1111/j.1747-0080.2007.00194.x, lire en ligne, consulté le )
- Chris Organ, Charles L. Nunn, Zarin Machanda et Richard W. Wrangham, « Phylogenetic rate shifts in feeding time during the evolution of Homo », Proc. Natl. Acad. Sci. U.S.A., Washington, D.C., National Academy of Sciences, vol. 108, no 35, , p. 14555–14559 (ISSN 0027-8424, PMID 21873223, PMCID 3167533, DOI 10.1073/pnas.1107806108)
- Sébastien Bohler, « Une mutation génétique qui a profité au cerveau d'Homo sapiens », Pour la science, no 473, , p. 8.
- (en) Marta Florio, Takashi Namba, Svante Pääbo, Michael Hiller1 et Wieland B. Huttner, « A single splice site mutation in human-specific ARHGAP11B causes basal progenitor amplification », Science Advances, vol. 2, no 12, , article no 1601941 (DOI 10.1126/sciadv.1601941).
- Min S. Park, Andrew D. Nguyen, Henry E. Aryan, Hoi Sang U, Michael L. Levy et Katerina Semendeferi, « Evolution of the human brain: changing brain size and the fossil record », Neurosurgery, Philadelphia, PA, Lippincott Williams & Wilkins, vol. 60, no 3, , p. 555–562 (ISSN 0148-396X, PMID 17327801, DOI 10.1227/01.NEU.0000249284.54137.32)
- Emiliano Bruner, « Cranial shape and size variation in human evolution: structural and functional perspectives », Child's Nervous System, Heidelberg, Springer-Verlag, vol. 23, no 12, , p. 1357–1365 (ISSN 0256-7040, PMID 17680251, DOI 10.1007/s00381-007-0434-2)
- Richard Potts, « Evolution and Environmental Change in Early Human Prehistory », Annual Review of Anthropology, Palo Alto, CA, Annual Reviews, vol. 41, , p. 151–167 (ISSN 0084-6570, DOI 10.1146/annurev-anthro-092611-145754)
- William R. Leonard, J. Josh Snodgrass et Marcia L. Robertson, « Effects of brain evolution on human nutrition and metabolism », Annual Review of Nutrition, Palo Alto, CA, Annual Reviews, vol. 27, , p. 311–327 (ISSN 0199-9885, PMID 17439362, DOI 10.1146/annurev.nutr.27.061406.093659)
- Robert A. Barton et Chris Venditti, « Rapid Evolution of the Cerebellum in Humans and Other Great Apes », Current Biology, Cambridge, MA, Cell Press, vol. 24, no 20, , p. 2440–2444 (ISSN 0960-9822, DOI 10.1016/j.cub.2014.08.056)
- Anna Starowicz-Filip, Olga Milczarek, Stanisław Kwiatkowski, Barbara Bętkowska-Korpała et Katarzyna Prochwicz, « Cerebellar cognitive affective syndrome CCAS – a case report », Archives of Psychiatry and Psychotherapy, Kraków, Poland, Polish Psychiatric Association, vol. 3, , p. 57–64 (OCLC 220954272, lire en ligne [PDF])
- Feng Yu, Qing-jun Jiang, Xi-yan Sun et Rong-wei Zhang, « A new case of complete primary cerebellar agenesis: clinical and imaging findings in a living patient », Brain, Oxford, UK, Published by Oxford University Press on behalf of the Guarantors of Brain, (ISSN 1460-2156, PMID 25149410, DOI 10.1093/brain/awu239)
- Anne H. Weaver, « Reciprocal evolution of the cerebellum and neocortex in fossil humans », Proc. Natl. Acad. Sci. U.S.A., Washington, D.C., National Academy of Sciences, vol. 102, no 10, , p. 3576–3580 (ISSN 0027-8424, PMID 15731345, PMCID 553338, DOI 10.1073/pnas.0500692102)
- Michel Lorblanchet, « L’origine de l’art », Diogène, no 14, , p. 116-131.
- Manuel Gutierrez et Emmanuelle Honoré, L'Art rupestre d'Afrique. Actualité de la recherche, Editions L'Harmattan, , 326 p..
Bibliographie
- Yves Coppens, L’histoire de l'homme, Odile Jacob, , 256 p. (lire en ligne)
- Pascal Picq, Au commencement était l'homme. De Toumaï à Cro-Magnon, Odile Jacob, , p. 16
- Pascal Picq, Les Origines de l'homme : L'odyssée de l'espèce, Tallandier, 1999, 2005, 2014 (ISBN 978-2-7028-2690-4)
- Robert Thomas Boyd et Joan Silk, L'aventure humaine : Des molécules à la culture, De Boeck, , 583 p. (ISBN 978-2-8041-4333-6, lire en ligne)
- (en) David R. Begun, The real Planet of the Apes : A new Story of human Origins, Princeton University Press, (lire en ligne)
- (en) Rob DeSalle et Ian Tattersall, Human Origins : What Bones and Genomes Tell Us About Ourselves, vol. 13, College Station, TX, Texas A&M University Press, coll. « Texas A&M University Anthropology Series », , 1st éd., 216 p. (ISBN 978-1-58544-567-7, OCLC 144520427)
- (en) R. P. Srivastava, Morphology of the Primates and Human Evolution, New Delhi, PHI Learning Private Limited, , 208 p. (ISBN 978-81-203-3656-8, OCLC 423293609, lire en ligne)
- (en) James R. Curry, Children of God : Children of Earth, Bloomington, IN, (ISBN 978-1-4389-1846-4, OCLC 421466369)
- (en) Wenda R. Trevathan, Human Birth : An Evolutionary Perspective, New Brunswick, NJ, Transaction Publishers, (1re éd. Originally published 1987; New York: Aldine De Gruyter), 268 p. (ISBN 978-1-4128-1502-4, OCLC 669122326)
- (en) Michael P. Muehlenbein, Basics in Human Evolution, Academic Press, , 584 p. (ISBN 978-0-12-802693-9 et 0-12-802693-6, lire en ligne)
- (en) Peter J. Richerson, Sergey Gavrilets et Frans B. M. de Waal, « Modern theories of human evolution foreshadowed by Darwin’s Descent of Man », Science, vol. 372, no 6544, , article no eaba3776 (DOI 10.1126/science.aba3776)
Voir aussi
Articles connexes
Liens externes
- Ressource relative à la littérature :
- Notices dans des dictionnaires ou encyclopédies généralistes :
- « Evolution Figures : Chapter 25 », Cold Spring Harbor Laboratory Press (consulté le ) — Illustrations from the book Evolution (2007)
- « Human Evolution », Smithsonian Institution's Human Origins Program (consulté le )
- « Becoming Human », Arizona State University's Institute of Human Origins (consulté le )
- "First Peoples", Public Broadcasting System, 24 juin 2015
- Lancelet and ancestral body (article : évolution des chordés, patrimoine génétique, découvertes récentes)
- Portail de la Préhistoire
- Portail de la paléontologie
- Portail des primates

