Harmaline
L'harmaline au même titre que l'harmine est un alcaloïde végétal du groupe des harmanes. Il provient notamment des plantes du genre banisteriopsis et possède des propriétés d'antagonistes sérotoninergiques[2]. Combiné à la diméthyltryptamine d'autres plantes, il confère à l'ayahuasca sa propriété hallucinogène.
| Harmaline | |
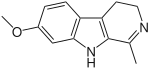
| |
| Structure de l'harmaline | |
| Identification | |
|---|---|
| Nom UICPA | 7-méthoxy-1-méthyl-4,9-dihydro-3H-β-carboline |
| No CAS | |
| No ECHA | 100.005.594 |
| No CE | 206-152-6 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C13H14N2O [Isomères] |
| Masse molaire[1] | 214,263 1 ± 0,012 1 g/mol C 72,87 %, H 6,59 %, N 13,07 %, O 7,47 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
L'harmaline est également le principal alcaloïde du Peganum harmala une plante de la famille des Zygophyllaceae. C'est à partir de cette espèce qu'il fut isolé en 1841.
Pharmacologie
L'harmaline est un IMAO (inhibiteur des monoamine oxydases) légèrement psychodysleptique et analgésique.
Neurotoxicité et source de tremblements
Dans les années 1970, on étudie les effets de l'harmaline sur le tremblement parkinsonien[3].
En 1984, on montre, chez le rat de laboratoire que l'harmaline peut induire des tremblements pathologiques[4].
Quatre décennies d'études ont ensuite confirmé que l'harmaline présente une neurotoxicité quand elle atteint le cervelet) ; elle y cause la perte de cellules neuronales et l'apoptose médiée par la caspase-3 dans les cellules granulaires et purkinje cérébelleuses ainsi que dans les neurones olivaires inférieurs[5], ces lésions induisent un tremblement musculaire expliqué par une action perturbatrice des noyaux olivaires inférieurs (inferior olivary nuclei) accessoires (médian et dorsaux), noyaux situés dans une zone du cerveau à la fois impliquée dans la coordination motrice et l'adaptation[6] et l'apprentissage[7], les fibres grimpantes aux cellules de Purkinje et aux noyaux cérébelleux profonds, puis les motoneurones du tronc cérébral et de la moelle épinière, relayant ensuite ces anomalies vers les muscles[8]. On a montré que les cellules de Purkinje ne sont pas en soi nécessaires pour que le tremblement apparaisse. Les canaux calciques de type T semblent en cause[8].
Ce tremblement, qui évoque le « tremblement essentiel », peut être exacerbé par un traitement stimulant la production de norépinéphrine synaptique ou bloquant les récepteurs ioniques du glutamate. Inversement, les benzodiazépines et le muscimol suppriment les tremblements. L'alcool supprime le tremblement induit par l'harmaline (mais exacerbe les lésions neurales associées à l'harmaline)[8]. Une étude (2011), basée sur un « modèle animal harmaline du tremblement d'action transitoire » a montré qu'outre l'éthanol (qui a aussi des effets toxiques), la mémantine a un certain effet neuroprotecteur (et par suite anti-trémogènes, c'est-à-dire anti-tremblement) sur les neurones cérébelleux et olivaires inférieurs (cette étude a aussi montré que les effets anti-trémogènes et neuroprotecteurs ne se chevauchent pas nécessairement) ; cet effet serait lié au fait que la néantise est un antagoniste des récepteurs NMDA)[5]. On a aussi montré (2012) que le riluzole a des effets comparables à ceux de l'harmaline, « probablement liés à son effet inhibiteur sur la neurotransmission glutamatergique »[9],[10], de même (en 2015)pour le Chlorhydrate de Berbérine[11].
Comme les médicaments actif contre le tremblement essentiel suppriment ou réduisent le tremblement induit par l'harmaline, il a été proposé (en 2012) que l'harmaline puisse être utilisé pour induire un modèle animal de tremblement utile pour des tests précliniques de médicaments anti-tremblements, mais un tel modèle présenterait encore des limites problématiques car lors des les essais cliniques seuls environ 50% des médicaments efficaces contre le tremblement induit par l'harmaline se sont ensuite avérés efficaces contre le tremblement essentiel[8].
Bioinsecticide ?

Une étude a exposé des larves (au 4e stade) du papillon Plodia interpunctella (Lepidoptera), via leur alimentation, à de l'harmaline[12]. Les larves exposées ont présenté une perte de poids, une perte en protéines et en glycogène et une inhibition de l'activité de l'α-amylase, associés à une cytotoxicité sévère. Le microscope révèle une dégradation des cellules épithéliales de l'intestin moyen de la chenille : vacuolisation du cytoplasme ; apparition de nombreuses vésicules autophagiques et de structures lysosomiques ; fragmentation d'une partie du réticulum endoplasmique rugueux ; rupture des microvillosités intestinales, rupture de la membrane plasmique… se traduisant par l'apparition de contenu cytoplasmique dans la lumière de l'intestin moyen. Ces dégâts internes ont tué la plupart des chenilles exposées[12].
Dans la fiction
L'harmaline est évoquée comme étant une substance utilisée dans un complot machiste contre les femmes dans le roman Vic St Val au finish paru en 1975.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Denis Richards Dictionnaire des drogues des toxicomanies et des dépendances, 1999
- Y. Lamarre, M. Dumont et A. J. Joffroy, « [Parkinsonian tremor and the action of harmaline: experimental facts and hypothetical mechanisms] », Archives Italiennes De Biologie, vol. 111, nos 3-4, , p. 493–503 (ISSN 0003-9829, PMID 18847047, lire en ligne, consulté le )
- (en) J.F. Bernard, C. Buisseret-Delmas, C. Compoint et S. Laplante, « Harmaline induced tremor III. A combined simple units, horseradish peroxidase, and 2-deoxyglucose study of the olivocerebellar system in the rat », Experimental Brain Research, vol. 57, no 1, (ISSN 0014-4819 et 1432-1106, DOI 10.1007/BF00231139, lire en ligne, consulté le )
- (en) Pervin K. Iseri, Ayse Karson, Kemal M. Gullu et Ozlem Akman, « The effect of memantine in harmaline-induced tremor and neurodegeneration », Neuropharmacology, vol. 61, no 4, , p. 715–723 (DOI 10.1016/j.neuropharm.2011.05.015, lire en ligne, consulté le )
- T. A. Martin, J. G. Keating, H. P. Goodkin et A. J. Bastian, « Throwing while looking through prisms: I. Focal olivocerebellar lesions impair adaptation », Brain, vol. 119, no 4, , p. 1183–1198 (ISSN 0006-8950 et 1460-2156, DOI 10.1093/brain/119.4.1183, lire en ligne, consulté le )
- Nicolas Schweighofer, Eric J. Lang et Mitsuo Kawato, « Role of the olivo-cerebellar complex in motor learning and control », Frontiers in Neural Circuits, vol. 7, (ISSN 1662-5110, DOI 10.3389/fncir.2013.00094, lire en ligne, consulté le )
- Adrian Handforth, « Harmaline Tremor: Underlying Mechanisms in a Potential Animal Model of Essential Tremor », Tremor and Other Hyperkinetic Movements, vol. 2, no 0, , p. 02 (ISSN 2160-8288, PMID 23440018, PMCID PMC3572699, DOI 10.5334/tohm.108, lire en ligne, consulté le )
- (en) Fatemeh Rahimi Shourmasti, Iran Goudarzi, Taghi Lashkarbolouki et Kataneh Abrari, « Effects of riluzole on harmaline induced tremor and ataxia in rats: Biochemical, histological and behavioral studies », European Journal of Pharmacology, vol. 695, nos 1-3, , p. 40–47 (DOI 10.1016/j.ejphar.2012.08.014, lire en ligne, consulté le )
- Fatemeh Rahimi Shourmasti, Iran Goudarzi, Kataneh Abrari et Mahmoud Elahdadi Salmani, « Riluzole Ameliorates Harmaline-induced Tremor in Rat », Basic and Clinical Neuroscience, vol. 5, no 2, , p. 138–143 (ISSN 2008-126X, PMID 25337372, PMCID 4202586, lire en ligne, consulté le )
- (en) Zohreh Vaziri, Hassan Abbassian, Vahid Sheibani et Masoud Haghani, « The therapeutic potential of Berberine chloride hydrate against harmaline-induced motor impairments in a rat model of tremor », Neuroscience Letters, vol. 590, , p. 84–90 (DOI 10.1016/j.neulet.2015.01.078, lire en ligne, consulté le )
- (en) Kacem Rharrabe, Ahmed Bakrim, Naima Ghailani et Fouad Sayah, « Bioinsecticidal effect of harmaline on Plodia interpunctella development (Lepidoptera: Pyralidae) », Pesticide Biochemistry and Physiology, vol. 89, no 2, , p. 137-145 (ISSN 0048-3575, DOI 10.1016/j.pestbp.2007.05.002).
Articles connexes
- Portail de la chimie
- Portail de la pharmacie