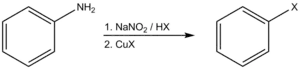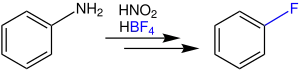Halogénure d'aryle
En chimie organique, les halogénures d'aryle ou halogénoarènes sont une classe de composés organiques dérivés des arènes (hydrocarbures aromatiques) où au moins l'un des atomes d'hydrogène a été substitué par un atome d'halogène (fluor, chlore, brome ou iode). Ils sont à ce titre un cas particulier des halogénures aromatiques qui comportent au moins un halogène et un cycle aromatique, mais pas nécessairement un halogène sur le cycle aromatique.
Les halogénure d'aryle se distinguent des halogénures d'alkyle par des propriétés et des méthodes de préparation différentes. Le sous-groupe le plus étudié et avec le plus de composés ayant une utilisation courante est sans doute celui des chlorures d'aryle.
Halogénobenzènes
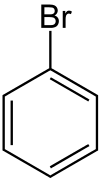
Les composés les plus simples appartenant à cette famille sont les halogénobenzènes ou monohalogénobenzènes, les dérivés halogénés du benzène.
| Représentation | 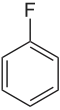 |
 |
 |
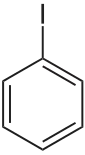 |
| Nom | Fluorobenzène | Chlorobenzène | Bromobenzène | Iodobenzène |
| Point de fusion | −42 °C[1] | −45,2 °C[2] | −31 °C[3] | −29 °C[4] |
| Point d'ébullition | 85 °C[1] | 132 °C[2] | 156 °C[3] | 188 °C[4] |
| Modèle compact |  |
 |
 |
 |
Propriétés physiques
Les monohalogénobenzènes sont des liquides incolores, dont les points d'ébullition augmentent fortement avec la masse molaire. A contrario, les points de fusion varient moins brutalement, le chlorobenzène ayant même un point de fusion légèrement plus faible que celui du fluorobenzène (−45,2 °C contre −42 °C).
Propriétés chimiques
Une réaction caractéristique des halogénures d'aryle, et des halogénobenzènes en particulier, est la substitution nucléophile aromatique.
Les halogénures d'aryle peuvent réagir avec la magnésium pour former les réactifs de Grignard (organomagnésiens mixtes) correspondants.
Synthèse
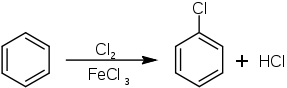
Le chlorobenzène et le bromobenzène peuvent être obtenus par halogénation du benzène, respectivement en présence de dichlore ou de dibrome, et d'un acide de Lewis.
Ce type de réaction ne fonctionne par contre pas avec le fluor, beaucoup trop réactif, produisant entre autres des composés multifluorés, ni avec l'iode qui au contraire n'est pas assez réactif.
Le chlorobenzène, le bromobenzène et l'iodobenzène peuvent être obtenus par réaction de Sandmeyer, à partir de l'aniline et de sels de cuivre halogénés :
Le fluorobenzène peut lui être produit par la réaction de Balz-Schiemann :
Dihalogénobenzènes
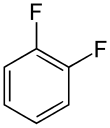
Il existe dix composés dérivés dihalogénés du benzène. Chacun de ces composés existe sous la forme de trois isomères, ortho, méta et para.
| Fluorobenzène (–F) | Chlorobenzène (–Cl) | Bromobenzène (–Br) | Iodobenzène (–I) | |
| Fluorobenzène (–F) | Difluorobenzène | Chlorofluorobenzène | Bromofluorobenzène | Fluoroiodobenzène |
 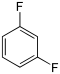 | 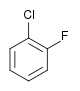 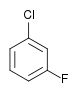 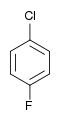 | 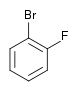 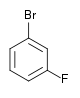 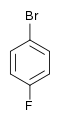 | 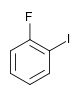 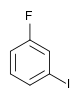 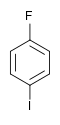 | |
| Chlorobenzène (–Cl) | Dichlorobenzène | Bromochlorobenzène | Chloroiodobenzène | |
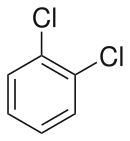 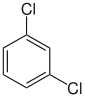 | 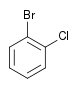 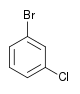 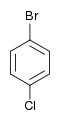 | 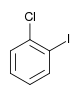 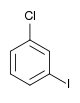 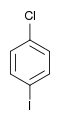 | ||
| Bromobenzène (–Br) | Dibromobenzène | Bromoiodobenzène | ||
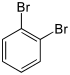 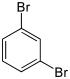 | 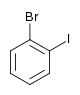 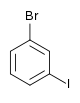 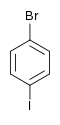 | |||
| Iodobenzène (–I) | Diiodobenzène | |||
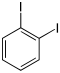 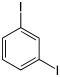 | ||||
Halogénobenzènes avec d'autres groupes fonctionnels
Les dérivés du benzène avec des groupes fonctionnels classiques, tels que le phénol (groupe hydroxyle), l'aniline (groupe amine), l'anisole (groupe méthoxyle), le toluène (groupe méthyle), le nitrobenzène (groupe nitro), l'alcool benzylique (groupe hydroxyméthyle), le benzaldéhyde (groupe carbonyle), l'acide benzoïque, peuvent aussi être substitués par un halogène. En général, le nom du dérivé est simplement celui du composé parent précédé du préfixe halogéno-. Lorsqu'il s'agit d'un benzène disubstitué, il existe sous la forme des trois isomères ortho, méta et para.
Du fait de l'effet -I de l'halogène, les halogénophénols et les acides halogénobenzoïques ont une acidité plus élevée comparée au composé non halogéné, et ont donc un pKA plus faible (phénol : 9,99[5], halogénophénol : 9,06[6], acide benzoïque : 4,20[5], acide halogénobenzoïque : 3,58[6]).
| –F | –Cl | –Br | –I | |
|---|---|---|---|---|
| Phénol (–OH) | Fluorophénol | Chlorophénol | Bromophénol | Iodophénol |
| Aniline (–NH2) | Fluoroaniline | Chloroaniline | Bromoaniline | Iodoaniline |
| Anisole (–OCH3) | Fluoroanisole | Chloroanisole | Bromoanisole | Iodoanisole |
| Toluène (–CH3) | Fluorotoluène | Chlorotoluène | Bromotoluène | Iodotoluène |
| Nitrobenzène (–NO2) | Fluoronitrobenzène | Chloronitrobenzène | Bromonitrobenzène | Iodonitrobenzène |
| Alcool benzylique (–CH2OH) | Alcool fluorobenzylique | Alcool chlorobenzylique | Alcool bromobenzylique | Alcool iodobenzylique |
| Benzaldéhyde (–CHO) | Fluorobenzaldéhyde | Chlorobenzaldéhyde | Bromobenzaldéhyde | Iodobenzaldéhyde |
| Acide benzoïque (–COOH) | Acide fluorobenzoïque | Acide chlorobenzoïque | Acide bromobenzoïque | Acide iodobenzoïque |
Notes et références
- Entrée « Fluorbenzene » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 29 juillet 2019 (JavaScript nécessaire)
- Entrée « Chlorbenzene » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 29 juillet 2019 (JavaScript nécessaire)
- Entrée « Brombenzene » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 29 juillet 2019 (JavaScript nécessaire)
- Fiche Sigma-Aldrich du composé Iodbenzene, consultée le 29 juillet 2019.
- CRC Handbook of Tables for Organic Compound Identification, 3e éd., 1984 (ISBN 0-8493-0303-6).
- Moyenne des pKA des différents dérivés, donnée pour comparaison. Les composés ortho où l'halogène est le plus proche de l'autre substituant, et où donc l'effet -I est le plus fort, sont les plus acides, l'effet étant tendanciellement croissant avec la masse atomique.
- Portail de la chimie