Radioisotope
Radionucléide, radioélément
- Un radionucléide (contraction de radioactivité et de nucléide) est un nucléide radioactif, c'est-à-dire qui est instable et peut donc se décomposer en émettant un rayonnement.
- Un radioisotope (contraction de radioactivité et d'isotope) est un isotope radioactif (parce que son noyau est un radionucléide).
- Un radioélément (contraction de radioactivité et d'élément) est un élément chimique dont tous les isotopes connus sont des radioisotopes.
Cette instabilité peut être due à un excès de protons ou de neutrons, voire des deux. Les radioisotopes existent naturellement mais peuvent aussi être produits artificiellement par une réaction nucléaire.
Lors d'une catastrophe nucléaire (telle que la catastrophe de Tchernobyl) ou lors d'une explosion atomique (telle qu'un essai nucléaire), une grande quantité de radionucléides sont propulsés dans l'atmosphère, se propagent autour du globe terrestre et retombent plus ou moins rapidement sur le sol.
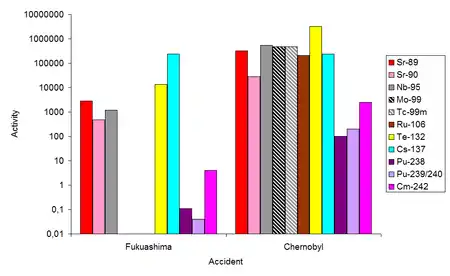
Utilisation des radioisotopes
Depuis la seconde moitié du XXe siècle, un nombre croissant de radionucléides est produit dans le monde pour la médecine et divers usages techniques (traçage isotopique, etc.)[1].
En médecine nucléaire
Les radioisotopes sont largement utilisés à des fins de diagnostic ou de recherche. Les radioisotopes présents naturellement ou introduits dans le corps, émettent des rayons gamma et, après détection et traitement des résultats, fournissent des informations sur l'anatomie de la personne et sur le fonctionnement de certains organes spécifiques. Lorsqu'ils sont utilisés ainsi les radioisotopes sont appelés traceurs.
La radiothérapie utilise aussi des radioisotopes dans le traitement de certaines maladies comme le cancer. Des sources puissantes de rayons gamma sont aussi utilisées pour stériliser le matériel médical.
Dans les pays occidentaux, environ une personne sur deux est susceptible de bénéficier de la médecine nucléaire au cours de sa vie, et la stérilisation par irradiation gamma est quasiment universellement utilisée.
Dans l'industrie
Les radioisotopes peuvent être utilisés pour examiner les soudures, détecter les fuites, étudier la fatigue des métaux et analyser des matériaux ou des minéraux. Ils sont aussi utilisés pour suivre et analyser les polluants, étudier les mouvements des eaux de surface, mesurer l'écoulement de la pluie et de la neige, ainsi que le débit des cours d'eau[réf. nécessaire].
De nombreux détecteurs de fumées utilisent un radioisotope dérivé du plutonium ou de l'américium produit artificiellement, ainsi que certains paratonnerres[2]. Ceux-là ont été interdits en France par un décret d'avril 2002, promulgué par le gouvernement Jospin et « relatif à la protection générale des personnes contre les dangers des rayonnements ionisants », conduisant au retrait du marché de plus de 7 millions de détecteurs de fumées d'ici 2015[3].
Un arrêté du 5 mai 2009, promulgué par le gouvernement Fillon et pris après avis défavorable de l'Autorité de sûreté nucléaire, permettrait toutefois l'usage de produits contenant des radionucléides dans les biens de consommation[4].
Dans l'environnement
On trouve aujourd'hui dans l'environnement et la biosphère des radioisotopes naturels et artificiels (principalement issus des mines d'uranium, de la combustion de certains combustibles fossiles, de déchets industriels (ex : phosphogypse) de la médecine nucléaire…, mais surtout des retombées des armes nucléaires et essais nucléaires (dans les années 1950 et 1960), de l'industrie nucléaire, et du retraitement des déchets radioactifs ou des accidents nucléaires). Ils sont parfois utilisés comme « radiotraceurs » pour l'étude de la cinétique de la radioactivité artificielle dans l'environnement ou le secteur agroalimentaire[5]. Ils peuvent localement poser des problèmes, parfois sérieux et durables de contamination de l'air, de l'eau, du sol ou des écosystèmes.
La cinétique environnementale des radionucléides est complexe et dépend de nombreux facteurs. Elle varie pour chaque famille de radio-éléments, dans l'environnement et dans les organismes (de nombreux radioéléments ont des affinités propres en termes de ligands, protéines-cibles ou organes-cibles et par suite un comportement différent dans le métabolisme ; par exemple l'iode radioactif est essentiellement concentré par la thyroïde). Dans ce cadre, l'étude des analogues chimiques apporte aussi des renseignements utiles.
Pour étudier ces questions on se base sur le traçage environnemental des radionucléides, ainsi que sur des dosages faits in situ pour la cartographie des contaminations, l'évaluation des risques directs ou le calage de modèles[6]). On essaye aussi de comprendre le comportement de chaque type de radionucléide, via des modélisations, encore incertaines, notamment basées sur des matrices d'interaction, méthode semi-quantitative facilitant l'identification et la hiérarchisation des multiples interactions (dont relations de type cause à effet) entre composantes biotiques et abiotiques de l'écosystème[6]. C'est ainsi qu'on a par exemple étudié la migration de radiocésium dans les écosystème prairiaux touché par les retombées de Tchernobyl en césium 137[6]. Ces matrices d'interaction ont dans le même temps permis d'explorer les changements dynamiques dans les voies de migration du césium et de comparer les conséquences des différentes voies d'exposition de rayonnement pour les organismes vivants[6]. ce travail doit être effectué pour tous les compartiments des écosystèmes. La migration du césium est par exemple très différente en plaine (lessivage intense) et en forêt où les champignons peuvent fortement le bioaccumuler, le remonter en surface (bioturbation) où il est alors biodisponible pour les sangliers, écureuils ou autres animaux (ou humains) mycophages.
La bioaccumulation et bioconcentration de certains radionucléides est possible en mer où les invertébrés fouisseurs et les animaux filtreurs (moules pour l'iode par exemple) jouent un rôle important dans la concentration de certains radioéléments. Sur terre où le nombre et la quantité de radionucléide artificiel a beaucoup augmenté à partir des années 1950 environ, puis après la catastrophe de Tchernobyl[5], ce sont les champignons (parfois symbiotes obligatoires de certaines plantes, arbres notamment via la mycorhization) qui peuvent également fortement les bioconcentrer ou les remobiliser. On s'en est aperçu dans les années 1960 en comptant et étudiant des taux croissants de radioactivité de certains horizons organiques de sols forestiers qui se sont avérés liés essentiellement à la biomasse fongique[7]. La compréhension du rôle des champignons s'améliore grâce à des modèles plus précis, notamment pour le radiocésium dans les écosystèmes forestiers[8]. L'activité fongique joue un rôle pivot dans la matrice d'interaction des éléments radioactifs du sol avec le vivant, via la chaine alimentaire (Réseau trophique). Ils sont l'un des « régulateurs » les plus importants connus du mouvement biotique des radionucléides dans les sols (de la mobilisation à la bioconcentration en passant par la bioturbation)[9].
Période radioactive des radioisotopes
Notes et références
- T.J. Ruth, B.D. Pate, R. Robertson, J.K. Porter, Radionuclide production for the biosciences Review Article International Journal of Radiation Applications and Instrumentation. Part B. Nuclear Medicine and Biology, Volume 16, Issue 4, 1989, Pages 323-336 (lien (article payant))
- Demande d'enlèvement des paratonnerres radioactifs. ANDRA
- Philippe Defawe, 7 millions de détecteurs ioniques de fumée doivent être retirés d'ici 2015, Le Moniteur, 24 novembre 2008
- Bientôt de la radioactivité dans nos objets de consommation ?, Rue89, 8 janvier 2010
- Jim Smith, Nick Beresford, G. George Shaw and Leif Moberg, Radioactivity in terrestrial ecosystems ; Springer Praxis Books, 2005, Chernobyl — Catastrophe and Consequences, p. 81-137 (Introduction)
- H. R. Velasco, J. J. Ayub, M. Belli and U. Sansone (2006), Interaction matrices as a first step toward a general model of radionuclide cycling: Application to the 137Cs behavior in a grassland ecosystem ; Journal of Radioanalytical and Nuclear Chemistry vol. 268, no 3, p. 503-509, DOI: 10.1007/s10967-006-0198-2 résumé
- Osburn 1967
- Avila et Moberg, 1999
- John Dighton, Tatyana Tugay and Nelli Zhdanova, Interactions of Fungi and Radionuclides in Soil ; Soil Biology, 1, Volume 13, Microbiology of Extreme Soils, Soil Biology, 2008, vol. 13, no 3, p. 333-355, DOI: 10.1007/978-3-540-74231-9_16, (Résumé)
Voir aussi
Bibliographie
- Monika Krysta (2006) Modélisation numérique et assimilation de données de la dispersion de radionucléides en champ proche et à échelle continentale, Thèse de doctorat de l’Université Paris XII - Val de Marne ; 2006-09-14 PDF, 196 pages
Articles connexes
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| 8 | 119 | 120 | * | ||||||||||||||||||||||||||||||
| * | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||
| Métaux Alcalins |
Alcalino- terreux |
Lanthanides | Métaux de transition |
Métaux pauvres |
Métal- loïdes |
Non- métaux |
Halo- gènes |
Gaz nobles |
Éléments non classés |
| Actinides | |||||||||
| Superactinides | |||||||||
- Portail de la physique
- Portail de la chimie