Lévamisole
Le lévamisole est un produit chimique, dérivé de l'imidazothiazole, essentiellement utilisé en médecine vétérinaire comme anthelminthique (pesticide antiparasitaire immunomodulateur ciblant les vers intestinaux et les strongles pulmonaires).
| Lévamisole | |
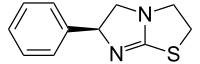
| |
| Identification | |
|---|---|
| Nom UICPA | (S)-6-phényl-2,3,5,6-tétrahydroimidazo[2,1-b][1,3]thiazole |
| Synonymes |
Decazole, Ergamisol, Levasole, L-tétramisole, Tramisole, Vermisole[1] |
| No CAS | |
| No ECHA | 100.035.290 |
| Code ATC | P02 « QP52AE01 » |
| DrugBank | DB00848 |
| PubChem | 26879 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C11H12N2S |
| Masse molaire[2] | 204,291 ± 0,015 g/mol C 64,67 %, H 5,92 %, N 13,71 %, S 15,7 %, |
| Données pharmacocinétiques | |
| Métabolisme | hépatique |
| Demi-vie d’élim. | 4,4-5,6 h (biphasique) |
| Considérations thérapeutiques | |
| Voie d’administration | orale |
| Unités du SI et CNTP, sauf indication contraire. | |
Le lévamisole fait partie de la liste des médicaments essentiels de l'Organisation mondiale de la santé (OMS)[3].
Utilisations
En médecine vétérinaire
Il est généralement vendu sous forme de chlorhydrate de lévamisole (soluble dans l'eau), par exemple sous le nom d'Ergamisol (R12564), ou de Bianminthic 5 % (largement utilisé pour vermifuger les bovins, ovins, porcins, volailles).
Lévamisole est aussi utilisé avec succès par les aquariophiles pour traiter les poissons tropicaux contre des vers Camallanus[4].
Le tétramizole est toxique chez les félins[5].
En médecine humaine
Dans le respect d'un encadrement strict, il est utilisé chez l'homme contre :
- la polyarthrite rhumatoïde[6] ;
- le cancer du côlon, le mélanome ou des cancers touchant la tête et le cou, mais toujours en association avec d'autres chimiothérapies (ex : avec le fluorouracil) ;
Il a montré une certaine activité (autant que le tétramisole) contre la leucémie dans certaines des études ayant porté sur des lignées cellulaires leucémiques. Une seule étude lui a trouvé un effet de stimulation immunitaire[7].
Il a toutefois été interdit pour les usages humains aux États-Unis (en 2000) et au Canada (en 2003), en raison d'effets secondaires graves (agranulocytose, appauvrissement sévère en globules blancs rendant les patients vulnérables à des infections), et parce que d'autres médicaments sont disponibles.
En France, il fait l'objet de fortes restrictions depuis 1998. Ce produit n'est plus délivré que dans les pharmacies hospitalières, en cas de maladies rares (comme le syndrome néphrotique idiopathique de l'enfant[8],[9],[10] et seulement dans le cadre d'une ATU (autorisation temporaire d'utilisation, accordée par l'AFSSAPS à titre nominatif)[11].
En agriculture
Dans le monde, il reste massivement utilisé en agriculture (élevage), proposé par une centaine d'industriels[12] sous plus de 160 noms commerciaux différents selon les pays et les usages[12] et souvent vendu combiné à des pesticides (ex :benzimidazole[13], oxfendazole, albendazole[14], abamectine[12], pipérazine[12] ,oxfendazole[12], oxyclozanide[12], niclosamide[12], fenbendazole[12], sélénate de Sodium[12], rafoxanide, etc.)
Classification
Il est classé parmi les antihelminthiques cholinergiques, car ciblant les récepteurs nicotiniques de l'acétylcholine situés sur les cellules somatiques musculaires des helminthes ; il les bloque, ce qui cause une paralysie musculaire chez ces vers.
Toxicité et santé publique
Cette molécule pose un problème émergeant de santé publique, et même un double problème :
Phénomènes de résistance
Dans les années 1980 (et peut-être plus tôt), des phénomènes préoccupants[15] de résistance à divers antihelminthiques[16] sont apparus chez des souches mutantes[17] de diverses espèces d'helminthes parasites des animaux d'élevage (par exemple chez : Caenorhabditis elegans chez lequel un groupe de gènes responsables d'une extrême résistance à ce pesticide a été identifié[18]).
Ces résistances apparaissent dans les élevages où les vermifuges sont très utilisés. Il faut alors utiliser d'autres médicaments et comprendre pour les contourner si cela est possible, l'origine de ces résistances. Des études récentes ont montré que les helminthes disposent de plusieurs récepteurs nicotiniques et que ces derniers sont le produit de plusieurs gènes ; Ils sont en outre modulés par plusieurs autres protéines. Des mutations peuvent toucher un ou plusieurs gènes et altérer les gènes codant les récepteurs ou les protéines modulatrices. Le contexte de l'élevage industriel peut induire une sélection naturelle des souches les plus résistantes et, à terme, diminuer la sensibilité des helminthes à ce biocide (ainsi qu'à d'autres pesticides cholinergiques).
Détournement comme produit dopant
Lors d'opérations de dépistage de produits dopants faites à la fin des années 2010 chez les chevaux de course au Royaume-Uni, des analyses d'urine ont montré que le lévamisole produisait chez les équins deux métabolites, la pémoline et l'aminorex qui sont des produits dopants interdits[19],[20],[21].
Détournement de la molécule par le trafic de stupéfiants
Depuis 2003 surtout, le lévamisole est retrouvé[22] en quantité importante dans la cocaïne. Ce problème a d'abord été identifié aux USA puis ailleurs dans le monde ; en 2009, la Drug Enforcement Administration ( DEA ) a estimé que 69 % de la cocaïne saisie aux États-Unis contenaient déjà du lévamisole en entrant sur le territoire, alors que moins de 5 % de la cocaïne saisie 2 ans avant (en 2007) en contenait.
Au Québec, l'Institut national de santé publique du Québec (INSPQ) a constaté que sur "un échantillon de dix individus décédés en et positifs pour la benzoylecgonine sanguine (métabolite de la cocaïne), huit démontraient une présence concomitante de lévamisole sanguin" [23]. Une autre étude, basée sur un échantillon de 100 individus, a permis aux chercheurs de détecter "dans 53 cas sur 100 la présence concomitante de lévamisole, principalement lorsque la cocaïne est encore présente et qu’elle n’est pas complètement métabolisée en benzoylecgonine et en d’autres métabolites"[23].
En France, selon le Système d’Identification National des Substances et Toxiques SINTES, en 2008, 29 % des échantillons de cocaïne en contenaient.
Or, associée à la cocaïne, cette substance peut provoquer des troubles graves à mortels (neutropénies, purpura pouvant évoluer en lésions nécrotiques apparaissant quelques semaines après la consommation de cocaïne contenant du lévamisole)[24]. Comme on l'avait observé sur certains effets secondaires du médicament, l'oreille[25],[26], et en particulier le lobe de l'oreille, fait souvent partie (mais pas toujours) des zones touchées par une vascularite nécrosante[27], de même que les joues, les arcs zygomatiques et les membres inférieurs. Les deux complications médicales les plus fréquemment rapportées par les médecins sont hématologiques et vasculaires[28],[29] (140 cas de neutropénie sur 203 cas étudiés) et dermatologiques (rash et/ou nécrose de la peau[30] dans 84 cas sur 203), elles apparaissent souvent conjointement[31].
On a d'abord supposé que ce lévamisole était introduit dans la cocaïne par les fabricants ou des dealers comme adultérant (c'est-à-dire pour « couper » la drogue). Ce produit est trop utilisé pour être un simple adultérant ; des travaux récents ont montré qu'il présente les caractéristiques d'un additif chimique psychoactif qui pourrait encore augmenter la dépendance du cocaïnomane au produit[31] ; Ce produit augmente en effet la neurotransmission noradrénergique en inhibant la recapture[31], il agit sur les récepteurs nicotiniques ganglionnaires et il est partiellement métabolisé en un composé de type amphétamine[31] ; il semble aussi pouvoir augmenter la production d'opioïdes endogènes et la concentration de dopamine dans le circuit de la récompense cérébrale[31].
Le traitement de ces nécroses est difficile car elles peuvent s'étendre sur une grande partie du corps. Elles doivent être stabilisées (par des excisions) avant toute greffe de peau (autogreffe). De plus, la nécrose peut aussi parfois atteindre le cartilage (nez, oreille fréquemment)[32], et l'os ce qui conduit à l'amputation si le système vasculaire est trop dégradé[30].
Une autre molécule, la phénacétine (qui est également un médicament toxique, ayant aussi été utilisé contre la polyarthrite rhumatoïde), est de plus en plus fréquemment détectée comme adultérant de la cocaïne[33].
Chimie
Le lévamisole, isomère(-) du tétramisole : c'est un dérivé synthétique de l'imidazothiazole, découvert en 1966 dans le laboratoire belge Janssen Pharmaceutica qui l'a d'abord préparé sous la forme de son racémate (dit Tétramisole).
Les deux stéréo-isomères de ce tétramisole ont ensuite été synthétisés, et l'isomère lévogyre a été nommé lévamisole.
Principe thérapeutique
Le lévamisole est un principe actif, il agit en paralysant les muscles des nématodes sensibles[34]. Plus précisément, il augmente le tonus musculaire axial du ver, provoquant sa paralysie[35]. Ne pouvant plus se fixer aux muqueuses, les vers sont éjectés grâce au péristaltisme intestinal, habituellement dans les 24 heures qui suivent le traitement[36]. En cas d'infestation grave, le traitement peut être renouvelé.
Pour augmenter son efficacité, le lévamisole est souvent associé à des excipients : en médecine vétérinaire, la molécule est ainsi associée à du Propylène glycol (E1520)[37], de l'Hypophosphite de sodium[37], de l'Acétate d'ammonium (E264)[37], de l'Acide chlorhydrique et de l'eau purifiée[37].
Métabolisation et cinétique dans l'organisme
Le lévamisole est rapidement et presque totalement résorbé dans le tractus digestif[38].
Le pic de concentration plasmatique est atteint après 2 heures [38].
La demi-vie plasmatique est d'environ 4 heures[38].
Ce médicament est métabolisé dans une très large proportion au niveau du foie, et il est excrété dans les urines, en partie inchangé et en partie sous forme de métabolites[38]. On pouvait donc le retrouver dans les égouts, et on le trouve dans les urines de bovins, ovins, caprins où il pourrait avoir un effet écotoxique sur les invertébrés du sol et de la strate herbacée, comme d'autres antihelminthiques.
Indications
Attention, les autorisations de mise sur le marché et d'utilisation diffèrent selon les pays. La réglementation peut être révisée en fonction de données toxicologiques ou écotoxicologiques nouvelles.
Chez l'homme
- Traitement de l’ascaridiase et des infestations mixtes à ascaris et à ankylostomes.
- certaines maladies rares.
Chez l'animal
En France, ce produit est autorisé depuis 1986[39] en prophylaxie et comme traitement curatif d'infections gastro-intestinales et d' « infestations vermineuses pulmonaires » chez différents animaux d'élevage (bovins, moutons, chèvres, volailles, porcs)[37], et accessoirement chez certains animaux de compagnie.
Les parasites ciblés sont les suivants :
Chez les bovins, ovins
Nématodes gastro-intestinaux :
- Trichostrongylus spp ;
- Cooperia spp ;
- Ostertagia ostertagi (sauf larves inhibées) ;
- Haemonchus spp ;
- Nematodirus spp ;
- Bunostomum spp ;
- Oesophagostomum spp ;
- Chabertia ovina (mouton).
Strongles pulmonaires :
- Dictyocaulus viviparus.
Chez les porcins
Nématodes gastro-intestinaux :
- Ascaris suum ;
- Strongyloïdes ransomi ;
- Oesophagostomum spp ;
Strongles pulmonaires : (?)
- Metastrongylus spp.
Chez les volailles
- Ascaridia spp ;
- Hétérakis spp ;
- Capillaria spp ;
- Amidostomum anseris (chez l'oie).
Posologie (et délai d'attente)
À titre indicatif, quand et là où ce produit est provisoirement et nominativement autorisé, pour une administration par voie orale : la posologie de 2,5 mg/kg ou 7,5 ml chez l'homme.
Chez les Bovins, veaux, moutons et chèvres, la dose prescrite par 200 kg de poids de corps pendant 1 jour est de 1 litre par 2 000 litres d’eau de boisson pendant 1 jour pour la volaille ou le porc.
Après le traitement, la viande et le lait ne doivent pas être utilisés, le temps que le produit soit entièrement métabolisé. Chez la vache, après un traitement, le délai d'attente est de :
- 10 jours pour la viande ;
- 4 jours pour le lait .
Contre-indications
Chez la femme enceinte, il est recommandé d'éviter d'administrer le lévamisole durant le premier trimestre de la grossesse, même si ce produit est réputé non tératogène[36].
Chez l'animal, les vétérinaires recommandent de ne pas utiliser cette molécule :
- chez les femelles laitières ;
- chez les volailles pondeuses ;
- chez les animaux souffrant de diminution des fonctions hépatiques ;
- en association avec le pyrantel, morantel ou du phosphate organique.
Traitement d'une intoxication par le lévamisole
En cas de surdose ingérée, il est possible de traiter par vomitif et lavage gastrique, mais ceci doit être fait rapidement (le plus tôt possible dans les premières heures après ingestion du produit[38]. En complément, un traitement symptomatique et de soutien est associé)[38].
Toxicité
Comme la plupart des médicaments, ce produit est toxique au-delà d'une certaine dose, mais sa toxicité peut être renforcée dans certaines conditions (contexte inflammatoire, association avec de la cocaïne).
Quand il est utilisé seul et comme médicament (et en cas de surdosage), des effets secondaires et indésirables ont été signalés :
- douleurs abdominales ;
- douleurs musculaires ;
- nausées ;
- vomissements ;
- diarrhée ;
- hyperpnée ;
- spasmes ;
- larmoiement ;
- sudation ;
- toux ;
- plaies buccales ;
- éruption cutanée;
- salivation excessive ;
- céphalées ;
- effets neurologiques ;
- leucoencéphalopathie multifocale (MIL)[40] ;
- étourdissements ;
- fatigue ;
- perte d'appétit ;
- altération du goût ;
- altération de l'odorat ;
- excitation ;
- Encéphalopathie[41] ;
- psychose[41].
- Associé à la cocaïne, ce produit peut occasionner des troubles graves, hématologiques (neutropénie notamment), et dermatologiques (éruption cutanée, et dans les cas les plus graves de très larges nécroses de la peau[42], qui devient violacée puis noirâtre au niveau du nez, des lobes et du tour des oreilles, sur le torse et les membres ;
- Tératogénicité : d'après les données d'expérimentation animale disponibles, ce produit n'est pas tératogène.
En cas de survenue de syndrome pseudo-grippal (fièvre, frissons, faiblesse, maux de gorge), une consultation médicale est nécessaire, et une prise en charge par les services d'urgence dans les cas plus graves.
Analyse
Le lévamisole peut être détecté et dosé dans les fluides biologiques par :
- chromatographie en phase gazeuse[43],[44] ;
- chromatographie en phase liquide[45],[46] ;
- spectrométrie de masse[47], éventuellement en association [48] avec la chromatographie en phase liquide.
Il est stable dans le plasma durant 1 semaine à -18 °C (Sari et al., 2006).
Producteurs
De très nombreux groupes industriels et laboratoires produisent et commercialisent cette molécule, dont (en 2013[12]) au moins (par ordre alphabétique) :
- A.A.-Vet
- ACI
- Acme
- Aesculaap
- Afrivet
- Agri Laboratories
- Allfarm Animal Health
- Ancare
- Animal Health
- Animax Ltd
- Animedic
- AstraZeneca
- Bagó
- Bayer
- Bayer Animal
- Bayer Animal Health
- Bayer Australia Ltd Animal Health
- Bayer Sanità Animale
- Biofaktor
- Bio-Pharma
- Bomac
- Bomac Animal Health
- Casa dos Cereais
- Ceva
- Ceva Animal Health
- Chanelle
- Chanelle Animal Health
- Chemifarma
- Chevita
- Cipla
- Cipla Agrimed
- CM Laboratories P/L
- Comércio International de Biocidas
- Coopers Animal Health ;
- Coophavet
- CPPharma
- Divasa Farmavic de Portugal
- Dopharma
- Drwalewskie Zaklady Przemyslu Bioweterynaryjnego
- Eng City
- Eurovet
- Experto Vet
- Flamingo Pharmacueticals
- Fort Dodge Animale Health
- Gedeon Richter
- GlaxoSmithKline
- Guilin
- Health & Nutrition
- Hofman-Lieve
- Ibercare Lda
- Interchem
- Intervet
- IVX (USA)
- Janssen
- Janssen Animal Health;
- Janssen Pharmaceutica
- Janssen-Cilag Ltd
- Lundbeck
- Jurox
- Kela
- Kommer
- Laboratoires Biové
- Laboratoires Moureau
- Lafedar
- Li Taka Pharmaceuticals
- Lundbeck
- Mavlab
- Merial Ancare
- New Chemical
- Norbrook
- Norbrook Laboratories
- Novartis Animal Health
- Novartis Santé Animale
- Novartis Tiergesundheit
- Omega Pharma France vet
- Opsonin
- Provet
- Qalian
- Schering-Plough Animal Health
- Schippers
- Serumber
- Shou Chan
- Shyh Dar
- Sineiro C.I.
- Sogeval
- Stock Distributors
- Sykes Vet International
- Teknofarma
- Unibios Laboratories
- Unique Pharmaceuticals
- V.M.D
- Vee-Service
- Vetem
- Vetem Spa
- Vetoquinol Biowet;
- Virbac
- Western Stock Distributors
- Wilshire
- Zhaohui
Divers
Le lévamisole fait partie de la liste des médicaments essentiels de l'Organisation mondiale de la santé (liste mise à jour en )[49].
Notes et références
- biomedical publications fiche Levamisole, PDF, P 901
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- WHO Model List of Essential Medicines, 18th list, avril 2013
- Shari Sanford, « Levamisole Hydrochloride: Its application and usage in freshwater aquariums », Loaches Online, (consulté le )
- Roger Wolter et Clémentine Jean-Philippe, « Les intoxications alimentaires », dans Alimentation du chat, Le Point Vétérinaire, , 287 p. (ISBN 978-2-86326-326-6 et 2-86326-326-9, OCLC 893487230, lire en ligne), p. 65-80.
- Jonathan Graf (2013), Rheumatic Manifestations of Cocaine Use ; Current Opinion in Rheumatology. ;25(1):50-55
- Sadigh-Eteghad S, khayat-Nuri H, Abadi N, Ghavami S, Golabi M, Shanebandi D, « Synergetic effects of oral administration of levamisole and Echinacea purpurea on immune response in Wistar rat », Res Vet Sci., vol. 91, no 1, , p. 82–5 (PMID 20797737, DOI 10.1016/j.rvsc.2010.07.027)
- British Association for Paediatric Nephrology (1991) Levamisole for corticosteroid-dependent nephrotic syndrome in childhood. Lancet ;337(8757):1555-7
- Davin JC, Merkus MP. (2005), Levamisole in steroid-sensitive nephrotic syndrome of childhood: the lost paradise ? Pediatr Nephrol ;20(1):10-4.
- [www.has-sante.fr Haute Autorité de Santé], (2008) Protocole national de diagnostic et de soins pour une maladie rare, avril 2008, PDF, 26p
- par exemple, 18 ATU ont été délivrées en 2009 pour l’hôpital des enfants de Nancy cf http://www.has-sante.fr/portail/upload/docs/application/pdf/2009-12/rencontres_09_-_diaporama_tr17.pdf (voir pp 54/71)
- cf sur le site drugs.com, données sur Levamisole
- ex : Bayer COMBIMAX LV Levamisole, consulté 2013-09-21
- Bayer, Bayer launches 13 new livestock products, consulté 2013-09-21
- Sangster NC.(1999), Anthelmintic resistance: past, present and future ; Int J Parasitol ; Jan; 29(1):115-24; discussion 137-8
- Sangster N. (1996), Pharmacology of anthelmintic resistance, Parasitology ;113 Suppl:S201-16.
- Lewis JA, Wu CH, Levine JH, Berg H. Levamisole-resistant mutants of the nematode Caenorhabditis elegans appear to lack pharmacological acetylcholine receptors. Neuroscience. 1980;5(6):967–989.
- Lewis JA, Wu CH, Levine JH, Berg H (1980), Levamisole-resistant mutants of the nematode Caenorhabditis elegans appear to lack pharmacological acetylcholine receptors, Neuroscience. 1980;5(6):967-89.
- J. Guiterrez et al. (2010) "Pemoline and tetramasole 'positives' in English racehorses following levamisole administration." Irish Veterinary Journal 63:8 498-500.
- E.N. Ho et al. (2009) "Aminorex and rexamino as metabolites of levamisole in the horse." Anal Chem Acta. 638(1); 58-68.
- J. Scarth et al. (2010) "The use of in vitro drug metabolism studies to complement, reduce and refine in vivo administrations in medication and doping control." Proceedings of the 18th International Conference of Racing Analyists and Veterinarians. pp 213-222
- Casale JF, Corbeil EM, Hays PA (2008) Identification of levamisole impurities found in illicit cocaine exhibits. Microgram J 2008;6:82-89
- PA Dubé, « Présence de lévamisole chez les utilisateurs de cocaïne », Bulletin d’information toxicologique, (lire en ligne).
- Medscape France, Cocaïne et héroïne coupées au lévamisole expédient les usagers aux urgences « Copie archivée » (version du 25 septembre 2013 sur l'Internet Archive)
- Trevor T. Muirhead, M.D., et Melody J. Eide, M.D., M.P.H. (2011), Toxic Effects of Levamisole in a Cocaine User ; N Engl J Med 2011; 364:e52 2011-06-16 ; DOI: 10.1056/NEJMicm1008722 résumé, et illustrations
- Chung C, Tumeh PC, Birnbaum R, Tan BH, Sharp L, McCoy E, Mercurio MG, Craft N. (2011), Characteristic purpura of the ears, vasculitis, and neutropenia - a potential public health epidemic associated with levamisole-adulterated cocaine. J Am Acad Dermatol. oct. 2011 ; 65(4):722-5. Epub 2011 Jun 11
- Bradford M, Rosenberg B, Moreno J, Dumyati G. (2010), Bilateral necrosis of earlobes and cheeks: another complication of cocaine contaminated with levamisole Ann Intern Med. 2010 Jun 1; 152(11):758-9 (Lien PubMed)
- Pearson T, Bremmer M, Cohen J, Driscoll M. (2012), Vasculopathy related to cocaine adulterated with levamisole : A review of the literature ; Dermatol Online J. 15 juillet 2012 ; 18(7):1. Epub 2012 Jul 15.
- Espinoza LR, Perez Alamino R. (2012), Cocaine-induced vasculitis: clinical and immunological spectrum ; Curr Rheumatol Rep. 2012 Dec; 14(6):532-8.
- Ching JA, Smith DJ Jr. J (2012), Levamisole-induced necrosis of skin, soft tissue, and bone: case report and review of literature ; Burn Care Res. janv-fev 2012 ; 33(1):e1-5
- Clin Toxicol (Phila). avril 2012 ;50(4):231-41. doi:10.3109/15563650.2012.665455. Larocque A, Hoffman RS (2012), Levamisole in cocaine: unexpected news from an old acquaintance (résumé)
- Arora NP, Jain T, Bhanot R, Natesan SK. (2012), Levamisole-induced leukocytoclastic vasculitis and neutropenia in a patient with cocaine use: an extensive case with necrosis of skin, soft tissue, and cartilage Addict Sci Clin Pract. 2012-09-24; 7(1):19. Epub:2012-09-24. (résumé et illustrations)
- OFDT et CEIP DE CAEN, Phénacétine : Produit de coupe de la cocaïne en augmentation. Note d’information SINTES du 21 décembre 2007, Saint-Denis, OFDT, 2007, PDF, 6 p
- Mode of action of levamisole and pyrantel, anthelmintic resistance, E153 and Q57. Martin RJ, Robertson AP. Parasitology. 2007; 134(Pt 8):1093-104 (résumé).
- Interchemie Leva-200 Oral ; Solution pour administration par voie orale
- IRCP, ANMV, ANSES, Index des Médicaments vétérinaires autorisés en France, consulté 2013-09-21
- Fiches modèles OMS d'information a l'usage des prescripteurs : Médicaments utilisés en parasitologie - Deuxième édition (1997; 160 pages)
- Autorisation de mise sur le marché : 14/02/1986 ; date de mise à jour RCP : 23/11/2010
- Blanc PD, Chin C, Lynch KL. (2012), Multifocal inflammatory leukoencephalopathy associated with cocaine abuse: is levamisole responsible ? Clin Toxicol (Phila). Jul; 50(6):534-5; author reply 536. Epub 2012 Jun 18 ;
- J.J. Jeffries et S. Cammisuli. (1998), Psychosis secondary to long-term levamisole therapy. Ann. Pharmacother. 32: 134–135, .
- Mouzakis J, Somboonwit C, Lakshmi S, Rumbak M, Sinnott J, Cherpelis B, Keshishian J. (2011), Levamisole induced necrosis of the skin and neutropenia following intranasal cocaine use: a newly recognized syndrome. J Drugs Dermatol. 2011 Oct; 10(10):1204-7.
- F. Rousseau, J.M. Haquenoer, D. Lesieur et A.P. Gamot. Gas-chromatographic determination of levamisole in human plasma-normalization and reliability of the method. Eur. J. Drug Metab. Pharmacokin. 6: 281–288, 1981
- E. Kouassi, G. Caille, L. Lery et al. (1986), Novel assay and pharmacokinetics of levamisole and p-hydroxylevamisole in human plasma and urine. Biopharm. Drug Disp. 7: 71–89.
- T.F. Vandamme, M. Demoustier et B. Rollmann. (1995) Quantitation of levamisole in plasma using high performance liquid chromatography. Eur. J. Drug Metab. Pharmacokin. 20: 145–149,
- S. Marriner, E.A. Galbraith et J.A. Bogan (1980), Determination of the anthelmintic levamisole in plasma and gastro-intestinal fluids by high-performance liquid chromatography. Analyst 105: 993–996
- P. Sari, J. Sun, M. Razzak et I.G. Tucker. (2006) HPLC assay of levamisole and abamectin in sheep plasma for application to pharmacokinetic studies. J. Liq. Chrom. Rel. Tech. 29: 2277–2290
- G. Dowling et L. Regan. (2011) A new mixed mode solid phase extraction strategy for opioids, cocaines, amphetamines and adulterants in human blood with hybrid liquid chromatography tandem mass spectrometry detection. J. Pharm. Biomed. Anal. 54: 1136–1145
- WHO Model List of Essential Medicines, 18th list, avril 2013
Voir aussi
Articles connexes
Liens externes
- (fr) Site de la mission interministérielle de lutte contre la drogue et la toxicomanie
- (fr) Site de l'Observatoire français des drogues et des toxicomanies
- (fr) Site du Centre de recherches et de traitements des addictions; centre de référence cocaïne
- (en) Site de l'Observatoire européen des drogues et des toxicomanies
- (en) Publication de l'Observatoire européen des drogues et des toxicomanies (OEDT) sur le trafic de cocaïne en Europe (avril 2010)
Illustrations externes
Bibliographie
- (en) Farmer RW, Malhotra PS, Mays MP, Egger ME, Smith JW, Jortani SA, Spiller H, Bosse GM, Callen JP, Franklin GA. (2012), Necrotizing peripheral vasculitis/vasculopathy following the use of cocaine laced with levamisole. J Burn Care Res. 2012 Jan-Feb; 33(1):e6-e11.
- Portail de la médecine
- Portail de la chimie
- Portail de la parasitologie
- Portail de l’élevage
- Portail de la médecine vétérinaire