Propellane
Les propellanes sont une classe d'hydrocarbures saturés ou alcanes tricycliques c'est-à-dire avec deux atomes de carbone tête de pont et quatre branches qui les relient dont une branche ne comportant aucun atome. Ils sont définis et nommés [m.n.p]propellane en référence à leur nom systématique, tricyclo[m.n.p. 01,m+2]alcane[1], avec le terme propellane qui dérive de l'anglais « propeller », du fait de leur ressemblance avec une « hélice » et avec le suffixe ane des alcanes.
Ils sont caractérisés, pour les plus petits d'entre eux, par la présence d'une géométrie dite en tétraèdre inversé (pyramidale) sur les carbone en tête de pont et donc par de fortes contraintes angulaires et stériques qui les rendent très réactifs. C'est pour ces raisons qu'ils sont beaucoup étudiés par la chimie organique. Les plus simples propellanes sont le [1.1.1]propellane (C5H6) et [2.2.2]propellane (C8H12).
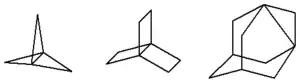
Les propellanes sont une classe particulière de paddlanes pour lesquels une branche est égale à zéro : [m.n.o]propellane = [m.n.o.0]paddlane.
Les 1,3-déshydroadamantanes sont de fait des [3.3.1]propellanes de la famille de l'adamantane.
Liaison
La liaison carbone-carbone centrale du [1.1.1]propellane qui connecte deux carbones de symétrie pyramidale a une longueur de 160 pm (154 pm pour une liaison C-C non contrainte). L'énergie de cette liaison est encore disputée et varie de 270-250 kJ/mol (59–65 kcal/mol) à 0, c'est-à-dire totalement non liante. Cependant, l'énergie du biradical est calculé être 335 kJ/mol (80 kcal/mol) plus haut. Récemment, le type de cette liaison dans cette molécule est expliqué en termes de charge-shift bonding[2].
D'autre part, étonnamment, le [1.1.1]propellane le plus contraint est beaucoup plus stable que les autres petits propellanes comme les [2.1.1], [2.2.1], [2.2.2], [3.2.1], [3.1.1] et [4.1.1][3].
[1.1.1]Propellane
Le [1.1.1]propellane de numéro CAS , a été synthétisé pour la première fois en 1982[4] en convertissant le 1,3 diacide carboxylique du bicyclo[1.1.1]pentane 1.1 via une réaction de Hunsdiecker en le dibromure correspondant 1.2 suivie d'une réaction de couplage avec le n-butyllithium comme représenté sur le schéma 1. Le produit est isolé par chromatographie sur colonne à −30 °C.
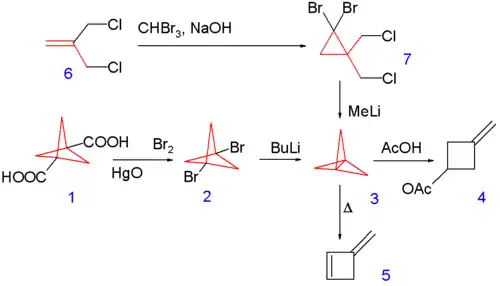 Schéma 1. Synthèse du [1.1.1]propellane
Schéma 1. Synthèse du [1.1.1]propellane
une autre voie de synthèse commence avec l'addition du dibromocarbène sur la double liaison du 3-chloro-2-(chlorométhyl)propène 1.6 suivie par une déprotonation avec le méthyl lithium et une substitution nucléophile dans 1.7[5] qui n'est pas isolé mais gardé en solution à −196 °C.
L'instabilité de ce propellane est mise en évidence par son isomérisation thermique en 3-méthylène-cyclobutène 1.5 (à 114 °C avec un temps de demi-vie de 5 minutes) et par sa réaction spontanée avec l'acide acétique vers un cyclobutane 1.4.
L'énergie de contrainte est estimée à 427 kJ/mol (102 kcal/mol).
Polymérisation
Le [1.1.1]propellane est un monomère pour la réaction de polymérisation vers les [n]staffanes[6]. Une polymérisation radicalaire initiée par le formiate de méthyle et l'anhydre benzoïque peroxyle forme une distribution d'oligomères (schéma 2) mais une polymérisation par « addition anionique » avec le n-butyllithium forme un vrai polymère. La diffraction X de ce polymère montre que la liaison C-C qui connecte les monomères n'est longue que de 148 pm.
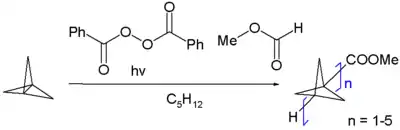 Schéma 2. Synthèse des staffanes
Schéma 2. Synthèse des staffanes
[2.2.2]Propellane
La synthèse de l'homologue suivant, le [2.2.2]propellane de numéro CAS , par le groupe de Philip Eaton, célèbre pour sa synthèse du cubane, précède celle du [1.1.1]propellane (1973)[7]. La synthèse[8] (schéma 3) consiste en deux réactions de réarrangement de Wolff.
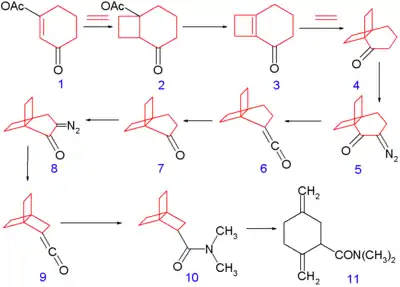 Schéma 3. Synthèse du squelette du [2.2.2]propellane
Schéma 3. Synthèse du squelette du [2.2.2]propellane
Ce propellane est aussi instable. À température ambiante, son temps de demi-vie par rapport à son isomérisation en l'amide alicyclique 3.11 est de 28 minutes. Son énergie de contrainte est estimée à 390 kJ/mol (93 kcal/mol).
Autres propellanes
- le [2.1.1]propellane, C6H8, numéro CAS , a été détecté par spectroscopie infrarouge à 30 K mais n'a pas isolé comme une molécule stable à température ambiante. Il semble qu'elle polymérise à 50 K. Les atomes de carbone en tête de pont ont une géométrie tétraédrique inversée et l'énergie de contrainte est estimée à plus de 106 kcal/mol[9].
- le [2.2.1]propellane, C7H10, numéro CAS , obtenu par une déshalogénation en phase gazeuse avec des atomes de métal alcalin, n'est stable qu'en matrice gazeuse à moins de 50 K. Il s'oligomérise et polymérise à plus haute température. L'énergie de contrainte libérée par clivage de la liaison centrale est estimée à 75 kcal/mol[10].
- le [3.1.1]propellane, C7H10, numéro CAS , est isolable[3],[11],[12].
- le [3.2.1]propellane ou tricyclo[3.2.1.01,5]octane, C8H12, numéro CAS , est aussi isolable. Il a aussi les atomes de carbone en tête de pont avec un géométrie tétraédrique inversée et une énergie de contrainte estimée à 60 kcal/mol. Il est remarquablement résistant à la thermolyse mais polymérise dans l'éther diphénylique avec une demi-vie d'environ 20 heures à 195 °C. Il réagit spontanément avec l'oxygène de l'air à température ambiante en donnant un copolymère avec des ponts –O–O–, peroxyde[13],[14],[15],[16],[17].
- le [4.1.1]propellane, C8H12, numéro CAS , est isolable[3],[18],[19],[20].
- le [3.3.3]propellane, C11H18, numéro CAS , est un solide stable qui fond à 130 °C. Il a été synthétisé par Robert W. Weber et James M. Cook qui ont mis au point une voie de synthèse générale pour tous les propellanes de la forme [n,3,3] avec n ≥ 3[21] :
La cyclo-n-ane-1,2-dione réagit avec le 3-cétoglutarate de diméthyle dans une solution aqueuse tampon citrate-phosphate acide pour donner la propellanedione tétraester méthyle correspondante avec un rendement de 70 à 95 %. Cette dernière subit une hydrolyse acide de ses fonctions ester puis une décarboxylation (rendement de plus de 80 %) et finalement via une réduction de Wolff-Kishner qui a un rendement de 50 %, fournit le [n,3,3]propellane correspondant avec un rendement total depuis le composé de départ de l'ordre de 60 %.
- le [4.3.3]propellane, C12H20, numéro CAS , est un solide stable qui fond à 100-101 °C[21].
- le [6.3.3]propellane, C14H24, numéro CAS , est un liquide huileux qui bout sous pression ambiante à 275-277 °C[21].
- le [10.3.3]propellane, C18H32, numéro CAS , est un solide stable qui se sublime à 33-34 °C[22].
1,3-Déshydroadamantanes
Le 1,3-déshydroadamantane ou tétracyclo[3.3.1.13,7.01,3]décane est abusivement[23] appelé un [3.3.1]propellane de la famille de l'adamantane. Il peut être préparé par oxydation des 1,3-dihalo-adamantanes[24] et est aussi instable que les autres propellanes à petits cycles. En solution, le composé réagit avec l'oxygène (temps de demi-vie 6 heures) pour former un peroxyde qui se convertit en di-hydroxyde par réaction avec le tétrahydruroaluminate de lithium (LiAlH4).
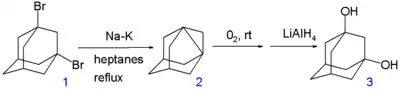 Schéma 4. Synthèse du 1,3-déshydroadamantane
Schéma 4. Synthèse du 1,3-déshydroadamantane
Polymérisation
Étant un propellane, le déshydroadamantane peut polymériser. Dans le schéma 4, il réagit avec l'acrylonitrile (cyanure de vinyle) pour une réaction de polymérisation radicalaire initié par le lithium métal dans le tétrahydrofuranne (THF). Le copolymère résultant est un polymère alterné avec une température de transition vitreuse de 217 °C[25].
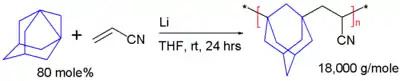 Schéma 5. Polymérisation du 1,3-déshydroadamantane
Schéma 5. Polymérisation du 1,3-déshydroadamantane
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « propellane » (voir la liste des auteurs).
- Nomenclature IUPAC
- The Inverted Bond in [1.1.1]Propellane is a Charge-Shift Bond, Wei Wu, Pr, Junjing Gu, Jinshuai Song, Sason Shaik, Philippe C. Hiberty, Angew. Chem. Int. Ed., 2009, 48, p. 1407 –1410. DOI:10.1002/anie.200804965
- Josef Michl, George J. Radziszewski, John W. Downing, Kenneth B. Wiberg, Frederick H. Walker, Robert D. Miller, Peter Kovacic, Mikolaj Jawdosiuk, Vlasta Bonačić-Koutecký, Highly strained single and double bonds, Pure & Appl. Chem., 1983, vol. 55(2), pp. 315–321. DOI:10.1351/pac198855020315.
- Kenneth B. Wiberg et Frederick H. Walker, [1.1.1]Propellane, J. Am. Chem. Soc., 1982, 104(19), p. 5239-5240. DOI:10.1021/ja00383a046
- Organic Syntheses, Coll. vol. 10, p. 658 (2004), vol. 75, p. 98 (1998). Online article
- Piotr Kaszynski et Josef Michl, [n]Staffanes: a molecular-size « Tinkertoy » construction set for nanotechnology. Preparation of end-functionalized telomers and a polymer of [1.1.1]propellane, J. Am. Chem. Soc., 1988, 110(15), p. 5225-5226. DOI:10.1021/ja00223a070
- Philip E. Eaton et George H. Temme, [2.2.2]Propellane system, J. Am. Chem. Soc., 1973, 95(22), p. 7508-7510. DOI:10.1021/ja00803a052
- Séquence de réactions : cycloaddition [2+2] photochimique d'éthylène sur le système cyclohexène 1 vers 2 suivie par une réaction d'élimination de l'acide acétique avec le t-butanolate de potassium vers le nouveau système cyclohexène 3 suivie par une autre cycloaddition de l'éthylène vers 4. Ce composé est converti en la cétone diazo 5 par déprotonation (acide acétique, méthanolate de sodium) et réaction avec l'azoture de tosyl et qui alors subit un réarrangement de Wolff vers la cétène 6. Une ozonolyse forme la cétone 7 et une autre séquence de diazotation et de réarrangement forme le [2.2.2]propellane avec un substituant diméthyl-amide 10 après la réaction du cétène final 9 avec la diméthylamine.
- Oliver Jarosch, GünterSzeimies, Thermal Behavior of [2.1.1]Propellane: A DFT/Ab Initio Study, J. Org. Chem., 2003, vol. 68(10), pp. 3797–3801. DOI:10.1021/jo020741d.
- Frederick H. Walker, Kenneth B. Wiberg, Josef Michl, [2.2.1]Propellane, J. Am. Chem. Soc., 1982, vol. 104, p. 2056. DOI:10.1021/ja00371a059.
- Paul G. Gassman, Gary S. Proehl, [3.1.1]Propellane, J. Am. Chem. Soc., 1980, vol. 102(22), pp. 6862–6863. DOI:10.1021/ja00542a040.
- Katica Mlinaric-Majerski, Zdenko Majerski, 2,4-Methano-2,4-dehydroadamantane. A [3.1.1]propellane, J. Am. Chem. Soc., 1980, vol. 102(4), pp. 1418–1419.DOI:10.1021/ja00524a033.
- Kenneth B. Wiberg, George J. Burgmaier, Tricyclo[3.2.1.01,5]octane, Tetrahedron Letters, 1969, vol. 10(5), pp. 317–319. DOI:10.1016/s0040-4039(01)87681-4.
- Paul G. Gassman, Alwin Topp, John W. Keller, Tricyclo[3.2.1.01,5]octane – a highly strained "propellerane", Tetrahedron Letters, 1969, vol. 10(14), pp. 1093–1095. DOI:10.1016/s0040-4039(01)97748-2.
- Kenneth B. Wiberg, George J. Burgmaier, Tricyclo[3.2.1.01,5]octane. A 3,2,1-Propellane, J. Am. Chem. Soc., 1972, vol. 94(21), pp. 7396–7401. DOI:10.1021/ja00776a022.
- Donald H. Aue, R. Norman Reynolds, Reactions of a highly strained propellane. Tetracyclo[4.2.1.12,5.01,6]decane, J. Org. Chem., 1974, vol. 39(15), pp. 2315–2316. DOI:10.1021/jo00929a051.
- Kenneth B. Wiberg, William E. Pratt, William F. Bailey, Reaction of 1,4-diiodonorbornane, 1,4-diiodobicyclo[2.2.2]octane, and 1,5-diiodobicyclo[3.2.1]octane with butyllithium. Convenient preparative routes to the [2.2.2]- and [3.2.1]propellanes, J. Am. Chem. Soc., 1977, vol. 99, pp. 2297–2302. DOI:10.1021/ja00449a045.
- David P. G. Hamon, V. Craige Trenerry, Carbenoid insertion reactions: formation of [4.1.1]propellane, J. Am. Chem. Soc., 1981, vol. 103, pp. 4962–4965. DOI:10.1021/ja00406a059.
- Ursula Szeimies-Seebach, Joachim Harnish, Günter Szeimies, Maurice Van Meerssche, Gabriel Germain, Jean-Paul Declerq, Existence of a New C6H6 Isomer: Tricyclo[3.1.0.02,6]hex-1(6)-ene, Angew. Chem. Int. Ed. Engl., 1978, vol. 17(11), pp. 848–850. DOI:10.1002/anie.197808481.
- Ursula Szeimies-Seebach, Günter Szeimies, A facile route to the [4.1.1]propellane system, J. Am. Chem. Soc., 1978, vol. 100, pp. 3966–3967. DOI:10.1021/ja00480a072.
- Robert W. Weber, James M. Cook, General method for the synthesis of [n.3.3]propellanes, n ≥ 3, Can. J. Chem., 1978, vol. 56, pp. 189–192. DOI:10.1139/v78-030.
- S. Yang, James M. Cook, Reactions of dicarbonyl compounds with dimethyl β-ketoglutarate: II. Simple synthesis of compounds of the [10.3.3]- and [6.3.3]-propellane series, J. Org. Chem., 1976, vol. 41(11), pp. 1903–1907. DOI:10.1021/jo00873a004.
- puisqu'il est tétracyclo contrairement aux propellanes qui sont tricyclo par définition.
- Richard E. Pincock et Edward J. Torupka, Tetracyclo[3.3.1.13,7.01,3]decane. Highly reactive 1,3-dehydro derivative of adamantane, J. Am. Chem. Soc., 1969, 91(16), p. 4593-4593. DOI:10.1021/ja01044a072
- Shin-ichi Matsuoka, Naoto Ogiwara et Takashi Ishizone, Formation of Alternating Copolymers via Spontaneous Copolymerization of 1,3-Dehydroadamantane with Electron-Deficient Vinyl Monomers, J. Am. Chem. Soc., 2006, 128(27), p. 8708-8709. DOI:10.1021/ja062157i
- Portail de la chimie
propellanes.svg.png.webp)