تنكس فصي جبهي صدغي
التنكّس الفصّي الجبهيّ الصدغيّ وهو عملية مرضيّة تحدث في الخرف الجبهي الصدغي. وتتّسم بضمور في الفصّ الجبهيّ والفصّ الصّدغي، مع الحفاظ على فص جداري وفص قذالي طبيعيين. ثمّة العديد من العيوب التي تحدث في البروتينات في هذا العملية، منها تراكم بروتينات Tau و TARDBPs. أيضا من الأمور الرئيسي التي تحدث هي الطفرات في جين C9orf72، كما يحدث أيضا اختلال في جينات GRN و MAPT.[2]
| Frontotemporal lobar degeneration | |
|---|---|
| معلومات عامة | |
| الاختصاص | طب نفسي، طب الجهاز العصبي |
| من أنواع | التنكس، وتحلل عصبي |
| الوبائيات | |
| انتشار المرض | 0.000008 [1] |
التصنيف
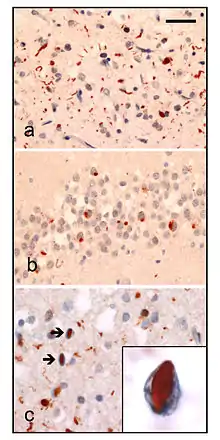
| صورة تحليل عصبي لنسيج مريض مصاب بftd-ldp. تُظهر الكيمياء الهستوليجية المناعية لليوبيكويتين في حالات FTD-LDP صبغ ال |
|---|
| (a) :المحاور العصبية و المشتملات العصبية في السيتوبلازم في superficial cerebral neocortex |
| (b): المشتملات العصبية في السيتوبلازم في hippocampal dentate granule cells |
| (c):مشتملات عصبية داخل انوية خلايا القشرة الدماغية |
| شريط المقاييس: (a) and (b) 40 μm, (c) 25 μm, insert 6 μm. |
هناك 3 أنماط هيستولوجيّة نجدها بعد موت المريض المصاب:
- FTLD-Tau: يتّسم بوجود مُشتَملات (tau positive Inclusions) – و هي مشتملات تحتوي على تراكمات من البروتين tau المختل (غير وظيفي) - داخل الخلية تُسَمّى ب أجسام بيك (Pick-bodies). من الأمثلة على هذا النمط: مرض بيك (Pick’s disease) والتنكس القشري القاعدي (Corticobasal degeneration) والشلل فوق النوى المترقي (Progressive supranuclear palsy).
- FTLD-TDP: يتّسم بوجود اليوبيكويتين (Ubiquitin) و TDP-43، وبعد وجود Tau كالنوع السابق، هنالك مشتملات موجودة في الخلايا تمتاز بانها لا تحتوي على تراكمات من بروتين tau المختل و لكنها تحتوي على تراكمات من البروتين fus المختل و تدعى هذه المشتملات (tau negative,fus positive inclusions). إنّ الصفات الهيستولوجية لهذا النوع متغيرة ومتنوعة جدا مما جعلنا نقسّم هذا النوع إلى 4 أقسام فرعية أيضا، تبعا للصفات الدقيقة التي نجدها هيستولوجيّا:
- النوع الأول: يحتوي على التهابات عصبية طويلة تشمل القشرة السطحية، لكن لا توجد – أو يندر وجود- مشتملات في الخلايا العصبية أو الدّبقية.
- النوع الثاني: يحتوي على العديد من المشتملات الموجودة في سيتوبلازم الخلايا العصبية والدبقية في الطبقات السطحية والعميقة من القشرة، لكن يندر أو يغيب عنه المشتملات الموجودة داخل انوية الخلايا العصبية.
- النوع الثالث: يحتوي على التهابات عصبية ومشتملات داخل سيتوبلازم الخلايا العصبية في طبقات العلوية السطحية من القشرة، كما توجد مشتملات تشبه الأشرطة داخل انوية الخلايا العصبية (bar-like intranuclear inclusion).و عادة ما يرتبط هذا النوع من FTLD-TDP مع طفرات C9ORF72.
- النوع الرابع: يحتوي على مشتملات داخل انوية الخلايا العصبية والتهابات عصبية ; كما تظهر تشوهات في محاور الخلايا العصبية، وغياب للمشتملات في الطبقة الحُبيبِيّة من الحصين (Hippocampus). ويحتوي على طفرات VCP.
تحليل لنسيج الدماغ من مرضى FTLD-TDP.
a: التهاب عصبي ومشتملات عصبية في الطبقة السطحية من القشرة.
b: مشتملات عصبية في الطبقة الحبيبية من الحصين.
c: مشتملات عصبية داخل النواة في القشرة.
- FTLD-FUS: يحتوي على مشتملات داخل الخلايا وداخل النواة ، و هذه المشتملات تمتاز بوجود تراكمات من البروتين FUS المختل (بروتين يرتبط بال RNA) ، و كما توجد هذه التراكمات على شكل خيوط في محاور الخلايا العصبية. ولوحظ وجود هذه المشتملات في القشرة والحصين وخلايا الحركة في نخاع العظم والعصب القحفي الثاني عشر.
أمّا الخَرَف الذي لا يحتوي على صفات هيستولوجية مميزة (DLDH) فيحدث في حالات نادرة ومثيرة للجدل. والتحليلات الجديدة جعلتنا نصنّف الكثير من الحالات التي كانت تعتبر (DLDH) ضمن التصنيف السابق.
الجينات
حدث الكثير من التقدّم مؤخرا في وصف الأسباب الجينية للتنكس الفصّي الجبهي الصدغي (FTLD)، والمرض المشابه (التصلّب الجانبيّ الضّموريّ).
- طفرات في جين Tau تنتج FTLD-Tau.[3] وهناك أكثر من 40 نوع طفرة من هذا النمط.
- طفرات في جين بروجرانيولين (Progranulin) تنتج FTLD-TDP43. وتنتج هذه الطفرات تقليلا في إنتاج البروجرانيولين إلى النصف.[4]
- طفرات في جين CHMP2B تنتج متلازمات سلوكية نادرة مقاربة ل bvFTLD. ولا يتواجد في هذه الحالات ال tau ولا FUS. ولكن اليوبيكويتونين يكون موجودا.
- طفرات في جين VCP تنتج FTLD-TDP43 وتتواجد مع متلازمة IBMPFD (الخرف الجبهي الصدغي ومرض باجيت).[5]
- طفرات فيجين TDP-43 و هي نادرا ما تسبب FTLD مع أنها تتواجد في بعض أنواعه.[6] لكنها سبب أكثر شيوعا للتصلب الجانبي الضموري (ALS).
جميع هذه الطفرات المذكورة أعلاه تسبّب جزءا صغيرا جدا من طيف أمراض التنكس الفصّي الجبهيّ الصدغيّ (FTLD). فمعظم الحالات تكون فُراديّة (بلا سبب جينيّ معلوم).
- تمّ ربط مجموعة من حالات ال FTLD-TDP43 (والذين معهم ALS أيضا) بمنطقة معينة في الكروموسوم 9. وتم تحديد المنطقة المسؤولة بالضبط بجين C9ORF72. ثمّة تضخم في تكرارات معينة في تسلسل الجين تسبّب هذا المرض. وهذا الأمر وُجد في نسبة كبيرة من الحالات العائلية والفراديّة، وخاصة في الشعب الفنلندي.[7]
التشخيص
تستخدم صورة الرنين المغناطيسي (MRI) والتوصير المقطعي بإصدار البوزيترون بهدف التشخيص. وتقيس الطريقتان السابقتان إما ضمور أو نقص في استعمال الجلوكوز. وتتّسم الثلاث أنماط الفرعية للتنكس الفصي الجبهي الصدغي (وهي الخرف الجبهي الصدغي، وخرف دلالة الرموز، ومرض الحُبسة الكلامية المتقدم) بخلل ما في شبكات عصبية معينة.[8] أما الخرف الجبهي الصدغي، فيصيب بشكل رئيسي الشبكة الجبهية الوسيطيّة (يؤثر على المعرفة الاجتماعية). وخرف دلالة الرموز يصيب المنطقة السفلية من الصدغيّة واللوزتين (يؤثر على المعرفة التصوّرية والاجتماعية). وأخيرا، الحُبسة الكلامية المتقدم يصيب جميع الشبكة الجبهية الصدغية الموجودة على اليسار (يؤثر على السمع والنطق).
مراجع
- المؤلف: James B. Rowe، Ian Coyle-Gilchrist و Carol Brayne — العنوان : Prevalence, characteristics, and survival of frontotemporal lobar degeneration syndromes — نشر في: Neurology — المجلد: 86 — الصفحة: 1736-1743 — العدد: 18 — https://dx.doi.org/10.1212/WNL.0000000000002638 — https://pubmed.ncbi.nlm.nih.gov/27037234 — https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4854589
- van der Zee, Julie; Van Broeckhoven, Christine (7 January 2014). "Dementia in 2013: Frontotemporal lobar degeneration—building on breakthroughs". Nature Reviews Neurology 10 (2): 70–72. doi:10.1038/nrneurol.2013.270. ببمد 24394289.
- Goedert, M. et al. (1989). "Cloning and sequencing of the cDNA encoding an isoform of microtubule-associated protein tau containing four tandem repeats: differential expression of tau protein mRNAs in human brain.". EMBO 8 (2): 393–9.Goedert, M. et al. (1989). "Cloning and sequencing of the cDNA encoding an isoform of microtubule-associated protein tau containing four tandem repeats: differential expression of tau protein mRNAs in human brain.". EMBO 8 (2): 393–9.
- Cruts, M., et al., (2006). "Null mutations in progranulin cause ubiquitin-positive frontotemporal dementia linked to chromosome 17q21.". Nature 442 (7105): 920–4.doi:10.1038/nature05017. ببمد 16862115.
- Kimonis, V.E., et al., (2008). "VCP disease associated with myopathy, Paget disease of bone and frontotemporal dementia: review of a unique disorder.". BiochimBiophysActa, 1782 (12): 744–8. doi:10.1016/j.bbadis.2008.09.003.
- Borroni, B., et al., (2010). "TARDBP mutations in frontotemporal lobar degeneration: frequency, clinical features, and disease course". Rejuvenation Res 13 (5): 509–17.doi:10.1089/rej.2010.1017.
- Dejesus-Hernandez, M., et al., (2011). "Expanded GGGGCC Hexanucleotide Repeat in Noncoding Region of C9ORF72 Causes Chromosome 9p-Linked FTD and ALS.". Neuron 72 (2): 245–56. doi:10.1016/j.neuron.2011.09.011. PMC 3202986. ببمد 21944778.
- Schroeter ML, Raczka KK, Neumann J, von Cramon DY (2007). "Towards a nosology for frontotemporal lobar degenerations – A meta-analysis involving 267 subjects.". NeuroImage 36 (3): 497–510. doi:10.1016/j.neuroimage.2007.03.024. ببمد 17478101.
- بوابة طب