حمض البيروفيك
حمض البيروفيك هو أبسط الأحماض الكيتونية ألفا. وبذلك فهو حامل لمجموعتين وظيفيتين، إحداهما كربوكسيلية والأخرى كيتونية، ومكون من ثلاث ذرات كربون. ويلعب دور هام في العمليات الكيميائية الحيوية.[4][5][6]
| حمض البيروفيك | |
|---|---|
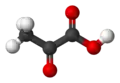 حمض البيروفيك |
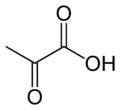 حمض البيروفيك |
| الاسم النظامي (IUPAC) | |
2-oxopropanoic acid | |
| أسماء أخرى | |
Pyruvic acid, α-ketopropionic acid; acetylformic acid; pyroracemic acid | |
| المعرفات | |
| رقم CAS | 127-17-3 |
| بوب كيم | 1060 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | C3H4O3 |
| الكتلة المولية | 88.06 g/mol |
| الكثافة | 1.250 g/cm³ |
| نقطة الانصهار | 11.8 °C |
| نقطة الغليان | 165 °C |
| حموضة (pKa) | 2.50 [3] |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
صيغته الكيميائية هي CH3COCO2H. ويُعَدُّ البيروفات، قاعدته المُرافِقة.
يعرف الأنيون الكربوكسيلي لحمض البيروفيك باسم بيروفات.
الكيمياء
حمض البيروفك سائل عديم اللون رائحته تشبه رائحة حمض الخليك، يختلط البيروفك بالماء ويذوب في الكحول والإيثر. يمكن تحضير حمض البيروفك في المعمل أما بتسخين مخلوط من حمض الطرطريك وثنائي كبريتات البوتاسيوم أو بالتحليل المائي لسيانيد الأسيتيل والذي يتكون بتفاعل كلوريد الأسيتيل مع سيانيد البوتاسيوم:
- CH3COCl + KCN → CH3COCN
- CH3COCN → CH3COCOOH
أهميته البيولوجية
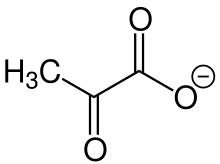
الجزءالموجب لجزييء بيروفات يكوّن جزءا هاما كناتج وسطي في عملية الأيض التي تتم سواء في الهواء بوجود الأكسجين aerob أو في عدم وجود الأكسجين anaerob في الخلايا.
يتواجد مثلا في سيتوبلازما الخلايا عندما ينقسم جزيء جلوكوز إلى 2 جزيء بيروفات. تلك جزيئات البروفات يمكن أن تنتج طاقة في حالة قيام العضلة بالحركة، فتتحول طاقة البيروفات مباشرة إلى طاقة حركة. وفي حالة عدم الحركة (عدم استخدام العضلات) يمكن للجسم تخزين طاقة البروفات في خلايا العضلة، ويتم ذلك بأن تدخل جزيئات البيروفات فيما يسمى دورة حمض الستريك ثم بعدها إلى سلسلة تنفس في متقدرة الخلية ليحترق تماما (يتأيض) في وجود الأكسجين (الآتي من الدم) ويعطي طاقته إلى أدينوسين ثلاثي الفوسفات ATP ؛ الذي يعتبر «بطارية الخلية» التي تمد الخلية بطاقتها المخزونة.
مراجع
- العنوان : Pyruvic acid — مُعرِّف "بَب كِيم" (PubChem CID): https://pubchem.ncbi.nlm.nih.gov/compound/1060 — تاريخ الاطلاع: 19 نوفمبر 2016 — الرخصة: محتوى حر
- مُعرِّف "بَب كِيم" (PubChem CID): https://pubchem.ncbi.nlm.nih.gov/compound/1060
- http://openmopac.net/pKa_table.html
- Thomson, Thomas (1838)، "Chapter II. Of fixed acids Section"، Chemistry of organic bodies, vegetables، London: J. B. Baillière، ص. 65، مؤرشف من الأصل في 16 ديسمبر 2019، اطلع عليه بتاريخ 1 ديسمبر 2010.
- Thorpe, Thomas Edward (1922)، "Glutaric acid"، A dictionary of applied chemistry، London: Longmans, Green, and Co.، ج. 3، ص. 426–427، مؤرشف من الأصل في 20 فبراير 2014، اطلع عليه بتاريخ 1 ديسمبر 2010.
- Aren van Waarde؛ G. Van den Thillart؛ Maria Verhagen (1993)، "Ethanol Formation and pH-Regulation in Fish"، Surviving Hypoxia، ص. 157–170، ISBN 0-8493-4226-0، مؤرشف من الأصل في 18 ديسمبر 2019.
- بوابة صيدلة
- بوابة أيض
- بوابة الكيمياء
- بوابة علم الأحياء
- بوابة الكيمياء الحيوية
.svg.png.webp)