فقر الدم الخبيث
فقر الدم الخبيث (بالإنجليزية: Pernicious anemia)، هو نوع من فقر الدم الناجم عن نقص فيتامين بي12.[4] هو مرض لا ينتج فيه ما يكفي من خلايا الدم الحمراء بسبب ضعف امتصاص فيتامين بي12.[9] ينتج ضعف الامتصاص عن نقص أو فقدان العامل الجوهري الضروري لامتصاص فيتامين بي12.[4] يعرف فقر الدم بأنه انخفاض في عدد خلايا الدم الحمراء أو كمية الهيموجلوبين عن المستوى المعتاد في الدم.[10] قد يكون ظهور المرض بطيئًا وغير ملحوظًا.[11]
| فقر الدم الخبيث | |
|---|---|
| Pernicious anemia | |
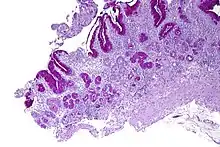
 صورة مجهرية توضح تضخم الخلايا العقيدية الشبيهة بالكروموجرين، كما يتضح من التلوين المناعي للكروموجرانين A في جسم المعدة. الخلايا الجدارية ليست ظاهرة بسهولة. هذه التغييرات تتماشى مع التهاب المعدة الضموري الحؤول المناعي، وهو ارتباط نسيجي لفقر الدم الناجم عن عوز الفيتامين بي12. صورة مجهرية توضح تضخم الخلايا العقيدية الشبيهة بالكروموجرين، كما يتضح من التلوين المناعي للكروموجرانين A في جسم المعدة. الخلايا الجدارية ليست ظاهرة بسهولة. هذه التغييرات تتماشى مع التهاب المعدة الضموري الحؤول المناعي، وهو ارتباط نسيجي لفقر الدم الناجم عن عوز الفيتامين بي12. | |
| تسميات أخرى | فقر الدم الناجم عن عوز فيتامين بي12، فقر الدم الوبيل، أنيميا بريمر،[1] أنيميا أديسون،[2] أنيميا بريمر–أديسون[3] |
| معلومات عامة | |
| الاختصاص | علم الدم |
| من أنواع | فقر الدم الغذائي، واضطراب سوء تغذية، ومرض |
| الأسباب | |
| الأسباب | ضعف امتصاص فيتامين بي12 الناتج عن نقص العامل الجوهري[4] |
| المظهر السريري | |
| البداية المعتادة | > 60 سنة[1] |
| الأعراض | شعور بالتعب، الضعف، شعور بالإغماء، ضيق في التنفس، شحوب، أحاسيس غير طبيعية، أكتئاب، ارتباك، تغييرات في المنعكس[5] |
| الإدارة | |
| التشخيص | فحص دم، فحص نخاع العظم[6] |
| العلاج | مكملات أو حقن فيتامين بي12[1] |
| أدوية | |
| المآل | العيش بحياة طبيعية مع العلاج[7] |
| الوبائيات | |
| انتشار المرض | 1 لكل 1000 شخص[8] |
| التاريخ | |
| سُمي باسم | توماس أديسون |
الأعراض الأولية الأكثر شيوعًا هي الشعور بالتعب والضعف.[5] تشمل الأعراض والعلامات الأخرى ضيق التنفس، شعور بالأغماء، لسان أحمر مؤلم، الصداع، ضعف القدرة على بذل مجهود، برودة اليدين والقدمين، شحوب أو أصفرار البشرة، أنخفاض ضغط الدم، عدم انتظام ضربات القلب وألم الصدر.[5] قد تنجم عن أنزعاجات القناة الهضمية أعراضًا يمكن أن تشمل الغثيان، حرقة الفؤاد، اضطراب المعدة وفقدان الشهية.[5] يمكن أن يسبب فقر الدم الخبيث هشاشة العظام وقد يؤدي إلى كسور في العظام.[5] أعراض نقص فيتامين بي12 الشديدة يمكن أن تشمل الخدر والوخز في اليدين والقدمين، مشاكل في الذاكرة، ضبابية الرؤية، تغيرات في الحركة والتوازن، ضعف العضلات، ضعف حاسة التذوق والشم، ضعف المنعكس، الخراقة، الاكتئاب، الأرتباك، شعور بالذنب والذهان.[5] بدون علاج، قد تصبح بعض هذه المشاكل دائمة.[4]
يحدث فقر الدم الخبيث بسبب استجابة المناعة الذاتية التي تنتج أجسامًا مضادة تهاجم الخلايا الجدارية في بطانة المعدة وتمنعها من خلق العامل الجوهري.[12] قد ينتج سوء الامتصاص أيضًا عن الاستئصال الجراحي لكل أو جزء من المعدة أو الأمعاء الدقيقة؛ أو من اضطراب وراثي أو أمراض تلحق الضرر ببطانة المعدة.[12] تشمل الأسباب الأخرى لانخفاض فيتامين بي12 عدم كفاية المدخول الغذائي (الذي يمكن أن يشكل خطرًا في النظام الغذائي النباتي)،[12] أو الداء البطني، أو عدوى الدودة الشريطية.[12] عند الاشتباه في ذلك، يتم التشخيص عن طريق الدم، وأحيانًا، اختبارات نخاع العظم.[6] قد تظهر اختبارات الدم عددًا أقل من خلايا الدم الحمراء ولكن بحجم أكبر، عددًا منخفضًا من خلايا الدم الحمراء الشابة، مستويات منخفضة من فيتامين بي12، وأجسامًا مُضادة للعامل الجوهري.[6]
فقر الدم الخبيث الناتج عن فقدان العامل الجوهري لا يمكن منعه.[13] يمكن علاج فقر الدم الخبيث بالحقن العضلي أو مكملات فيتامين بي12.[14] إذا كانت الأعراض شديدة، يوصى عادةً بالحقن في البداية.[14] بالنسبة لأولئك الذين يجدون صعوبة في بلع الحبوب، يتوفر بخاخ للأنف.[14] قد يحتاج العلاج إلى أن يكون مدى الحياة.[7][14]
يحدث فقر الدم الخبيث الناتج عن مشاكل المناعة الذاتية في حوالي شخص واحد لكل 1000 شخص في الولايات المتحدة.[1] من بين أولئك الذين تزيد أعمارهم عن 60 عامًا، يعاني حوالي 2% من هذه الحالة. يصيب بشكل أكثر شيوعًا الأشخاص المنحدرين من أصل شمال أوروبي.[2] ويصيب النساء أكثر من الرجال.[15] مع العلاج المناسب، يعيش معظم الناس حياة طبيعية.[4] نظرًا لارتفاع خطر الإصابة بسرطان المعدة، يجب فحص المصابين بفقر الدم الخبيث بانتظام للتحقق من ذلك.[7] أول وصف واضح كان بواسطة توماس أديسون في عام 1849.[16][17] مصطلح "خبيث" يعني "مميت"، وقد بدأ استخدام هذا المصطلح لأنه قبل توفر العلاج كان المرض قاتلًا في كثير من الأحيان.[4][18]
الأعراض والعلامات
غالبًا ما يكون ظهور فقر الدم الخبيث بطيئًا، ويمكن أن يسبب ضررًا خبيثًا وغير ملحوظًا. إذا لم يتم علاجه، يمكن أن يؤدي إلى مضاعفات عصبية، وفي الحالات الخطيرة، الوفاة.[19] من الممكن ان يستغرق ظهور فقر الدم الخبيث سنواتٍ عديدة، لذلك، قد يمر المرض دون التعرف عليه، حيث يصبح الجسم مُعتادًا على عدم الشعور بصحة جيدة.[20] قد تكون البداية غامضة وبطيئة، حيث أن نفس الأعراض غالبا ما تكون موجودة أيضا مع فقر الدم؛ في 30% من حالات نقص الكوبالامين، لم يُلاحظ فقر الدم.[21] فقر الدم الخبيث قد يكون موجودًا دون أن يعاني الشخص من أعراض في البداية، مع مرور الوقت، الشعور بالتعب والضعف، الشعور بالأغماء، الدوخة، الصداع، سرعة أو عدم أنتظام ضربات القلب، ضيق التنفس، أحمرار اللسان (لسان الكرزة)، أنخفاض ضغط الدم، شحوب أو أصفرار الجلد، برودة اليدين والقدمين، سهولة تعرض الجلد للكدمات أو النزيف، حمى منخفضة الدرجة، الرجفان، عدم تحمل البرد، ألم في الصدر، اضطراب المعدة، الغثيان، فقدان الشهية، حرقة الفؤاد، فقدان الوزن، الإسهال، الإمساك، آلام المفاصل الشديدة، الشعور بالأحاسيس غير الطبيعية بما في ذلك الخدر والوخز في أصابع اليدين والقدمين (دبابيس وإبر)، وطنين الأذن، قد تحدث.[5][11][20][22] بالرغم من ذلك، قد يظهر فقر الدم مع عدد من الأعراض الشائعة الأخرى مثل تساقط الشعر وضعفه، الشيب المبكر،[11] تقرحات الفم، نزيف اللثة،[11] التهاب زوايا الشفاة، مظهر مرهق مع شفتين متششقه ودوائر مُظلمة حول العينين، وكذلك أظافر هشة.[11]

في الحالات الأكثر حدة أو طويلة المدى من فقر الدم الخبيث، قد يحدث تلف في الخلايا العصبية،[20] مما قد يؤدي إلى ظهور الأعراض الأكثر حدة، بما في ذلك، فقد الحس، صعوبة استقبال الحس العميق، ألم الأعصاب، المشي غير المستقر (رنح)، ضعف التوازن، ضياع الإحساس في القدمين، ضعف العضلات، ضبابية الرؤية (إما بسبب اعتلال الشبكية[23] أو الاعتلال العصبي البصري[24])، صعوبة التبول، مشاكل الخصوبة، ضعف حاسة التذوق والشم، فقدان الذاكرة، تغييرات في المنعكس، انخفاض مستوى الوعي، الأكتئاب، الهيجان، الارتباك، تقلب المزاج، الضعف الإدراكي، القلق، الخراقة، الذهان، وفي الحالات الشديدة، من الممكن حدوث الخرف.[11][20][25][26][27] قد يؤدي فقر الدم أيضًا إلى نفخة قلبية[11] و/أو ضغط دم مُتقلب (منخفض أو مرتفع). قد يكون النقص موجودًا أيضًا مع اضطرابات الغدة الدرقية.[11] في الحالات الشديدة، قد يسبب فقر الدم دليلاً على قصور القلب الاحتقاني. المضاعفات في فقر الدم الخبيث تؤدي إلى التنكس المشترك تحت الحاد للنخاع الشوكي، والذي يؤدي إلى فقدان الحواس البعيدة (العمود الخلفي)، غياب منعكس الكاحل، زيادة الاستجابة الانعكاسية للركبة والاستجابة الأخمصية الباسطة.[22] بخلاف فقر الدم، قد تشمل أعراض الدم قلة الكريات، انحلال الدم داخل النقي، واعتلال الأوعية الدماغية التخثر الزائفة. ممكن أن يساهم فقر الدم الخبيث في تأخر النمو البدني عند الأطفال، وقد يكون أيضًا سببًا للتأخير في سن البلوغ للمراهقين.
أسباب الإصابة
لا يمكن لجسم الإنسان أن يُنتج فيتامين بي12، ويجب الحصول عليه من النظام الغذائي. عندما يتم تناول الأطعمة التي تحتوي على فيتامين بي12، فعادة ما يرتبط الفيتامين بالبروتين ويتم إطلاقه بواسطة البروتياز الذي يفرزه البنكرياس في الأمعاء الدقيقة. بعد إطلاقه، يمتص الجسم معظم بي12 في الأمعاء الدقيقة (اللفائفي) بعد الارتباط ببروتين يُعرف باسم العامل الجوهري. يتم إنتاج العامل الجوهري بواسطة الخلايا الجدارية في الغشاء المخاطي للمعدة (بطانة المعدة) ويتم امتصاص مركب العامل الجوهري-بي12 بواسطة مستقبلات الكوبيلين في الخلايا الطلائية.[28][29] يشير فقر الدم الخبيث إلى نقص بي12 الناجم عن غياب العامل الجوهري.[30]
يمكن اعتبار فقر الدم الخبيث مرحلة نهائية من التهاب المعدة المناعي، وهو مرض يتميز بضمور المعدة ووجود أجسام مضادة للخلايا الجدارية والعامل الجوهري.[31] يرتبط شكل محدد من التهاب المعدة المزمن، التهاب المعدة من النوع أ أو التهاب المعدة الضموري بالجسم، ارتباطًا وثيقًا بفقر الدم الخبيث. يتمركز اضطراب المناعة الذاتية هذا في بطانة المعدة، حيث توجد الخلايا الجدارية.[30] تتسبب الأجسام المضادة للعامل الجوهري والخلايا الجدارية في تدمير الغشاء المخاطي المعدي المؤكسد، حيث توجد الخلايا الجدارية، مما يؤدي إلى فقدان لاحق لتخليق العامل الجوهري.[32]
على الرغم من أن الدور الدقيق لعدوى الملوية البوابية (جرثومة المعدة) في فقر الدم الخبيث لا يزال مثيرًا للجدل، تشير الدلائل إلى أن الحلزونية البوابية من الممكن أن تكون سببًا في المرض. قد تتسبب عدوى بكتيريا الملوية البوابية طويلة الأمد في حدوث مناعة ذاتية في المعدة من خلال آلية تُعرف باسم التقليد الجزيئي.
يمكن للأجسام المضادة التي ينتجها الجهاز المناعي أن تكون تفاعلية تبادلية وقد ترتبط بكل من مستضدات الحلزونية البوابية وتلك الموجودة في الغشاء المخاطي في المعدة. يتم إنتاج الأجسام المضادة بواسطة الخلايا البائية المنشطة التي تتعرف على كل من العوامل الممرضة والببتيدات المشتقة ذاتيًا. يُعتقد أن المستضدات الذاتية التي تسبب النشاط الذاتي هي الوحدات الفرعية ألفا وبيتا من H+/K+-ATPase.[32][33] في إحدى الدراسات، كان نقص فيتامين بي12 الناجم عن جرثومة المعدة مرتبطًا بشكل إيجابي بإيجابية CagA والنشاط الالتهابي المعدي، بدلاً من ضمور المعدة.[33]
أقل شيوعًا، يمكن أن تسبب جرثومة المعدة ومتلازمة زولينجر إيليسون أيضا شكلًا من أشكال التهاب المعدة غير المرتبطة بالمناعة الذاتية والتي يمكن أن تؤدي إلى فقر الدم الخبيث.[34]
يمكن أن يحدث ضعف امتصاص بي12 أيضًا بعد إزالة المعدة (استئصال المعدة) أو جراحة المجازة المعدية. في هذه العمليات الجراحية، يتم إزالة أجزاء المعدة التي تنتج إفرازات معدية أو يتم تجاوزها. وهذا يعني أن العامل الجوهري، بالإضافة إلى العوامل الأخرى اللازمة لامتصاص بي12، غير متوفرة. ومع ذلك، فإن نقص فيتامين بي12 بعد جراحة المعدة لا يصبح عادة مشكلة سريرية. ربما يرجع ذلك إلى أن الجسم يخزن ما يصل إلى سنوات عديدة من فيتامين بي12 في الكبد، ويتم تزويد مرضى جراحة المعدة بالفيتامين بشكل كافٍ.[35][36]
على الرغم من عدم تحديد جينات محددة للإصابة بفقر الدم الخبيث، فمن المحتمل أن يكون للعامل الوراثي دورًا في المرض. غالبًا ما يتم العثور على فقر الدم الخبيث بالاقتران مع اضطرابات المناعة الذاتية الأخرى، مما يوحي إلى أن جينات المناعة الذاتية الشائعة قد تكون عاملاً مسببًا.[30] على الرغم من ذلك، أشارت الدراسات العائلية السابقة وتقارير الحالة التي تركز على فقر الدم الخبيث إلى وجود ميل وراثي لفقر الدم الخبيث على وجه الخصوص، ويبدو أن أقرباء مرضى فقر الدم الخبيث لديهم معدل أعلى للإصابة بفقر الدم الخبيث والحالات المرتبطة بها. علاوة على ذلك، تمت الإشارة أيضًا إلى أن تكوين الأجسام المضادة للخلايا المعدية كان جينا سائدًا وراثيًا، وقد لا يكون وجود الأجسام المضادة لخلايا المعدة مرتبطًا بالضرورة بحدوث التهاب المعدة الضموري.[37][38]
طريقة حدوث المرض
على الرغم من أن الجسم السليم يخزن ما بين ثلاث إلى خمس سنوات من بي12 في الكبد، فإن نشاط المناعة الذاتية غير المكتشف عادة في الأمعاء خلال فترة طويلة من الزمن يؤدي إلى استنفاد بي12 وفقر الدم هو الناتج. يشير فقر الدم الخبيث إلى أحد المظاهر الدموية لالتهاب المعدة المناعي الذاتي المزمن، حيث يستهدف الجهاز المناعي الخلايا الجدارية للمعدة أو العامل الجوهري نفسه، مما يؤدي إلى عدم القدرة على امتصاص فيتامين بي12.[39]
مطلوب بي12 بواسطة الانزيمات لاثنين من التفاعلات: تحويل CoA methylmalonyl إلى succinyl CoA، وتحويل الهوموسيستين إلى ميثيونين.في التفاعل الأخير، يتم نقل مجموعة الميثيل من 5-methyltethydrofolate إلى الهموسيستين لإنتاج رباعي هيدروفولات والميثيونين.يتم تحفيز هذا التفاعل بواسطة إنزيم ميثيونين سينثيز مع بي12 كعامل مساعد أساسي. خلال نقص بي12، لا يمكن لهذا التفاعل أن يستمر، مما يؤدي إلى تراكم 5 methyltethydrofolate. يستنزف هذا التراكم أنواع أخرى من حمض الفوليك اللازمة لتخليق البيورين وتيرميديلات، وهي مطلوبة لتوليف الحمض النووي. تثبيط تكرار الحمض النووي في خلايا الدم الحمراء يؤدي إلى تكوين كرات الدم الحمراء الضخمة الهشة. ويعتقد أن المظاهر العصبية للمرض تنشأ من تراكم ميثيل مالونيل CoA بسبب اشتراط بي12 كعامل مساعد لعامل إنزيم metaylmalonyl CoA mutase.[40][41][42][43]
التشخيص
يعتقد أن فقر الدم الخبيث هو اضطراب في المناعة الذاتية يؤذي الخلايا الجدارية في المعدة - حيث إنه يؤدي إلى انخفاض في إنتاج العامل الجوهري وعدم كفاية أمتصاص B-12.[20] ومع ذلك، قد يحتوي فقر الدم الخبيث أيضًا على مكون وراثي له أيضًا، ومن المحتمل أن يكون متوارثًا في العائلات.[20] يكون هناك احتمال الإصابة بفقر الدم الخبيث إذا كانت عينة الدم للمريض تُظهر خلايا دم حمراء ضخمة وهشة وغير ناضجة تُسمى الأرومات الضخمة. تشخيص فقر الدم الخبيث يتطلب عينة دم وفحص تعداد الدم، وهذه الفحوصات تتطلب:[6][20][40][44]
- يقيم التعداد الدموي الكامل ومسحة الدم الطرفية تشخيص فقر الدم الخبيث أولاً بإظهار فقر الدم الضخم الأرومات عن طريق إجراء تعداد الدم الكامل ومسحة الدم، والتي تقيم متوسط حجم الكرية الوسطي (MCV)، وكذلك، متوسط تركيز الهيموجلوبين الكروي (MCHC). يتم التعرف على المرض مع ارتفاع MCV (فقر الدم كبير الكريات) وMCHC طبيعي (فقر الدم الطبيعي الصبغي). وعادة ما تتواجد الخلايا البيضاوية أيضًا على مسحة الدم، والسمة المرضية لفقر الدم الضخم الأرومات (الذي يشمل فقر الدم الخبيث) هي العدلات كثيرة التجزئة[20]
- تُستخدم مستويات مصل فيتامين بي12 في الدم للكشف عن نقصه،[20] لكنها لا تميز أسبابه. يمكن أن تكون مستويات فيتامين بي12 مرتفعة أو منخفضة بشكل خاطئ وتختلف بيانات الحساسية والنوعية على نطاق واسع، لذلك لا تكون دقيقة، حيث قد يكون مستوى بي12 في مصل الدم طبيعي في حالة تواجد أمراض الكبد أو اضطرابات التكاثر النقيي اونقص البروتين الحامل للبي12 ويدعى ترانزكوبلامين 2 أو فرط بكتيريا الأمعاء الدقيقة
- الأجسام المضادة لخلايا المعدة الجدارية والعامل الجوهري — يتم فحص الدم بحثًا عن الأجسام المضادة ضد العامل المعدي الجوهري والخلايا الجدارية في المعدة، يعتبر وجود الأجسام المضادة لخلايا المعدة الجدارية والعامل المعدي الجوهري أمر شائع في فقر الدم الخبيث.[45][20] إلا أن هذه الأجسام المضادة متواجدة في اضطرابات ذاتية أخرى وأيضا في 10% من الأفراد الأصحاء؛ ومع ذلك، حوالي 85% من مرضى فقر الدم الخبيث لديهم أجسام مضادة للخلايا الجدارية، مما يعني أنها دلالة دقيقة للمرض. تكون الأجسام المضادة للعامل المعدي الجوهري أقل حساسية بكثير من الأجسام المضادة للخلايا الجدارية، ولكنها أكثر تحديدًا.[46] حيث أن نصف مرضى فقر الدم الخبيث يحملون الاجسام المضادة للعامل الجوهري وانها نادرا جدًا ما توجد في اضطرابات أخرى. يمكن أن تميز اختبارات الأجسام المضادة هذه بين فقر الدم الخبيث وسوء امتصاص بي12-الغذائي[47]
- حمض الميثيل مالونيك و/أو الهوموسيستين — يلعب فيتامين بي12 دورًا مهمًا في عمليات الأيض والوظائف الخلوية. لذلك فإن نقصه يؤدي إلى تراكم بعض نواتج عمليات الايض.[48] يعتبر حمض الميثيل مالونيك و/أو الهوموسيستين إحدى نواتج عمليات الأيض والتي يمكن قياس نسبها في الدم، حيث إن الزيادة في نسب كلاهما يساعد في التفريق بين نقص فيتامين بي12 ونقص حمض الفوليك، ذلك لأن زيادة نسبة الهموسيستين وحده دليل على نقص حمض الفوليك[49]
80-90% من مرضى فقر الدم الخبيث يملكون نسب مرتفعة من الغاسترين، لكن هذه النسب المرتفعة موجودة أيضا في حالات التهابات المعدة. انخفاض مستويات البيبسينوجين الأول أو انخفاض نسبة البيبسينوجين 1 إلى نسبة البيبسين 2 قد تكون موجودة أيضًا، على الرغم من أن هذه النتائج أقل دقة بالنسبة إلى فقر الدم الخبيث ويمكن العثور عليها في سوء امتصاص فيتامين بي12 وأشكال أخرى من التهابات المعدة.
ينبغي تأكيد تشخيص التهاب المعدة الضامر من النوع A عن طريق تنظير المعدة والخزعة التدريجية. حوالي 90% من الأفراد الذين لديهم فقر الدم الخبيث لديهم أجسام مضادة للخلايا الجدارية. ومع ذلك، فإن 50% فقط من جميع الأفراد في عموم السكان المصابين بهذه الأجسام المضادة يعانون من فقر الدم الخبيث.[50]
يجب النظر في أشكال نقص فيتامين بي12 غير فقر الدم الخبيث في التشخيص التفريقي لفقر الدم الضخم الأرومات. على سبيل المثال، قد تكون حالة نقص فيتامين بي12 التي تسبب فقر الدم الضخم الأرومات والتي قد تكون مخطئة بسبب فقر الدم الخبيث التقليدي ناتجة عن الإصابة بالدودة الشريطية العوساء، ربما بسبب منافسة الطفيلي مع مستقبل فيتامين بي12.[51]
لم يعد الاختبار الكلاسيكي لفقر الدم الخبيث، اختبار شيلينغ، مستخدمًا على نطاق واسع، حيث تتوفر طرق أكثر كفاءة. اشتمل هذا الاختبار التاريخي، في خطوته الأولى، على تناول جرعة فموية من فيتامين بي12 الموسوم إشعاعيًا، متبوعًا بتقدير كمية الفيتامين في بول المريض على مدار 24 ساعة عن طريق قياس النشاط الإشعاعي. خطوة ثانية من الاختبار تكرر اسلوب واجراء الخطوة الأولى، مع إضافة عامل جوهري عن طريق الفم. يقدم المريض المصحوب بمرض فقر الدم الخبيث كميات أقل من المعتاد من العامل الجوهري؛ وبالتالي، فإن إضافة عامل جوهري في الخطوة الثانية يؤدي إلى زيادة في امتصاص فيتامين بي12 (على خط الأساس المحدد في الأول). ميز اختبار شيلينغ فقر الدم الخبيث عن الأشكال الأخرى من نقص فيتامين بي12، على وجه التحديد، متلازمة إمرسلوند-جراسبك (IGS)، وهو عوز فيتامين بي12 بسبب طفرات في مستقبلات الكوبالامين.[52]
العلاج
في البداية، قد لا يتم تشخيص فقر الدم الخبيث.[1] قد تكون هنالك حاجة إلى مزيد من التعمق في التشخيص.[1] فقر الدم الخبيث الناجم عن فقدان أو نقص العامل الجوهري لا يمكن الوقاية منه.[13] إذا كانت هناك اسباب أخرى لانخفاض مستويات فيتامين بي12 قابلة للعكس، يجب علاج السبب وراء ذلك.[13] عادةً ما يتم علاج فقر الدم الخبيث بسهولة من خلال توفير المستوى اللازم من مُكملات فيتامين بي12.[53] يمكن علاج الحالات الشديدة بالحقن العضلية من فيتامين بي12.[53] الحقن سريعة المفعول، وعادةً ما تختفي الأعراض في غضون أسبوع إلى أسبوعين.[14] مع تحسن الحالة، يتم تقليل الجرعات إلى أسابيع ومن ثم يمكن إعطاؤها شهريًا.[14] قد يحتاج النشاط إلى أن يكون محدودًا أثناء العلاج.[14] طالما أن فيتامين بي12 مُكمل يمكن أن تتعافى جميع الأعراض الدموية والعصبية بشكل دائم إذا لم يتم تواجد مضاعفات عصبية، حيث يمكن تحقيق أشباع الجسم من فيتامين بي12 بطرق عدة.[44][54][55] يمكن علاج الحالات الأقل حدة بجرعات عالية من مكملات فيتامين بي12 الفموية.[53] يتوفر أيضًا رذاذ للأنف، كريم، والحبوب تحت اللسان للأشخاص الذين قد يجدون صعوبة في البلع.[14] قد تؤثر مكملات الفولات على مسار وعلاج فقر الدم الخبيث، لذلك، عادةً ما يوصى باستبدال فيتامين بي12 في البداية.[56] في بعض الحالات الشديدة من فقر الدم، قد تكون هنالك حاجة إلى نقل الدم لتصحيح الآثار الدموية.[14] في العادة ستكون هناك حاجة إلى علاج مدى الحياة.[53][55]
التاريخ
في البداية، تم وصف حالة مع فقر الدم مع أول اعتراف بالتهاب المعدة الضموري المرتبط به وهي سمة من سمات فقر الدم الخبيث، لأول مرة في عام 1824 من قبل الدكتور جيمس كومب في معاملات الجمعية الطبية العلاجية في إدنبرة.[57] ومع ذلك، لم يتم التحقيق في هذا الأمر بمزيد من العمق حتى عام 1849 من قبل الطبيب البريطاني توماس أديسون، والتي سُميت لاحقًا ”أنيميا أديسون“. في 1871، أول وصف دقيق للمرض في أوروبا كان بواسطة مايكل أنطون بيرمر، وهو طبيب ألماني أشار إلى المسار الخبيث للحالة، ولأنها كانت غير قابلة للعلاج ومميتة في ذلك الوقت، أشار إليها لأول مرة باسم فقر الدم ”الخبيث“.[58][59] في 1900، ذكر راسل مصطلح التنكس المشترك تحت الحاد للحبل الشوكي.[60]
في 1907، أبلغ عن سلسلة من 1200 مريض من قبل ريتشارد كلارك كابوت يعانون من فقر الدم الخبيث؛ وكان متوسط بقائهم على قيد الحياة بين سنة وثلاث سنوات.[61] كان فقر الدم الخبيث مرضًا قاتلًا قبل حوالي عام 1920. حتى تم التعرف على أهمية الكبد في تكون الدم، كان علاج فقر الدم الخبيث غير ناجح وتعسفي. قد يكون هذا قد حفز جورج ويبل، الذي كان لديه اهتمام كبير بأمراض الكبد، للتحقيق في دور الكبد في تكون الدم. بدأ ويبل في تقييم آثار علاجات فقر الدم الناجمة عن فقدان الدم المزمن. درس ويبل وهوبر وروبشيت الآثار على الهيموغلوبين وتجديد الدم لمجموعة متنوعة من العلاجات - من بينها الكبد النيء فقط أظهر وعدًا حقيقيا.[59] يُقال إن الصدفة لعبت دورًا في هذا الاكتشاف. لاحظ ويبل أن تجدد الدم كان سيئًا في الكلاب التي تتغذى بالكبد المطبوخ بعد فقدان الدم المزمن. لو لم يكن فني المختبر الكسول قد أعطى للكلاب كبدًا نيئًا، فربما لم يتم اكتشاف الاستجابة الأكثر دراماتيكية في تلك المرحلة من التاريخ.[59]

تقريبًا في 1926، سعى جورج مينوت وويليام بي مورفي، اللذان علما باكتشاف ويبل، تجربة الكبد النيء كعلاج لفقر الدم الخبيث، لاحقًا اقترحو نظامًا غذائيًا غني بالبروتين مع كميات عالية من الكبد النيء، تسبب هذا في تحسن سريع في الأعراض وارتفاع متزامن في عدد خلايا الدم الحمراء.[62] كانت الفاكهة والحديد أيضًا جزءًا من النظام الغذائي، ويبدو أنه في هذه المرحلة، لم يكن مينوت ومورفي متأكدين تمامًا من أن الكبد كان عاملاً مهمًا للغاية - كان الأعتقاد السائد ان عنصر الحديد في أنسجة الكبد، وليس العامل القابل للذوبان في عصارة الكبد هو المسؤول عن علاج فقر الدم من النزف في الكلاب - وهكذا؛ فإن اكتشاف عصارة الكبد كعلاج لفقر الدم الخبيث كان بالصدفة. ومع ذلك، حصل مينوت ومورفي وويبل على جائزة نوبل المشتركة لاكتشاف علاج لمرض قاتل سابقًا لسبب غير معروف في عام 1934، ليصبحوا أول أميركيين حصلوا على جائزة نوبل في علم وظائف الأعضاء والطب.[63]
نظرًا لأنه ليس من السهل تناول نظام غذائي من الكبد النيء، فقد تم تطوير مقتطفات من الكبد للحقن العضلي، حتى توفر تركيز من عصارة الكبد. في عام 1928، أعد الكيميائي إدوين كون مستخلصًا للكبد كان أقوى بنسبة 50 إلى 100 مرة من الغذاء الطبيعي ”الكبد“. يمكن حتى حقن المستخلص في العضلات، مما يعني أن المرضى لم يعودوا بحاجة إلى تناول كميات كبيرة من الكبد أو العصارة. وأصبح هذا جزءًا من الإدارة القياسية لفقر الدم الخبيث حتى الخمسينيات من القرن العشرين. ظل العنصر النشط في الكبد غير معروف حتى عام 1948، لم يتم عزل العامل المضاد لفقر الدم الخبيث من الكبد الا بواسطة سميث وريكس وآخرون، كانت المادة عبارة عن كوبالامين، والذي أطلق عليه المكتشفون ”فيتامين بي12“.[59] أظهروا أن إعطاء بضعة ميكروغرامات يمكن أن يمنع الانتكاس في المرض. واصلت دوروثي هودجكن وزملاؤها استخدام علم البلورات بالأشعة السينية لتوضيح بنية الكوبالامين (المسمى فيتامين بي12) العمل الذي حصلت من أجله على جائزة نوبل.[64]
زاد فهم التسبب في فقر الدم الخبيث على مدى العقود اللاحقة - كان من المعروف منذ فترة طويلة أن المرض ارتبط بعيوب في الجهاز الهضمي؛ يعاني المرضى من التهاب المعدة المزمن ونقص إفراز الحمض (الكلورهيدريا). من المعروف أن نقل الكميات الفسيولوجية من فيتامين بي12 يعتمد على الإجراءات المشتركة لمكونات المعدة واللفائفي والبنكرياس. تم اكتشاف جزء المعدة وتسميته ”العامل الجوهري“ بواسطة ويليام كاسل في عام 1930. تم إحراز تقدم مهم آخر في أوائل الستينيات من قبل دونياش مع الاعتراف بأن فقر الدم الخبيث هو أحد أمراض المناعة الذاتية.[65] يُعالج فقر الدم الخبيث في النهاية إما عن طريق الحقن أو بجرعات فموية كبيرة من بي12، عادةً ما بين 1 و4 ملغ يوميًا.
ذكر أحد الكتاب أن ماري تود لينكولن، زوجة الرئيس الأمريكي أبراهام لينكولن، كانت مصابة بفقر الدم الخبيث لعقود من الزمن وتوفيت بسببه.[66]
التنبؤ بالمرض
يمكن للشخص المصاب بمرض فقر الدم الخبيث المسيطر عليه جيدًا أن يعيش حياة صحية. بينما، قد يؤدي عدم التشخيص والعلاج في الوقت المناسب إلى حدوث ضرر دائم في الجهاز العصبي، الإرهاق المفرط، الاكتئاب، فقدان الذاكرة، ومضاعفات أخرى. في الحالات الشديدة، يمكن أن تؤدي المضاعفات العصبية الناتجة عن فقر الدم الخبيث إلى الموت - ومن هنا جاء الاسم، "الخبيث"، الذي يعني المميت.
وقد لوحظ وجود ارتباط بين فقر الدم الخبيث وأنواع معينة من سرطان المعدة، إلا أن الصلة السببية غير مؤكدة.[32]
علم الأوبئة
و يقدر ان فقر الدم الخبيث يؤثر على 0.1% من عامة الناس، و 1.9% من الذين تزيد أعمارهم عن 60 وهو ما يمثل 20-50% من نقص فيتامين بي12 لدى البالغين. يظهر استعراض للأدبيات أن فقر الدم الخبيث ينتشر بكثرة في شمال أوروبا، الدول الاسكندنافية خاصة، وبين السكان المنحدرين من أصل أفريقي، وأن زيادة الوعي بالمرض وأدوات التشخيص الأفضل قد تلعب دوراً في ارتفاع معدلات الإصابة على ما يبدو.[67]
بحث
مركب “SNAC”
على الرغم من أن الجرعات الكبيرة الفموية والحقن العضلي هي أكثر طرق العلاج المتوفرة حاليًا، يتم اختبار العديد من الأساليب الجديدة، مع وعد كبير للدمج المستقبلي في أساليب المعالجة السائدة. بما أن الحقن هي مركبات غير مفضلة لإيصال الدواء، فإن الأبحاث الحالية تتضمن تحسين الانتشار السلبي عبر الدقاق عن طريق الابتلاع بالفم لمشتقات الكوبالامين. استفاد الباحثون مؤخرًا من مركبN-[8-(2-hydroxybenzoyl) amino]caprylate (SNAC)، والذي يعزز إلى حد كبير التوافر البيولوجي والاستقرار الأيضي
[68] مركبات "SNAC" لها القدرة على تشكيل مركبات تساهمية مع الكوبلامين مع الحفاظ على سلامتها الكيميائية. هذا المركب أكثر حبا للدهون من فيتامين بي12 القابل للذوبان في الماء، لذا فهو قادر على المرور عبر الأغشية الخلوية بسهولة أكبر.
عامل داخلي مؤتلف
طريقة أخرى لزيادة الامتصاص من خلال الدقاق هو ابتكار معقد Cbl الذي يرتبط به العامل الجوهري بالفعل. يمكن استكمال النقص في العامل الجوهري الذي ينتجه جسم المريض باستخدام العامل الجوهري الإنساني الاصطناعي إذا تم إنتاجه من اتحادات نباتات البازلاء.[69] مع ذلك، في الحالات التي تكون فيها الأجسام المضادة للعامل الجوهري هي سبب سوء الامتصاص عبر اللفائفي، يكون هذا العلاج غير فعال
توصيل تحت اللسان والانف
كما تم افتراض علاجات تحت اللسان لتكون أكثر فعالية من العلاجات الفموية وحدها. وجدت دراسة أجريت عام 2003[70] في حين أن هذه الطريقة فعالة، فإن جرعة مقدارها 500 ميكروغرام من السيانوكوبالامين تعطى إما عن طريق الفم أو تحت اللسان، تكون فعالة بنفس القدر في استعادة التركيزات الفيزيولوجية الطبيعية للكوبالامين. وقد درست طرق الأنف أيضا كوسيلة لتوصيل كوبالامين. رصدت دراسة[71] أجريت عام 1997 تركيز الكوبالمين في البلازما لستة مرضى بفقر الدم الخبيث خلال فترة 35 يومًا أثناء علاجهم بكمية 1500 ميكروغرام من هيدروكسيوكوبالامين الأنفي. بعد ساعة واحدة من الإعطاء، أظهر جميع المرضى في المتوسط زيادة فورية بثمانية أضعاف في تركيز الكوبالامين في البلازما وزيادة مرتين بعد 35 ومًا مع ثلاث معالجات 1500 ميكروغرام. ومع ذلك، هناك حاجة إلى مزيد من الدراسات للتحقيق في فعالية طريقة التوصيل هذه على المدى الطويل.
علاجات استكشافية
أحد الطرق الاستكشافية، والطريقة البديلة المحتملة لعلاج فقر الدم الخبيث هو استخدام البقع عبر الأدمة. في أحد هذه الأنظمة، تتكون البقع من سيانوكوبالامين، المثبتات، محفزات اختراق البشرة.[72] المصدر الذي تم نشره ذاتيًا يسمح عبر الجلد لمشتق الكوبالمين بالانتشار السلبي من خلال الطبقة القرنية، البشرة، والأدمة، وفي النهاية دخول مجرى الدم. وبالتالي، يتجنب الكوبالامين تأثير الكبريت الأول، وبالتالي يوفر إمكانية تحسين التوافر الحيوي وفعاليته. يؤدي الإطلاق البطيء إلى زيادة عمر نصف للكوبالامين، مما يوفر إمكانية الانخفاض في الجرعة المطلوبة، المطلوبة بالنسبة لأساليب الولادة عن طريق الفم.في أحد هذه الأنظمة، يمكن لألياف بوليكابرولاكتون المحشوة بالمخدرات والتي يتم تحضيرها ككربون نانوي دقيق electrospun أن تطلق المئات من ميكروغرام كوبلامين في اليوم الواحد.[73]
المراجع
- Andres, Emmanuel؛ Serraj, Khalid (10 سبتمبر 2012)، "Optimal management of pernicious anemia"، Journal of Blood Medicine، 3: 97–103، doi:10.2147/JBM.S25620، ISSN 1179-2736، PMID 23028239، مؤرشف من الأصل في 31 أكتوبر 2021.
- Professional guide to diseases، Philadelphia : Wolters Kluwer Health/Lippincott Williams & Wilkins، 2008، ISBN 978-0-7817-7899-2، مؤرشف من الأصل في 1 يونيو 2022.
- Thomas Lathrop (2005)، Stedman's Medical Eponyms (باللغة الإنجليزية)، Lippincott Williams & Wilkins، ISBN 978-0-7817-5443-9، مؤرشف من الأصل في 6 فبراير 2022.
- "What Is Pernicious Anemia?"، National Heart, Lung, and Blood Institute. (باللغة الإنجليزية)، مؤرشف من الأصل في 09 أبريل 2019، اطلع عليه بتاريخ 06 مايو 2018.
- "What Are The Signs And Symptoms Of Pernicious Anemia?"، National Heart, Lung, and Blood Institute. (باللغة الإنجليزية)، مؤرشف من الأصل في 09 أبريل 2019، اطلع عليه بتاريخ 06 مايو 2018.
- "How Is Pernicious Anemia Diagnosed?"، National Heart, Lung, and Blood Institute. (باللغة الإنجليزية)، مؤرشف من الأصل في 09 أبريل 2019، اطلع عليه بتاريخ 06 مايو 2018.
- "Living With Pernicious Anemia"، National Heart, Lung, and Blood Institute. (باللغة الإنجليزية)، مؤرشف من الأصل في 09 أبريل 2019، اطلع عليه بتاريخ 06 مايو 2018.
- Li, Xinjun؛ Thomsen, Hauke؛ Sundquist, Kristina؛ Sundquist, Jan؛ Försti, Asta؛ Hemminki, Kari (2021)، "Familial Risks between Pernicious Anemia and Other Autoimmune Diseases in the Population of Sweden"، Autoimmune Diseases، 2021: 8815297، doi:10.1155/2021/8815297، ISSN 2090-0422، PMID 33505716، مؤرشف من الأصل في 3 مارس 2022.
- "ICD-10 Version:2015"، icd.who.int، مؤرشف من الأصل في 7 يونيو 2021، اطلع عليه بتاريخ 04 سبتمبر 2021.
- "What Is Anemia?"، National Heart, Lung, and Blood Institute.، 24 مارس 2022، مؤرشف من الأصل في 13 يونيو 2022، اطلع عليه بتاريخ 15 يونيو 2022.
- "Pernicious Anemia Clinical Presentation: History, Physical Examination"، emedicine.medscape.com (باللغة الإنجليزية)، مؤرشف من الأصل في 14 سبتمبر 2017، اطلع عليه بتاريخ 12 مايو 2018.
- "What Causes Pernicious Anemia?"، National Heart, Lung, and Blood Institute. (باللغة الإنجليزية)، مؤرشف من الأصل في 09 أبريل 2019، اطلع عليه بتاريخ 06 مايو 2018.
- "How Pernicious Anemia Is Prevented?"، National Heart, Lung, and Blood Institute. (باللغة الإنجليزية)، مؤرشف من الأصل في 09 أبريل 2019، اطلع عليه بتاريخ 06 مايو 2018.
- "How Pernicious Anemia Is Treated?"، National Heart, Lung, and Blood Institute. (باللغة الإنجليزية)، مؤرشف من الأصل في 09 أبريل 2019، اطلع عليه بتاريخ 06 مايو 2018.
- Greer, John P. (2009)، Wintrobe's Clinical Hematology (باللغة الإنجليزية)، Lippincott Williams & Wilkins، ISBN 9780781765077، مؤرشف من الأصل في 22 يونيو 2018.
- Wailoo, Keith (04 نوفمبر 2002)، Drawing Blood: Technology and Disease Identity in Twentieth-Century America (باللغة الإنجليزية)، JHU Press، ISBN 9780801870293، مؤرشف من الأصل في 4 أبريل 2019.
- Collin, P. H. (11 يونيو 2014)، Dictionary of Medicine (باللغة الإنجليزية)، Routledge، ISBN 9781135928414، مؤرشف من الأصل في 17 ديسمبر 2019.
- Tamparo, Carol D. (03 فبراير 2016)، Diseases of the Human Body (باللغة الإنجليزية)، F.A. Davis، ISBN 9780803657915، مؤرشف من الأصل في 22 يونيو 2018.
- "Pernicious Anemia Symptoms, Types, Causes & Treatment"، web.archive.org، 14 نوفمبر 2021، اطلع عليه بتاريخ 28 يناير 2022.
- "Pernicious Anemia"، Healthline (باللغة الإنجليزية)، 13 مايو 2020، مؤرشف من الأصل في 28 يناير 2021، اطلع عليه بتاريخ 30 سبتمبر 2021.
- Htut, Thura Win؛ Thein, Kyaw Zin؛ Oo, Thein Hlaing (2021)، "Pernicious anemia: Pathophysiology and diagnostic difficulties"، Journal of Evidence-Based Medicine (باللغة الإنجليزية)، 14 (2): 161–169، doi:10.1111/jebm.12435، ISSN 1756-5391، مؤرشف من الأصل في 10 نوفمبر 2021.
- "Pernicious anemia: MedlinePlus Medical Encyclopedia"، www.nlm.nih.gov (باللغة الإنجليزية)، مؤرشف من الأصل في 05 يوليو 2016، اطلع عليه بتاريخ 12 مايو 2018.
- Li, Kenneth؛ McKay, Gerald (23 مارس 2000)، "Ischemic Retinopathy Caused by Severe Megaloblastic Anemia"، New England Journal of Medicine، 342 (12): 860–860، doi:10.1056/NEJM200003233421205، ISSN 0028-4793، PMID 10727590، مؤرشف من الأصل في 12 يونيو 2018.
- Ata, Fateen؛ Bint I Bilal, Ammara؛ Javed, Saad؛ Shabir Chaudhry, Hammad؛ Sharma, Rohit؛ Fatima Malik, Rubab؛ Choudry, Hassan؛ Bhaskaran Kartha, Anand (05 نوفمبر 2020)، "Optic neuropathy as a presenting feature of vitamin B-12 deficiency: A systematic review of literature and a case report"، Annals of Medicine and Surgery، 60: 316–322، doi:10.1016/j.amsu.2020.11.010، ISSN 2049-0801، PMID 33204422، مؤرشف من الأصل في 21 يناير 2022.
- Hvas, Anne-Mette؛ Nexo, Ebba (نوفمبر 2006)، "Diagnosis and treatment of vitamin B12 deficiency--an update"، Haematologica، 91 (11): 1506–1512، ISSN 1592-8721، PMID 17043022، مؤرشف من الأصل في 5 ديسمبر 2018.
- "Harmful and Sneaky - Vitamin B12 deficiency | Unjury Protein"، unjury.com، مؤرشف من الأصل في 14 سبتمبر 2021، اطلع عليه بتاريخ 14 سبتمبر 2021.
- "Vitamin B12 or folate deficiency anaemia - Complications"، nhs.uk (باللغة الإنجليزية)، 20 أكتوبر 2017، مؤرشف من الأصل في 16 يوليو 2021، اطلع عليه بتاريخ 13 أكتوبر 2021.
- "Redirecting"، linkinghub.elsevier.com، مؤرشف من الأصل في 29 ديسمبر 2018، اطلع عليه بتاريخ 06 مايو 2018.
- Christensen, Erik Ilsø؛ Birn, Henrik (2002-04)، "Megalin and cubilin: multifunctional endocytic receptors"، Nature Reviews Molecular Cell Biology (باللغة الإنجليزية)، 3 (4): 258–267، doi:10.1038/nrm778، ISSN 1471-0072، مؤرشف من الأصل في 17 ديسمبر 2019.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - "Pernicious anemia – Genetic insights"، Autoimmunity Reviews (باللغة الإنجليزية)، 10 (8): 455–459، 01 يونيو 2011، doi:10.1016/j.autrev.2011.01.009، ISSN 1568-9972، مؤرشف من الأصل في 08 مارس 2020.
- De Block, Christophe E. M.؛ De Leeuw, Ivo H.؛ Van Gaal, Luc F. (2008-02)، "Autoimmune Gastritis in Type 1 Diabetes: A Clinically Oriented Review"، The Journal of Clinical Endocrinology & Metabolism (باللغة الإنجليزية)، 93 (2): 363–371، doi:10.1210/jc.2007-2134، ISSN 0021-972X، مؤرشف من الأصل في 28 يونيو 2018.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - Lahner, Edith؛ Annibale, Bruno (2009)، "Pernicious anemia: New insights from a gastroenterological point of view"، World Journal of Gastroenterology (باللغة الإنجليزية)، 15 (41): 5121، doi:10.3748/wjg.15.5121، ISSN 1007-9327، مؤرشف من الأصل في 2 يونيو 2018.
- Desai, H. G.؛ Gupte, P. A. (ديسمبر 2007)، "Helicobacter pylori link to pernicious anaemia"، The Journal of the Association of Physicians of India، 55: 857–859، ISSN 0004-5772، PMID 18405134، مؤرشف من الأصل في 23 يوليو 2018.
- Kaferle, Joyce؛ Strzoda, Cheryl E. (01 فبراير 2009)، "Evaluation of macrocytosis"، American Family Physician، 79 (3): 203–208، ISSN 0002-838X، PMID 19202968، مؤرشف من الأصل في 12 أبريل 2019.
- von Drygalski, Annette؛ Andris, Deborah A. (2009-04)، "Anemia After Bariatric Surgery: More Than Just Iron Deficiency"، Nutrition in Clinical Practice (باللغة الإنجليزية)، 24 (2): 217–226، doi:10.1177/0884533609332174، ISSN 0884-5336، مؤرشف من الأصل في 08 مارس 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - John, Seeniann؛ Hoegerl, Carl (نوفمبر 2009)، "Nutritional deficiencies after gastric bypass surgery"، The Journal of the American Osteopathic Association، 109 (11): 601–604، ISSN 1945-1997، PMID 19948694، مؤرشف من الأصل في 21 أكتوبر 2019.
- Whittingham, Senga؛ Mackay, IanR.؛ Ungar, Berta؛ Mathews, J.D. (مايو 1969)، "THE GENETIC FACTOR IN PERNICIOUS ANÆMIA"، The Lancet، 293 (7602): 951–954، doi:10.1016/s0140-6736(69)91856-x، ISSN 0140-6736، مؤرشف من الأصل في 08 مارس 2020.
- Wangel, A. G.؛ Callender, S. T.؛ Spray, G. H.؛ Wright, R. (فبراير 1968)، "A Family Study of Pernicious Anaemia: II. INTRINSIC FACTOR SECRETION, VITAMIN B12ABSORPTION AND GENETIC ASPECTS OF GASTRIC AUTOIMMUNITY"، British Journal of Haematology (باللغة الإنجليزية)، 14 (2): 183–204، doi:10.1111/j.1365-2141.1968.tb01486.x، ISSN 0007-1048، مؤرشف من الأصل في 08 مارس 2020.
- Langan, Robert C.؛ Goodbred, Andrew J. (15 سبتمبر 2017)، "Vitamin B12 Deficiency: Recognition and Management"، American Family Physician، 96 (6): 384–389، ISSN 0002-838X، مؤرشف من الأصل في 8 أغسطس 2021.
- Wickramasinghe, S.N. (2006-11)، "Diagnosis of megaloblastic anaemias"، Blood Reviews، 20 (6): 299–318، doi:10.1016/j.blre.2006.02.002، ISSN 0268-960X، مؤرشف من الأصل في 08 مارس 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - O’Leary, Fiona؛ Samman, Samir (05 مارس 2010)، "Vitamin B12 in Health and Disease"، Nutrients، 2 (3): 299–316، doi:10.3390/nu2030299، ISSN 2072-6643، PMID 22254022، مؤرشف من الأصل في 06 يناير 2020.
- Oh, Robert؛ Brown, David L. (01 مارس 2003)، "Vitamin B12 deficiency"، American Family Physician، 67 (5): 979–986، ISSN 0002-838X، PMID 12643357، مؤرشف من الأصل في 27 نوفمبر 2019.
- Stover, Patrick J. (يونيو 2004)، "Physiology of folate and vitamin B12 in health and disease"، Nutrition Reviews، 62 (6 Pt 2): S3–12, discussion S13، ISSN 0029-6643، PMID 15298442، مؤرشف من الأصل في 28 ديسمبر 2018.
- Snow, Christopher F. (28 يونيو 1999)، "Laboratory Diagnosis of Vitamin B12 and Folate Deficiency"، Archives of Internal Medicine (باللغة الإنجليزية)، 159 (12): 1289، doi:10.1001/archinte.159.12.1289، ISSN 0003-9926، مؤرشف من الأصل في 28 يونيو 2018.
- "Intrinsic Factor Antibody"، Lab Tests Online (باللغة الإنجليزية)، 19 مارس 2021، مؤرشف من الأصل في 8 أكتوبر 2021، اطلع عليه بتاريخ 15 أكتوبر 2021.
- https://doi.org/10.1186%2F1750-1172-1-17 نسخة محفوظة 2020-09-25 على موقع واي باك مشين.
- Laboratory diagnosis of vitamin B12 and folate deficiency: a guide for the primary care physician. - PubMed - NCBI نسخة محفوظة 16 فبراير 2017 على موقع واي باك مشين.
- "How are serum folic acid, methylmalonic acid, and homocysteine values used to differentiate folic acid deficiency from pernicious anemia?"، www.medscape.com (باللغة الإنجليزية)، مؤرشف من الأصل في 15 أكتوبر 2021، اطلع عليه بتاريخ 15 أكتوبر 2021.
- Laboratory Diagnosis of Vitamin B12 and Folate Deficiency: A Guide for the Primary Care Physician | Nutrition | JAMA Internal Medicine | JAMA Network "نسخة مؤرشفة"، مؤرشف من الأصل في 25 سبتمبر 2020، اطلع عليه بتاريخ 7 مايو 2018.
- Oral vitamin B12 versus intramuscular vitamin B12 for vitamin B12 deficiency: a systematic review of randomized controlled trials. - PubMed - NCBI نسخة محفوظة 03 مايو 2018 على موقع واي باك مشين.
- Usha؛ Ramakrishnan (2000)، Nutritional anemias، Boca Raton: CRC Press، ISBN 978-0849385698.
- Andres E., Serra K. (2012). "Optimal management of pernicious anemia". Journal of Blood Medicine. 3: 97–103.
- Carmel, Ralph (15 سبتمبر 2008)، "How I treat cobalamin (vitamin B12) deficiency"، Blood، 112 (6): 2214–2221، doi:10.1182/blood-2008-03-040253، ISSN 0006-4971، PMID 18606874، مؤرشف من الأصل في 28 أغسطس 2017.
- "ISBN0781765072 - بحث Google"، www.google.com، مؤرشف من الأصل في 06 يوليو 2017، اطلع عليه بتاريخ 06 مايو 2018.
- Efficacy of oral cobalamin (vitamin B12) therapy: Expert Opinion on Pharmacotherapy: Vol 11, No 2 نسخة محفوظة 10 يناير 2020 على موقع واي باك مشين.
- Cuskelly, Geraldine J.؛ Mooney, Kathleen M.؛ Young, Ian S. (2007-11)، "Folate and vitamin B12: friendly or enemy nutrients for the elderly"، The Proceedings of the Nutrition Society، 66 (4): 548–558، doi:10.1017/S0029665107005873، ISSN 0029-6651، PMID 17961276، مؤرشف من الأصل في 9 يناير 2021.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - History, Leith، "History of Leith, Edinburgh » James Scarth Combe"، www.leithhistory.co.uk، مؤرشف من الأصل في 20 يونيو 2018، اطلع عليه بتاريخ 06 مايو 2018.
- "Whonamedit - dictionary of medical eponyms"، www.whonamedit.com (باللغة الإنجليزية)، مؤرشف من الأصل في 15 ديسمبر 2018، اطلع عليه بتاريخ 06 مايو 2018.
- Sinclair, Leonard (01 مايو 2008)، "Recognizing, treating and understanding pernicious anaemia"، Journal of the Royal Society of Medicine، 101 (5): 262–264، doi:10.1258/jrsm.2008.081006، ISSN 0141-0768، PMID 18463283، مؤرشف من الأصل في 16 نوفمبر 2021.
- "Vitamin B-12 Associated Neurological Diseases: Background, Pathophysiology, Epidemiology"، 11 مارس 2022، مؤرشف من الأصل في 4 مارس 2022.
{{استشهاد بدورية محكمة}}: Cite journal requires|journal=(مساعدة) - Bunn, H. Franklin (20 فبراير 2014)، Longo, Dan L. (المحرر)، "Vitamin B 12 and Pernicious Anemia — The Dawn of Molecular Medicine"، New England Journal of Medicine (باللغة الإنجليزية)، 370 (8): 773–776، doi:10.1056/NEJMcibr1315544، ISSN 0028-4793، PMID 24552327، مؤرشف من الأصل في 9 يونيو 2018.
- Mon, Dr David Lipschitz Published:؛ July 15؛ Mon, 2013 12:00 AM Updated:؛ July 15؛ Am, 2013 10:26، "The Oklahoman"، www.oklahoman.com (باللغة الإنجليزية)، مؤرشف من الأصل في 16 نوفمبر 2021، اطلع عليه بتاريخ 16 نوفمبر 2021.
{{استشهاد ويب}}: صيانة CS1: extra punctuation (link) صيانة CS1: أسماء عددية: قائمة المؤلفون (link) - The Nobel Prize in Physiology or Medicine 1934 نسخة محفوظة 02 أكتوبر 2017 على موقع واي باك مشين.
- "The Nobel Prize in Chemistry 1964"، NobelPrize.org (باللغة الإنجليزية)، مؤرشف من الأصل في 10 نوفمبر 2021، اطلع عليه بتاريخ 18 نوفمبر 2021.
- Taylor, K. B.؛ Roitt, I. M.؛ Doniach, D.؛ Couchman, K. G.؛ Shapland, C. (24 نوفمبر 1962)، "Autoimmune Phenomena in Pernicious Anaemia: Gastric Antibodies"، British Medical Journal، 2 (5316): 1347–1352، ISSN 0007-1447، PMID 13993616، مؤرشف من الأصل في 16 نوفمبر 2021.
- John G. Sotos, What an Afflication -- Mary Todd Lincoln's Fatal Pernicious Anemia. Perspectives in Biology and Medicine. 2015; 58: 419-443
- Stabler, Sally P.؛ Allen, Robert H. (09 يونيو 2004)، "Vitamin b12 deficiency as a worldwide problem"، Annual Review of Nutrition، 24 (1): 299–326، doi:10.1146/annurev.nutr.24.012003.132440، ISSN 0199-9885، مؤرشف من الأصل في 05 مارس 2020.
- "Redirecting"، linkinghub.elsevier.com، مؤرشف من الأصل في 27 يونيو 2018، اطلع عليه بتاريخ 06 مايو 2018.
- Fedosov, Sergey N.؛ Laursen, Niels B.؛ Nexo, Ebba؛ Moestrup, Soren K.؛ Petersen, Torben E.؛ Jensen, Erik O.؛ Berglund, Lars (2003-08)، "Human intrinsic factor expressed in the plant Arabidopsis thaliana"، European Journal of Biochemistry (باللغة الإنجليزية)، 270 (16): 3362–3367، doi:10.1046/j.1432-1033.2003.03716.x، ISSN 0014-2956، مؤرشف من الأصل في 08 مارس 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - Sharabi, Amir؛ Cohen, Eytan؛ Sulkes, Jaqueline؛ Garty, Moshe (2003-12)، "Replacement therapy for vitamin B12 deficiency: comparison between the sublingual and oral route"، British Journal of Clinical Pharmacology، 56 (6): 635–638، doi:10.1046/j.1365-2125.2003.01907.x، ISSN 0306-5251، PMID 14616423، مؤرشف من الأصل في 11 مارس 2017.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - "Redirecting"، linkinghub.elsevier.com، مؤرشف من الأصل في 13 يونيو 2018، اطلع عليه بتاريخ 06 مايو 2018.
- Transdermal Patch and Method For Delivery Of Vitamin B12، مؤرشف من الأصل في 10 يناير 2020، اطلع عليه بتاريخ 06 مايو 2018
- "Vitamin B12 loaded polycaprolactone nanofibers: A novel transdermal route for the water soluble energy supplement delivery"، International Journal of Pharmaceutics (باللغة الإنجليزية)، 444 (1–2): 70–76، 28 فبراير 2013، doi:10.1016/j.ijpharm.2013.01.040، ISSN 0378-5173، مؤرشف من الأصل في 17 ديسمبر 2019.
- بوابة طب