Agelaius phoeniceus
El tordo sargento[2][3] (Agelaius phoeniceus), también conocido como sargento alirrojo,[4] tordo alirrojo,[5] tordo capitán[5] o turpial alirrojo,[6] es una especie de ave paseriforme de la familia Icteridae.[6] Es un pájaro de hábitos migratorios que habita en zonas húmedas y terrenos de cultivo de América del Norte y Central.[6] Presenta un marcado dimorfismo sexual vinculado a una sensible diferencia en su tamaño y al color del plumaje,[7][8] que se manifiesta a temprana edad.[9] Las hembras son principalmente marrones con un intenso veteado ventral y los machos, predominantemente negros con un par de manchas rojas bordeadas por una banda amarilla sobre las alas.[5][6] Los insectos y las semillas constituyen la mayor parte de su dieta.[5][6][10] Es considerado una plaga para la agricultura.[10][11][12] Quizá sea el ave nativa más abundante de América del Norte,[5] con una población estimada de ciento noventa millones de individuos para 1974 solo en Estados Unidos,[13] por lo que ha sido clasificado como especie bajo preocupación menor.[1][5] Sus poblaciones crecieron enormemente a mediados del siglo XX.[5] El tordo sargento ha sido extensivamente estudiado debido a su sistema de emparejamiento poligínico.[9][14] También se destaca por su alto grado de territorialismo[15] durante la época reproductora.[11]
| Tordo sargento | ||
|---|---|---|
 | ||
| Estado de conservación | ||
 Preocupación menor (UICN)[1] | ||
| Taxonomía | ||
| Reino: | Animalia | |
| Filo: | Chordata | |
| Clase: | Aves | |
| Orden: | Passeriformes | |
| Familia: | Icteridae | |
| Género: | Agelaius | |
| Especie: |
A. phoeniceus (Linnaeus, 1766)[1] | |
| Distribución | ||
 | ||
| Subespecies | ||
Véase «Subespecies». | ||
| Subartículos |
Taxonomía
.jpg.webp)
El tordo sargento es una de las once especies tradicionalmente clasificadas dentro del género Agelaius,[10][16] y una de las cinco que siguen siendo consideradas parte de este desde la reclasificación del Congreso Ornitológico Internacional de 2010.[16] Pertenece a la familia de los ictéridos, la cual comprende a aves paseriformes oriundas de América del Norte y del Sur.[2][10] Carlos Linneo lo describió bajo el nombre de Oriolus phoeniceus en su obra Systema naturae en el siglo XVIII,[10][17] pero en 1816 Louis Jean Pierre Vieillot lo reclasificó dentro del género Agelaius junto con otras aves.[2][10][17][18] Este nombre es una latinización del griego agelaios, «perteneciente a una bandada». El nombre de la especie, phoeniceus, es una palabra latina que significa «rojo intenso».[10]
Importantes diferenciaciones morfológicas entre distintas poblaciones han surgido aparentemente en un contexto de relativamente escasa divergencia filogénica. Cabe destacar que si bien los tordos sargento adultos exhiben una considerable variabilidad en su morfología entre distintas regiones, experimentos de trasplante de huevos entre nidos demuestran que una proporción significativa de las diferencias regionales en el desarrollo de los polluelos no está relacionada con la genética. Es probable que la reducida diferenciación filogeográfica en esta especie en comparación a otros vertebrados estudiados se deba a niveles de flujo genético históricamente elevados, posibles gracias a su gran capacidad de dispersión mediada por la habilidad de volar. Comparado con otros vertebrados, tales como el ratón ciervo (Peromyscus maniculatus), el tordo sargento es una especie altamente interconectada desde un punto de vista genético, sin grandes subdivisiones filogénicas. Aunque la mayoría de los tordos sargento —alrededor del 88%— se reproduce dentro de unos 100 kilómetros de su lugar de nacimiento, el resto se dispersa más allá de esa distancia, e incluso migraciones de larga distancia ocasionales podrían bastar para impedir una diferenciación genética sustancial a través de la deriva genética.[19]
Subespecies
Existen diversas subespecies, las cuales son bastante similares en apariencia.[10][20] La subespecie típica (A. p. phoeniceus) habita desde Ontario centro-septentrional al norte de Florida y desde el río Mississipi al océano Atlántico.[21] A pesar de las similitudes en la mayor parte de las formas de tordo sargento, en la subespecie de la Mesa Central Mexicana, A. p. gubernator, el veteado de la hembra está muy reducido y se restringe a la garganta; el resto del plumaje es marrón muy oscuro.[10][22] En las subespecies californianas, A. p. californicus y A. p. mailliardorum, el veteado de los ejemplares femeninos también cubre una menor superficie y el plumaje es marrón oscuro, aunque no en el grado de gubernator;[22] asimismo su lista superciliar está ausente o poco desarrollada.[20] Los machos de las subespecies mailliardorum, californicus, aciculatus, neutralis y gubernator carecen de la banda amarilla en el ala presente en la mayoría de los miembros masculinos de la especie.[10][20][23] El mayito de la ciénaga (Agelaius assimilis), endémico de Cuba, era considerado antiguamente una subespecie de tordo sargento, pero luego se lo reconoció como una especie distinta.[24]
A continuación, se listan las subespecies y grupos de subespecies de tordo sargento reconocidos a la fecha de enero de 2014 con sus respectivas áreas de distribución y la ubicación de sus cuarteles de invernada:
- Grupo phoeniceus:
- A. p. arctolegus – desde el sudeste de Alaska y Yukón al centro-norte Estados Unidos; migra al centro-sur de Estados Unidos.
- A. p. fortis – desde Montana al sudeste de Nuevo México (este de las Montañas Rocosas); migra a Texas.
- A. p. nevadensis – desde el sudeste de la Columbia Británica a Idaho, sudeste de California y sur de Nevada; migra al sur de Arizona.
- A. p. caurinus – desde la costa sudoeste de Columbia Británica al noroeste de California; migra a California central.
- A. p. aciculatus – montañas del centro-sur de California (centro-este del condado de Kern).
- A. p. neutralis – desde la costa del sur de California (condado de San Luis Obispo) al noroeste de Baja California.
- A. p. sonoriensis – desde el sudeste de California al noreste de Baja California, sur de Nevada, Arizona central y noroeste de México.
- A. p. nyaritensis – llanuras costeras del sudoeste de México (Nayarit).
- A. p. grinnelli – vertiente del Pacífico desde el oeste de Guatemala al noroeste de Costa Rica (Guanacaste).
- A. p. phoeniceus – desde el sudeste de Canadá a Texas y sudeste de Estados Unidos.
- A. p. littoralis – costa del Golfo desde el sudeste de Texas al noroeste de Florida.
- A. p. mearnsi – extremo sudeste de Georgia y norte de Florida.
- A. p. floridanus – sur de Florida (Everglades a Cayo Hueso).
- A. p. megapotamus – desde Texas central y el bajo valle del Río Bravo al este de México (norte de Veracruz).
- A. p. richmondi – vertiente caribeña de México (sur de Veracruz) a Belice y norte de Guatemala.
- A. p. pallidulus – sudeste de México (norte de la península de Yucatán).
- A. p. nelsoni – centro-sur de México (desde Morelos y el adyacente Guerrero al oeste de Puebla y Chiapas).
- A. p. matudae – sudeste tropical de México.
- A. p. arthuralleni – norte de Guatemala.
- A. p. brevirostris – vertiente caribeña de Honduras y sudeste de Nicaragua.
- A. p. bryanti – noroeste de las Bahamas.
- Grupo californicus/mailliardorum:
- A. p. mailliardorum – costa de California central.
- A. p. californicus – Valle Central de California.
- Grupo gubernator:
Descripción


La coloración del plumaje del macho es negra, a excepción de las plumas cobertoras alares menores —las que cubren los hombros—, que son escarlata,[3] y pueden apreciarse cuando el ave está en vuelo o exhibiéndose.[10] También muestra una banda amarilla pálido más pequeña debajo de las manchas rojas, la cual se vuelve visible en reposo,[10] y se corresponde con las plumas medianas.[3] Las manchas de los machos de menos de un año de edad, generalmente subordinados, son más pequeñas y anaranjadas que las de los adultos.[25]
Las partes superiores de la hembra son de color marrón, mientras que las inferiores están cubiertas por un intenso veteado blanco y oscuro;[6] presenta asimismo una lista superciliar blanquecina.[5][26] Las hembras de un año exhiben una mancha rosada o salmón sobre los hombros y una coloración rosada clara en el rostro y debajo de este, mientras que las de mayor edad muestran una mancha por lo general más carmesí sobre los hombros y una tonalidad rosada oscura en el rostro y debajo del mismo.[27] Observaciones en hembras en cautividad indican que pequeñas cantidades de pigmento amarillo están presentes en los hombros de estas tras abandonar el nido, que la concentración del pigmento aumenta con el primer plumaje de invierno tras la muda de las plumas y que el pasaje de amarillo a naranja tiene lugar generalmente en el segundo verano con la adquisición del segundo plumaje de invierno, después de lo cual ya no se producen nuevos cambios en el color de las plumas.[28] El área coloreada en el ala aumenta en superficie con la edad de la hembra,[9] y varía en intensidad de marrón a un rojo-anaranjado brillante similar al de los machos en su primer año.[29]
Los juveniles son similares a las hembras adultas, pero presentan una coloración abdominal más pálida y bordes beiges en las plumas.[10] A diferencia de la mayor parte de los paseriformes norteamericanos, que desarrollan su plumaje adulto en su primer año de vida, de modo que el individuo de un año y el de más edad son indistinguibles en la temporada reproductiva, el tordo sargento no lo adquiere sino hasta después de la época de reproducción del año siguiente a su nacimiento, cuando tiene entre trece y quince meses de edad.[30] Los machos jóvenes atraviesan una etapa de transición en la que las manchas alares presentan una coloración anaranjada antes de adquirir el tono más intenso típico de los adultos.[26]
El macho mide entre 22 y 24 cm de longitud, mientras que la hembra, 17 o 18 cm.[10] Su envergadura es de entre 31 y 40 cm aproximadamente.[nota 2][5] El pico en ambos sexos es largo, delgado y puntiagudo.[6][26][31] Tanto el pico del macho como las patas, las garras y los ojos son negros;[6][26][32] en la hembra el pico es marrón oscuro en la mitad superior y claro en la inferior.[26] La cola es de longitud media y redondeada.[5][10] Así como en otras especies poligínicas, existe en el tordo sargento un considerable dimorfismo sexual tanto en el plumaje como en el tamaño, pesando los machos entre 65 y 80 g y las hembras alrededor de 35 g.[11][33] Los machos son un 50% más pesados que las hembras,[nota 3] un 20% más grandes en sus dimensiones lineares,[7] y un 20% más grandes respecto de la longitud de sus alas.[8] La tendencia hacia un mayor dimorfismo en el tamaño de las especies de ictéridos no monógamas indica que el mayor tamaño de los machos ha evolucionado a causa de la selección sexual.[8]

El macho es inconfundible a lo largo de la mayor parte de su área de distribución, excepto en California y algunas áreas aledañas, en donde cohabita con el tordo tricolor (Agelaius tricolor), de aspecto similar.[5][10] Sin embargo, el macho de esa especie presenta manchas alares de un color rojo más intenso, bordeadas de blanco en vez de amarillo.[5][10] En vuelo, es posible discriminar entre estos e ictéridos menos emparentados —tales como el zanate norteño (Quiscalus quiscula) y el tordo cabecicafé (Molothrus ater)— por su particular silueta y su movimiento ondulante.[10]
Coloración de las manchas rojas y las bandas amarillas
Dos ketocarotenoides —carotenoides con un grupo cetona— rojos sintetizados por las propias aves —a saber, la astaxantina y la cantaxantina— son responsables del brillante color rojo de las manchas alares, pero dos pigmentos precursores dietarios amarillos —la luteína y la zeaxantina— también están presentes en concentraciones moderadamente altas en las plumas rojas. La astaxantina es el carotenoide más abundante (35% del total), seguida por la luteína (28%), la cantaxantina (23%) y la zeaxantina (12%). Una combinación tan balanceada de precursores dietarios y derivados metabólicos en las plumas de color es bastante inusual, no solo dentro de una especie en su conjunto sino también en individuos y plumas particulares.[34]
Después de extraer los carotenoides en un experimento, las plumas rojas adquirían una coloración marrón profundo. Esto se debe a que las bárbulas de las plumas de la mancha coloreada contienen pigmentos melanínicos —principalmente eumelanina, que equivalía al 83% del total de las melaninas, pero también feomelanina— en una concentración aproximadamente igual a la de los carotenoides, lo cual parece ser un rasgo poco común para un plumaje ornamental de base carotenoidea. Por otro lado, las plumas de las franjas amarillas de los machos están desprovistas de carotenoides —excepto ocasionalmente cuando aparecen teñidas de una coloración rosada derivada de pequeñas cantidades de dichos pigmentos— y presentan altas concentraciones de feomelanina —82% del total de las melaninas—. Las concentraciones de melanina en la banda amarilla son aún más altas que en la mancha roja.[34]
Función de las manchas alares
Estas manchas son vitales en la defensa del territorio.[35] Los machos con las manchas más grandes son más efectivos al ahuyentar a sus rivales no territoriales y tienen mayor éxito en contiendas dentro de aviarios.[36][37][38] Al teñirlas de negro como parte de un experimento, el 64% de los machos perdió sus territorios, mientras que solo el 8% de los individuos de control lo hizo. Sin embargo, los machos cuyas alas habían sido teñidas antes de que hubieran conseguido pareja aún podían atraer hembras y reproducirse exitosamente. En el tordo sargento, las manchas sobre las alas constituyen una señal de amenaza entre los machos y tienen un rol poco importante, si es que acaso tienen alguno, en encuentros intersexuales. Por lo tanto, es probable que las manchas hayan evolucionado en respuesta a las presiones vinculadas a la selección intrasexual.[39] Adicionalmente, ni el tamaño ni la coloración de las mismas están vinculados al éxito reproductivo de los machos con aquellas hembras que no son compañeras suyas, es decir, aquellas con las que copulan eventualmente.[35] Se ha sugerido que también en el caso de las hembras la mejor explicación para la evolución de una coloración variable en las manchas de los hombros es que su intensidad indique la condición física de estas en encuentros agresivos entre las mismas.[29]
El hecho de que las hembras de tordo sargento no parezcan utilizar consistentemente la variabilidad en el tamaño y color de las manchas alares de los machos a la hora de elegir compañero va en contra de la función clásica de las plumas ornamentales de pigmentación carotenoidea, mayormente empleadas en la atracción de pareja. A su vez, su uso como señal de agresividad y estatus social frente a machos rivales no es un rasgo común en los ornamentos carotenoideos. Por otro lado, los ornamentos con preponderancia de melanina sí suelen tener un rol importante como indicador de estatus en las poblaciones aviares, por lo que las manchas de los tordos sargento parecerían funcionar más como ornamentos melanínicos que como carotenoideos.[34]
Muda de las plumas
El período más crítico de la muda de las plumas se extiende entre fines de agosto y comienzos de septiembre. Cuando se los observa en vuelo, presentan una apariencia desalineada o «apolillada» y, por lo general, un desplazamiento más lento y trabajoso. Su movilidad se ve reducida debido a que les faltan varias rémiges o rectrices o estas no están enteramente renovadas. La mayor parte de los tordos sargento ha mudado casi por completo para el 1 de octubre. Para entonces, algunas aves no han concluido la muda de las plumas de la región capital y las plumas timoneras del centro de la cola y las rémiges secundarias internas han emergido solo parcialmente de la vaina. Virtualmente todos los individuos han finalizado sus mudas para mediados de octubre.[40]
Las aves no comienzan su migración a los cuarteles de invernada hasta que las dos rémiges primarias externas y las dos rectrices internas o centrales hayan completado al menos dos tercios de su desarrollo. Por lo tanto, existe una correlación entre la muda, particularmente el reemplazo de las rémiges y rectrices, y la migración de otoño en los tordos sargento.[40]
Sucesión de plumajes y mudas
- Plumaje juvenil: tanto en machos como en hembras, el plumaje juvenil es similar en color y patrón al de la hembra adulta, excepto por la coloración amarilla de la parte inferior del cuerpo y de los costados de la cabeza. Las manchas de los hombros aparecen moteadas y son marrones y amarillas o marrones y beiges.[40] Otras fuentes describen el plumaje juvenil del macho de la siguiente manera: arriba, incluyendo los costados de la cabeza, las alas, la cola y las cobertoras menores —las plumas de los «hombros»—, negro amarronado apagado —no se aprecia nada de rojo en esta etapa—, con las plumas bordeadas de beige, más pálido y angosto en las primarias, rectrices, cabeza y obispillo y más profundo en las escapulares y secundarias; debajo, beige rosáceo, ocre sobre la barbilla, densamente veteado —excepto en la barbilla— con listas negras amarronadas; lista superciliar ocre-beige poco definida. La hembra es descrita como más marrón por encima con menos beige por debajo y la barbilla estrechamente veteada.[41]
- Primera muda prebásica (o muda postjuvenil): generalmente comienza entre 45 y 60 días después de que los individuos hayan abandonado el nido.[40] La muda empieza en agosto y el momento en el que se inicia varía entre las nidadas tempranas y las tardías.[41] Se trata de una muda completa, excepto por la retención en algunos individuos de unas pocas plumas cobertoras de debajo del ala.[40]
- Aspecto en otoño e invierno del primer plumaje básico (también denominado primer plumaje de invierno o plumaje inmaduro): en el macho, es negro, con las plumas de la parte superior del cuerpo bordeadas de marrón o beige y las de la parte inferior bordeadas de beige o blanco. El ave presenta entonces una apariencia moteada. La mancha del hombro es generalmente anaranjada moteada de negro, en especial sobre la franja amarilla. Algunos machos inmaduros tienen una mancha rojiza como los adultos, pero con motas negras en la banda amarilla. Otros tienen una mancha negruzca en el hombro.[40] Otras fuentes describen el primer plumaje de invierno del macho de la siguiente manera: todo el plumaje, incluyendo las alas y la cola, negro verdoso, gran parte del mismo con bordes beiges y óxido, más pálidos debajo y tenues o ausentes en las primarias y rectrices; cobertoras alares menores —«hombros»— oropimente-anaranjado apagado, cada pluma con barras o manchas subterminales negras; cobertoras medianas beiges ocre profundo, generalmente moteadas de negro en áreas subterminales, principalmente en las barbas de la parte interna de las plumas; raquis generalmente negros.[41]
- Las hembras son oscuras por encima con las plumas bordeadas de beige u óxido. La parte inferior exhibe vetas negras y blancas, pero con más beige en el pecho y a veces en los flancos que en el plumaje reproductivo. Las plumas cobertoras mayores medianas y secundarias están notablemente bordeadas de beige. Generalmente carecen de la coloración rosada en la barbilla y la garganta —que pueden ser beiges, amarillas o salmón claro— y la mancha alar carmesí —que puede ser óxido, anaranjada o grisácea— típicas del segundo plumaje de invierno.[40]
- Aspecto en primavera y verano del primer plumaje básico (también conocido como primer plumaje nupcial o plumaje subaldulto): los machos, que normalmente aún no están defendiendo un territorio, presentan una coloración negra apagada adquirida por el desgaste de los bordes de las plumas.[40][41] La mancha alar puede ser más notoria que en el primer plumaje de invierno debido al desgaste de las listas negras subterminales, que por lo general solo permanecen bajo la forma de pequeños puntos negros.[40] Las manchas alares moteadas son características de los individuos jóvenes y la extensión del anaranjado es muy variable.[41] Las hembras, que usualmente ya se están reproduciendo, exhiben un plumaje similar al primer plumaje de invierno, pero más oscuro por encima debido al desgaste de los bordes beiges u óxido de las plumas. El pecho es menos beige,[40] y presenta un veteado blanco y negro.[41]
- Segunda y subsecuentes mudas prebásicas (o mudas postnupciales): la segunda muda prebásica tiene lugar aproximadamente un año después de la primera. Las mudas postnupciales constituyen mudas completas, excepto por la retención ocasional de unas pocas plumas cobertoras de debajo del ala.[40]
- Aspecto en otoño e invierno del segundo y subsecuentes plumajes básicos (también llamado plumaje adulto de invierno o segundo plumaje de invierno): el macho ya no exhibe la apariencia moteada característica del aspecto en otoño e invierno del primer plumaje básico. La parte inferior es casi inmaculada y similar a la del plumaje reproductivo. Las plumas de la cabeza y la espalda y las cobertoras secundarias aparecen bordeadas de marrón y beige.[40] La mancha alar se torna escarlata-bermellón brillante, al tiempo que aparece la coloración beige ocre profundo en las cobertoras medianas.[40][41] Otras fuentes describen el plumaje adulto de invierno del macho de la siguiente manera: negro verdoso lustroso; plumas de la cabeza, espalda, cobertoras alares mayores y terciarias más o menos bordeadas, según el individuo, de beige y óxido; debajo, bordes más pálidos o ausentes.[41] El plumaje de la hembra es similar al aspecto en otoño e invierno del primer plumaje básico, excepto por el hecho de que la mancha alar es generalmente carmesí y la barbilla y la garganta, rosadas.[40]
- Aspecto en primavera y verano del segundo y subsecuentes plumajes básicos (o plumaje adulto nupcial): es adquirido a través del desgaste de las plumas.[40][41] Es similar al aspecto en primavera y verano del primer plumaje básico, pero las manchas alares de ambos sexos presentan una coloración más intensa, así como la barbilla y la garganta de la hembra.[40] Desaparecen los bordes beiges y marrones de las plumas de los machos.[41]
A pesar de que las puntas marrones o blancas en las plumas de los machos sean más grandes justo después de la muda y de que se desgasten a lo largo del año, los individuos varían considerablemente en cuanto al tamaño de esas puntas no negras en las plumas en primavera.[42]
Plumas alares
El reemplazo completo de las plumas alares requiere unas ocho semanas. Sin embargo, las aves en su primer año de edad frecuentemente retienen algunas de las cobertoras de debajo del ala y rémiges terciarias juveniles después de la muda postjuvenil. De setenta machos inmaduros examinados durante la última semana de octubre, el 70% conservaba algunas cobertoras primarias inferiores mayores. En la mayoría de los casos en los que se produce un reemplazo parcial de las plumas cobertoras, son las cobertoras proximales las que el ave retiene.[40]
Plumas remeras o rémiges
Las rémiges primarias son unas de las primeras plumas en mudar. La muda de estas plumas procede regularmente desde la primaria más interna —primaria I— hasta la más externa —primaria IX—. Para el 1 de octubre, la mayoría de las aves ya ha adquirido las tres nuevas primarias externas —VII, VIII y IX— o estas se encuentran en alguna etapa avanzada de desarrollo. Las fechas promedio para la compleción del desarrollo de las nuevas rémiges primarias son: 15 de agosto para la primaria I; 1 de septiembre, primarias II-IV; 15 de septiembre, primarias V y VI; y 1 de octubre, primarias VII-IX.[40]
La muda de las rémiges secundarias comienza con la más externa —secundaria I— y procede hacia adentro hasta la secundaria VI. La vaina de la secundaria I aparece más o menos al mismo tiempo en que todas las cobertoras secundarias han sido remplazadas y rara vez antes de mediados de agosto. Estas plumas no se renuevan totalmente sino hasta comienzos de octubre.[40]
La muda de las rémiges terciarias se inicia más o menos al mismo tiempo que la de las secundarias. La terciaria del medio cae primero, seguida de la terciaria interna. A menudo, ambas plumas se encuentran nuevamente bien desarrolladas antes de que la terciaria externa salga de la vaina.[40]
Plumas cobertoras y álula
Las cobertoras primarias mayores son cambiadas junto con sus respectivas rémiges primarias. A diferencia de las cobertoras primarias mayores, las cobertoras secundarias mayores mudan antes que las rémiges secundarias. La muda de estas plumas es rápida, con varias de ellas en la misma etapa de desarrollo simultáneamente. La progresión de la muda en estas plumas es de afuera hacia adentro, como en las rémiges secundarias. La mayoría de las aves ha completado la muda de las cobertoras secundarias para el 15 de agosto, más o menos al tiempo en que solo es apreciable la vaina de la rémige secundaria I.[40]
La muda de las cobertoras menores comienza temprano, siendo con frecuencia las primeras plumas en caer. El inicio de la muda en los juveniles machos es particularmente notorio debido a que implica el reemplazo de las cobertoras menores y resulta en la aparición de la mancha alar rojiza o anaranjada. La nueva mancha alar contrasta marcadamente con el plumaje juvenil marrón amarillento en esta área del ala. La muda de las cobertoras menores generalmente ha concluido para el 1 de septiembre.[40]
Las plumas del álula completan su desarrollo más o menos al mismo tiempo que las últimas tres rémiges primarias. Las cobertoras marginales sobre la superficie superior o exterior del antebrazo, ubicadas debajo del álula, mudan aproximadamente al mismo tiempo en que la rémige primaria VI está siendo remplazada.[40]
Las primeras plumas de debajo del ala en mudar son las cobertoras marginales, debajo del antebrazo. La muda de estas plumas comienza más o menos al mismo tiempo en que la rémige primaria IV cae y es seguida por la de las cobertoras primarias inferiores medias y secundarias inferiores medias. La progresión de la muda de las cobertoras secundarias inferiores medias es de afuera hacia adentro, mientras que la de las cobertoras primarias inferiores medias parece ser irregular o casi simultánea. Las cobertoras inferiores medias mudan antes que las rémiges primarias VIII y IX. Las cobertoras primarias inferiores mayores y secundarias inferiores mayores mudan por último. La progresión de la muda de estas últimas plumas es la misma que en las rémiges primarias y secundarias, es decir, de adentro hacia afuera y de afuera hacia adentro, respectivamente. La muda se completa más o menos al mismo tiempo que la de las rémiges primarias y secundarias.[40]
Plumas caudales y capitales
Las plumas caudales comprenden las plumas timoneras o rectrices y las cobertoras superiores e inferiores de la cola. Las cobertoras de la cola comienzan a mudar antes que las rectrices. Generalmente, las cobertoras superiores de la cola empiezan a mudar primero. Ciertas aves pierden algunas rectrices para el final de la tercera semana de agosto. Las timoneras del centro de la cola son las últimas rectrices en ser renovadas.[40]
La muda en la región capital implica el cambio de las plumas del píleo y de los lados de la cabeza. Es una de las últimas partes del cuerpo en comenzar el reemplazo de las plumas, pero el renovamiento de la mayor parte de las plumas capitales está completo antes que el de las rémiges secundarias, plumas de la cola y de debajo del ala. El inicio de la muda en esta región coincide con el comienzo del desarrollo de la rémige primaria V o VI. Algunos individuos ya han empezado el reemplazo de las plumas capitales para mediados de agosto. La muda comienza en el píleo y las últimas zonas de la región capital en completarla son la franja del ojo y las mejillas (región malar).[40]
Otras plumas
En algunas aves, los primeros signos de muda en las plumas ventrales aparecen durante los últimos días de julio, cuando las plumas de la porción anterior de los laterales comienzan a caer. Desde allí, la muda progresa hacia atrás a lo largo de los laterales y hacia adelante en dirección a la garganta y la barbilla. Las últimas plumas ventrales en ser remplazadas son aquellas hacia el centro del abdomen. La muda de las plumas dorsales se inicia alrededor de la primera semana de agosto. Empieza en el obispillo, avanza hacia la espalda alta y luego hacia la región cervical.[40]
La evidencia más temprana de muda en las plumas humerales corresponde a los últimos días de julio. La muda procede de la región anterior hacia atrás. El cambio de las plumas femorales comienza más tarde que el de las humerales. Sin embargo, la progresión es similar. El reemplazo de las plumas crurales rara vez se inicia antes del 15 de agosto. La progresión es generalmente del extremo proximal de la tibia a la región del tarsometatarso.[40]
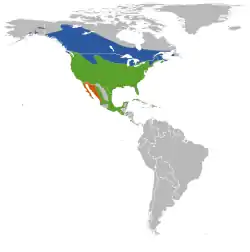
Distribución y hábitat
El tordo sargento está muy diseminado por toda América del Norte, excepto en el desierto árido, las altas cadenas montañosas y las regiones árticas o de forestación densa.[41] Se reproduce desde Alaska centro-oriental y Yukón, en el noroeste,[11] y Terranova, en el noreste,[10] hasta el norte de Costa Rica, en el sur, y del Atlántico al Pacífico.[11] Las poblaciones septentrionales migran al sur de los Estados Unidos, pero las que se reproducen allí, en México y en Centroamérica son sedentarias.[23] El área de distribución invernal del tordo sargento oriental cubre gran parte de su área distribución reproductiva en los estados del sudeste y del sur. La mayor parte de las aves pasa el invierno al sur de los ríos Ohio y Delaware y desde el norte de Florida hasta el norte de Luisiana y noreste de Texas. Por otro lado, algunos pocos ejemplares podrán ser encontrados ocasionalmente en invierno bastante más al norte de esos límites, incluso tan al norte y al este como el sudeste de Massachusetts, de manera local y principalmente a lo largo de la costa.[41]
Habita en áreas abiertas con hierba y generalmente prefiere los humedales.[10] Se reproduce tanto en pantanos de agua dulce como de agua salada.[10][26] Los pantanos con extensos lotes de totoras (Typha spp.), ciperáceas y carrizos (Phragmites australis) son su hábitat reproductivo favorito, aunque también puede hallársele allí donde tipos similares de vegetación, o arbustos o pequeños árboles hidrófilos, crezcan en estanques, alrededor de lagos o a lo largo de las orillas de arroyos de escaso caudal.[41] En gran parte de su área de distribución, constituye el ave paseriforme más abundante en los pantanos en los que nidifica.[11] También se encuentra presente en áreas sin mucha agua, en donde habita en campo abierto —a menudo áreas agrícolas— y bosques caducifolios poco densos.[26]
En el invierno de 1975-1976, en las cercanías de Milan (oeste de Tennessee), el 36% de los tordos sargento observados —que descansaban en un dormidero mixto que llegó a albergar 11 millones de individuos en enero y a comienzos de febrero en una plantación de 4,5 hectáreas de pino amarillo (Pinus taeda) con escaso sotobosque—[nota 4] fue visto en campos de soja durante el día, siendo que estos constituían solo el 21% del hábitat en la zona y que las otras especies de aves presentes en el dormidero no eran comúnmente observadas en esos campos; también eran comunes en maizales. Su presencia en feedlots aumentó a medida que avanzaba el invierno, pero, representando menos del 5% de los ictéridos y estorninos registrados tanto en feedlots de vacas como de cerdos, eran mucho más escasos allí que los tordos cabecicafé (Molothrus ater), zanates norteños (Quiscalus quiscula) y estorninos pintos (Sturnus vulgaris).[43]
Preferencias por tipos de hábitats durante la época de reproducción
Durante la época de reproducción, la densidad de adultos reproductivos es mucho mayor en pantanos que en campos en tierras altas.[38] Aunque las mayores concentraciones de tordos sargento anidando se encuentren en pantanos, la mayoría de ellos nidifica en hábitats de tierras altas puesto que son mucho más abundantes.[44][45][46] En un estudio llevado a cabo en el condado de Wood (norte de Ohio) entre 1964 y 1968, se constató una densidad de machos territoriales en humedales —pantanos y zanjas— 2,89 veces superior a la registrada en los hábitats de tierras altas —principalmente henares de alfalfa (Medicago sativa) y otras legumbres— y una proporción de 2,14 territorios en tierras altas por cada territorio en humedales, lo cual refleja una marcada preferencia por estos últimos hábitats así como su escasez.[47]
En un estudio en Illinois central, las poblaciones de tordos sargento eran mucho mayores a lo largo de carreteras interestatales que a los lados de rutas de menor envergadura. Esto probablemente se deba a que las primeras se ubicaban en medio de amplias franjas dominadas por el pasto azul de Kentucky (Poa pratensis), a menudo en compañía de arbustos y pequeños árboles. Por otro lado, las pequeñas dimensiones del área no cultivada a los lados de las rutas de menor envergadura presumiblemente brindaran menos sustratos adecuados para la nidificación.[48]
Según un estudio en el condado de Washtenaw (sudeste de Míchigan), en las áreas agrícolas, los tordos sargento parecen exhibir marcadas preferencias por ciertos tipos de hábitats durante la temporada reproductiva. Aquellos hábitats con más vegetación vieja —campos agrícolas en desuso y humedales— son ocupados tempranamente en la época de reproducción. El establecimiento de las aves en otros hábitats favorecidos pero con vegetación inadecuada —henares viejos y nuevos y pasturas— es pospuesto hasta que se haya desarrollado una suficiente cantidad de vegetación nueva. Los hábitats favorecidos inexistentes el año anterior —henares nuevos— son los últimos en ser ocupados. Cuando los nuevos henares finalmente comienzan a ser utilizados, son ocupados muy rápidamente, probableblemente por adultos sin sitios de reproducción y machos territoriales no exitosos.[49]
Preferencias por tipos de vegetación durante la época de reproducción
En ese mismo estudio, los individuos reproductivos en hábitats de tierras altas demostraban una ligera preferencia por pastos viejos y nuevos —Phleum pratense, Dactylis glomerata, Poa spp., Festuca spp., Bromus spp.— en la primera parte de la época de reproducción y plantas herbáceas no graminoides nuevas a mediados y finales de la temporada.[nota 5] En humedales, preferían consistentemente monocotiledóneas viejas y nuevas de hoja ancha —principalmente Carex spp. de hoja ancha y Typha spp.— y rechazaban consistentemente las monocotiledóneas viejas y nuevas de hoja angosta —primordialmente Carex spp. de hoja angosta, Phalaris arundinacea y Calamagrostis canadensis— y plantas herbáceas no graminoides. Los tordos sargento que se reproducían en tierras altas se inclinaban por la vegetación vieja de mayor altura solo en la primera parte de la temporada reproductiva —abril y mayo— y por la vegetación nueva más alta y la vegetación densa durante toda la temporada reproductiva. Por su parte, los que se establecían en humedales parecían tener una ligera predilección por la vegetación vieja más alta.[49] Durante la época de reproducción, esta especie se siente atraída a la vegetación alta y que restrinja la visibilidad.[49][50]
Las preferencias de principios de la temporada por pastos viejos en las tierras altas y monocotiledóneas viejas de hoja ancha en los humedales señalan la importancia de la vegetación residual erguida. Los pastos de las tierras altas y las monocotiledóneas de hoja ancha de los humedales se yerguen de manera parcialmente vertical y son fácilmente visibles a principios de la primavera, a diferencia de los tréboles, las monocotiledóneas de hoja angosta en los humedales y la mayoría de las plantas herbáceas no graminoides. Las plantas viejas de alfalfa también se encuentran parcialmente erguidas a inicios de la primavera, pero no constituye una especie tan consistentemente escogida como los pastos viejos. El comienzo de la actividad territorial es más temprano cuando la cantidad de vegetación residual es grande. La fortaleza estructural de la vegetación también parece ser importante para la nidificación dado que las hembras se inclinan por monocotiledóneas de hoja ancha en los humedales a lo largo de la época de reproducción y plantas herbáceas no graminoides nuevas a mediados y finales de la temporada.[49]
En el sudoeste de Míchigan, la densidad de tallos de totoras en diferentes estanques estaba positivamente relacionada con la concentración de adultos reproductivos.[51] Sin embargo, otros estudios detectaron una predilección por la vegetación más esparcida.[50][52] Uno de ellos encontró que los tordos sargento evitaban a los chivirenes pantaneros (Cistothorus palustris), un depredador común en nidos de esta especie, reproduciéndose entre vegetación más dispersa, que era más fácilmente defendida de los chivirines; a la inversa, los chivirines parecían preferir la vegetación más densa, en donde eran más proclives a evitar la agresividad del tordo sargento; estas diferencias en la selección del hábitat entre una y otra especie resultaban en una segregación espacial de sus áreas de reproducción.[52] Por otro lado, los tordos sargento suelen optar por lotes de vegetación pequeños y las plantas con tallos gruesos.[50]
Población
Quizá sea el ave nativa más abundante de América del Norte.[5] En el invierno de 1974-1975, el Servicio de Pesca y Vida Silvestre de los Estados Unidos estimó que en ese país, de once especies de aves —diez ictéridos y el estornino pinto (Sturnus vulgaris)— que se congregan en dormideros, el tordo sargento era por lejos la más abundante, representando el 37,8% del total —casi 190 millones de individuos—, habiendo ascendido considerablemente desde aproximadamente un 33% en 1963-1964. Cabe destacar que mientras que en los estados orientales constituía el 29,7% del total —alrededor de 111 millones—, en los occidentales componía el 61,4% —cerca de 79 millones—.[13] A pesar de representar allí un porcentaje mucho mayor sobre el total de ictéridos y estorninos, en el oeste del continente las poblaciones están más esparcidas que en el este.[53]
En el sudoeste de Míchigan, 1,78 polluelos por nidada lograron abandonar el nido, lo que implica una tasa de supervivencia del 54%.[51] En otro estudio en la misma población, por cada nidada de cuatro huevos en promedio eclosionaron 3,78 de ellos y 1,96 polluelos sobrevivieron hasta dejar el nido, lo que equivale a una tasa de mortalidad del 48% de los pequeños que conseguían romper el cascarón.[54] La cantidad promedio de polluelos por hembra que logran abandonar el nido cada temporada es de al menos 2,5. La tasa de supervivencia anual es de cerca del 60% para las aves adultas —de al menos un año de edad— y probablemente inferior al 40% para los individuos de menos de un año. El análisis de registros de aves marcadas indica que menos del 1% de los individuos identificados cuando eran polluelos logra superar los siete años de edad.[45] El ejemplar más longevo en estado salvaje del que se tenga registro vivió 15 años y 9 meses.[26]
En una población reproductiva en el condado de Brown (sur de Indiana), se descubrió que la proporción representada por cada sexo sobre el total de los polluelos que sobrevivía hasta dejar el nido variaba según la edad de la madre. Las hembras de más edad —5 años o más— producían una mayor cantidad de machos; las de mediana edad —3 o 4 años—, casi la misma proporción de hijos de ambos sexos, y las más jóvenes —1 o 2 años—, más hembras que machos. Más machos que hembras eclosionaban en los nidos de las madres de más edad, mientras que para las de mediana edad y las más jóvenes, la cantidad de recién nacidos de uno y otro sexo era más o menos equivalente. Los hijos de las hembras jóvenes morían de hambre más frecuentemente que los de las mayores y los pequeños fallecidos por esta causa eran generalmente machos, probablemente debido a que en el mismo intervalo de desarrollo estos alcanzan una masa corporal muy superior a la de las hembras y por lo tanto requieren un mayor suministro de energía, siendo más vulnerables ante un aprovisionamiento insuficiente. En el caso de las hembras de mediana edad, la proporción de polluelos machos y hembras al nacer estaba balanceada y no se alteraba luego por la mortalidad de estos. En la población en su conjunto, la cantidad de pequeños de ambos sexos estaba equilibrada.[9]
En un estudio en el este de Ontario, se encontró que, al nacer, la proporción de machos sobre hembras durante la época de reproducción en su conjunto era de 1 a 0,94. Sin embargo, las proporciones de individuos de uno y otro sexo sobre el total de los polluelos variaban conforme avanzaba la temporada: las nidadas iniciadas temprana y tardíamente —antes del 11 de mayo y después del 31 de mayo— producían más hembras y las de mediados de la temporada, más machos. Aunque dichas diferencias estacionales fueran pequeñas, el patrón descubierto en la proporción de pequeños de uno y otro sexo guardaba coherencia con el patrón de abundancia prevista de recursos, puesto que el mayor costo energético implicado en la crianza de machos en especies sexualmente dimórficas debería favorecer la producción de una mayor cantidad de polluelos de este sexo cuando el alimento abunda.[55]
Comportamiento

Se trata de aves territoriales, poligínicas, gregarias y migratorias de corta distancia. Su manera de volar es característica, con raptos de rápido batimiento de alas, entre los cuales se producen pequeñas pausas intermitentes.[41] El comportamiento de los machos hace que su presencia sea fácilmente percibida: se posan en lugares altos[5] —árboles, arbustos, cercas, líneas de teléfono, etc.—[56] y cantan durante todo el día. Las hembras suelen quedarse en lo bajo, merodeando entre la vegetación y construyendo sus nidos. Puede encontrárseles en jardines hogareños, particularmente durante su migración, si se ha esparcido semillas sobre el suelo.[5] Las cortinas forestales les sirven de lugar de descanso durante el día.[57]
Durante varias semanas después de su primera aparición a comienzos de la primavera, los tordos sargento son vistos generalmente en bandadas compuestas íntegramente por machos. Por esos días, rara vez se los ve en sus sitios de reproducción, excepto temprano en la mañana y tarde en la tarde. En la mayoría de las restantes horas del día, frecuentan terrenos agrícolas abiertos y a menudo elevados, en donde se alimentan principalmente en rastrojos de granos y campos cubiertos con hierbas. Cuando son molestados mientras comen, vuelan a los árboles caducifolios más cercanos e inmediatamente después de posarse comienzan a cantar.[41]
Alimentación
Esta especie es omnívora.[10][26] Se alimenta principalmente de productos vegetales —particularmente en otoño e invierno—,[6] tales como semillas de hierbas y granos (maíz, arroz, trigo, girasol, etc.),[5][12] pero alrededor de un cuarto de su alimentación —y significativamente más durante la temporada de reproducción— consiste en insectos y otros animales pequeños.[10][26] Consume principalmente insectos como libélulas, caballitos del diablo, mariposas, polillas y otros insectos alados, pero también caracoles, ranas, huevos, carroña, lombrices y arácnidos.[10] Consigue sus presas entre las plantas o atrapándolas en vuelo.[10][26] A veces las obtiene explorando la base de plantas acuáticas con su pico delgado, abriendo orificios para llegar a los insectos escondidos adentro.[5][26] Los insectos acuáticos, particularmente los odonatos emergentes, son de gran importancia en la dieta de los tordos sargento que se reproducen en pantanos. Estas aves típicamente capturan a los odonatos cuando las larvas trepan desde el agua por el tallo de una planta, se deshacen de sus exuvias y se aferran a la vegetación mientras sus exoesqueletos se endurecen.[51] Los años de emergencia de las cigarras periódicas (Magicicada spp.) proporcionan una cantidad superabundante de alimento.[29] En temporada, come además arándanos, moras y otras frutas.[10] Según Edward Howe Forbush, cuando llegan al norte en la primavera, se alimentan en los campos y prados. Luego, siguen a los arados, recogiendo larvas, lombrices y orugas dejadas al descubierto, y en caso de haber una plaga de orugas de Paleacrita vernata en un huerto de frutales, estas aves volarán un kilómetro para conseguirlas para sus polluelos.[41]
Se alimenta de maíz mientras este se encuentra en proceso de maduración; una vez que el grano se ha endurecido está relativamente a salvo de esta ave, puesto que su pico y sistema digestivo no están adaptados para el consumo de granos de maíz duros y enteros, a diferencia de lo que sucede con el zanate norteño (Quiscalus quiscula), que tiene un pico más largo y fuerte.[45] Estudios de los estómagos de individuos de ambos sexos revelan que los machos consumen mayores proporciones de granos de cultivo, mientras que las hembras ingieren una cantidad relativamente mayor de semillas de hierbas y materia animal.[28] En el invierno de 1975-1976, en las cercanías de Milan (oeste de Tennessee), el maíz y las semillas de hierbas constituyeron los principales alimentos consumidos por los tordos sargento. Las hierbas cuyas semillas eran comúnmente consumidas eran Sorghum halepense, Xanthium strumarium, Digitaria ischaemum, Sporobolus spp., Polygonum spp. y Amaranthus spp.[43]
Reproducción
El tordo sargento se reproduce en la mayor parte de América del Norte tanto en humedales como en hábitats de tierras altas.[54] Los machos llegan a las áreas de reproducción dos o tres semanas antes que las hembras para establecer sus territorios;[58][59] luego las hembras se asientan dentro de los mismos.[60][61] Los machos arriban a los sitios reprductivos a mediados de marzo,[58] y las hembras, a principios de abril.[62] Las hembras de mayor edad llegan antes que las de un año.[63] Los machos comienzan a establecer sus territorios durante la primera semana de abril y empiezan a producir espermatozoides durante la segunda.[58] En un estudio en el condado de Washtenaw (sudeste de Míchigan), se encontró que la diferencia temporal entre el establecimiento de los territorios por parte de los machos y la aparición de las hembras en dichos territorios variaba en función del hábitat: al menos cuatro semanas en las pasturas, una a tres semanas en henares viejos, campos de cultivo en desuso y humedales y cero en henares nuevos.[49]
La temporada reproductiva del tordo sargento se extiende aproximadamente desde fines de abril a fines de julio.[53][64] Por otro lado, en diferentes estados se ha estimado que el período en el que los nidos activos contenían huevos se extendía entre comienzos a fines de abril y comienzos a fines de agosto; y en el norte de Luisiana, se constató que los nidos albergaban polluelos desde fines de abril hasta fines de julio. La cúspide de la temporada de nidificación (el momento con mayor cantidad de nidos activos) ha sido registrada entre la primera mitad de mayo e inicios de junio en distintos lugares.[65] Un estudio en el este de Ontario descubrió que aunque los tordos sargento comenzaban a nidificar más temprano en años con primaveras cálidas, asociadas a bajos valores invernales en el índice de oscilación del Atlántico Norte, las fechas de puesta de los huevos permanecían inalteradas.[66] Los niveles de testosterona en los machos alcanzan su punto culminante en la primera parte de la época de reproducción, pero se mantienen altos a lo largo de la temporada.[42] Las hembras se reproducen por hasta diez años.[63]
Para el momento en que se producen las cópulas, disminuyen significativamente la cantidad de canciones y exhibiciones de los machos y el número de intrusiones a territorios ajenos. Antes del apareamiento muchos aspectos del territorialismo llegan a su punto máximo. Después de este, la frecuencia de muchas de las conductas territoriales decrece y los machos territoriales se ocupan principalmente de la defensa de las hembras, los huevos y los polluelos de la depredación. Experimentos de remoción sistemática de las aves de sus territorios sugieren que la población extra de machos que se encuentra presente en los pantanos antes de las cópulas desaparece después de las mismas.[67]
Territorialismo y emparejamiento
El establecimiento de un territorio durante la temporada reproductiva es clave para los machos, pues aquellos que no consiguen uno son responsables de un bajo porcentaje de las fecundaciones. La intensidad de la competencia por las parcelas se ve reflejada en el alto número de intrusiones a los dominios de los machos propietarios, lo que los obliga a pasar buena parte de su tiempo alejando a invasores de sus territorios. Sin embargo, las disputas agresivas por las parcelas son infrecuentes. Los dominios de los machos pueden hallarse tanto aislados como contiguos, y sus límites están bien definidos y se mantienen a lo largo de la temporada. Su forma y tamaño son altamente variables y dependen del tipo de vegetación y hábitat, cercanía a árboles y densidad de población. Aunque suelen alimentarse fuera de sus territorios, durante el período de cópulas los machos pasan casi todo el día dentro de ellos.
La enorme mayoría de los individuos masculinos obtiene una parcela por primera vez al tomar posesión de los dominios de un macho territorial que no haya sobrevivido al invierno. Asimismo, pueden establecerse en espacios ya ocupados a través de un proceso gradual y persistente. En otras ocasiones, invaden territorios en presencia de sus dueños simplemente haciéndose presentes en el área y permaneciendo allí a pesar de los ataques recibidos. Empero, en ciertas oportunidades, demuestran dominancia inmediata sobre el residente. En los casos en los que dos machos con parcelas adyacentes regresan al mismo sitio un segundo año, los límites territoriales a menudo se ajustan a los del año anterior.
El tordo sargento se caracteriza por su sistema de emparejamiento poligínico. Su poliginia ha hecho de esta ave una especie extensivamente estudiada. Los machos territoriales pueden alcanzar las quince compañeras en algunos casos, aunque normalmente tienen dos o tres. El tamaño promedio del harén varía entre 1,6 y 6,2 hembras en distintas poblaciones. Tanto la calidad del macho como la de su territorio influyen en grados variables sobre el éxito reproductivo femenino y, en consecuencia, sobre la elección de pareja por parte de las hembras. Debido a que la calidad del macho guarda solo una débil relación con la de su parcela, es necesario considerar ambos parámetros por separado. A su vez, los dos componentes de la calidad parental masculina ―esfuerzo en la defensa del nido y alimentación de los polluelos― difieren entre los distintos individuos y no covarían. En algunas especies, particularmente en las poligínicas, un sistema de emparejamiento basado en la defensa de un recurso ―un territorio― está asociado a una considerable variabilidad en el éxito en la obtención de pareja de los machos, y este es el caso del tordo sargento.
Depredadores y parásitos
.jpg.webp)
Probablemente el hombre mate a más tordos sargento que cualquier depredador natural debido a que estos atacan los cultivos de cereales. Las colonias reproductivas son campos de caza fructíferos tanto para depredadores mamíferos como aviares.[41] Entre los depredadores conocidos de la especie, pueden mencionarse el mapache (Procyon lotor),[10][26][45][68][69][70] el visón americano (Neovison vison),[10][26][45][69][71] la comadreja de cola larga (Mustela frenata),[70] el chivirín pantanero (Cistothorus palustris),[10][14][26][41][68][72][73] el cuervo americano (Corvus brachyrhynchos),[41][69][70][73][74] la urraca (Pica pica),[26][73][75] el zanate norteño (Quiscalus quiscula),[41][73] los halcones,[26] los búhos,[26] el gavilán colirrojo (Buteo jamaicensis),[69] las serpientes[3][10][68] —como la serpiente de agua del norte (Nerodia sipedon)[41] y la culebra de las praderas (Thamnophis radix)—,[73] etc. Los cuervos y zanates se alimentan de los huevos, e incluso de polluelos pequeños, si el nido es dejado sin vigilancia. Los chivirines pantaneros picotean los huevos y luego beben su contenido; en ocasiones, después de algunos sorbos, toman el huevo roto con su pico y se lo llevan para continuar alimentándose en otro lado. Con frecuencia, se encuentran uno o más huevos en un nido con agujeros prolijos y circulares sobre un lado, tal como los que produce el pequeño y puntiagudo pico del chivirín.[41]
La importancia relativa de diferentes depredadores de nidos varía en función de la región geográfica: los principales depredadores en distintas regiones incluyen al chivirín pantanero en la Columbia Británica, las urracas en Washington y los mapaches en Ontario.[73] La incidencia de la depredación aviar en los nidos de tordo sargento es mayor en las poblaciones occidentales que en las orientales.[76]
Debido a las altas tasas de depredación, especialmente de los huevos y polluelos, el tordo sargento ha desarrollado diversas adaptaciones para proteger sus nidos. Una de ellas consiste en nidificar en grupos, lo cual reduce el peligro puesto que existe un mayor número de padres alerta. Anidar sobre el agua también disminuye las probabilidades de un ataque. Los nidos en particular ofrecen una ventaja estratégica ya que con frecuencia se hallan ocultos entre densos carrizos ribereños, a una altura de uno o dos metros.[10][26] Los machos a menudo hacen las veces de centinelas, empleando un repertorio de llamados.[10][77] En especial los machos persiguen a potenciales depredadores con el fin de ahuyentarlos, incluso cuando se trata de animales de dimensiones muy superiores.[10][26] La agresividad del tordo sargento hacia el chivirín pantanero, el cual también nidifica en pantanos, ocasiona un territorialismo interespecífico parcial.[78] Por otro lado, los depredadores nocturnos como el mapache y el visón americano no son atacados por los adultos.[73][75] La coloración apagada de la hembra podría servir para camuflarla, protegiéndola a ella y a su nido cuando está incubando.[10][26]
Asimismo, puede alojar ectoparásitos como distintas especies de ftirápteros —por ejemplo, los ischnóceros Philopterus agelaii y Brueelia ornatissima—[79] y ácaros hematófagos —como el macronísido Ornithonyssus sylviarum—[79] y endoparásitos como Haemoproteus quiscalus,[79] Leucocytozoon icteris,[79] Plasmodium vaughani,[79] nematodos,[79][80] trematodos[80] y cestodos.[80]
Impacto ecológico y económico
Según el ornitólogo estadounidense Arthur Cleveland Bent, en las regiones septentrionales de su área de distribución el tordo sargento oriental es casi completamente beneficioso desde una perspectiva económica y se registran comparativamente pocas quejas de daños severos a los cultivos. Allí su dieta consiste casi enteramente en insectos, muy pocos de los cuales son especies útiles, y semillas de hierbas. No obstante, provoca ciertos perjuicios a los granos que germinan en primavera y al maíz dulce en verano, mientras los granos son aún suaves, rasgando la cobertura foliácea de las mazorcas y arruinándolas desde un punto de vista comercial. También ataca otros granos de manera limitada, pero la mayor parte de los que consume son desperdicios que han quedado en el suelo. En el Medio Oeste, donde estas aves son mucho más abundantes y donde los cereales son cultivados más extensivamente que en el norte, los tordos sargento y otros ictéridos, a fines del verano y en otoño, causan gran daño a los campos de granos, tanto mientras están madurando como cuando son cosechados. Sin embargo, se ha afirmado que incluso allí resultan beneficiosos debido a las larvas perniciosas que eliminan de las mazorcas de maíz y de las plantas de remolacha, pudiendo contrarrestar plagas de orugas. En los estados sureños, perjudican gravemente al arroz arrancando los plantines en primavera y comiendo los granos aún suaves mientras maduran, siendo en este sentido casi tan dañinos como los charlatanes (Dolichonyx oryzivorus). Por otro lado, son de cierta utilidad al consumir las semillas de malezas que de otro modo devaluarían el producto.[41]
Al ser una de las aves más numerosas del continente, juega un rol importante en la dispersión de otras especies. Puesto que los tordos sargento se agrupan y descansan en cantidades tan grandes, la supervivencia de determinadas especies que se unen a sus bandadas seguramente se vea afectada por su compañía.[26] Pueden constituir además una importante fuente de alimento para animales tales como el mapache y el visón. Asimismo, las poblaciones que anidan y descansan en pantanos podrían amortiguar el efecto de la depredación sobre especies de anátidos y otros animales.[45] En síntesis, estas aves son tan numerosas y activas que su sola presencia y comportamiento natural es suficiente para influir sobre el medio ambiente de un modo visible.[26]
Aspectos positivos: control de malezas e insectos nocivos
A través del control de las poblaciones de insectos por medio de la depredación y de las hierbas indeseadas con el consumo de sus semillas, permiten el crecimiento de plantas de mayores dimensiones y cultivos.[26][81] Se alimentan de Anthonomus grandis e Hypera postica, dos especies de curculiónidos que afectan el algodón y la alfalfa respectivamente, así como también de las orugas nocivas de la polilla gitana (Lymantria dispar) y de las del género Malacosoma.[41] En algunas áreas del sur de los Estados Unidos, las semillas del arrancamoños común (Xanthium strumarium), una maleza perjudicial para la soja y el algodón, parece constituir una importante fuente de alimento para la especie.[45][43] Beal (1900) afirmó:
Al resumir el estatus económico del tordo sargento, el principal aspecto a tener en cuenta es el pequeño porcentaje que representan los granos en su dieta anual, lo cual aparentemente contradice las quejas sobre sus hábitos destructivos. A juzgar por los contenidos estomacales, el tordo sargento es decididamente un ave útil. El servicio que brinda a través de la eliminación de insectos y semillas de hierbas nocivos supera ampliamente los daños que produce su consumo de granos. Los estragos que a veces provoca deben ser atribuidos enteramente a su excesiva abundancia en ciertos lugares.[41][82]
Durante la temporada reproductiva, los aproximadamente 8 millones de tordos sargento que anidan en Ohio y sus polluelos probablemente consuman más de 5,4 millones de kg de insectos, un promedio de casi 53 kg/km². Muchos de estos insectos, como los picudos (Hypera spp.), proceden de los campos de alfalfa, pasturas, campos de avena y otros cultivos. En los maizales, los ictéridos a menudo se alimentan de gusanos eloteros (Helicoverpa zea) y escarabajos del género Diabrotica. A comienzos de la primavera, los tordos sargento consumen taladros del maíz (Ostrinia nubilalis) en campos con rastrojo de maíz.[45] Sin embargo, Bendell y otros (1981) encontraron que el beneficio económico del control de plagas, tales como las larvas de ese lepidóptero, por parte del tordo sargento solo compensaba el 20% del daño a los cultivos ocasionados por esta ave.[83][84]
Aspectos negativos: consumo de granos de cultivo

Los tordos sargento pueden devastar campos de cultivo. A pesar de que consumen semillas de malezas, son conocidos por provocar grandes daños a la agricultura a causa de sus hábitos de descansar en grupos masivos y su gusto por los productos agrícolas.[26] Pueden ser nocivos para las plantaciones de maíz, arroz, girasol y sorgo,[26][57][85] particularmente en las cercanías de dormideros importantes.[57] El tordo sargento es la especie de ictérido más numerosa de América del Norte y la que más perjudica los cultivos.[13][57][86] De 215 aves neotropicales migratorias, ha sido identificado como la que ocasionaba, por un amplio margen, la mayor pérdida económica.[83] En América del Norte, el daño a los cultivos de maíz por parte de esta especie aumentó desde finales de la década de 1960 a principios de la de 1980, quizá debido al incremento del área destinada a la producción de granos[83][87][88] y por la disminución de pequeñas áreas con rastrojo, henares y terrenos no cultivados, lo cual, a su vez, acentuó la dependencia del ave con respecto al maíz para asegurarse el sustento.[83][89]
Aparentemente el macho produce un mayor daño a dicho grano que la hembra. En algunas áreas de Ohio, el maíz puede representar hasta el 75% de la dieta de los machos y solo el 6% de la de las hembras en los meses de agosto y septiembre. En Dakota del Sur, a fines del verano, las mollejas de los machos estudiados contenían un 29% de maíz, mientras que en el caso de la hembra esa cifra se limitaba a un 9%.[45]
Situación en el Medio Oeste

El tordo sargento constituye la especie dominante en las grandes concentraciones de ictéridos que se alimentan en los campos de girasol, maíz y granos pequeños en maduración a fines del verano o comienzos del otoño en las Dakotas. En la década de 1970, las pérdidas en los cultivos de girasol y maíz ocasionadas por los ictéridos en las Dakotas excedían los 3 millones de dólares anuales para cada caso.[90] En la parte norte de las Grandes Llanuras —un área conocida como Prairie Pothole Region—, en la que los tordos sargento son muy abundantes en verano, se congregan en bandadas posreproductivas que perjudican significativamente los cultivos, en particular las plantaciones de girasol cercanas a sus sitios natales. La mayor parte de los daños al girasol se produce entre mediados de agosto y comienzos de septiembre, cuando el contenido calórico de las semillas inmaduras es bajo y las aves deben consumir una mayor cantidad de ellas para saciarse. Durante esta etapa inicial de depredación de los cultivos de girasol en la que se provoca más del 75% del perjuicio total, los tordos sargento representan el 80% de los ictéridos observados en los campos de esta semilla. Este período es anterior a la migración masiva de las aves y la mayoría de ellas es de origen local. La mayor parte permanece dentro de los 200 km de sus sitios natales hasta que la muda de sus plumas esté completa —o casi completa— a fines de agosto o principios de septiembre. El daño puede ser bastante serio en el centro y sudeste de Dakota del Norte y noreste de Dakota del Sur, áreas de gran concentración de la producción de girasol y abundantes en humedales que atraen a los tordos sargento durante la temporada reproductiva.[91]
Investigaciones llevadas a cabo entre 1968 y 1979 revelaron que los ictéridos —entre los que se destacaban el tordo sargento y el zanate norteño (Quiscalus quiscula)— anualmente destruían menos del 1% de los cultivos de maíz en Ohio, lo que equivalía a una pérdida de entre 4 y 6 millones de dólares según los precios de 1979. Los insectos, las malezas, la enfermedades y los hongos probablemente causen pérdidas mayores al 20% de la cosecha potencial total de maíz en los estados del Medio Oeste y los procedimientos de cosecha a menudo dejan un 5% del maíz o más en los campos, lo cual revela que comparativamente el daño por parte de los ictéridos en Ohio no es grande. Sin embargo, el perjuicio promedio ocasionado por estas aves no es de tanta importancia económica como la distribución del mismo entre los productores. Mientras que el 97,5% de maizales estudiados en Ohio sufría una pérdida de menos del 5%, la cual constituía alrededor del 60% del daño total en el estado, el restante 2,5% a menudo incurría en pérdidas superiores al 5% y representaba aproximadamente el 40% del perjuicio total en Ohio.[45]
Todos los condados de Ohio sufren algún grado de depredación en sus cultivos de maíz a causa de los ictéridos, pero los más afectados son unos pocos condados en donde aún abundan los pantanos que les sirven de dormideros. Los condados de Ottawa, Sandusky y Lucas, sobre las aguas de la bahía de Sandusky y el lago Erie, fueron los más castigados. Estos tres condados, entre los 19 estudiados entre 1968 y 1976, contenían el 62% de los campos en los que las pérdidas excedieron el 5% y el 77% de aquellos en los que superaron el 10%. Otros condados con grandes daños localizados fueron Erie, Ashtabula —también ubicados sobre las costas de los mencionados cursos de agua— y Hamilton. Casi todas las plantaciones con perjuicios superiores al 5% se encontraban dentro de los 8 km de algún importante dormidero de ictéridos. En el período 1968-1976, en el noreste del condado de Sandusky y el noroeste del de Ottawa, donde grandes dormideros de hasta un millón de aves han sido descubiertos a fines del verano y en otoño, las pérdidas promedio superaban el 9% en campos a entre 3 y 5 km de los dormideros, pero eran menores al 5% a los 8 km e inferiores al 2% a los 16 km.[45] En el sudoeste de Ontario, en el verano de 1964, se comprobó que el mayor daño a los maizales por parte de tordos sargento también se producía cerca de dormideros en pantanos.[92]
Control de plagas
Las dos principales opciones entre las que pueden elegir los agricultores para evitar la presencia de las aves una vez que el maíz ha ingresado en la etapa lechosa de su proceso de maduración consisten en la utilización del químico 4-aminopiridina y la implementación de dispositivos mecánicos de ahuyentado.[45] El momento escogido para tomar medidas que dispersen a los ictéridos es de gran importancia puesto que una vez que las aves han optado por un campo para alimentarse allí es probable que regresen durante varios días.[45][92] Cuanto más tiempo se les permita alimentarse sin ser molestadas, más difícil se volverá ahuyentarlas.[45] Asimismo, la mayor parte del daño es infligida en un lapso de solo unos pocos días, cuando los granos son suaves; en consecuencia, las técnicas de control no serán muy útiles si se aplican después de este período.[45][93]
Historia del control de plagas
Ya en 1667, los colonos de la bahía de Massachusetts habían establecido leyes para intentar reducir las poblaciones de ictéridos y mitigar los daños al maíz. Según Henry David Thoreau, una ley disponía que cada hombre soltero en un pueblo debía matar seis de esas aves y, como castigo por no hacerlo, no podría contraer matrimonio hasta que no hubiera cumplido con el mencionado designio. Obviamente, como los ictéridos se reproducen a una velocidad mucho mayor a la que los humanos se casan, esta estrategia de control fue un fracaso. Los pioneros que viajaban al oeste hacia la región de los Grandes Lagos enfrentaron problemas similares. Hacia 1749, los ictéridos eran tan abundantes alrededor del oeste del Lago Erie que las personas se turnaban para vigilar los cultivos de granos en maduración. Aparentemente los aborígenes habían utilizado esta técnica en la región durante siglos.[45]
A principios del siglo XX, en algunos lugares, cuando los carrizos se secaban, se aprovechaban dichas circunstancias para matar a estas aves de la siguiente manera. Una cuadrilla se acercaba en silencio a un dormidero, oculta en la oscuridad de la noche, y simultáneamente encendía en varios puntos los carrizos, los que eran rápidamente envueltos por una sola gran llama. Esto causaba un enorme tumulto entre los tordos sargento, que, iluminados por el fuego, eran derribados en grandes cantidades por los disparos mientras se mantenían suspendidos en el aire y gritaban por todo el lugar. A veces, se utilizaba paja para el mismo propósito, la cual era previamente esparcida cerca de los carrizos y de los arbustos de alisos (Alnus spp.) en los que se congregaban para descansar, cuya quema producía gran consternación entre las aves. La cuadrilla regresaba al día siguiente a recoger las presas cazadas.[41]
Arthur Cleveland Bent afirma que, antes de que fuera ilegalizada la venta de presas de caza en el mercado, los tordos sargento eran masacrados en grandes números en otoño y vendidos en los mercados. Cuando habían engordado sobre la base de una dieta de granos o arroz, sus pequeños cuerpos eran servidos como deliciosos bocadillos en las mesas de gastrónomos. Pocos podían distinguirlos de los charlatanes (Dolichonyx oryzivorus).[41]
En 1926, cuando el U. S. Biological Survey —predecesor del Servicio de Pesca y Vida Silvestre de los Estados Unidos— realizó su primera compilación de dormideros de ictéridos indeseables, se registró en Ohio, con sus cuantiosas poblaciones de esas aves y la quinta mayor superficie destinada al cultivo de maíz entre los estados americanos, un número de quejas superior al de cualquier otro estado. Durante la década de 1950, se organizaron comités de control de aves en algunos condados para lidiar con los perjuicios al maíz ocasionados por los ictéridos y la Ohio Agricultural Experiment Station —en la actualidad llamada Ohio Agricultural Research and Development Center— y el Departamento de Zoología y Entomología de la universidad estatal comenzaron a investigar el problema.[45]
Uso de trampas y químicos letales
La depredación de los cultivos ha llevado a la utilización de trampas, veneno y tensoactivos por parte de los agricultores en un intento por controlar las poblaciones de tordos sargento;[26] estos últimos suprimen las propiedades impermeables de las plumas, haciéndolos extremadamente vulnerables al frío,[26][94] pero su efectividad depende de ciertas condiciones atmosféricas, a saber: bajas temperaturas y precipitaciones.[94] Los programas en los que se utilizaron cebos envenenados para reducir las concentraciones de ictéridos a fines del verano han sido poco fructíferos. Mientras que miles de aves han muerto ocasionalmente, el efecto sobre bandadas numerosas asociadas a dormideros que a veces contienen más de un millón de individuos es pequeño; además, frecuentemente mueren ejemplares de otras especies. El uso de trampas de gran tamaño con señuelos, que a menudo capturan cientos de aves por día, también es inefectivo frente a estas bandadas de importantes dimensiones.[45]
El rocío de la solución detergente PA-14 en los dormideros durante la noche remueve la protección aceitosa de las plumas causando la muerte de las tordos sargento por la exposición a condiciones meteorológicas húmedas y frías. Varios millones de ictéridos —principalmente zanates norteños— han sido aniquilados con PA-14 en invierno en Tennessee y Kentucky; esta técnica, sin embargo, no es aplicable a los dormideros de fines del verano en los pantanos de Ohio porque temperatura ambiental es demasiado alta y porque el uso de PA-14 está restringido a lugares sobre tierras altas donde los problemas relacionados con la contaminación del agua o a riesgos sobre otras especies son improbables.[45] Asimismo, cabe destacar que la experiencia con la utilización de PA-14 en el sur de Estados Unidos indica que, incluso cuando grandes cantidades de aves son eliminadas, la disminución poblacional generalmente es solo a corto plazo, pues aves de las áreas circundantes pronto repueblan los dormideros:[45] tras la aplicación de dicho tensoactivo en un dormidero de zanates norteños, tordos sargento, estorninos pintos y tordos cabecicafé en las cercanías de Milan (oeste de Tennessee) en enero de 1977, más del 90% de los individuos murió, pero la población dentro de los 40 km del dormidero se recuperó en solo dos semanas.[88]
Los intentos por disminuir sus números a través de la disposición de arroz tratado con el avicida DRC-1339 en áreas de suelo desnudo no han tenido éxito por varias razones. En primer lugar, los tordos sargento se alimentaban casi exclusivamente sobre las cabezas de los girasoles y no bajaban a comer sobre el suelo. En segundo lugar, las precipitaciones hacían necesaria la renovación de los granos de arroz tratados. Por último, el riesgo de afectar a otras especies accidentalmente se incrementaba a lo largo del período de implementación del método a causa de la migración.[91]
Debido a que los tordos sargento que pasan el invierno en determinado lugar proceden de distintas áreas de reproducción, la aniquilación masiva de las aves en dormideros en el sur de Estados Unidos en esa estación probablemente no tenga un efecto demasiado significativo sobre el daño localizado que producen a fines del verano, ya que un decrecimiento poblacional a gran escala en algunos dormideros invernales no resultaría en una homóloga disminución en ninguna población reproductiva local en particular en el verano siguiente.[53][64]
Uso de 4-aminopiridina
La 4-aminopiridina se aplica a una de cada cien partículas de maíz molido utilizado como cebo. Generalmente el maíz es arrojado a los campos desde aviones que liberan una carga de unos 3,4 kg de cebo por hectárea sobre un tercio del terreno. Debido a que esa cantidad de maíz molido contiene alrededor de 205.000 partículas, aproximadamente 2050 partículas tóxicas son distribuidas por hectárea tratada.[45] La ingesta de una o más de estas partículas por parte de un ictérido provoca vuelo errático, llamados de sufrimiento y finalmente la muerte; ese comportamiento a menudo lleva a las restantes aves de la bandada a abandonar el campo.[45][95][96] El químico DRC-1327, que ha probado su utilidad mitigando el daño al maíz en maduración, opera de la misma manera: cuando un ave ingiere granos de una mazorca parcialmente pelada a mano a la que se le ha aplicado el químico con un rociador manual, su vuelo errático y sus llamados de sufrimiento previos a la muerte, que se extienden por un espacio de entre cinco y quince minutos, ahuyentan a las bandadas de los campos.[57]
La aplicación inicial de 4-aminopiridina debe efectuarse tan pronto como sea posible tras el comienzo de la etapa lechosa del proceso de maduración de los granos. Se recomiendan generalmente otras dos aplicaciones de refuerzo separadas por entre cinco y siete días; a menudo basta con solo una, pero bajo condiciones de actividad prolongada por parte de las aves pueden requerirse más de tres aplicaciones en intervalos más cortos.[45] En el condado de Brown (noreste de Dakota del Sur), en 1965, los cebos con 4-aminopiridina esparcidos a mano en intervalos de alrededor de una semana redujeron en un 85% la pérdida por tordos sargento proyectada en cultivos de maíz en maduración. El angustiante comportamiento exhibido por los individuos afectados por el químico produjo una marcada respuesta de espanto en otros miembros de las bandadas y los campos quedaron libres de tordos sargento incluso cuando la proporción directamente afectada estimada fue de menos del 1%.[97] Se ha sugerido incluso que el empleo constante de la 4-aminopiridina a lo largo de los años podría ocasionar un cambio en el patrón de migración al sur, como si las aves aprendieran a evitar las áreas persistentemente tratadas con el químico.[86]
En otro experimento en el mismo condado, el número de ictéridos que hacía uso del área tratada cayó drásticamente durante un período de cinco días después de que el tratamiento hubiera comenzado y se mantuvo en un nivel bajo por el resto de la temporada de daño a los maizales. Los resultados de este método se limitaron en gran medida a los ictéridos. A pesar de que abundaban los faisanes comunes (Phasianus colchicus), no hubo evidencia de que ninguno resultara afectado, y la mortalidad entre otras especies de aves fue insignificante.[95]
Debe considerarse que la abundancia de malezas restringe las posibilidades de que las aves encuentren las partículas del cebo esparcidas sobre el suelo, de modo que el empleo de este químico debe ir acompañado de un programa de control de malezas. Un problema menos obvio es el que representan los insectos que remueven el cebo. Si se detectan grillos (Gryllus spp.) en un campo, es esperable que el maíz molido desaparezca rápidamente. Los grillos seleccionan generalmente las partículas no tratadas y dejan las tóxicas; sin embargo, la rápida disminución en el volumen total del maíz molido sobre la tierra disminuye el atractivo de la alimentación a nivel del suelo para los ictéridos. Debido a que las poblaciones de grillos son difíciles de controlar, aplicaciones más frecuentes u otra técnica de control de aves podrían ser convenientes bajo estas circunstancias. Un tercer problema es el de las lluvias fuertes, que cubren el cebo con tierra o lo arrastran a grietas en el suelo.[45] Asimismo, una baja densidad poblacional de ictéridos puede reducir la efectividad de su control con 4-aminopiridina.[96]
Métodos no letales
Disparos con un arma de calibre .22 justo por encima del maíz a menudo alejan a las aves de un campo de hasta 16 hectáreas. Una variedad de dispositivos para repelerlas, incluyendo sistemas electrónicos que producen ruido, globos con helio atados en los campos, aviones a control remoto y diversos tipos de espantapájaros son ocasionalmente utilizados en los maizales.[45] Métodos tales como los espantapájaros, la pirotecnia y los cañones de propano ayudan a mitigar una depredación leve, pero solo funcionan efectivamente si la duración del período de daño es menor a la del acostumbramiento de las aves a dichos métodos. Los tordos sargento se habitúan rápidamente a los mismos, en particular si el cultivo es una fuente de alimento privilegiada en un área con pocas fuentes de sustento alternativas.[91] Si bien una cosecha lo más temprano posible después de que el maíz se haya secado lo suficiente puede limitar el daño por parte de las bandadas de zanates norteños, el ajustar la fecha de la cosecha no ayuda a los agricultores a reducir las pérdidas ocasionadas por tordos sargento durante la etapa lechosa.[45]
Un enfoque que ha tenido éxito en el control de los dormideros en tierras altas consiste en la dispersión de las poblaciones a través de la alteración del hábitat o el acoso a las aves. Estos procedimientos, llevados a cabo por biólogos en cooperación con ciudadanos locales, han sido exitosos en la dispersión o desplazamiento de poblaciones de hasta un millón de individuos. Aunque esta dispersión puede en ocasiones trasladar el problema de un lugar a otro —especialmente cuando el área ha sido cultivada con maíz de manera intensiva y no abundan las fuentes de alimento alternativas—, con frecuencia ha sido efectivo para solucionar situaciones problemáticas locales. Debido a que los granos de avenas y trigo en campos ya cosechados constituyen un alimento importante para los ictéridos a fines del verano, la postergación del arado de los terrenos con rastrojo de pequeños granos puede menguar la presión ejercida por la depredación de esas aves sobre el maíz en maduración. La existencia natural o la siembra de plantas como mijo, sorgo (Sorghum spp.), polígonos (Polygonum spp.) y varios pastos —por ejemplo, las mohas (Setaria spp.)— podría ser beneficiosa. Como principio ecológico general, la diversidad en los tipos de hábitats que puedan mantenerse en regiones de intensa actividad agrícola está relacionada con una mayor probabilidad de que los perjuicios ocasionados por las plagas se restrinjan a niveles económicamente tolerables.[45]
Estudios en campos de maíz dulce indican que los ictéridos a menudo podrían ser atraídos inicialmente a los cultivos en maduración por los insectos.[45][93] Las bandadas pueden deambular por los terrenos cultivados durante alrededor de una semana consumiendo insectos y semillas de hierbas antes de atacar el maíz. Los escarabajos del género Diabrotica podrían ser especialmente atractivos durante este período. Así las aves se habitúan a alimentarse en los campos y rápidamente pasan de los insectos al maíz cuando este ingresa en la vulnerable etapa lechosa. Experimentos en los que las poblaciones de insectos en cultivos de maíz dulce eran tratadas con insecticidas durante la semana previa a que el grano entrara en la fase lechosa mostraron que una menor cantidad de aves visitaba esos campos y se registraban menos daños al maíz en el subsecuente período de vulnerabilidad que en terrenos cercanos no tratados. Es probable que la abundancia de malezas en los maizales también incremente el atractivo de estos para los ictéridos y el control de las mismas propiciaría una disminución en las pérdidas producidas por estas aves.[45]
Esterilización química
Una manera alternativa de reducir las poblaciones de tordos sargento, y por lo tanto el perjuicio que causan a los cultivos, supone la implementación de un programa que tenga por objeto interferir con su capacidad de reproducirse, por ejemplo, por medio del uso de químicos esterilizadores. Debido a la naturaleza poligínica de la especie, se ha sugerido que dicho programa podría llegar a ser más efectivo si es dirigido a los machos. Sin embargo, la incidencia de la promiscuidad implicaría que la esterilización química de una determinada fracción de los machos de una población local no resultaría en una disminución proporcional de las nidadas fértiles.[98]
Los efectos de este método probablemente variarían según el tipo de hábitat en el que los machos tratados hayan establecido sus territorios. En general, debería haber una mayor proporción de nidadas fértiles en aquellos hábitats más densamente poblados y con una mayor cantidad de renidificaciones. Las renidificaciones son más comunes en los pantanos que en las tierras altas. A su vez, los individuos que se reproducen en tierras altas probablemente se alimenten más a menudo dentro de sus propios territorios que los que lo hacen en pantanos, lo que probablemente dificulte la promiscuidad en el primer tipo de hábitat. Así, la esterilización química podría ser más efectiva entre poblaciones de tierras altas que entre aquellas de pantanos.[98]
Es posible que los químicos esterilizadores reduzcan en cierta medida la cantidad de polluelos producida por nido exitoso. Dado que las nidadas de renidificaciones son significativamente menos numerosas que las originales, incluso si una hembra que en un primer momento se apareó con un macho estéril luego renidificase y se emparejara con una macho fértil, quizá produciría menos polluelos de los que hubiese tenido si su primera nidada hubiera sido fértil.[98]
El número de nidadas fértiles en el territorio de un macho puede limitarse a través de la esterilización de aquel, pero el grado en que disminuya dicho número dependerá de la disposición de los machos territoriales fértiles aledaños y quizá también de la cantidad de machos no territoriales fértiles en la población. Estudios con huevos artificiales sugieren que la incubación de los huevos estériles sería prolongada,[98] puesto que las hembras normalmente incuban los huevos artificiales durante alrededor de 20 días.[98][99] Una incubación extendida de huevos inviables repercutiría en una menor cantidad de intentos de renidificación y, por lo tanto, en un decrecimiento de las oportunidades de encontrar un compañero fértil para una hembra que originalmente se apareó con un macho estéril.[98]
Estado de conservación
Se trata de una especie bajo preocupación menor.[1][5] Al ser una de las aves más numerosas y más ampliamente distribuidas de América del Norte, poco se ha hecho para protegerla de los efectos de la destrucción de su hábitat y la urbanización. Debido a que puede sobrevivir en una amplia gama de entornos, muchas poblaciones logran sobreponerse a la pérdida de hábitats naturales. Sin embargo, los tordos sargento prosperan en zonas de humedales y con la destrucción de los humedales naturales es probable que su población se reduzca.[26] La especie está protegida bajo el Migratory Bird Treaty Act de 1918, un tratado formal entre Estados Unidos y Canadá que luego fue ampliado para incluir a México. Esta ley le otorga protección legal en Estados Unidos, pero se les puede matar «cuando sean encontrados depredando o a punto de depredar árboles ornamentales o árboles plantados para que den sombra, cultivos, ganado o la vida silvestre.»[45]
Un estudio en Illinois indicó que las poblaciones de tordos sargento se duplicaron entre 1908 y 1958. Tradicionalmente se había reproducido en humedales, habitando en Ohio principalmente los pantanos asociados con lagos y ríos.[45] Durante el siglo XX, sin embargo, se adaptó a los cambios en el hábitat introducidos por el hombre y ahora a menudo anida en henares, a lo largo de carreteras y zanjas y en otros sitios ubicados en tierras altas.[45][46]
A pesar de su exitosa adaptación a los cambios en las prácticas relacionadas con el uso de la tierra, las poblaciones de tordos sargento se han reducido a lo ancho de su área de distribución durante la segunda mitad del siglo XX,[46][85] y los cambios en la abundancia y adecuación de los pastizales han estado implicados en ello.[46] En Ohio, el tordo sargento se vio negativamente afectado entre 1966 y 1996 por el decrecimiento de la producción de heno, la cosecha más temprana del mismo y el incremento de los cultivos sembrados en surcos, una situación homóloga a la que sufren otras especies de aves de los pastizales menos numerosas. Si bien efecto negativo de la creciente eficiencia y la menguante diversidad de las prácticas agrícolas modernas sobre las poblaciones de tordos sargento en dicho estado puede ser percibido como un acontecimiento positivo por parte de los productores de maíz y girasol, las prácticas agrícolas que han precipitado la declinación numérica de esta especie posiblemente hayan causado repercusiones más severas para aves de los pastizales menos comunes, tales como el correlimos batitú (Bartramia longicauda) y el gorrión sabanero pechileonado (Ammodramus savannarum).[85]
A finales de la década de 1970, Ohio acogía la mayor densidad de tordos sargento durante la temporada reproductiva entre todos los estados estadounidenses y provincias canadienses,[45][85] albergando un estimado de 8 millones de individuos.[45] Sin embargo, entre 1966 y 1996, las poblaciones reproductivas en dicho estado mostraron un marcado descenso. La disminución del área cultivada con heno que no fuera alfalfa entre esos mismos años probablemente redujera la disponibilidad de hábitats de nidificación de calidad. Asimismo, el maíz —aunque atraiga insectos que los tordos sargento consumen y pese a que sus granos representan en sí mismos una fuente de energía— y la soja —que no constituye una fuente de alimento para la especie—, los cuales en conjunto conformaron de 1966 a 1996 un promedio del 70% del área cultivada en Ohio, no proporcionan un hábitat adecuado para la anidación. A su vez, las grandes fluctuaciones anuales en el área cultivada con heno, tanto de un año a otro como dentro del mismo año de determinada temporada reproductiva, posiblemente perturbaran la nidificación y el subsecuente éxito reproductivo.[85] De manera similar, en Ontario entre 1974 y 1995, el tamaño medio de los harenes en un año dado estaba positivamente relacionado con la producción de heno del año previo, si bien la variación porcentual en el tamaño de los harenes de una temporada a la siguiente no se relacionaba de manera linear a la variación porcentual anual en la producción de heno; la producción de heno decayó en dicho período y el tamaño de los harenes disminuyó de aproximadamente tres hembras por macho a 1,6 hembras.[46]
Además, en Ontario se encontró una relación negativa entre el índice de oscilación del Atlántico Norte (NAO) en los seis meses previos a determinada época reproductiva y el tamaño de los harenes. Si la mortalidad durante el invierno contribuye al decrecimiento del tamaño de los harenes, las variaciones anuales en el tamaño de los mismos deberían estar relacionadas con los cambios anuales en las tasas de retorno de machos territoriales marcados. Se descubrió que efectivamente las variaciones en el tamaño de los harenes y las tasas de retorno de los machos por año estaban positivamente correlacionadas. Aunque no tan pronunciada, la relación entre las tasas de retorno de los machos y los valores de la NAO en el invierno era similar a aquella entre los cambios en el tamaño de los harenes y la NAO.[46]
Por otro lado, en el sudoeste de Quebec las poblaciones de tordos sargento se duplicaron con creces entre 1966 y 1981, aparentemente en respuesta al desarrollo de la producción de maíz. La mayor disponibilidad de granos residuales en primavera y verano —la temporada reproductiva— probablemente jugara un rol fundamental en el crecimiento de la población de esta ave.[87] Asimismo, a mediados de los años 1990, la población reproductiva de Dakota del Norte —que al menos entre 1994 y 2002 se encontraba a la cabeza entre todos los estados estadounidenses y provincias canadienses en lo que hace a la densidad poblacional de esta especie— comenzó a aumentar rápidamente.[91]
Véase también
Notas
- La subespecie cubana (A. p. assimlis) es reconocida en la actualidad como una especie distinta (A. assimilis), por lo que ya no se considera que el tordo sargento habite en Cuba (Whittingham Et alii 1996).
- Rosenthal (2004) señala, por su parte, que la envergadura es de entre 30 y 37 cm.
- Blank y Nolan (1983) sostienen, por su parte, que los machos adultos pesan en promedio aproximadamente un 38% más que las hembras adultas y que, cuando abandonan el nido, los machos ya tienen un peso promedio un 25% mayor al de las hembras.
- Entiéndase por «dormidero mixto» el lugar donde una determinada cantidad de aves de diversas especies se congrega específicamente para dormir.
- Se empleó la expresión «plantas herbáceas no graminoides» como traducción aproximada de la palabra forb. Véase: en:forb.
Referencias
- BirdLife International (2012). «Agelaius phoeniceus». Lista Roja de especies amenazadas de la UICN 2013.2 (en inglés). ISSN 2307-8235. Consultado el 2 de enero de 2014.
- «ITIS Standard Report Page: Agelaius phoeniceus» (en inglés). Integrated Taxonomic Information System. Consultado el 22 de diciembre de 2010.
- «Agelaius phoeniceus phoeniceus». Universidad Francisco Marroquín. Archivado desde el original el 6 de diciembre de 2013. Consultado el 10 de enero de 2011.
- De Juana, E; Del Hoyo, J; Fernández-Cruz, M; Ferrer, X; Sáez-Royuela, R; Sargatal, J (2012). «Nombres en castellano de las aves del mundo recomendados por la Sociedad Española de Ornitología (Decimosexta parte: Orden Passeriformes, Familias Thraupidae a Icteridae)». Ardeola. Handbook of the Birds of the World (Madrid: SEO/BirdLife) 59 (1): 157-166. ISSN 0570-7358. Consultado el 5 de mayo de 2019.
- «Red-winged Blackbird». All About Birds (en inglés). Ithaca (Nueva York): Cornell Lab of Ornithology. 2009. Consultado el 23 de diciembre de 2010.
- Bologna, Gianfranco (1981). Guías de la naturaleza: Aves. Barcelona: Grijalbo. ISBN 84-253-3362-8.
- Searcy, William A.; Yasukawa, Ken (marzo-abril de 1983). «Sexual selection and red-winged blackbirds: Variation among individuals in mating success has played an important role in the evolution of sexual dimorphism». American Scientist (en inglés) (Sigma Xi, The Scientific Research Society) 71 (2): 166-174. Consultado el 1 de agosto de 2012.
- Searcy, William A. (junio de 1979). «Sexual selection and body size in male red-winged blackbirds». Evolution (en inglés) (Society for the Study of Evolution) 33 (2): 649-661. Consultado el 17 de agosto de 2011.
- Blank, James L.; Nolan, Val, Jr. (octubre de 1983). «Offspring sex ratio in red-winged blackbirds is dependent on maternal age». Proceedings of the National Academy of Sciences USA (en inglés) 80 (19): 6141-6145. Consultado el 7 de octubre de 2012.
- «Red-winged Blackbirds: Species information and Photos». Avian Web (en inglés). Archivado desde el original el 1 de diciembre de 2011. Consultado el 24 de diciembre de 2010.
- Orians, Gordon H. (1980). Some adaptations of marsh-nesting blackbirds (en inglés). Monographs in populaton biology n° 14. Princeton (Nueva Jersey): Princeton University Press. ISBN 0691082375. Consultado el 12 de agosto de 2011.
- Homan, H. Jeffrey; Penry, Linda B.; Linz, George M. (10 de febrero de 2004). «Linear modeling of blackbird populations breeding in central North America». National Sunflower Association Research Forum Papers (en inglés) (National Sunflower Association). Consultado el 10 de enero de 2013.
- Meanley, Brooke; Royall, Willis C., Jr. (5 de noviembre de 1976). «Nationwide estimates of blackbirds and starlings». Paper 49. Bird Control Seminars Proceedings (en inglés) 7: 39-40. Consultado el 7 de enero de 2012.
- Picman, Jaroslav; Leonard, M.; Horn, A. (enero de 1988). «Antipredation role of clumped nesting by marsh-nesting red-winged blackbirds». Behavioral Ecology and Sociobiology (en inglés) (Springer-Verlag) 22 (1): 9-15. Consultado el 3 de enero de 2013.
- Real Academia Española. «territorialismo». Diccionario de la lengua española (23.ª edición).
- «Catalogue of Life: 2010 Annual Checklist» (en inglés). Integrated Taxonomic Information System. Consultado el 22 de enero de 2011.
- Lowther, P. E.; Fraga, R.; Schulenberg, T. S.; Lanyon, S. M. (2004). «Nomenclatural solution for a polyphyletic Agelaius». Bulletin of the British Ornithologists' Club (en inglés) (British Ornithologists' Club) 124 (3): 171-177. Archivado desde el original el 19 de agosto de 2008. Consultado el 20 de julio de 2011.
- Vieillot, Louis Jean Pierre (1816). Analyse D'Une Nouvelle Ornithologie Elementaire (en francés). p. 33.
- Ball, R. Martin, Jr.; Freeman, Scott; James, Frances C.; Bermingham, Eldredge; Avise, John C. (1 de marzo de 1988). «Phylogeographic population structure of red-winged blackbirds assessed by mitochondrial DNA». Proceedings of the National Academy of Sciences (en inglés) (Academia Nacional de Ciencias de Estados Unidos) 85 (5): 1558-1562. Consultado el 29 de enero de 2013.
- «Red-Winged Blackbird (Agelaius phoeniceus)». National Geographic Complete Birds of North America (en inglés). National Geographic Society. 2006. Consultado el 20 de julio de 2011.
- Whittingham, Linda A.; Kirkconnell, Arturo; Ratcliffe, Laurene M. (octubre de 1992). «Differences in song and sexual dimorphism between Cuban and North American red-winged blackbirds (Agelaius phoeniceus)». The Auk (en inglés) (American Ornithologists' Union) 109 (4): 928-933. Consultado el 20 de julio de 2011.
- Garrido, Orlando; Kirkconnell, Arturo (junio de 1996). «Taxonomic status of the Cuban form of the red-winged blackbird». The Wilson Bulletin (en inglés) (Wilson Ornithological Society) 108 (2): 372-374. Consultado el 19 de julio de 2011.
- Clements, J. F.; Schulenberg, T. S.; Iliff, M. J.; Sullivan, B. L.; Wood, C. L.; Roberson, D. (2013). The Clements checklist of birds of the world: Version 6.8 (en inglés). Consultado el 26 de enero de 2014.
- Whittingham, Linda A.; Kirkconnell, Arturo; Ratcliffe, Laurene M. (noviembre de 1996). «Breeding behavior, social organization and morphology of red-shouldered (Agelaius assimilis) and tawny-shouldered (Agelaius humeralis) blackbirds». The Condor (en inglés) (Cooper Ornithological Society) 98 (4): 832-836. Consultado el 10 de julio de 2011.
- Searcy, William A. (1979). «Morphological correlates of dominance in captive male red-winged blackbirds». The Condor (en inglés) (Cooper Ornithological Society) 81: 417-420. Consultado el 30 de agosto de 2011.
- Rosenthal, Anthony (2004). «ADW: Agelaius phoeniceus: Information». Animal Diversity Web (en inglés). Míchigan: University of Michigan Museum of Zoology. Consultado el 24 de diciembre de 2010.
- Crawford, Richard D. (marzo de 1977). «Breeding biology of year-old and older female red-winged and yellow-headed blackbirds». The Wilson Bulletin (en inglés) (Wilson Ornithological Society) 89 (1): 73-80. Consultado el 26 de septiembre de 2011.
- Miskimen, Mildred (septiembre de 1980). «Red-winged blackbirds: II. Pigmentation in epaulets of females». The Ohio Journal of Science (en inglés) (Ohio Academy of Science) 80 (5): 236-239. Archivado desde el original el 15 de mayo de 2013. Consultado el 29 de noviembre de 2012.
- Johnsen, Torgeir S.; Hengeveld, James D.; Blank, James L.; Yasukawa, Ken; Nolan, Val, Jr. (abril de 1996). «Epaulet brightness and condition in female red-winged blackbirds». The Auk (en inglés) (American Ornithologists' Union) 113 (2): 356-362. Consultado el 21 de noviembre de 2012.
- Wright, Philip L.; Wright, Margaret H. (marzo-abril de 1944). «The reproductive cycle of the male red-winged blackbird». The Condor (en inglés) (Cooper Ornithological Society) 46 (2): 46-59. Consultado el 7 de enero de 2012.
- Gough, Gregory (2003). «Red-winged blackbird Agelaius phoeniceus» (en inglés). USGS Patuxent Wildlife Research Center. Consultado el 23 de diciembre de 2010.
- Beletsky, Les D.; Orians, Gordon H. (noviembre de 1989). «Red bands and red-winged blackbirds». The Condor (en inglés) (Cooper Ornithological Society) 91 (4): 993-995. Consultado el 22 de diciembre de 2012.
- Irwin, Rebecca E. (diciembre de 1994). «The evolution of plumage dichromatism in the New World Blackbirds: social selection on female brightness». The American Naturalist (en inglés) (American Society of Naturalists) 144 (6): 890-907. Consultado el 13 de agosto de 2011.
- McGraw, Kevin J.; Wakamatsu, Kazumasa; Clark, Anne B.; Yasukawa, Ken (noviembre de 2004). «Red-winged blackbirds Agelaius phoeniceus use carotenoid and melanin pigments to color their epaulets». Journal of Avian Biology (en inglés) (John Wiley & Sons) 35 (6): 543-550. Consultado el 28 de noviembre de 2012.
- Johnson, Kevin P.; Lanyon, Scott M. (2000). «Evolutionary changes in color patches of blackbirds are associated with marsh nesting». Behavioral Ecology (en inglés) (International Society for Behavioural Ecology) 11 (5): 515-519. Consultado el 11 de agosto de 2011.
- Shutler, Dave; Weatherhead, Patrick J. (abril de 1991). «Owner and floater red-winged blackbirds: Determinants of status». Behavioral Ecology and Sociobiology (en inglés) (Springer-Verlag) 28 (4): 235-241. Consultado el 20 de agosto de 2011.
- Røskaft, Eivin; Rohwer, Sievert (agosto de 1987). «An experimental study of the function of the red epaulettes and the black body colour of male red-winged blackbirds». Animal Behaviour (en inglés) (Association for the Study of Animal Behaviour) 35 (4): 1070-1077. Archivado desde el original el 15 de mayo de 2013. Consultado el 2 de septiembre de 2011.
- Eckert, Christopher G.; Weatherhead, Patrick J. (enero de 1987). «Ideal dominance distributions: a test using red-winged blackbirds (Agelaius phoeniceus)». Behavioral Ecology and Sociobiology (en inglés) (Springer-Verlag) 20 (1): 43-52. Consultado el 22 de diciembre de 2012.
- Smith, Douglas G. (1972). «The role of the epaulets in the red-winged blackbird, (Agelaius phoeniceus) social system». Behaviour (en inglés) (BRILL) 41 (3/4): 251-268. Consultado el 20 de agosto de 2011.
- Meanley, Brooke; Bond, Gorman M. (enero de 1970). «Molts and plumages of the red-winged blackbird with particular reference to fall migration». Bird-Banding (en inglés) (Association of Field Ornithologists) 41 (1): 22-27. Consultado el 2 de diciembre de 2012.
- Bent, Arthur Cleveland (1958). «Red-winged Blackbird, Agelaius phoeniceus [Eastern Redwing]». Life Histories of North American Blackbirds, Orioles, Tanagers, and Allies (Life Histories of North American Birds) (en inglés). Instituto Smithsoniano, United States National Museum Bulletin 211. pp. 123-150. Consultado el 20 de febrero de 2011.
- Westneat, David F.; Hasselquist, Dennis; Wingfield, John C. (abril de 2003). «Tests of association between the humoral immune response of red-winged blackbirds (Agelaius phoeniceus) and male plumage, testosterone, or reproductive success». Behavioral Ecology and Sociobiology (en inglés) (Springer-Verlag) 53 (5): 315-323. Consultado el 6 de diciembre de 2012.
- Dolbeer, Richard A.; Woronecki, Paul P.; Stickley, Allen R., Jr.; White, Stephen B. (1 de marzo de 1978). «Agricultural impact of a winter population of blackbirds and starlings». The Wilson Bulletin (en inglés) (Wilson Ornithological Society) 90 (1): 31-44. Consultado el 31 de diciembre de 2011.
- Wiens, John A.; Dyer, Melvin I. (abril de 1975). «Simulation modelling of red-winged blackbird impact on grain crops». Journal of Applied Ecology (en inglés) (British Ecological Society) 12 (1): 63-82. Consultado el 2 de enero de 2012.
- Dolbeer, Richard A. (11 de diciembre de 2002). «Blackbirds and corn in Ohio». Resource Publication (en inglés) (Washington D. C.: Departamento de Interior de Estados Unidos, Servicio de Pesca y Vida Silvestre) 136. Consultado el 12 de diciembre de 2011.
- Weatherhead, Patrick J. (7 de noviembre de 2005). «Long-term decline in a red-winged blackbird population: ecological causes and sexual selection consequences». Proceedings of the Royal Society of London, B: Biological Sciences (en inglés) (Royal Society) 272 (1578): 2313-2317. Consultado el 10 de enero de 2013.
- Dyer, Melvin I. (17 de septiembre de 1970). «Territorial male red-winged blackbird distribution in Wood County, Ohio». Paper 219. Bird Control Seminars Proceedings (en inglés) 5: 185-194. Consultado el 2 de enero de 2012.
- Clark, W. Dwight; Karr, James R. (marzo de 1979). «Effects of highways on red-winged blackbird and horned lark populations». The Wilson Bulletin (en inglés) (Wilson Ornithological Society) 91 (1): 143-145. Consultado el 5 de septiembre de 2011.
- Albers, Peter H. (diciembre de 1978). «Habitat selection by breeding red-winged blackbirds». The Wilson Bulletin (en inglés) (Wilson Ornithological Society) 90 (4): 619-634. Consultado el 26 de diciembre de 2012.
- Pribil, Stanislav (diciembre de 1998). «Reproductdive success is a misleading indicator of nest-site preferences in the red-winged blackbird». Canadian Journal of Zoology (en inglés) (NRC Research Press) 76 (12): 2227-2234. Consultado el 15 de diciembre de 2012.
- Turner, Andrew M.; McCarty, John P. (diciembre de 1997). «Resource availability, breeding site selection, and reproductive success of red-winged blackbirds». Oecologia (en inglés) (Springer-Verlag) 113 (1): 140-146. Archivado desde el original el 3 de diciembre de 2013. Consultado el 7 de enero de 2013.
- Picman, Jaroslav (1980). Behavioral interactions between red-winged blackbirds and long-billed marsh wrens and their role in the evolution of the redwing polygynous mating system (en inglés). Disertación doctoral. Vancouver: Universidad de Columbia Británica. Consultado el 29 de julio de 2012.
- Dolbeer, Richard A. (1 de enero de 1978). «Movement and migration patterns for red-winged blackbirds: A continental overview». Bird-banding (en inglés) (Association of Field Ornithologists) 49: 17-34. Consultado el 18 de diciembre de 2011.
- Reed, Wendy L.; Sotherland, Paul R. (abril de 1999). «Consequences of egg-size variation in the red-winged blackbird». The Auk (en inglés) (American Ornithologists' Union) 116 (2): 549-552. Consultado el 7 de enero de 2013.
- Weatherhead, Patrick J. (marzo de 1983). «Secondary sex ratio adjustment in red-winged blackbirds (Agelaius phoeniceus)». Behavioral Ecology and Sociobiology (en inglés) (Springer-Verlag) 12 (1): 57-61. Consultado el 23 de noviembre de 2012.
- Brenowitz, Eliot A. (febrero de 1982). «Long-range communication of species identity by song in the red-winged blackbird». Behavioral Ecology and Sociobiology (en inglés) (Springer-Verlag) 10 (1): 29-38. Consultado el 17 de diciembre de 2012.
- De Grazio, John W. (3 de junio de 1964). «Methods of controlling blackbird damage to field corn in South Dakota». Paper 9. Vertebrate Pest Conference Proceedings (en inglés) 2: 43-49. Consultado el 3 de septiembre de 2012.
- Brenner, Fred J. (julio de 1966). «The influence of drought on reproduction in a breeding population of redwinged blackbirds». American Midland Naturalist (en inglés) (Universidad de Notre Dame) 76 (1): 201-210. Consultado el 23 de agosto de 2012.
- Yasukawa, Ken (agosto de 1979). «Territory establishment in red-winged blackbirds: importance of aggressive behavior and experience». The Condor (en inglés) (Cooper Ornithological Society) 81 (3): 258-264. Consultado el 19 de agosto de 2011.
- Shutler, Dave; Weatherhead, Patrick J. (agosto de 1992). «Surplus territory contenders in male red-winged blackbirds: Where are the desperados?». Behavioral Ecology and Sociobiology (en inglés) (Springer-Verlag) 31 (2): 97-106. Consultado el 11 de enero de 2013.
- Searcy, William A.; Yasukawa, Ken; Lanyon, Scott (enero de 1999). «Evolution of polygyny in the ancestors of red-winged blackbirds». The Auk (en inglés) (American Ornithologists' Union) 116 (1): 5-19. Consultado el 10 de agosto de 2011.
- Goddard, Stephen V.; Board, Veryl V. (septiembre de 1967). «Reproductive success of red-winged blackbirds in north central Oklahoma». The Wilson Bulletin (en inglés) (Wilson Ornithological Society) 79 (3): 283-289. Consultado el 9 de enero de 2012.
- Beletsky, Les D.; Orians, Gordon H. (junio de 1991). «Effects of breeding experience and familiarity on site fidelity in female red-winged blackbirds». Ecology (en inglés) (Ecological Society of America) 72 (3): 787-796. Consultado el 9 de enero de 2013.
- Dolbeer, Richard A. (19 de marzo de 1982). «Migration patterns for age and sex classes of blackbirds and starlings». Journal of Field Ornithology (en inglés) (Association of Field Ornithologists) 53 (1): 28-46. Consultado el 2 de enero de 2012.
- Brown, Bryan T.; Goertz, John W. (junio de 1978). «Reproduction and nest site selection by red-winged blackbirds in north Louisiana». The Wilson Bulletin (en inglés) (Wilson Ornithological Society) 90 (2): 261-270. Consultado el 1 de agosto de 2012.
- Weatherhead, Patrick J. (junio de 2005). «Effects of climate variation on timing of nesting, reproductive success, and offspring sex ratios of red-winged blackbirds». Oecologia (en inglés) (Springer-Verlag) 144 (1): 168-175. Consultado el 29 de enero de 2013.
- Peek, Frank W. (diciembre de 1971). «Seasonal change in the breeding behavior of the male red-winged blackbird». The Wilson Bulletin (en inglés) (Wilson Ornithological Society) 83 (4): 383-395. Consultado el 20 de septiembre de 2011.
- Yasukawa, Ken; Knight, Richard L.; Knight Skagen, Susan (octubre de 1987). «Is courtship intensity a signal of male parental care in red-winged blackbirds (Agelaius phoeniceus)?». The Auk (en inglés) (American Ornithologists' Union) 104 (4): 628-634. Archivado desde el original el 7 de diciembre de 2013. Consultado el 30 de julio de 2012.
- Knight, Richard L.; Temple, Stanley A. (febrero de 1988). «Nest-defense behavior in the red-winged blackbird». The Condor (en inglés) (Cooper Ornithological Society) 90 (1): 193-200. Consultado el 20 de julio de 2012.
- Pribil, Stanislav; Picman, Jaroslav (marzo de 1996). «Polygyny in the red-winged blackbird: Do females prefer monogamy or polygamy?». Behavioral Ecology and Sociobiology (en inglés) (Springer-Verlag) 38 (3): 183-190. Consultado el 19 de diciembre de 2012.
- Knight, Richard L.; Sooil, Kim; Temple, Stanley A. (1985). «Predation of red-winged blackbird nests by mink». The Condor (en inglés) (Cooper Ornithological Society) 87: 304-305. Archivado desde el original el 1 de febrero de 2014. Consultado el 29 de julio de 2012.
- Picman, Jaroslav (marzo de 1980). «Impact of marsh wrens on reproductive strategy of red-winged blackbirds». Canadian Journal of Zoology (en inglés) (NRC Research Press) 58 (3): 337-350. Consultado el 6 de enero de 2012.
- Sawin, Richard S.; Lutman, Mark W.; Linz, George M.; Bleier, William J. (1 de julio de 2003). «Predators on red-winged blackbird nests in eastern North Dakota». Journal of Field Ornithology (en inglés) (Association of Field Ornithologists) 74 (4): 288-292. Consultado el 10 de enero de 2013.
- Clotfelter, Ethan D. (1997). «Red-winged blackbird parental investment following brood parasitism by brown-headed cowbirds: Is parentage important?». Behavioral Ecology and Sociobiology (en inglés) (Springer-Verlag) 41 (3): 193-201. Consultado el 13 de enero de 2012.
- Weatherhead, Patrick J. (abril de 1995). «Effects on female reproductive success of familiarity and experience among male red-winged blackbirds». Animal Behaviour (en inglés) (Association for the Study of Animal Behaviour) 49 (4): 967-976. Archivado desde el original el 8 de febrero de 2013. Consultado el 17 de agosto de 2011.
- Weatherhead, Patrick J.; Sommerer, Sophie J. (junio de 2001). «Breeding synchrony and nest predation in red-winged blackbirds». Ecology (en inglés) (Ecological Society of America) 82: 1632-1641. Consultado el 29 de enero de 2013.
- Beletsky, Les David (agosto de 1991). «Alert calls of male red-winged blackbirds: call rate and function». Canadian Journal of Zoology (en inglés) (NRC Research Press) 69 (8): 2116-2120. Consultado el 20 de agosto de 2011.
- Picman, Jaroslav (agosto de 1983). «Aggression by red-winged blackbirds towards marsh wrens». Canadian Journal of Zoology (en inglés) (NRC Research Press) 61 (8): 1896-1899. Consultado el 30 de julio de 2012.
- Dufour, Kevin W.; Weatherhead, Patrick J. (1998). «Bilateral symmetry as an indicator of male quality in red-winged blackbirds: associations with measures of health, viability, and parental effort». Behavioral Ecology (en inglés) (International Society for Behavioural Ecology) 9 (3): 220-231. Consultado el 10 de agosto de 2011.
- Weatherhead, Patrick J.; Metz, Karen J.; Bennett, Gordon F.; Irwin, Rebecca E. (julio de 1993). «Parasite faunas, testosterone and secondary sexual traits in male red-winged blackbirds». Behavioral Ecology and Sociobiology (en inglés) (Springer-Verlag) 33 (1): 13-23. Consultado el 6 de febrero de 2013.
- McNicol, Donald K.; Robertson, Raleigh J.; Weatherhead, Patrick J. (diciembre de 1982). «Seasonal, habitat, and sex-specific food habits of red-winged blackbirds: implications for agriculture». Canadian Journal of Zoology (en inglés) (NRC Research Press) 60 (12): 3282-3289. Consultado el 30 de diciembre de 2012.
- Mott, Donald F.; West, Richard R.; De Grazio, John W.; Guarino, Joseph L. (julio de 1972). «Foods of the red-winged blackbird in Brown County, South Dakota». Journal of Wildlife Management (en inglés) (The Wildlife Society) 36 (3): 983-987. Consultado el 1 de enero de 2012.
- Rodenhouse, Nicholas L.; Best, Louis B.; O'Connor, Raymond J.; Bollinger, Eric K. (1992). «Effects of temperate agriculture on neotropical migrant landbirds». General Technical Report RM-229 (en inglés) (Fort Collins (Colorado): Departamento de Agricultura de Estados Unidos, Servicio Forestal, Rocky Mountain Forest and Range Experiment Station): 280-295. Consultado el 4 de abril de 2011.
- Bendell, Barry E.; Weatherhead, Patrick J.; Stewart, Robin K. (1981). «The impact of predation by red-winged blackbirds on European corn borer populations». Canadian Journal of Zoology (en inglés) (NRC Research Press) 59 (8): 1535-1538. Consultado el 9 de agosto de 2011.
- Blackwell, Bradley F.; Dolbeer, Richard A. (1 de octubre de 2001). «Decline of the red-winged blackbird population in Ohio correlated to changes in agriculture (1965-1996)». Journal of Wildlife Management (en inglés) (The Wildlife Society) 65 (4): 661-667. Consultado el 10 de diciembre de 2011.
- Besser, Jerome F.; De Grazio, John W.; Guarino, Joseph L. (30 de octubre de 1973). «Decline of a blackbird population during seven years of baiting with a chemical frightening agent». Paper 92. Bird Control Seminars Proceedings (en inglés) 6: 12-14. Consultado el 2 de septiembre de 2012.
- Clark, Robert G.; Weatherhead, Patrick J.; Greenwood, Hamilton; Titman, Rodger D. (1986). «Numerical responses of red-winged blackbird populations to changes in regional land-use patterns». Canadian Journal of Zoology (en inglés) (NRC Research Press) 64 (9): 1944-1950. Consultado el 9 de agosto de 2011.
- White, Stephen B.; Dolbeer, Richard A.; Bookhout, Theodore A. (abril de 1985). «Ecology, bioenergetics, and agricultural impacts of a winter-roosting population of blackbirds and starlings». Wildlife Monographs (en inglés) (Allen Press) (93): 3-42. ISSN 0084-0173. Consultado el 9 de agosto de 2011.
- Besser, Jerome F.; Brady, Daniel J. (1986). «Bird damage to ripening field corn increases in the United States from 1971 to 1981». Fish and Wildlife Leaflet 7 (en inglés) (Washington D. C.: Departamento del Interior de los Estados Unidos, Servicio de Pesca y Vida Silvestre). Consultado el 9 de agosto de 2011.
- Besser, Jerome F.; De Grazio, John W.; Guarino, Joseph L.; Mott, Donald F.; Otis, David L.; Besser, Blake R.; Knittle, C. Edward (1984). «Decline in breeding red-winged blackbirds in the Dakotas, 1965-1981». Journal of Field Ornithology (en inglés) (Association of Field Ornithologists) 55 (4): 435-443. Consultado el 11 de diciembre de 2011.
- Homan, H. J.; Linz, G. M.; Engeman, R. M.; Penry, L. B. (2004). «Spring dispersal patterns of red-winged blackbirds, Agelaius phoeniceus, staging in eastern South Dakota». The Canadian Field-Naturalist (en inglés) 118 (2): 201-209. Archivado desde el original el 5 de diciembre de 2013. Consultado el 27 de agosto de 2012.
- Dyer, Melvin I. (septiembre de 1967). «An analysis of blackbird feeding behavior». Canadian Journal of Zoology (en inglés) (NRC Research Press) 45 (5): 765-772. Consultado el 1 de enero de 2012.
- Dolbeer, Richard A. (abril de 1990). «Ornithology and integrated pest management: Red-winged blackbirds Agelaius phoeniceus and corn». Ibis (en inglés) (British Ornithologists' Union) 132 (2): 309-322. Consultado el 2 de enero de 2012.
- Lefebvre, Paul W.; Seubert, John L. (1 de febrero de 1970). «Surfactants as blackbird stressing agents». Paper 32. Vertebrate Pest Conference Proceedings (en inglés) 4: 156-161. Consultado el 1 de enero de 2012.
- De Grazio, John W.; Besser, Jerome F.; DeCino, Thomas J.; Guarino, Joseph L.; Starr, Robert I. (julio de 1971). «Use of 4-aminopyridine to protect ripening corn from blackbirds». Journal of Wildlife Management (en inglés) (Allen Press) 35 (3): 565-569. Consultado el 23 de septiembre de 2012.
- Dolbeer, Richard A.; Ingram, Charles R.; Seubert, John L.; Stickley, Allen R., Jr.; Mitchell, Robert T. (julio de 1976). «4-aminopyridine effectiveness in sweet corn related to blackbird population density». Journal of Wildlife Management (en inglés) (The Wildlife Society) 40 (3): 564-570. Consultado el 31 de diciembre de 2011.
- De Grazio, John W.; Besser, Jerome F.; DeCino, Thomas J.; Guarino, Joseph L.; Schafer, Edward W., Jr. (octubre de 1972). «Protecting ripening corn from blackbirds by broadcasting 4-aminopyridine baits». Journal of Wildlife Management (en inglés) (The Wildlife Society) 36 (4): 1316-1320. Consultado el 18 de diciembre de 2011.
- Bray, Olin E.; Kennelly, James J.; Guarino, Joseph L. (junio de 1975). «Fertility of eggs produced on territories of vasectomized red-winged blackbirds». The Wilson Bulletin (en inglés) (Wilson Ornithological Society) 87 (2): 187-195. Consultado el 24 de noviembre de 2012.
- Holcomb, Larry C. (1970). «Prolonged incubation behaviour of red-winged blackbird incubating several egg sizes». Behaviour (en inglés) (BRILL) 36 (1/2): 74-83. Consultado el 25 de noviembre de 2012.
Enlaces externos
 Wikimedia Commons alberga una categoría multimedia sobre Agelaius phoeniceus.
Wikimedia Commons alberga una categoría multimedia sobre Agelaius phoeniceus. Wikispecies tiene un artículo sobre Agelaius phoeniceus.
Wikispecies tiene un artículo sobre Agelaius phoeniceus.- Cornell Lab of Ornithology



