Élément chimique
Un élément chimique est la classe des atomes dont le noyau compte un nombre donné de protons. Ce nombre, noté Z, est le numéro atomique de l'élément, qui détermine la configuration électronique des atomes correspondants, et donc leurs propriétés physicochimiques. Ces atomes peuvent en revanche compter un nombre variable de neutrons dans leur noyau, ce qu'on appelle des isotopes. L'hydrogène, le carbone, l'azote, l'oxygène, le fer, le cuivre, l'argent, l'or, etc., sont des éléments chimiques, dont le numéro atomique est respectivement 1, 6, 7, 8, 26, 29, 47, 79, etc. Chacun est conventionnellement désigné par un symbole chimique : H, C, N, O, Fe, Cu, Ag, Au, etc. Au total, 118 éléments chimiques ont été observés à ce jour, de numéro atomique 1 à 118. Parmi eux, 94 éléments ont été identifiés sur Terre dans le milieu naturel, et 80 ont au moins un isotope stable : tous ceux de numéro atomique inférieur ou égal à 82 hormis les éléments 43 et 61.
Pour les articles homonymes, voir Élément.
Les éléments chimiques peuvent se combiner entre eux au cours de réactions chimiques pour former d'innombrables composés chimiques. Ainsi, l'eau résulte de la combinaison d'oxygène et d'hydrogène en molécules de formule chimique H2O — deux atomes d'hydrogène et un atome d'oxygène. Dans des conditions opératoires différentes, l'oxygène et l'hydrogène pourront donner des composés différents, par exemple du peroxyde d'hydrogène, ou eau oxygénée, de formule H2O2 — deux atomes d'hydrogène et deux atomes d'oxygène. Réciproquement, chaque composé chimique peut être décomposé en éléments chimiques distincts, par exemple l'eau peut être électrolysée en oxygène et hydrogène.
Une substance pure constituée d'atomes du même élément chimique est appelée corps simple, et ne peut pas être décomposée en d'autres éléments distincts, ce qui différencie un corps simple d'un composé chimique. L'oxygène est un élément chimique, mais le gaz appelé couramment « oxygène » est un corps simple dont le nom exact est dioxygène, de formule O2, pour le distinguer de l'ozone, de formule O3, qui est également un corps simple ; l'ozone et le dioxygène sont des variétés allotropiques de l'élément oxygène. L'état standard d'un élément chimique est celui du corps simple dont l'enthalpie standard de formation est la plus faible aux conditions normales de température et de pression, par convention égale à zéro.
Un élément chimique ne peut pas se transformer en un autre élément par une réaction chimique, seule une réaction nucléaire appelée transmutation peut y parvenir. Cette définition a été formulée en substance pour la première fois par le chimiste français Antoine Lavoisier en 1789[1],[alpha 1]. Les éléments chimiques sont communément classés dans une table issue des travaux du chimiste russe Dmitri Mendeleïev et appelée « tableau périodique des éléments » :
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| 1 | H | He | |||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |
| 6 | Cs | Ba | * | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | * * |
Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| ↓ | |||||||||||||||||||
| * | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | |||||
| * * |
Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | |||||
Tableau périodique des éléments chimiques |
|||||||||||||||||||
Définitions
Noms, symboles
En 2011 l'Union internationale de chimie pure et appliquée (UICPA) a entériné les noms en anglais et les symboles chimiques internationaux des 112 premiers éléments (par ordre de numéro atomique)[2]. Le , l'UICPA a nommé deux éléments supplémentaires, le flérovium Fl et le livermorium Lv (numéros 114 et 116)[3],[4]. Le l'UICPA a officialisé l'observation de quatre autres éléments, de numéros atomiques 113, 115, 117 et 118, mais ne leur a pas attribué de noms définitifs. Provisoirement désignés sous les noms systématiques d'ununtrium (Uut), ununpentium (Uuv), ununseptium (Uus) et ununoctium (Uuo)[5], ils reçurent leur nom définitif le , respectivement nihonium (Nh), moscovium (Mc), tennesse (Ts) et oganesson (Og)[6].
Quand on veut représenter par un symbole un élément quelconque, on choisit généralement la lettre M (parfois en italique[alpha 2]). Quand on veut représenter différents types d'éléments interchangeables, notamment pour écrire la formule chimique d'un minéral, on se résout à employer des lettres comme A, B, C ou X, Y, Z, dans un contexte où l'on sait qu'il ne s'agit pas des éléments portant ces symboles (argon, bore, etc.)[alpha 3].
Abondance
| Z | Élément | ppm |
|---|---|---|
| 1 | Hydrogène | 739 000 |
| 2 | Hélium | 240 000 |
| 8 | Oxygène | 10 400 |
| 6 | Carbone | 4 600 |
| 10 | Néon | 1 340 |
| 26 | Fer | 1 090 |
| 7 | Azote | 960 |
| 14 | Silicium | 650 |
| 12 | Magnésium | 580 |
| 16 | Soufre | 440 |
En tout, 118 éléments ont été observés au 1er trimestre 2012. « Observé » signifie qu'on a identifié au moins un atome de cet élément de façon raisonnablement sûre : ainsi, seuls trois atomes de l'élément 118 ont été détectés à ce jour, et ce de façon indirecte à travers les produits de leur chaîne de désintégration.
Seuls les 94 premiers éléments sont observés sur Terre dans le milieu naturel. Parmi eux, six ne sont présents qu'à l'état de traces : le technétium 43Tc, le prométhium 61Pm, l'astate 85At, le francium 87Fr, le neptunium 93Np et le plutonium 94Pu. Il s'agit d'éléments qui se désintègrent trop rapidement en comparaison de leur taux de formation ; le neptunium 93Np et le plutonium 94Pu résultent par exemple de la capture neutronique par le thorium 90Th ou surtout par l'uranium 92U. Le réacteur nucléaire naturel d’Oklo a aussi produit les transuraniens de l'américium 95Am jusqu'au fermium 100Fm, mais ils se sont rapidement désintégrés en éléments plus légers[8].
Les astronomes ont observé les raies spectroscopiques des éléments jusqu'à l'einsteinium 99Es dans l'étoile de Przybylski.
Les 18 autres éléments observés non détectés sur Terre ni dans l'espace ont été produits artificiellement par réactions nucléaires à partir d'éléments plus légers.
Selon le modèle standard de la cosmologie, l'abondance relative des isotopes des 95 éléments naturels dans l'univers résulte de quatre phénomènes[9] :
- la nucléosynthèse primordiale pour les trois (ou quatre) premiers éléments : hydrogène, hélium, lithium, voire béryllium ;
- la nucléosynthèse stellaire pour les vingt-deux éléments suivants (l'hydrogène et l'hélium servant de matière première dans les usines stellaires), jusqu'au fer ;
- la spallation de ces noyaux qui enrichit le milieu interstellaire notamment en lithium, béryllium et bore, détectés en surabondance dans les rayons cosmiques ;
- la capture neutronique sur ces mêmes noyaux dans les étoiles en fin de vie, et notamment les supernovas, pour générer tous les éléments au-delà du fer, au cours de processus appelés r ou s selon qu'ils sont rapides ou lents, ainsi que la capture de protons rapides (processus rp) et la photodésintégration (processus p) pour ce qui concerne les noyaux riches en protons (tels que 196Hg).
Numéro atomique
Le numéro atomique d'un élément, noté Z (en référence à l'allemand Zahl), est égal au nombre de protons contenu dans les noyaux des atomes de cet élément. Par exemple, tous les atomes d'hydrogène ne comptent qu'un seul proton, donc le numéro atomique de l'hydrogène est Z = 1. Si tous les atomes d'un même élément comptent le même nombre de protons, ils peuvent en revanche avoir différents nombres de neutrons : chaque nombre de neutrons possible définit un isotope de l'élément.
Les atomes étant électriquement neutres, ils comptent autant d'électrons, chargés négativement, que de protons, chargés positivement, de sorte que le numéro atomique représente également le nombre d'électrons des atomes d'un élément donné. Les propriétés chimiques d'un élément étant déterminées avant tout par sa configuration électronique, on comprend que le numéro atomique est la caractéristique déterminante d'un élément chimique.
Le numéro atomique définit entièrement un élément : connaître le numéro atomique revient à connaître l'élément. C'est pour cela qu'il est généralement omis avec les symboles chimiques, sauf éventuellement pour rappeler la position de l'élément dans le tableau périodique. Lorsqu'il est représenté, il se positionne en bas à gauche du symbole chimique : ZX.
Nombre de masse
Le nombre de masse d'un élément, noté A, est égal au nombre de nucléons (protons et neutrons) contenu dans les noyaux des atomes de cet élément. Si tous les atomes d'un élément donné ont par définition le même nombre de protons, ils peuvent en revanche avoir des nombres différents de neutrons, et donc des nombres de masse différents, ce qu'on appelle des isotopes. Par exemple, l'hydrogène 1H a trois isotopes principaux : le protium 1
1H, hydrogène courant, dont le noyau à un proton n'a aucun neutron ; le deutérium 2
1H ; plus rare, dont le noyau à un proton compte, en plus, un neutron ; et le tritium 3
1H, radioactif, présent dans le milieu naturel à l'état de traces, et dont le noyau à un proton compte deux neutrons.
Le nombre de masse n'a généralement aucune incidence sur les propriétés chimiques des atomes, car il n'affecte pas leur configuration électronique ; un effet isotopique peut néanmoins être observé pour les atomes légers, c'est-à-dire le lithium 3Li, l'hélium 2He et surtout l'hydrogène 1H, car l'ajout ou le retrait d'un neutron dans le noyau de tels atomes entraîne une variation relative significative de la masse de l'atome, qui affecte les fréquences et l'énergie de vibration et de rotation des molécules (mesurable par spectroscopie infrarouge). Cela modifie la cinétique des réactions chimiques, et l'intensité des liaisons chimiques, le potentiel d'oxydoréduction. Pour les éléments lourds, en revanche, le nombre de masse n'a pratiquement pas d'influence sur leurs propriétés chimiques.
La densité volumique est proportionnelle à la masse atomique donc presque au nombre de masse. La vitesse de translation étant inversement à la racine carrée de la masse moléculaire, certains propriétés physiques comme la vitesse du son, la conductibilité thermique, la volatilité, la vitesse de diffusion sont un peu modifiées. Les propriétés physiques peuvent différer suffisamment pour permettre de séparer les isotopes, comme 238
92U et 235
92U, par diffusion ou centrifugation.
Le nombre de masse n'affectant pas les propriétés chimiques des éléments, il est généralement omis avec les symboles chimiques, sauf lorsqu'il s'agit de distinguer des isotopes. Lorsqu'il est représenté, il se positionne en haut à gauche du symbole chimique : AX.
Masse atomique
L'unité de masse atomique a été définie par l'UICPA en 1961 comme étant exactement le douzième de la masse du noyau d'un atome de 12C (carbone 12) :
La masse au repos d'un nucléon n'est en effet pas pertinente pour mesurer la masse des atomes car protons et neutrons n'ont pas exactement la même masse au repos — respectivement 938,201 3(23) MeV/c2 et 939,565 560(81) MeV/c2 — et surtout cette masse diffère de celle qu'ils ont lorsqu'ils font partie d'un noyau atomique en raison de l'énergie de liaison nucléaire de ces nucléons, qui induit un défaut de masse entre la masse réelle d'un noyau atomique et le cumul des masses au repos des nucléons qui composent ce noyau.
La masse atomique d'un élément est égale à la somme des produits des nombres de masse de ses isotopes par leur abondance naturelle. Appliqué par exemple au plomb, cela donne :
Isotope Abondance naturelle A Produit 204Pb 1,4 % × 204 = 2,9 206Pb 24,1 % × 206 = 49,6 207Pb 22,1 % × 207 = 45,7 208Pb 52,4 % × 208 = 109,0 Masse atomique du plomb = 207,2
La mole étant définie par le nombre d'atomes contenus dans 12 g de carbone 12 (soit N ≈ 6,022 141 79 × 1023 atomes), la masse atomique du plomb est donc de 207,2 g/mol, avec un défaut de masse de l'ordre de 7,561 676 MeV/c2 par nucléon.
De ce qui précède, on comprend qu'on ne peut définir de masse atomique que pour les éléments dont on connaît la composition isotopique naturelle ; à défaut d'une telle composition isotopique, on retient le nombre de masse de l'isotope connu ayant la période radioactive la plus longue, ce qu'on indique généralement en représentant la masse atomique obtenue entre parenthèses ou entre crochets.
Isotopes
| Isotope | Nucléides (ppm) |
|---|---|
| 1H | 705 700 |
| 4He | 275 200 |
| 16O | 5 920 |
| 12C | 3 032 |
| 20Ne | 1 548 |
| 56Fe | 1 169 |
| 14N | 1 105 |
| 28Si | 653 |
| 24Mg | 513 |
| 32S | 396 |
| 22Ne | 208 |
| 26Mg | 79 |
| 36Ar | 77 |
| 54Fe | 72 |
| 25Mg | 69 |
| 40Ca | 60 |
| 27Al | 58 |
| 58Ni | 49 |
| 13C | 37 |
| 3He | 35 |
| 29Si | 34 |
| 23Na | 33 |
| 57Fe | 28 |
| 2H | 23 |
| 30Si | 23 |
Deux atomes dont le noyau compte le même nombre de protons mais un nombre différent de neutrons sont dits « isotopes » de l'élément chimique défini par le nombre de protons de ces atomes. Parmi les 118 éléments observés, seuls 80 ont au moins un isotope stable (non radioactif) : tous les éléments de numéro atomique inférieur ou égal à 82, c'est-à-dire jusqu'au plomb 82Pb, hormis le technétium 43Tc et le prométhium 61Pm. Parmi ceux-ci, seuls 14 n'ont qu'un seul isotope stable (par exemple le fluor, constitué exclusivement de l'isotope 19F), les 66 autres en ont au moins deux (par exemple le cuivre, dans les proportions 69 % de 63Cu et 31 % de 65Cu, ou le carbone, dans les proportions 98,9 % de 12C et 1,1 % de 13C). Il existe en tout 256 isotopes stables connus des 80 éléments non radioactifs, ainsi qu'une vingtaine d'isotopes faiblement radioactifs présents dans le milieu naturel (parfois avec une période radioactive tellement grande qu'elle en devient non mesurable), certains éléments ayant à eux seuls plus d'une demi-douzaine d'isotopes stables ; ainsi, l'étain 50Sn en compte pas moins de dix, d'occurrences naturelles fort variables :
Isotope Abondance naturelle
(%)N 112Sn 0,97 62 114Sn 0,65 64 115Sn 0,34 65 116Sn 14,54 66 117Sn 7,68 67 118Sn 24,23 68 119Sn 8,59 69 120Sn 32,59 70 122Sn 4,63 72 124Sn 5,79 74
Parmi les 274 isotopes les plus stables connus (comprenant 18 isotopes « quasi stables » ou très faiblement radioactifs), un peu plus de 60 % (165 nucléides pour être exact) sont constitués d'un nombre pair à la fois de protons (Z) et de neutrons (N), et un peu moins de 1,5 % (seulement quatre nucléides[alpha 4]) d'un nombre impair à la fois de protons et de neutrons ; les autres nucléides se répartissent à peu près à parts égales (un peu moins de 20 %) entre Z pair et N impair, et Z impair et N pair. Globalement, 220 nucléides stables (un peu plus de 80 %) ont un nombre pair de protons, et seulement 54 en ont un nombre impair ; c'est un élément sous-jacent à l'effet d'Oddo-Harkins, relatif au fait que, pour Z> 4 (c'est-à-dire à l'exception des éléments issus de la nucléosynthèse primordiale), les éléments de numéro atomique pair sont plus abondants dans l'univers que ceux dont Z est impair. Cet effet se manifeste notamment dans la forme en dents de scie des courbes d'abondance des éléments par numéro atomique croissant :
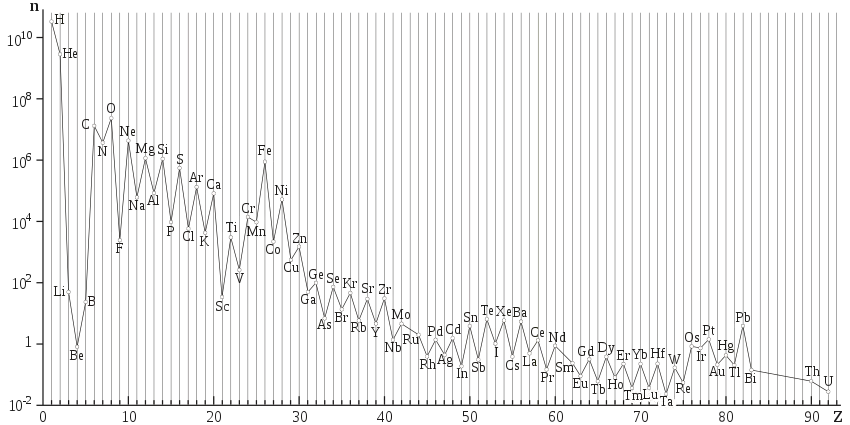 Abondance des éléments dans l'univers. |
 Abondance des éléments dans l'écorce terrestre continentale. |
Isotones
Deux atomes qui ont le même nombre de neutrons mais un nombre différent de protons sont dits isotones. Il s'agit en quelque sorte de la notion réciproque de celle d'isotope.
C'est par exemple le cas des nucléides stables 36S, 37Cl, 38Ar, 39K et 40Ca, situés sur l'isotone 20 : ils comptent tous 20 neutrons, mais respectivement 16, 17, 18, 19 et 20 protons ; les isotones 19 et 21, quant à eux, ne comptent aucun isotope stable.
Radioactivité
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| 1 | H | He | |||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |
| 6 | Cs | Ba | * |
Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | * * |
Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
| ↓ | |||||||||||||||||||
* |
La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | |||||
* * |
Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | |||||
| Pb | Un isotope au moins de cet élément est stable | ||||||||||||||||||
| Cm | Un isotope a une période d'au moins 4 millions d'années | ||||||||||||||||||
| Cf | Un isotope a une période d'au moins 800 ans | ||||||||||||||||||
| Md | Un isotope a une période d'au moins 1 journée | ||||||||||||||||||
| Bh | Un isotope a une période d'au moins 1 minute | ||||||||||||||||||
| Og | Tous les isotopes connus ont une période inférieure à 1 minute | ||||||||||||||||||
80 des 118 éléments du tableau périodique standard possèdent au moins un isotope stable : ce sont tous les éléments de numéro atomique compris entre 1 (hydrogène) et 82 (plomb) hormis le technétium 43Tc et le prométhium 61Pm, qui sont radioactifs.
Dès le bismuth 83Bi, tous les isotopes des éléments connus sont (au moins très faiblement) radioactifs — l'isotope 209Bi a ainsi une période radioactive valant un milliard de fois l'âge de l'univers. Lorsque la période dépasse quatre millions d'années, la radioactivité produite par ces isotopes est négligeable et ne constitue pas de risque sanitaire : c'est par exemple le cas de l'uranium 238, dont la période est de près de 4,5 milliards d'années.
Au-delà de Z = 110 (darmstadtium 281Ds), tous les isotopes des éléments ont une période radioactive de moins de 30 secondes, et de moins d'un dixième de seconde à partir du moscovium 288
115Mc.
Le modèle en couches de la structure nucléaire permet de rendre compte de la plus ou moins grande stabilité des noyaux atomiques en fonction de leur composition en nucléons (protons et neutrons). En particulier, des « nombres magiques » de nucléons, conférant une stabilité particulière aux atomes qui en sont composés, ont été observés expérimentalement, et expliqués par ce modèle[11]. Le plomb 208, qui est le plus lourd des noyaux stables existants, est ainsi composé du nombre magique de 82 protons et du nombre magique de 126 neutrons.
Certaines théories[alpha 5] extrapolent ces résultats en prédisant l'existence d'un îlot de stabilité parmi les nucléides superlourds, pour un « nombre magique » de 184 neutrons et — selon les théories et les modèles — 114, 120, 122 ou 126 protons.
Une approche plus moderne de la stabilité nucléaire montre toutefois, par des calculs fondés sur l'effet tunnel, que, si de tels noyaux superlourds doublement magiques seraient probablement stables du point de vue de la fission spontanée, ils devraient cependant subir des désintégrations α avec une période radioactive de quelques microsecondes[12],[13],[14] ; un îlot de relative stabilité pourrait néanmoins exister autour du darmstadtium 293, correspondant aux nucléides définis par Z compris entre 104 et 116 et N compris entre 176 et 186 : ces éléments pourraient avoir des isotopes présentant des périodes radioactives atteignant quelques minutes.
Isomères nucléaires
| Isomère | Énergie d'excitation (keV) |
Période | Spin |
|---|---|---|---|
| 179Ta | 0,0 | 1,82 an | 7/2+ |
| 179m1Ta | 30,7 | 1,42 μs | 9/2- |
| 179m2Ta | 520,2 | 335 ns | 1/2+ |
| 179m3Ta | 1 252,6 | 322 ns | 21/2- |
| 179m4Ta | 1 317,3 | 9,0 ms | 25/2+ |
| 179m5Ta | 1 327,9 | 1,6 μs | 23/2- |
| 179m6Ta | 2 639,3 | 54,1 ms | 37/2+ |
Un même noyau atomique peut parfois exister dans plusieurs états énergétiques distincts caractérisés chacun par un spin et une énergie d'excitation particuliers. L'état correspondant au niveau d'énergie le plus bas est appelé état fondamental : c'est celui dans lequel on trouve naturellement tous les nucléides. Les états d'énergie plus élevée, s'ils existent, sont appelés isomères nucléaires de l'isotope considéré ; ils sont généralement très instables et résultent la plupart du temps d'une désintégration radioactive.
On note les isomères nucléaires en adjoignant la lettre « m » — pour « métastable » — à l'isotope considéré : ainsi l'aluminium 26, dont le noyau a un spin 5+ et est radioactif avec une période de 717 000 ans, possède un isomère, noté 26mAl, caractérisé par un spin 0+, une énergie d'excitation de 6 345,2 keV et une période de 6,35 s.
S'il existe plusieurs niveaux d'excitation pour cet isotope, on note chacun d'eux en faisant suivre la lettre « m » par un numéro d'ordre, ainsi les isomères du tantale 179 présentés dans le tableau ci-contre.
Un isomère nucléaire retombe à son état fondamental en subissant une transition isomérique, qui se traduit par l'émission de photons énergétiques, rayons X ou rayons γ, correspondant à l'énergie d'excitation.
Isomères nucléaires d'intérêt particulier
Certains isomères nucléaires sont particulièrement remarquables :
- le technétium 99m est très utilisé en médecine pour son émission de photons de 141 keV correspondant aux rayons X employés usuellement en radiologie ;
- le hafnium 178m2 est à la fois très énergétique et plutôt stable, avec une période de 31 ans ; selon certains scientifiques[15], sa transition isomérique vers l'état fondamental pourrait être déclenchée par un rayonnement X incident (phénomène d'émission γ induite), ce qui ouvrirait la voie à l'accumulation à très haute densité d'énergie, ainsi qu'à la réalisation d'armes de destruction massive compactes de nouvelle génération ;
- le tantale 180m1 a la particularité d'être stable sur au moins 1015 ans (près de 75 000 fois l'âge de l'univers), ce qui est d'autant plus remarquable que l'état fondamental de l'isotope 180Ta est, au contraire, très instable : le 180mTa est le seul isomère nucléaire présent dans le milieu naturel ; le mécanisme de sa formation dans les supernovae est d'ailleurs mal compris ;
- le thorium 229m est peut-être l'isomère connu ayant la plus faible énergie d'excitation, à peine quelques électron-volts : cette énergie est si faible qu'elle est difficilement mesurable, l'estimation la plus récente la situant vers (7,6 ± 0,5) eV[16], tandis qu'un consensus plus ancien la plaçait vers (3,5 ± 1,0) eV[17]. Cela correspond à des photons dans l'ultraviolet, et, s'il était possible d'exciter l'isotope 229Th avec un laser ultraviolet de longueur d'onde adéquate, cela rendrait possible la réalisation de batteries à haute densité d'énergie, voire peut-être d'horloges atomiques de précision ;
- l'américium 242m est, comme le tantale 180m1, plus stable que son état fondamental ; sa masse critique de quelques kilogrammes en ferait un possible combustible nucléaire pour des applications spatiales de propulsion par fragments de fission.
Allotropes
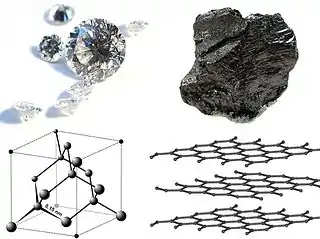
Un même élément chimique peut former plusieurs corps simples différant seulement les uns des autres par l'agencement des atomes dans les molécules ou les structures cristallines qui les définissent. Le carbone existe ainsi sous forme graphite à système cristallin hexagonal, sous forme diamant à structure tétraédrique, sous forme graphène qui correspond à un unique feuillet hexagonal de graphite, ou encore sous formes fullerène ou nanotube de carbone qui peuvent être vues comme des feuillets de graphène respectivement sphériques et tubulaires. Ces différentes formes de carbone sont appelées allotropes de cet élément. De la même façon, l'ozone O3 et le dioxygène O2 sont des allotropes de l'élément oxygène.
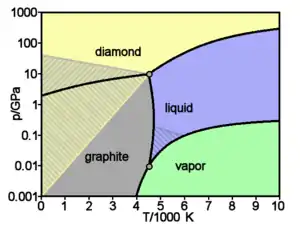
Chaque allotrope d'un élément ne peut exister que dans une gamme de températures et de pressions définies, ce qu'on représente par un diagramme de phases. Ainsi, le carbone ne cristallise sous forme diamant qu'en étant soumis à de hautes pressions, le diamant demeurant stable jusqu'à pression ambiante ; lorsqu'il cristallise à pression ambiante, le carbone donne néanmoins du graphite, et non du diamant.
État standard
Parmi toutes les variétés allotropiques d'un élément pouvant exister aux conditions normales de température et de pression, l'état standard est, par définition, celle dont l'enthalpie standard de formation est la plus faible, par convention définie comme nulle. Celui du carbone est le graphite, et celui de l'oxygène est le dioxygène, appelé pour cette raison communément « oxygène » en le confondant avec l'élément dont il est l'état standard.
Symboles, nomenclature et classification
Premiers symboles
Le chimiste suédois Jöns Jacob Berzelius (1779-1848) est à l'origine des symboles chimiques des éléments en définissant un système typographique fondé sur l'alphabet latin sans aucun signe diacritique : une lettre majuscule, parfois suivie d'une lettre minuscule (ou deux chez certains éléments synthétiques), sans point marquant normalement une abréviation, dans une démarche universaliste qui a conduit à l'adoption de symboles issus du néolatin de l'époque moderne, par exemple :
- Ag < Argentum = Argent
- Au < Aurum = Or
- C < Carbonium = Carbone
- Cl < Chlorum = Chlore
- Cu < Cuprum = Cuivre
- Fe < Ferrum = Fer
- Hg < Hydrargyrum = Mercure
- K < Kalium = Potassium
- N < Nitrogenum = Azote
- Na < Natrium = Sodium
- O < Oxygenium = Oxygène
- P < Phosphorus = Phosphore
- Pb < Plumbum = Plomb
- S < Sulphur = Soufre
- Sb < Stibium = Antimoine
- Sn < Stannum = Étain
- etc.
Tous les symboles chimiques ont une validité internationale quels que soient les systèmes d'écriture en vigueur, à la différence des noms des éléments qui doivent être traduits.
Nomenclature actuelle
L'Union internationale de chimie pure et appliquée (UICPA) est l'instance chargée notamment de normaliser la nomenclature internationale des éléments chimiques et de leurs symboles. Cela permet de s'affranchir des querelles de nommage des éléments, qu'il s'agisse des querelles anciennes (par exemple au sujet du lutécium, que les Allemands ont appelé cassiopeium jusqu'en 1949 à la suite d'une querelle de paternité entre un Français et un Autrichien quant à la première purification de l'élément) ou récentes (notamment au sujet de l'élément 104, synthétisé par deux équipes, russe et américaine, qui s'opposaient sur le nom à donner à cet élément) :
- le nom des 118 éléments reconnus par l'UICPA est à présent fixé, et le symbole chimique de ces éléments est unifié dans le monde entier[6] ;
- les éléments suivants, encore hypothétiques, reçoivent à titre provisoire une dénomination systématique fondée sur leur numéro atomique. L'élément 119 est ainsi appelé ununennium (Uue), l'élément 120 unbinilium (Ubn), etc.
Le tableau périodique des éléments est universellement utilisé pour classer les éléments chimiques de telle sorte que leurs propriétés soient largement prédictibles en fonction de leur position dans ce tableau. Issue des travaux du chimiste russe Dmitri Mendeleïev et de son contemporain allemand méconnu Julius Lothar Meyer, cette classification est dite périodique car organisée en périodes successives au long desquelles les propriétés chimiques des éléments, rangés par numéro atomique croissant, se succèdent dans un ordre identique.
Ce tableau fonctionne parfaitement jusqu'aux deux tiers de la septième période, ce qui englobe les 95 éléments détectés naturellement sur Terre ou dans l'espace ; au-delà de la famille des actinides (éléments qu'on appelle les transactinides), des effets relativistes, négligeables jusqu'alors, deviennent significatifs et modifient sensiblement la configuration électronique des atomes, ce qui altère très nettement la périodicité des propriétés chimiques aux confins du tableau.
Caractéristiques des différents éléments
Galerie partielle
 Blocs de lithium flottant dans de l'huile de paraffine pour prévenir leur oxydation.
Blocs de lithium flottant dans de l'huile de paraffine pour prévenir leur oxydation.



 Brome et vapeurs dans une ampoule.
Brome et vapeurs dans une ampoule. Iode cristallisé.
Iode cristallisé.
 Goutte de mercure.
Goutte de mercure.
| Z |
Élément |
Symbole |
Famille |
Masse atomique (g/mol) |
Abondance des éléments dans la croûte terrestre[18] (μg/kg) |
Isotopes naturels, classés par abondance décroissante (les isotopes radioactifs sont marqués d'un astérisque) |
|---|---|---|---|---|---|---|
| 1 | Hydrogène | H | Non-métal | 1,00794(7)[alpha 6],[alpha 7],[alpha 8] | 1 400 000 | 1H, 2H |
| 2 | Hélium | He | Gaz noble | 4,002602(2)[alpha 6],[alpha 8] | 8 | 4He, 3He |
| 3 | Lithium | Li | Métal alcalin | 6,941(2)[alpha 6],[alpha 7],[alpha 8],[alpha 9] | 20 000 | 7Li, 6Li |
| 4 | Béryllium | Be | Métal alcalino-terreux | 9,012182(3) | 2 800 | 9Be |
| 5 | Bore | B | Métalloïde | 10,811(7)[alpha 6],[alpha 7],[alpha 8] | 10 000 | 11B, 10B |
| 6 | Carbone | C | Non-métal | 12,0107(8)[alpha 6],[alpha 8] | 200 000 | 12C, 13C |
| 7 | Azote | N | Non-métal | 14,0067(2)[alpha 6],[alpha 8] | 19 000 | 14N, 15N |
| 8 | Oxygène | O | Non-métal | 15,9994(3)[alpha 6],[alpha 8] | 461 000 000 | 16O, 18O, 17O |
| 9 | Fluor | F | Halogène | 18,9984032(5) | 585 000 | 19F |
| 10 | Néon | Ne | Gaz noble | 20,1797(6)[alpha 6],[alpha 7] | 5 | 20Ne, 22Ne, 21Ne |
| 11 | Sodium | Na | Métal alcalin | 22,98976928(2) | 23 600 000 | 23Na |
| 12 | Magnésium | Mg | Métal alcalino-terreux | 24,3050(6) | 23 300 000 | 24Mg, 26Mg, 25Mg |
| 13 | Aluminium | Al | Métal pauvre | 26,9815386(8) | 82 300 000 | 27Al |
| 14 | Silicium | Si | Métalloïde | 28,0855(3)[alpha 8] | 282 000 000 | 28Si, 29Si, 30Si |
| 15 | Phosphore | P | Non-métal | 30,973762(2) | 1 050 000 | 31P |
| 16 | Soufre | S | Non-métal | 32,065(5)[alpha 6],[alpha 8] | 350 000 | 32S, 34S, 33S, 36S |
| 17 | Chlore | Cl | Halogène | 35,453(2)[alpha 6],[alpha 7],[alpha 8] | 145 000 | 35Cl, 37Cl |
| 18 | Argon | Ar | Gaz noble | 39,948(1)[alpha 6],[alpha 8] | 3 500 | 40Ar, 36Ar, 38Ar |
| 19 | Potassium | K | Métal alcalin | 39,0983(1) | 20 900 000 | 39K, 41K, 40K* |
| 20 | Calcium | Ca | Métal alcalino-terreux | 40,078(4)[alpha 6] | 41 500 000 | 40Ca, 44Ca, 42Ca, 48Ca*, 43Ca, 46Ca |
| 21 | Scandium | Sc | Métal de transition | 44,955912(6) | 22 000 | 45Sc |
| 22 | Titane | Ti | Métal de transition | 47,867(1) | 5 650 000 | 48Ti, 46Ti, 47Ti, 49Ti, 50Ti |
| 23 | Vanadium | V | Métal de transition | 50,9415(1) | 120 000 | 51V, 50V* |
| 24 | Chrome | Cr | Métal de transition | 51,9961(6) | 102 000 | 52Cr, 53Cr, 50Cr, 54Cr |
| 25 | Manganèse | Mn | Métal de transition | 54,938045(5) | 950 000 | 55Mn |
| 26 | Fer | Fe | Métal de transition | 55,845(2) | 56 300 000 | 56Fe, 54Fe, 57Fe, 58Fe |
| 27 | Cobalt | Co | Métal de transition | 58,933195(5) | 25 000 | 59Co |
| 28 | Nickel | Ni | Métal de transition | 58,6934(4) | 84 000 | 58Ni, 60Ni, 62Ni, 61Ni, 64Ni |
| 29 | Cuivre | Cu | Métal de transition | 63,546(3)[alpha 8] | 60 000 | 63Cu, 65Cu |
| 30 | Zinc | Zn | Métal pauvre | 65,38(2) | 70 000 | 64Zn, 66Zn, 68Zn, 67Zn, 70Zn |
| 31 | Gallium | Ga | Métal pauvre | 69,723(1) | 19 000 | 69Ga, 71Ga |
| 32 | Germanium | Ge | Métalloïde | 72,64(1) | 1 500 | 74Ge, 72Ge, 70Ge, 73Ge, 76Ge |
| 33 | Arsenic | As | Métalloïde | 74,92160(2) | 1 800 | 75As |
| 34 | Sélénium | Se | Non-métal | 78,96(3)[alpha 8] | 50 | 80Se, 78Se, 76Se, 82Se, 77Se, 74Se |
| 35 | Brome | Br | Halogène | 79,904(1) | 2 400 | 79Br, 81Br |
| 36 | Krypton | Kr | gaz rare | 83,798(2)[alpha 6],[alpha 7] | 0,1 | 84Kr, 86Kr, 82Kr, 83Kr, 80Kr, 78Kr |
| 37 | Rubidium | Rb | Métal alcalin | 85,4678(3)[alpha 6] | 90 000 | 85Rb, 87Rb* |
| 38 | Strontium | Sr | Métal alcalino-terreux | 87,62(1)[alpha 6],[alpha 8] | 370 000 | 88Sr, 86Sr, 87Sr, 84Sr |
| 39 | Yttrium | Y | Métal de transition | 88,90585(2) | 33 000 | 89Y |
| 40 | Zirconium | Zr | Métal de transition | 91,224(2)[alpha 6] | 165 000 | 90Zr, 94Zr*, 92Zr, 91Zr, 96Zr* |
| 41 | Niobium | Nb | Métal de transition | 92,90638(2) | 20 000 | 93Nb |
| 42 | Molybdène | Mo | Métal de transition | 95,96(2)[alpha 6] | 1 200 | 98Mo, 96Mo, 95Mo, 92Mo, 100Mo*, 97Mo, 94Mo |
| 43 | Technétium | Tc | Métal de transition | [98,9063][alpha 10] | Traces | 99Tc*, 99mTc* |
| 44 | Ruthénium | Ru | Métal de transition | 101,07(2)[alpha 6] | 1 | 102Ru, 104Ru, 101Ru, 99Ru, 100Ru, 96Ru, 98Ru |
| 45 | Rhodium | Rh | Métal de transition | 102,90550(2) | 1 | 103Rh |
| 46 | Palladium | Pd | Métal de transition | 106,42(1)[alpha 6] | 15 | 106Pd, 108Pd, 105Pd, 110Pd, 104Pd, 102Pd |
| 47 | Argent | Ag | Métal de transition | 107,8682(2)[alpha 6] | 75 | 107Ag, 109Ag |
| 48 | Cadmium | Cd | Métal pauvre | 112,411(8)[alpha 6] | 150 | 114Cd, 112Cd, 111Cd, 110Cd, 113Cd*, 116Cd*, 106Cd, 108Cd |
| 49 | Indium | In | Métal pauvre | 114,818(3) | 250 | 115In*, 113In |
| 50 | Étain | Sn | Métal pauvre | 118,710(7)[alpha 6] | 2 300 | 120Sn, 118Sn, 116Sn, 119Sn, 117Sn, 124Sn, 122Sn, 112Sn, 114Sn, 115Sn |
| 51 | Antimoine | Sb | Métalloïde | 121,760(1)[alpha 6] | 200 | 121Sb, 123Sb |
| 52 | Tellure | Te | Métalloïde | 127,60(3)[alpha 6] | 1 | 130Te*, 128Te*, 126Te, 125Te, 124Te, 122Te, 123Te, 120Te |
| 53 | Iode | I | Halogène | 126,90447(3) | 450 | 127I |
| 54 | Xénon | Xe | gaz rare | 131,293(6)[alpha 6],[alpha 7] | 0,03 | 132Xe, 129Xe, 131Xe, 134Xe, 136Xe, 130Xe, 128Xe, 124Xe, 126Xe |
| 55 | Césium | Cs | Métal alcalin | 132,9054519(2) | 3 000 | 133Cs |
| 56 | Baryum | Ba | Métal alcalino-terreux | 137,327(7) | 425 000 | 138Ba, 137Ba, 136Ba, 135Ba, 134Ba, 130Ba, 132Ba |
| 57 | Lanthane | La | Lanthanide | 138,90547(7)[alpha 6] | 39 000 | 139La, 138La* |
| 58 | Cérium | Ce | Lanthanide | 140,116(1)[alpha 6] | 66 500 | 140Ce, 142Ce, 138Ce, 136Ce |
| 59 | Praséodyme | Pr | Lanthanide | 140,90765(2) | 9 200 | 141Pr |
| 60 | Néodyme | Nd | Lanthanide | 144,242(3)[alpha 6] | 41 500 | 142Nd, 144Nd*, 146Nd, 143Nd, 145Nd, 148Nd, 150Nd* |
| 61 | Prométhium | Pm | Lanthanide | [146,9151][alpha 10] | Traces | 145Pm* |
| 62 | Samarium | Sm | Lanthanide | 150,36(2)[alpha 6] | 7 050 | 152Sm, 154Sm, 147Sm*, 149Sm, 148Sm*, 150Sm, 144Sm |
| 63 | Europium | Eu | Lanthanide | 151,964(1)[alpha 6] | 2 000 | 153Eu, 151Eu* |
| 64 | Gadolinium | Gd | Lanthanide | 157,25(3)[alpha 6] | 6 200 | 158Gd, 160Gd, 156Gd, 157Gd, 155Gd, 154Gd, 152Gd* |
| 65 | Terbium | Tb | Lanthanide | 158,92535(2) | 1 200 | 159Tb |
| 66 | Dysprosium | Dy | Lanthanide | 162,500(1)[alpha 6] | 5 200 | 164Dy, 162Dy, 163Dy, 161Dy, 160Dy, 158Dy, 156Dy |
| 67 | Holmium | Ho | Lanthanide | 164,93032(2) | 1 300 | 165Ho |
| 68 | Erbium | Er | Lanthanide | 167,259(3)[alpha 6] | 3 500 | 166Er, 168Er, 167Er, 170Er, 164Er, 162Er |
| 69 | Thulium | Tm | Lanthanide | 168,93421(2) | 520 | 169Tm |
| 70 | Ytterbium | Yb | Lanthanide | 173,054(5)[alpha 6] | 3 200 | 174Yb, 172Yb, 173Yb, 171Yb, 176Yb, 170Yb, 168Yb |
| 71 | Lutécium | Lu | Lanthanide | 174,9668(1)[alpha 6] | 800 | 175Lu, 176Lu* |
| 72 | Hafnium | Hf | Métal de transition | 178,49(2) | 3 000 | 180Hf, 178Hf, 177Hf, 179Hf, 176Hf, 174Hf* |
| 73 | Tantale | Ta | Métal de transition | 180,9479(1) | 2 000 | 181Ta, 180m1Ta |
| 74 | Tungstène | W | Métal de transition | 183,84(1) | 1 250 | 184W, 186W, 182W, 183W, 180W* |
| 75 | Rhénium | Re | Métal de transition | 186,207(1) | 0,7 | 187Re*, 185Re |
| 76 | Osmium | Os | Métal de transition | 190,23(3)[alpha 6] | 1,5 | 192Os, 190Os, 189Os, 188Os, 187Os, 186Os*, 184Os |
| 77 | Iridium | Ir | Métal de transition | 192,217(3) | 1 | 193Ir, 191Ir |
| 78 | Platine | Pt | Métal de transition | 195,084(9) | 5 | 195Pt, 194Pt, 196Pt, 198Pt, 192Pt, 190Pt* |
| 79 | Or | Au | Métal de transition | 196,966569(4) | 4 | 197Au |
| 80 | Mercure | Hg | Métal pauvre | 200,59(2) | 85 | 202Hg, 200Hg, 199Hg, 201Hg, 198Hg, 204Hg, 196Hg |
| 81 | Thallium | Tl | Métal pauvre | 204.3833(2) | 850 | 205Tl, 203Tl |
| 82 | Plomb | Pb | Métal pauvre | 207,2(1)[alpha 6],[alpha 8] | 14 000 | 208Pb, 206Pb, 207Pb, 204Pb |
| 83 | Bismuth | Bi | Métal pauvre | 208,98040(1) | 8,5 | 209Bi* |
| 84 | Polonium | Po | Métal pauvre | [208,9824][alpha 10] | 200×10−9 | 209Po* |
| 85 | Astate | At | Métalloïde | [209,9871][alpha 10] | Traces | 210At* |
| 86 | Radon | Rn | Gaz noble | [222,0176][alpha 10] | 400×10−12 | 222Rn* |
| 87 | Francium | Fr | Métal alcalin | [223,0197][alpha 10] | Traces | 223Fr*, 221Fr* |
| 88 | Radium | Ra | Métal alcalino-terreux | [226,0254][alpha 10] | 900×10−6 | 226Ra* |
| 89 | Actinium | Ac | Actinide | [227,0278][alpha 10] | 550×10−9 | 227Ac* |
| 90 | Thorium | Th | Actinide | 232,03806(2)[alpha 6],[alpha 10] | 9 600 | 232Th* |
| 91 | Protactinium | Pa | Actinide | 231,03588(2)[alpha 10] | 1,4×10−3 | 231Pa* |
| 92 | Uranium | U | Actinide | 238,02891(3)[alpha 6],[alpha 7],[alpha 10] | 2 700 | 238U*, 235U*, 234U* |
| 93 | Neptunium | Np | Actinide | [237,0482][alpha 10] | Traces | 237Np* |
| 94 | Plutonium | Pu | Actinide | [244,0642][alpha 10] | Traces | 244Pu* |
| 95 | Américium | Am | Actinide | [243,0614][alpha 10] | — | — |
| 96 | Curium | Cm | Actinide | [247,0704][alpha 10] | — | — |
| 97 | Berkélium | Bk | Actinide | [247,0703][alpha 10] | — | — |
| 98 | Californium | Cf | Actinide | [251,0796][alpha 10] | — | — |
| 99 | Einsteinium | Es | Actinide | [252,0829][alpha 10] | — | — |
| 100 | Fermium | Fm | Actinide | [257,0951][alpha 10] | — | — |
| 101 | Mendélévium | Md | Actinide | [258,0986][alpha 10] | — | — |
| 102 | Nobélium | No | Actinide | [259,1009][alpha 10] | — | — |
| 103 | Lawrencium | Lr | Actinide | [264][alpha 10] | — | — |
| 104 | Rutherfordium | Rf | Métal de transition | [265][alpha 10] | — | — |
| 105 | Dubnium | Db | Métal de transition | [268][alpha 10] | — | — |
| 106 | Seaborgium | Sg | Métal de transition | [272][alpha 10] | — | — |
| 107 | Bohrium | Bh | Métal de transition | [273][alpha 10] | — | — |
| 108 | Hassium | Hs | Métal de transition | [276][alpha 10] | — | — |
| 109 | Meitnérium | Mt | Indéfinie | [279][alpha 10] | — | — |
| 110 | Darmstadtium | Ds | Indéfinie | [278][alpha 10] | — | — |
| 111 | Roentgenium | Rg | Indéfinie | [283][alpha 10] | — | — |
| 112 | Copernicium | Cn | Métal de transition | [285][alpha 10] | — | — |
| 113 | Nihonium | Nh | Indéfinie | [287][alpha 10] | — | — |
| 114 | Flérovium | Fl | Indéfinie | [289][alpha 10] | — | — |
| 115 | Moscovium | Mc | Indéfinie | [291][alpha 10] | — | — |
| 116 | Livermorium | Lv | Indéfinie | [293][alpha 10] | — | — |
| 117 | Tennesse | Ts | Indéfinie | [294][alpha 10] | — | — |
| 118 | Oganesson | Og | Indéfinie | [294][alpha 10] | — | — |
Notes et références
Notes
- Le physicien et chimiste irlandais Robert Boyle, souvent présenté comme l'auteur du concept d'élément chimique, pratiquait en fait l'alchimie et recherchait le moyen de procéder à la transmutation des métaux entre eux. C'est davantage dans le domaine de l'atomisme qu'il a été précurseur, avec ses travaux fondateurs sur la physique des gaz et l'énoncé de la loi de Mariotte.
- Exemple : (en) Tamara Đorđević et Ljiljana Karanović, « Three new Sr-bearing arsenates, hydrothermally synthesized in the system SrO–MO–As2O5–H2O (M2+ = Mg, Cu, Zn) », European Journal of Mineralogy, vol. 30, , p. 785-800 (DOI 10.1127/ejm/2018/0030-2749).
- Exemple : on exprime souvent la formule chimique d'un grenat sous la forme XII3YIII2[SiO4]3 où XII représente un élément divalent et YIII un élément trivalent (a priori pas l'yttrium, ou pas spécialement).
- Ce sont : 2H, 6Li, 10B, et 14N ; il y en a de facto un cinquième avec le 180m1Ta, qui devrait théoriquement connaître une désintégration β en 180W ainsi qu'une capture électronique en 180Hf, mais aucune radioactivité de cette nature n'a jamais été observée, de sorte que cet élément, théoriquement instable, est considéré comme stable.
- Notamment les théories de champ moyen et les théories MM.
- La composition isotopique de cet élément dépend des sources de prélèvement, et la variation peut dépasser l'incertitude indiquée dans la table.
- La composition isotopique de cet élément dépend des sources du marché, ce qui peut entraîner un écart significatif par rapport à la valeur indiquée ici.
- La composition isotopique dépend des sources géologiques de sorte qu'une masse atomique plus précise ne peut être déterminée.
- La masse atomique du lithium commercial peut varier de 6,939 à 6,996 ; l'analyse de l'échantillon est nécessaire afin de déterminer la valeur exacte de la masse atomique du lithium fourni.
- Cet élément n'a pas de nucléide stable, et la valeur indiquée entre crochets correspond à la masse de l'isotope le plus stable de cet élément ou à sa composition isotopique caractéristique.
Références
- Traité élémentaire de chimie, p. 101.
- « IUPAC Periodic Table of the Elements » [« Tableau périodique des éléments, selon l'IUPAC (21 janvier 2011) »] (consulté le ).
- (en) « Element 114 is Named Flerovium and Element 116 is Named Livermorium » [« Les éléments 114 et 116 sont nommés flérovium et livermorium »] (consulté le )
- « IUPAC Periodic Table of the Elements » [« Tableau périodique des éléments, selon l'UICPA (1er mai 2013) »] (consulté le ).
- « IUPAC Periodic Table of the Elements » [« Tableau périodique des éléments, selon l'UICPA (8 janvier 2016) »] (consulté le ).
- (en) « Elements 113, 115, 117, and 118 are now formally named nihonium (Nh), moscovium (Mc), tennessine (Ts), and oganesson (Og) », .
- (en) Ken Croswell (trad. du grec ancien), Alchemy of the Heavens, New York, Anchor, , 1re éd., 340 p., poche (ISBN 978-0-385-47214-2, OCLC 34384881, lire en ligne)
- John Emsley, « Nature's Building Blocks: An A-Z Guide to the Elements », Oxford University Press, New York, New, (ISBN 978-0-19-960563-7)
- (en) Abondance des éléments dans l'espace et nucléosynthèse.
- (en) David Arnett (trad. du grec ancien), Supernovae and Nucleosynthesis, Princeton, New Jersey, Princeton University Press, , 1re éd., 598 p., poche (ISBN 978-0-691-01147-9, OCLC 33162440, LCCN 95041534, lire en ligne)
- Nuclear Shell Model : Table 1 – Nuclear Shell Structure, d'après Maria Goeppert Mayer et J. Hans D. Jensen dans « Elementary Theory of Nuclear Shell Structure », John Wiley & Sons, New York, 1955.
- (en) C. Samanta, P. Roy Chowdhury et D.N. Basu, « Predictions of alpha decay half lives of heavy and superheavy elements », Nucl. Phys. A, vol. 789, , p. 142–154 (DOI 10.1016/j.nuclphysa.2007.04.001)
- (en) P. Roy Chowdhury, C. Samanta et D. N. Basu, « Search for long lived heaviest nuclei beyond the valley of stability », Phys. Rev. C, vol. 77, , p. 044603 (DOI 10.1103/PhysRevC.77.044603, lire en ligne)
- (en) P. Roy Chowdhury, C. Samanta et D. N. Basu, « Nuclear half-lives for α -radioactivity of elements with 100 < Z < 130 », At. Data & Nucl. Data Tables, vol. 94, , p. 781 (DOI 10.1016/j.adt.2008.01.003)
- Carl B. Collins et al., « First experimental evidence of induced gamma emission of a longlived Hafnium-178 isomer showing a highly efficient X-rays to gamma-rays conversion », Phys. Rev. Lett., 82, 695 (1999).
- (en) B. R. Beck et al., « Energy splitting in the ground state doublet in the nucleus 229Th », Physical Review Letters, vol. 98, , p. 142501 (DOI 10.1103/PhysRevLett.98.142501, lire en ligne)
- (en) R. G. Helmer et C. W.Reich, « An Excited State of Th-229 at 3.5 eV », Physical Review Letters, vol. C49, , p. 1845-1858 (DOI 10.1103/PhysRevC.49.1845)
- David R. Lide (éd.) : CRC Handbook of Chemistry and Physics, 85e éd., CRC Press, Boca Raton, Floride, 2005. Section 14, Geophysics, Astronomy, and Acoustics; Abundance of Elements in the Earth's Crust and in the Sea.
Voir aussi
Bibliographie
- Robert Luft, Dictionnaire des corps purs simples de la chimie, Nantes, Association Cultures et Techniques, , 392 p. (ISBN 978-2-9510168-3-5). En particulier, la définition de l'élément.
- Jean-Louis Basdevant, Xavier Bataille, Philippe Fleury, Patrick Kohl et Jérôme Robert (coordination) (préf. Guy Ourisson), Dictionnaire de physique et de chimie, Paris, Nathan, coll. « Dictionnaires thématiques », , 467 p. (ISBN 978-2-09-188212-3, OCLC 892593674, BNF 43528667).
Articles connexes
- Corps simple
- Diversité minéralogique des éléments chimiques
- Élément synthétique
- Galerie d'éléments chimiques
- Histoire de la découverte des éléments chimiques
- Isotope stable
- Liste des éléments chimiques
- Liste des éléments chimiques, triés par température de fusion
- Molécule homonucléaire
- Table des isotopes
- Tableau périodique des éléments
Liens externes
- Ressources relatives à la santé :
- (en) Medical Subject Headings
- (no + nn + nb) Store medisinske leksikon
- Ressource relative à la littérature :
- Notices dans des dictionnaires ou encyclopédies généralistes :
- Base de données de la Société chimique de France (SCF)
- (en) « The Photographic Periodic Table of the Elements », où pour chaque élément (et chacun de ses isotopes) on a accès aux full technical data (« données techniques détaillées »)
Tableaux
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| 8 | 119 | 120 | * | ||||||||||||||||||||||||||||||
| * | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||
| Métaux Alcalins |
Alcalino- terreux |
Lanthanides | Métaux de transition |
Métaux pauvres |
Métal- loïdes |
Non- métaux |
Halo- gènes |
Gaz nobles |
Éléments non classés |
| Actinides | |||||||||
| Superactinides | |||||||||
- Portail de la physique
- Portail de la chimie
- Portail des sciences