Anatomie des araignées
L’anatomie des araignées décrit la morphologie des structures externes et internes chez les Araneae et les principales propriétés de ces structures. Cette anatomie présente de nombreux points communs avec celle des Arthropodes Chélicérates : corps divisé en deux tagmes, le prosome ou céphalothorax (partie antérieure dépourvue de mandibules et d'antennes, recouverte par une carapace en bouclier), et l’opisthosome (ou abdomen) dont les deux premiers métamères sont modifiés en organe génital. Le prosome a une première paire d’appendices transformée en chélicères et une deuxième paire d’appendices transformée en pédipalpes.
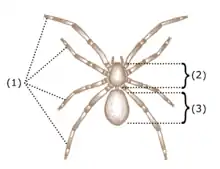
(1) Quatre paires de pattes ambulatoires ;
(2) Céphalothorax ;
(3) Opisthosome.

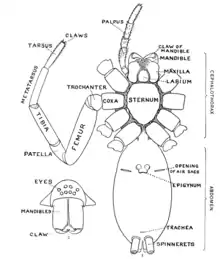
1 : pédipalpe ; 2 : trichobothrie ; 3 : carapace du prosoma ; 4 : opisthosoma ; 5 : yeux.
Articles des pattes. 6 : hanche ou coxa ; 7 : trochanter ; 8 : fémur ; 9 : patella ; 10 : tibia ; 11 : métatarse ou basitarse ; 12 : tarse ; 13 : griffes ; 14 : chélicère.

3 : tache cardiaque, zone longitudinale centrée à l’avant de l’opisthosome, souvent de forme lancéolée et de couleur différente par rapport au reste de ce tagme, surplombant le cœur. Le motif abdominal sur la face dorsale varie selon les taxons : présence de bandes transversales ou longitudinales, de chevrons ou d'un folium, dessin évoquant une feuille lobée.

15 : sternum du prosome ; 16 : pédicule ; 17 : sac pulmonaire ; 18 : stigmate pulmonaire ; 19 : pli épigastrique ; 20 : épigyne ; 21 : filière antérieure ; 22 : filière postérieure ; I, II, III et IV : paires de pattes.
L’anatomie de l'araignée présente également de nombreux points communs avec celle des Arachnides : prosoma équipé de paires d'yeux simples et de six paires d’appendices chez l’adulte (chélicères, pédipalpes et quatre paire de pattes ambulatoires) ; réduction voire perte des appendices de l’opisthosome ; développement d’un système respiratoire aérien qui peut avoir la forme d’un système trachéen ou d’un système pulmonaire.
Les araignées ont des adaptations qui les distinguent des autres arachnides : le prosome et l’opisthosome sont articulés par le pédicule ; les sternites du prosome sont fusionnés au niveau ventral pour former une plaque sternale ; la paire de chélicères biarticulés en crochets est parfois reliée à une glande à venin ; un bulbe copulateur est généralement présent au niveau de l'extrémité du pédipalpe des mâles ; parmi les quatre paires de pattes locomotrices, les deux premières paires de pattes antérieures sont dites tractives et les deux paires postérieure sont dites pulsives ; l’opisthosome non segmenté est muni en position postérieure de glandes séricigènes qui produisent de la soie filée par une à six paires de filières, appendices spécialisés excréteurs. Les araignées ♀ sont également équipées d'un organe sexuel externe féminin spécialisé, l'épigyne (plaque chitineuse en position ventrale qui contient un crochet et un réceptacle séminal).
Anatomie externe
Tagmatisation
Le céphalothorax est formé, comme son nom l'indique, de la fusion (tagmatisation) de la partie céphalique et de la partie thoracique qui portent ventralement respectivement les appendices prosomatiques et le plastron sternal. La région céphalique porte fondamentalement quatre paires d'yeux simples. Entre le groupe oculaire et le bord antérieur du bouclier céphalothoracique, se trouve une sclérite appelée bandeau ou clypéus et qui compose le « visage »[1].
Il assume au point de vue physiologique l'intégration neuro-sensorielle, la prise de nourriture, la locomotion, une partie de l'activité sexuelle (pédipalpes, pièces buccales) et un rôle glandulaire phéromonal, surtout chez le mâle.
Exceptionnellement, les Archaeidae ont un céphalothorax divisé en deux : appelées Pelican spiders par les anglophones, les Archaeidae ont un céphalothorax allongé, presque vertical, prolongé par de long chélicères dont la position évoque un bec de pélican maintenu contre le long cou.
Prosome
La région céphalique résulte de la fusion de l'acron (extrémité antérieure non métamérisée) avec deux métamères, dits céphalisés. Chacun de ces segments porte une paire d’appendices, la première de ces paires donnant les chélicères (qui injectent les enzymes digestives et parfois le venin), la deuxième les pédipalpes (qui interviennent dans le processus masticatoire), plus ou moins développés selon les groupes[2].
L'orifice buccal est bordé de deux lèvres : une lèvre supérieure ou rostre (rostrum) et une lèvre inférieure, le labium flanqué d'une paire de lames maxillaires[3] ou gnathocoxae (it) qui correspondent à la différenciation des hanches des pédipalpes.
_-_femelle_8.jpg.webp) On observe vers le centre du prosome de la Tégénaire noire une dépression, la fovéa[4].
On observe vers le centre du prosome de la Tégénaire noire une dépression, la fovéa[4]. 4 trichobothries sur une patte de Paratropis tuxtlensis.
4 trichobothries sur une patte de Paratropis tuxtlensis.
Pièces buccales
La première paire d'appendices buccaux est transformée en chélicères analogues aux mandibules des insectes. Ces appendices sont utilisés avant tout pour mordre, empoisonner et immobiliser les proies. La majorité des espèces (Pholcidae, Eresidae, Filistatidae, etc.) ne perce dans la cuticule de leurs proies qu'un seul point minuscule par où elles injectent le liquide digestif[5]. Ces pièces buccales peuvent également servir à transporter des proies et le cocon ovigère.
La deuxième paire d’appendices est transformée en pédipalpes, appelés aussi pattes-mâchoires. Elles servent à l'examen sensoriel des proies et à leur manipulation. Leur base est pourvue d'une excroissance recouvrant en partie l'orifice buccal et jouant un rôle de filtre lors de l'ingestion de nourriture grâce à la série de poils située sur leur bord antérieur et faisant office de peigne filtrant. Certaines espèces (Argiopidae, Lycosidae, Agelenidae, etc.) découpent leurs proies grâce à la serrula, scie présente sur les lames masticatrices à la base de ces pédipalpes[6].
Yeux simples

Dans leur majorité, les araignées portent sur leur prosome huit yeux simples ou ocelles, comme leur ancêtre probablement : deux yeux principaux (yeux médians antérieurs) qui assurent une vision frontale et six yeux secondaires (deux yeux médians postérieurs et quatre yeux latéraux antérieurs et postérieurs) qui permettent de percevoir et de localiser les mouvements périphériques. 99 % des araignées ont huit ocelles disposés au niveau de l'aire oculaire (appelée aussi groupe oculaire, divisé typiquement en deux blocs oculaires — yeux antérieurs et postérieurs — formant une ligne plus ou moins récurvée ou procurvée). 1 % ne possèdent que six yeux, leurs médians antérieurs ayant disparu, comme dans la famille des Haplogynae. Quelques rares espèces en ont quatre (Tetrablemma spp.), deux (la plupart des Caponiidae) ou plus du tout (araignées cavernicoles, certaines araignées tisseuses vivant sur leur toile ou chassant à l'affût sur un poste fixe). La plupart des espèces au mode de vie crépusculaire ou nocturne ont des yeux secondaires munis d'un tapetum afin d'accroître leur vision en faible luminosité, ce qui leur donne un aspect argenté par rapport aux yeux principaux sombres[7],[8].
La disposition oculaire et la forme des yeux, souvent des critères diagnostiques, sont propres au taxon. Reliés au cerveau, ils sont constitués par une seule masse nerveuse et comportent un cristallin, un corps vitré et une rétine, dont les cellules sont directes dans les yeux médians et inversées dans les yeux latéraux[9].
Ces ocelles permettent de détecter les mouvements environnants et participent à la localisation des proies. Les yeux fixes n'ont pas de mise au point optique, ont un pouvoir séparateur faible et le champ visuel, comme les autres champs sensoriels, ne s'étend que sur quelques centimètres, si bien que la vision est souvent considérée comme médiocre, la majorité des araignées étant plus sensibles aux vibrations émises par leur proie avec leurs pattes, et à leurs odeurs[10]. Certaines espèces (Salticidae, Lycosidae, Deinopidae) possèdent une très bonne vision pour leur activité de chasse diurne ou nocturne et la reconnaissance du partenaire lors de la parade nuptiale. Après avoir détecté les mouvements avec leurs yeux latéraux, elles pivotent et fixent leurs yeux frontaux pour préciser la nature de l'objet (taille, couleur)[11].
Les yeux des araignées sauteuses ont une spécialisation : la paire latérale postérieure, lui offrant un champ de vision étendu mais de faible résolution, sert à détecter les proies assez lointaines ; la paire latérale antérieure, aux mêmes caractéristiques sert principalement à détecter les prédateurs menaçants ou la distance des proies dont s'est rapprochée l'araignée ; la grosse paire centrale (yeux médians antérieurs) qui est la seule à posséder une rétine mobile (grâce à un jeu de muscles qui peut la déplacer et la concentrer sur une zone particulière) lui donnant une vision précise et en couleur (vision jusque dans le domaine des ultraviolets) et un pouvoir d'accommodation, lui permettant de suivre ses proies avec netteté. La vision de la plupart des espèces d'araignées est de qualité médiocre, mais les tarentules en ont une assez bonne. Les yeux médians antérieurs ont un champ limité (inférieur à 5°) mais une excellente résolution (10' environ)[12].
Pattes ambulatoires

Chaque patte ambulatoire se compose de 7 articles : de la base vers l'apex respectivement, on observe une hanche (coxa), un trochanter court et peu mobile, un long fémur (le trochanter et le fémur forment l'analogue d'une cuisse), une plus courte patella, un long tibia (patella et tibia formant la jambe), un métatarse et un tarse. Ce dernier est prolongé par un segment apical appelé prétarse[14] dont l'extrémité, chez les araignées tisserandes, porte 2 ou 3 griffes souvent denticulées à la face inférieure, lesquelles interviennent dans la manipulation de la soie et dans le déplacement sur la toile. Sont associées aux pattes diverses structures liées au mode de vie particulier de chaque taxon, que ce soient des peignes pour « carder » la soie, des épines, crins, poils qui servent d'organes sensoriels, des structures de stridulation. Chez certaines Araignées, qui ont les pattes longues et grêles, le tarse est rendu flexible[15].
Les pattes ambulatoires et les pattes-mâchoires disposent de poils tactiles : organes tarsaux jouant le rôle de chimiorécepteurs, trichobothries jouant le rôle de mécanorécepteurs, structures disposées isolément (lyrifissures) ou en série (organes lyriformes) jouant le rôle de propriocepteurs[16].
Les deux premières paires de pattes antérieures sont dites tractives et les deux paires postérieure sont dites pulsives. La majorité des familles des araignées ont les deux premières paires tournées vers l'avant (implantation prograde des pattes) alors que chez quelques familles anciennes, les quatre paires sont déployées sur le côté (implantation latérigrade des pattes), ce qui leur permet de courir sur le côté et en arrière, comme les crabes (plusieurs familles étant désignées par le nom vernaculaire d'araignées-crabes)[17],[18]. La présence de griffes permet aux araignées de grimper sur des surfaces rugueuses verticales (feuilles, rochers, volets de fenêtres, murs, plafonds, poutres). L'adhésion sur des surfaces lisses (fenêtre, évier) est assurée par des scopulae, touffes denses de soies qui permettent également aux araignées d'assurer une meilleure prise sur les proies glissantes, et de soulever jusqu'à 160 fois le poids de leur corps[19].
La course brève (les tégénaires peuvent atteindre une vitesse de 40 à 50 cm par seconde, les araignées les plus rapides une vitesse de 2 km/h) utilise le système hydraulique de locomotion : la contraction est réalisée par les muscles fléchisseurs et l'extension est hydraulique (liée aux mouvements de l'hémolymphe qui remplit des lacunes), ce qui explique que les araignées meurent les pattes extrêmement fléchies, ramassées autour de leur corps qui ressemble à une boule (raidissement des muscles fléchisseurs en état contracté de rigor mortis)[20]. La « disparition » des extenseurs antagonistes au niveau des pattes a permis une augmentation du volume des muscles fléchisseurs, ce qui a favorisé la prédation de proies de même taille que les araignées, voire même plus grandes[21].
Opisthosome
L'opisthosome est constitué du pédicule, de la région génitale (pli épigastrique[22] chez le mâle et la femelle, épigyne chez la femelle) ainsi que des filières (organes séricigènes) et de l'anus en position distale. La segmentation de l’opisthosome est très souvent non apparente en raison de la tagmatisation, à l'exception de la famille primitive des Liphistiidae.
Il assume sur le plan physiologique des fonctions végétatives (digestion, circulation intérieure, respiration, excrétion, reproduction et fabrication de la soie).
Le tégument n'est fortement sclérifié qu'au céphalothorax et aux pattes, celui de l'opisthosome est muni d'une cuticule mince et souple (certaines araignées non tisserandes, telles les Oonopidae, portent dessus une plaque dure appelée scutum). L'araignée peut ainsi fabriquer ses fils dans des directions privilégiées grâce à cet « abdomen » flexible[23].
Émetteurs de sons dont l'appareil stridulatoire
Plusieurs araignées produisent des sons qui semblent avoir des fonctions diverses (pour la reconnaissance intraspécifique, la reproduction, effrayer un éventuel prédateur, etc.[28]), le plus souvent des vibrations inaudibles pour l'humain. Un son nettement audible a été signalé en 1876 par Wood-Mason chez Chilobrachys stridulans, une grande mygale vivant en Inde et Birmanie.
Les sons sont émis par :
- vibration d’organes ou appendices ; Rovner a le premier en 1980 montré la capacité d'une grosse araignée tropicale, Heteropoda venatoria (Eusparassidae), à faire vibrer ses pattes. Des Ctenidae, dont le genre Phoneutria, pourraient faire de même[réf. nécessaire].
- percussion d'un substrat («tambourinage»), par les pattes, les palpes ou l'opisthosome. Ce phénomène a d'abord été démontré par Lahee en 1904 chez des Alopecosa en Amérique du Nord, puis souvent chez d’autres Lycosidae, les Clubionidae, les Anyphaenidae, les Ctenidae, les Salticidae et les Thomisidae[28].
- stridulation ; le son est alors émis par frottement de deux parties rigides du corps entre elles. Il est perceptible chez plusieurs espèces jusqu'à 20 cm de l'araignée; jusqu'à 1 m chez de petits Theridiidae, dont Steatoda bipunctata (Meyer, 1928), et plus rarement jusqu’à 2, voire 3 mètres, par exemple chez la mygale Theraphosa leblondi[29]. Il s'agit alors d'un appareil stridulatoire, différenciation spéciale de leur tégument, paire, symétrique et pouvant occuper une position très variée sur leur corps. Comme chez les autres arthropodes, il comporte toujours deux parties bien distinctes, dites antagonistes. Chez les Argyrodes, l'appareil dit stridulatoire de type « a » se compose d'un « archet » et d'une « lyre » situés respectivement sur le prosoma et l'opisthosome au-dessus du pédicule. L'« archet » est innervé et sa stimulation pourrait être impliquée dans l'équilibration, de concert avec des organes lyriformes pédiculaires en « bourrelet » également étudiés chez les Meta [30],[31],[32]).
Le son, lorsqu'il existe, est perçu par les autres araignées via des organes sensoriels situés sur les pattes : les trichobothries et les sensilles à fentes (slit sensilla (en)).
Anatomie interne

Appareil respiratoire et circulatoire
Les araignées ont un système circulatoire ouvert. Leur corps est rempli d'hémolymphe, qui est pompée par le cœur dans des espaces appelés sinus, autour des principaux organes internes. L'hémolymphe contient de l'hémocyanine, une protéine liée à la fonction respiratoire, comparable à celle de l'hémoglobine, qui contient deux atomes de cuivre, teintant l'hémolymphe d'une légère couleur bleue[33].
La majorité des araignées respirent par deux poumons en feuillets (en), organes doublés par un système trachéen amenant l'air aux divers organes internes. Chez quelques petites espèces, la respiration se fait directement à travers la peau[34].
La plupart des araignées sont « essoufflées » si elles sont poursuivies pendant une à deux minutes et elles évitent ce type d'effort qui impose un rythme cardiaque très accéléré pour faire perfuser l'hémolymphe oxygénée dans le céphalothorax, au niveau des pattes, chaque extension nécessitant une pression hydrostatique de l'hémolymphe. Ces phases d'activité intense utilisent la capacité des tissus, y compris ceux du système nerveux, à fonctionner en anaérobiose (fermeture de valves musculaires qui empêche la perfusion d'hémolymphe oxygénée dans le céphalothorax, d'où l'accumulation rapide d'acide lactique et la baisse de pH dans l'abdomen, à l'origine de l'épuisement). La phase de récupération (dette en oxygène) dure souvent une heure, voire davantage pour les plus grandes espèces. Elles restent alors immobiles et parfois, il est possible d'observer un léger battement de leurs pattes dont la fréquence correspond à celles des pulsations cardiaques, ce qui traduit l'ouverture des valves musculaires et la perfusion pulsée d'hémolymphe dans le céphalothorax[35],[36].
Appareil digestif
La digestion des proies peut se faire extérieurement ou intérieurement. Les araignées qui ne sont pas munies de puissantes chélicères sécrètent des fluides digestifs (injection d'enzymes extracellulaires) à l'intérieur de leurs proies à partir de canaux internes à ces mêmes chélicères[5]. Les glandes coxales sont des organes excréteurs situés dans le prosoma et débouchent à l'extérieur aux coxae des pattes ambulatoires.
Chez les araignées primitives, comme les Mesothelae et les Orthognata, deux paires de glandes coxales aboutissent à l'arrière des premières et troisièmes coxae. Elles ne produisent un fluide que durant la nutrition et jouent un rôle important dans l'équilibre entre les ions et le liquide interne[37].
Les fluides digestifs dissolvent les tissus intestinaux de la proie. Ensuite, l'araignée se nourrit en aspirant les fluides partiellement digérés. D'autres araignées, disposant de chélicères plus puissants, mastiquent le corps entier de leur proie et abandonnent une relativement petite partie de matière indigestible.
Les araignées n'absorbent que de la nourriture liquide. Beaucoup d'entre elles stockent leurs proies temporairement. Les araignées qui tissent des toiles entourent leurs proies d'un réseau soyeux et les consomment ensuite à loisir.
Appareil reproducteur
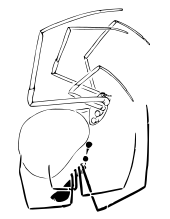
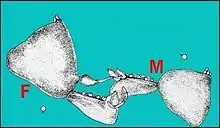
Presque toutes les araignées se reproduisent sexuellement. Elles ont ceci de particulier qu'elles ne transfèrent pas directement le sperme, par exemple via un pénis. Paradoxalement, les mâles transfèrent leur liquide reproducteur vers des pédipalpes spécialisés (induction spermatique) pourvus d'un bulbe copulateur contenant un tube séminifère et se préoccupent alors de trouver une partenaire[38].
Ces palpes sont ensuite introduits dans l'épigyne des femelles (copulation et éjaculation). Le transfert du sperme fait intervenir un jeu subtil de pressions et dépressions engendrées dans le tube séminifère par les déplacements de sa sécrétion épithéliale et de sa cuticule complexe[39],[40],[41],[42],[43].
Cette façon de procéder a été décrite pour la première fois en 1678 par Martin Lister. En 1843, il s'est avéré que le mâle construisait une toile spermatique sur laquelle il déposait une goutte de liquide séminal qui était ensuite prise par l'appareil copulatoire dans le pédipalpe. Avant ce dépôt, la toile spermatique est recouverte par la sécrétion des glandes acinoïdes prégonoporales (appareil épigastrique) et pourvues de fusules[44] comme les glandes séricigènes.
À noter que l'Araignée pyrénéenne, Telema tenella[45],[46],[47] et les autres Telemidae [48]élaborent des spermatophores pour conditionner leurs gamètes mâles. Chez d'autres Araneae, il n'existe que des coenospermies.
L'appareil copulatoire est très différent suivant les différentes espèces de mâles. Alors que le large tarse palpatoire de Filistata hibernalis (Filistatidae) n'est qu'une sorte de bulbe copulateur contenant un très discret canal enroulé, les membres du genre Argiope disposent d'une structure d'une grande complexité.
Glandes tégumentaires diverses
Ignorées par l'aranéologie de vulgarisation et même par les spécialistes[1],[6],[34],[37], elles doivent leur découverte à la seule recherche histologique.
Le tube séminifère
Logé dans le bulbe copulateur, le tube séminifère, ou receptaculum seminis, comporte une glande palpaire qui joue un rôle de premier plan, avec les cuticules[39],[40], dans la transmission spermatique.
La glande clypéale ou acronale
La glande clypéale, ou glande acronale, propre au genre Argyrodes (Theridiidae), se situe dans la partie toute antérieure du céphalothorax des mâles et est responsable de leur dimorphisme sexuel remarquable[44].
La glande du rostre
La glande rostrale occupe une partie de l'équivalent de la lèvre supérieure, ou rostre, près de son extrémité.
Les glandes gnathocoxales
Considérées comme « salivaires », les glandes gnathocoxales sont logées dans les lames maxillaires ou gnathocoxes, et peuvent présenter un dimorphisme sexuel, notamment chez des Araneidae et les Leptonetidae.
Les glandes maxillo-labiales
Bien distinctes des précédentes, ces glandes péribuccales sont localisées à la surface des lames maxillaires et dans la lèvre inférieure.
La glande labiosternale
La glande labiosternale est caractéristique de la famille des Theridiosomatidae[49],[50].
Les glandes segmentaires
Particulièrement bien développées dans le genre Metepeira, les glandes segmentaires siègent à la base des appendices du céphalothorax. La plus remarquable est la glande rétrognathocoxale[51],[52].
Les glandes du pédicule
Les glandes du pédicule, ou pédicelle, sont de petits organes sécréteurs dorsaux plus ou moins associés aux sensilles impliqués dans l'équilibration.
Les glandes épigastriques
Elles sont situées en avant de l'orifice génital chez les mâles d'une partie des Araignées et s'apparentent aux glandes séricigènes[44]. Elles sont rattachées à l'appareil épigastrique, complexe incluant toujours des sensilles (mécanorécepteurs) et, parfois, des glandules à phéromones.
La glande rétrogonoporale
La glande rétrogonoporale est située en arrière de l'orifice génital chez la femelle de Leptyphantes sanctibenedicti (Linyphiidae) ou Pseudomaro aenigmaticus.
L'appareil stridulatoire
L'appareil stridulatoire implique des différenciations du tégument sans participation glandulaire, mais comportant, dans le cas précis des Argyrodes (Theridiidae), une composante nerveuse (sensilles), de sorte qu'il interviendrait dans l'équilibration plutôt que pour émettre un son comme sus-mentionné[31].
Glandes abdominales intervenant dans l'attraction des proies
L'opisthosome de certaines araignées (genres Mastophora, Celaenia, Kaira) renferme des tissus glandulaires dont la sécrétion est susceptible d'attirer leurs proies (Diptères et surtout papillons Hétérocères mâles) en simulant les phéromones des femelles de ces insectes (« mimétisme chimique agressif »).
Chez Kaira[53], il s'agit des « coussinets à cellules géantes » de la glande botryoïde, agrégée profondément modifiée[53] et composante la plus remarquable de son appareil séricigène ; chez Mastophora et Celaenia[réf. à confirmer] d'un tissu glandulaire endocrinoïde interstitiel très particulier[54].
Dimorphisme et cannibalisme sexuel

Le dimorphisme sexuel présente chez les araignées une importance considérable, qui s'accompagne parfois d'un cannibalisme sexuel des femelles pour les mâles au moment de la copulation. Les mâles cannibalisés, ou tout au moins leurs restes, demeurent en position de copulation deux fois plus longtemps que les mâles non consommés. Ce suicide copulatoire leur permet ainsi de fertiliser deux fois plus d'œufs et d'augmenter d'autant leur succès reproducteur[55]. Il existe même un cannibalisme précopulatoire de la part des femelles, qui se révèlent par cet apport de ressources nutritives spécifiques, plus attractives et enclines que les autres à protéger leurs œufs dans une oothèque, tandis que le taux d'éclosion est plus élevé[56]. Ce cannibalisme avant l'insémination de sperme s'interprète dans le cadre de la théorie du conflit sexuel[57].
Ce dimorphisme est plus prononcé parmi les espèces d'araignées qui chassent activement que chez les araignées qui restent à l'affût[réf. nécessaire]. Outre les organes précédents, presque tous impliqués, il peut se caractériser par une différence de taille quasi-caricaturale entre le mâle et la femelle, notamment chez les Néphiles telles que Nephila inaurata et Nephila comorana, de la Réunion et de Mayotte. On trouve un autre exemple chez le mâle de l'espèce Latrodectus hasselti, la Veuve noire d'Australie, dont le corps ne pèse que deux pour cent de celui de sa partenaire[58].
Encore plus rare, il existe des araignées-loups et des Argyronètes mâles, caractérisés par un dimorphisme sexuel « inversé », qui cannibalisent leurs homologues de sexe féminin, plus fréquemment des femelles non vierges[59].
Notes et références
- Michel Hubert, Les araignées, Société nouvelle des éditions Boubée, , p. 22.
- (en) Eldra Solomon, Linda Berg, Diana W. Martin, Biology, Cengage Learning, (lire en ligne), p. 567
- La lame maxillaire est aussi appelée lame masticatrice ou gnathocoxa.
- Appelée aussi fovea media, cette dépression transverse ou longitudinale suivant les familles correspond au point où s'insère le puissant muscle dilatateur dorsal du jabot aspirateur.
- Michel Hubert, Les araignées, Société nouvelle des éditions Boubée, , p. 41.
- Alain Canard et Christine Rollard, La découverte des Araignées, Dunod, , p. 57.
- (en) Marie Elisabeth Herberstein, Spider Behaviour. Flexibility and Versatility, Cambridge University Press, , p. 13.
- (en) Ivan R. Schwab, Richard R. Dubielzig, Charles Schobert, Evolution's Witness. How Eyes Evolved, Oxford University Press, , p. 14-115.
- (en) Spider Vision : Do Spiders Have Good Eyesight ?
- (en) Friedrich G. Barth, A Spider’s World : Senses and Behavior, Springer Science & Business Media, (lire en ligne), p. 128-137
- Yves Pouliquen, La transparence de l’œil, Odile Jacob, , p. 69.
- (en) Lauren Spano , Skye M. Long , Elizabeth M. Jakob, « Secondary eyes mediate the response to looming objects in jumping spiders (Phidippus audax, Salticidae) », Biology Letters, vol. 11, no 2, (DOI 10.1098/rsbl.2012.0716).
- Cette légende a de nombreuses variantes toutes aussi improbables : pendant le sommeil, les araignées se tapiraient dans une oreille ou le nez du dormeur. Cf (en) Peter Marren et Richard Mabey, Bugs Britannica, Chatto & Windus, , p. 103.
- Ce segment est appelé selon les auteurs prétarse, post-tarse, transtarse ou onychium. Ce n'est qu'exceptionnellement que le prétarse forme un article distinct.
- Maurice Thomas, Vie et mœurs des araignées, Payot, , p. 18.
- Grassé, Zoologie : Arthropodes, Gallimard, , p. 219.
- (de) Ehlers, M. (1939). Untersuchungen über Formen aktiver Lokomotion bei Spinnen. Zool. Jb. Syst. 72, 373–499
- (en) Tom Weihmann, Michael Günther, Reinhard Blickhan, « Hydraulic leg extension is not necessarily the main drive in large spiders », Journal of Experimental Biology, vol. 215, , p. 578-583 (DOI 10.1242/jeb.054585).
- (en) Wolfgang Nentwig, Spider Ecophysiology, Springer Science & Business Media, , p. 58-65
- (en) Ch. Ellis, « The mechanism of extension of the legs of spiders », The Biological Bulletin, vol. 86, no 1, , p. 41–50 (DOI 10.2307/1537950).
- (en) Steven Vogel, Comparative Biomechanics : Life's Physical World, Princeton University Press, , p. 421
- Repli de la cuticule dans lequel débouchent les appareils reproducteurs mâle ou femelle.
- Maurice Thomas, Vie et mœurs des araignées, Payot, , p. 13.
- Il est parfois possible d'observer sous cette tache, par transparence, le cœur allongé (les arachnologues parlent de tube cardiaque). Un examen attentif à l'œil nu chez les plus grosses araignées ou à l'aide d'une loupe chez les plus petites, permet de déceler des pulsations régulières (Cf Christine Rollard, Fascinantes araignées, éditions Quae, , p. 48. Chez les petites araignées, la fréquence cardiaque peut dépasser les 100 battements par minute (cf <(en) Rainer Foelix, Biology of Spiders, Oxford University Press, , p. 70).
- Il est parfois possible d'observer sous cette tache, par transparence, le cœur allongé (les arachnologues parlent de tube cardiaque). Un examen attentif à l'œil nu chez les plus grosses araignées ou à l'aide d'une loupe chez les plus petites, permet de déceler des pulsations régulières (Cf Christine Rollard, Fascinantes araignées, éditions Quae, , p. 48. Chez les petites araignées, la fréquence cardiaque peut dépasser les 100 battements par minute (cf <(en) Rainer Foelix, Biology of Spiders, Oxford University Press, , p. 70).
- L'exosquelette est renforcé par un endosquelette rigidifiant l'ensemble, constitué d'apodèmes (invaginations tégumentaires correspondant à des prolongements internes de l'exosquelette). Ces invaginations forment au niveau de la face dorsale de l'abdomen les sigilles ou points calleux plaques chitinisées qui correspondent à des insertions musculaires. Elles dessinent des points symétriques ou des stries rayonnantes souvent soulignées par la coloration.
- L'exosquelette est renforcé par un endosquelette rigidifiant l'ensemble, constitué d'apodèmes (invaginations tégumentaires correspondant à des prolongements internes de l'exosquelette). Ces invaginations forment au niveau de la face dorsale de l'abdomen les sigilles ou points calleux plaques chitinisées qui correspondent à des insertions musculaires. Elles dessinent des points symétriques ou des stries rayonnantes souvent soulignées par la coloration.
- Uetz, G.W. & G.E.Stratton, 1982.- Acoustic communication and reproductive isolation in Spiders in Witt & Rovner ed. : Spider Communication. Mechanisms and Ecological Significance. Princeton Univ. Press, pp. 123–159.
- Lopez, A., 1988.- Bull.Soc.Et.Sci.nat.Béziers, N.S., XII (53), 1987-1988, pp. 9–20.
- Lopez, A., « Les appareils stridulatoires d’Argyrodes dracus Chamb. & Iv. (Theridiidae), d’Holocnemus pluchei (Scop.)(Pholcidae) et autres Araignées. », Bull. Soc. Et. Sci. nat. Béziers, 12, 53, p. 21-31., .
- Lopez, A., L. Juberthie-Jupeau, « L’appareil « stridulatoire » des Argyrodes (Araneae : Theridiidae) : un complexe sensoriel présumé stato-récepteur. », Mém. Biospéol.,XXI, p.91-96., .
- Lopez, A., L. Juberthie-Jupeau, « Les organes lyriformes du pédicule des Araignées : observations microscopiques chez Argyrodes argyrodes (Walck.) (Theridiidae) et chez deux Metinae souterraines : Meta bourneti Sim. et Meta menardi (Latr.) (Araneidae). », Mém. Biospéol., 23, p. 157-162., .
- Rainer F. Foelix, Biology of Spiders, Oxford University Press, , 2e éd., 53–60 p.
- Christine Rollard, Portraits d'araignées, Éditions Quae, , p. 45.
- (en)Paul RJ (1992) Gas exchange, circulation, and energy metabolism in arachnids. In: Wood SC, Weber RE, Hargens AR, Millard RW (eds) Physiological adaptations in vertebrates. Marcel Dekker, New York, p. 169–197
- (en)Paul R, Fincke T, Linzen B (1989) Book lung function in arachnids. I. Oxygen uptake and respiratory quotient during rest, activity and recovery—relations to gas transport in the haemolymph. J Comp Physiol B 159, p.409–418
- Foelix RF, 1996, Biology of Spiders, 2e ed., Oxford University Press, New York, p. 52.
- Baez, E. C. & J. W. Abalos, On Spermatic Transmission in Spiders, vol. 70, coll. « Psyche », , 197–207 p. (DOI 10.1155/1963/93732, lire en ligne), p. 4.
- André Lopez, « Structure et ultrastructure de l’organe palpaire mâle chez Pholcus phalangioides (Fuessl.) (Aranéides, Pholcidae). », C.R.Acad.Sci., vol. 278, , p. 1373-1376.
- André Lopez, « Le tube séminifère des Araignées mâles ; quelques précisions sur sa structure microscopique », Rev. Arachnol., vol. 1, no 1, , p. 1–7.
- Lopez, A. avec L. Juberthie-Jupeau,, « – Ultrastructure du tube séminifère chez Leptoneta microphthalma Simon, 1872 (Araneae, Leptonetidae). », Rev. Arachnol., 3 (2), p. 65-73., .
- Lopez, A. et L. Juberthie-Jupeau, « Structure et ultrastructure du bulbe copulateur chez la mygale Nemesia caementaria (Latr., 1798) (Araneae, Ctenizidae). », Bull. Soc. Et. Sci. nat. Béziers, 8, 49, p. 12-19., .
- Lopez, A. et L. Juberthie-Jupeau, « Ultrastructure comparée du tube séminifère chez les mâles d’Araignées », Mem. Biospéol., 12, p. 97-109., .
- Lopez, A., « Thèse de Doctorat d'Etat es Sciences, Université de Montpellier II. 117 pp + planches (dont 4 en couleurs)., 1977 », Thèse de Doctorat d'Etat es Sciences, 1977, Université de Montpellier II. 117 pp + planches (dont 4 en couleurs)., .
- Lopez,A. & H. Salvayre, « L’Araignée cavernicole pyrénéenne Telema tenella Simon et son habitat. », Bull. Soc. Et. Sci.nat. Béziers, 4, 45, p. 17-23.,
- Lopez,A., « Sur un nouveau mode de reproduction chez les Araignées : existence de spermatophores chez Telema tenella Simon. », Bull. Soc. Zool. France, 102, p. 261- 266.,
- (en) Lopez,A.,Juberthie,C. et J.Kovoor, « Spermiogenesis and spermatophore in Telema tenella Simon (Araneae : Telemidae). An ultrastructural study. », Int. J.Invert.Reprod., 3, p.181-191,
- Lopez,A. & R.Legendre, « Présence d’un spermatophore dans le genre Apneumonella (Araneae : Telemidae) : valeur taxonomique et problèmes de biologie sexuelle. », Bull.Soc.Zool.France, 103, p.35-41.,
- Lopez, A. et M. Emerit, « Wendilgarda mustelina arnouxi n.sp. et la glande labio-sternale des Theridiosomatidae (Araneae) », Mem. Biospéol, no 12, , p. 67-76.
- A. Lopez & L. Juberthie-Jupeau, « Structure et ultrastructure de la glande labio-sternale chez Theridiosoma splendidum (Tacz.)(Araneae : Theridiosomatidae) », C.R.XI e Coll. Europ. Arachnol. Berlin, , p. 332-339 (lire en ligne).
- (en) Lopez, A., « Some observations on the internal anatomy of Diguetia canities (McCook,1890) (Araneae,Diguetidae). », The Journal of Arachnology, 11, p. 377-384., (lire en ligne).
- L. Juberthie-Jupeau et A. Lopez, « Les glandes segmentaires rétro-gnathocoxales de Leptyphantes sanctivincentii (Simon, 1872) (Araneae : Linyphiidae) : structure et ultrastructure, Compte-rendu du Xe colloque européen d'arachnologie, », Bulletin de la Société des sciences de Bretagne no 59, (n° hors série I) , 1988, p. 115-129., (lire en ligne).
- Lopez, A., L. Juberthie-Jupeau et M.K. Stowe, « L’appareil séricigène de Kaira alba (Hentz). », Mém. Soc. r. belge Ent., 33, p. 119-128., (lire en ligne).
- Lopez,A., « L’origine des odeurs attractives de Papillons et de Diptères mâles chez certaines Araignées exotiques (genres Kaira, Mastophora et Celaenia : Araneidae) : une approche histologique. », Bull. Soc.Et.Sci.nat. Béziers, 17, 58, p.9-24., .
- (en) Mark A. Elgar, « Sexual cannibalism in spiders and other invertebrates », in Cannibalism: ecology and evolution among diverse taxa (Elgar MA, Crespi BJ, eds), Oxford University Press, 1992, p. 129-156.
- (en) Jonathan N. Pruitt, Aric W. Berning, Brian Cusack, Taylor A. Shearer, Mathew McGuirk, Anna Coleman, Robin Y. Y. Eng, Fawn Armagost, Kayla Sweeney, Nishant Singh, « Precopulatory sexual cannibalism causes increase egg case production, hatching success, and female attractiveness to males », Ethology: International Journal of Behavioural Biology, vol. 120, no 5, , p. 453–462 (DOI 10.1111/eth.12216).
- (en) Jutta M. Schneider, « Sexual Cannibalism as a Manifestation of Sexual Conflict », Cold Spring Harb Perspect Biol., vol. 6, no 11, , p. 201-207 (DOI 10.1101/cshperspect.a017731).
- Stéphane Deligeorges, « Dans les rets de la femme araignée », La Recherche, no 303, , p. 41.
- (en) Dolores Schütz & Michael Taborsky, « Mate choice and sexual conflict in the size dimorphic water spider Argyroneta aquatica (Araneae: Argyronetidae) », Journal of Arachnology, vol. 33, no 3, , p. 767–775 (DOI 10.1636/S03-56.1, lire en ligne).
Annexes
Articles connexes
Liens externes
- (en) Spiders anataomy
- Portail de l’anatomie
- Portail de l’arachnologie
- Portail de la biologie cellulaire et moléculaire