Cet article a été coécrit par Bess Ruff, MA. Bess Ruff est doctorante en géographie à l'université d'État de Floride. Elle a obtenu un master en sciences et gestion de l'environnement à l'université de Californie, Santa Barbara, en 2016. Elle a aussi mené des enquêtes pour des projets de planification des espaces marins dans les Caraïbes et a contribué à la recherche en tant que boursière d'études supérieures pour Sustainable Fisheries Group.
Cet article a été consulté 199 990 fois.
Tous atomes d'un même élément contiennent le même nombre de protons, mais leur nombre de neutrons peut varier. La connaissance du nombre de neutrons d'un atome peut vous aider à déterminer s'il s'agit d'un atome ordinaire ou d'un isotope, car ce dernier peut avoir un nombre de neutrons plus petit ou plus grand [1] . À bien y regarder, il n'est pas si difficile de déterminer le nombre de neutrons que contient un atome, et ce, sans expérience ! Si vous devez un jour calculer le nombre de neutrons contenus dans un atome ordinaire ou dans un isotope, prenez le temps pour vous informer d'abord afin de faire vos opérations plus facilement.
Étapes
Méthode 1
Méthode 1 sur 2:Trouver le nombre de neutrons contenus dans un atome ordinaire
-
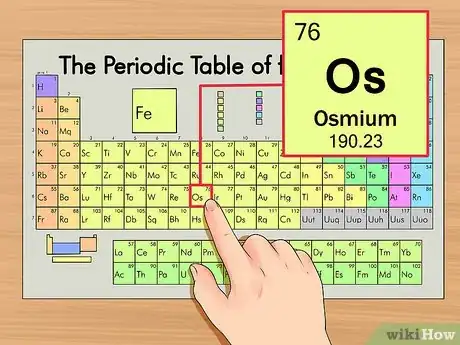
1Trouvez d'abord votre élément dans le tableau périodique des éléments. Recherchons par exemple l'osmium (Os) qui se trouve à la 6e ligne en partant du haut.
-
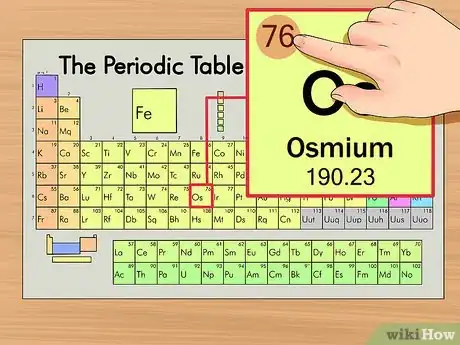
2Trouvez le numéro atomique de votre élément. Il s'agit du nombre le plus visible, il se trouve généralement en haut et à gauche du symbole chimique de l'élément (sur notre tableau, c'est même le seul nombre visible). Le numéro atomique représente le nombre de protons contenus dans un seul atome de l'élément. Pour l'osmium (symbole : Os), le numéro atomique est 76, un atome d'osmium renferme 76 protons.
- Le nombre de protons ne change jamais dans un élément, c'est ce qui fait sa spécificité.
-
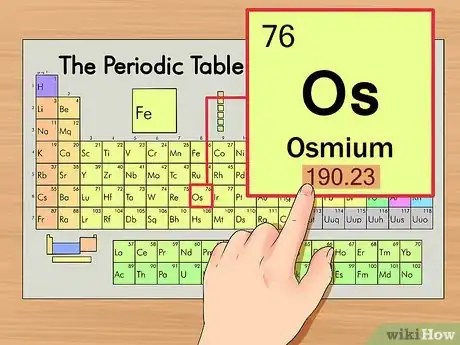
3Trouvez la masse atomique de votre élément. Ce chiffre se trouve généralement sous le symbole chimique de l'élément, il est écrit en plus petit que le numéro atomique (attention ! Il n'est pas représenté sur notre tableau !). L'osmium a donc une masse atomique de 190,23.
-
4Arrondissez le chiffre de la masse atomique pour calculer le nombre de masse. Dans notre exemple, 190,23 sera arrondi à 190, ce qui nous donnera un nombre de masse de 190 pour l'osmium. Le nombre de masse représentant le nombre de nucléons contenus dans un atome (le nombre de nucléons étant la somme des protons et des neutrons), l'osmium a donc 190 nucléons.
- La masse atomique est une moyenne des isotopes des éléments, c'est la raison pour laquelle ce n'est généralement jamais un nombre entier.
-
5Soustrayez le numéro atomique du nombre de masse. Comme le nombre de masse d'un atome est la somme de ses protons et de ses neutrons contenus, soustrayez le numéro atomique (ou nombre de protons dans un atome) du nombre de masse (ou somme des nombres de protons + neutrons dans un atome) et vous obtiendrez tout naturellement le nombre de neutrons de votre atome. La masse des électrons est toujours considérée comme négligeable, c'est pour cela qu'on arrondit le nombre de masse. Dans notre cas, on a : 190 (nombre de masse) – 76 (nombre de protons) = 114 (nombre de neutrons).
-
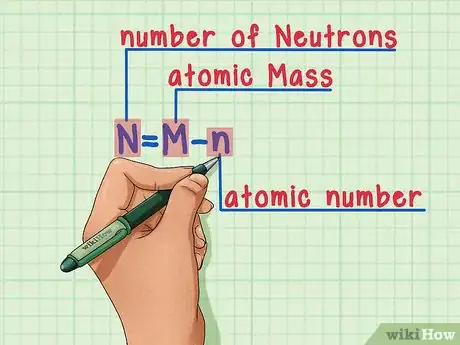
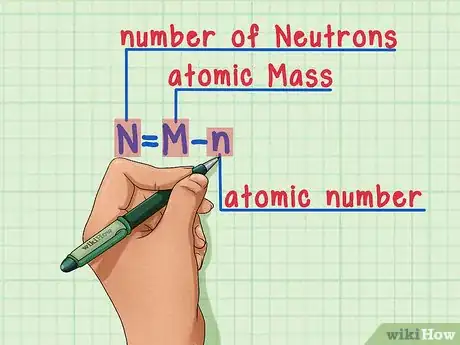
6Souvenez-vous toujours de cette formule :
-
N = M – n
- N = nombre de Neutrons
- M = nombre de Masse
- n = numéro atomique
Publicité -
N = M – n
Méthode 2
Méthode 2 sur 2:Trouver le nombre de neutrons contenus dans un isotope
-
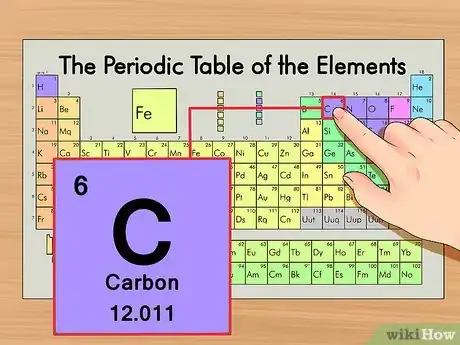
1Trouvez votre élément dans le tableau périodique des éléments. Recherchons par exemple le carbone 14. Comme la forme non isotopique du carbone 14 est le carbone (C), cherchez le carbone dans le tableau périodique, il se trouve à la deuxième ligne en partant du haut, à droite du tableau.
-
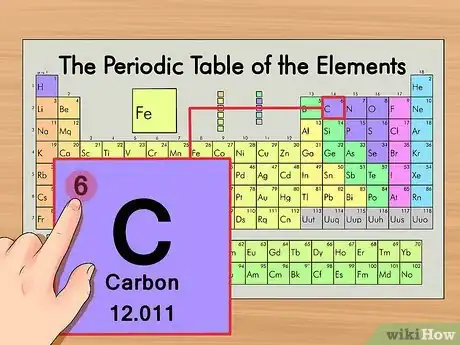
2Trouvez le numéro atomique de votre élément. Il s'agit du nombre le plus visible, il se trouve généralement en haut et à gauche du symbole chimique de l'élément (sur notre tableau, c'est même le seul nombre visible). Le numéro atomique représente le nombre de protons contenus dans un seul atome de l'élément. Le numéro atomique du carbone (symbole : C) est le 6, ce qui signifie que le carbone a 6 protons.
-
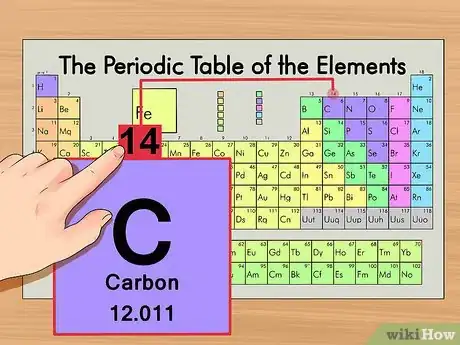
3Trouvez le nombre de masse. Cela est extrêmement facile à deviner avec les isotopes puisqu'on les nomme d'après leur nombre de masse. Le nombre de masse du carbone 14 est donc égal à… 14 ! Partant, on retombe sur le schéma précédent, il faut opérer ensuite comme dans la première partie de cet article.
-
4Soustrayez le numéro atomique du nombre de masse. Comme le nombre de masse d'un atome est la somme de ses protons et de ses neutrons contenus, soustrayez le numéro atomique (ou nombre de protons dans un atome) du nombre de masse (ou somme des nombres de protons + neutrons dans un atome) et vous obtiendrez tout naturellement le nombre de neutrons de votre atome. Dans le présent cas, on a : 14 (nombre de masse) – 6 (nombre de protons) = 8 (nombre de neutrons).
-
5Souvenez-vous toujours de cette formule :
-
N = M – n
- N = nombre de Neutrons
- M = nombre de Masse
- n = numéro atomique
Publicité -
N = M – n
Conseils
- L'osmium est un métal solide à température ambiante. Son nom vient du terme grec « osme » qui signifie « odeur ».
- Les protons et les neutrons représentent quasiment toute la masse d'un élément tandis que les électrons et les particules diverses représentent une masse négligeable (proche de zéro). Puisqu'un proton a quasiment la même masse qu'un neutron et que le numéro atomique représente le nombre de protons, vous n'avez qu'à déduire le numéro atomique du nombre de masse pour trouver le nombre de neutrons que contient un atome.
- Si vous avez des doutes concernant les nombres entourant les éléments dans le tableau périodique, souvenez-vous simplement que ce dernier est ordonné par numéro atomique (ou nombre de protons) croissant des éléments. Le tableau commence en effet par l'hydrogène (en haut à gauche) qui a un numéro atomique égal à 1 et se termine par l'ununoctium (ou eka-radon) qui a un nombre atomique de 118 (en bas à droite). Si le tableau est conçu ainsi, c'est que le nombre de protons que contient un atome détermine ce qu'est l'atome. Dès lors, se baser sur le nombre de protons est apparu comme étant la méthode la plus logique pour organiser les éléments. Un atome contenant 2 protons sera toujours un atome d'hélium de la même façon qu'un atome constitué de 79 protons sera toujours un atome d'or.