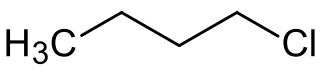
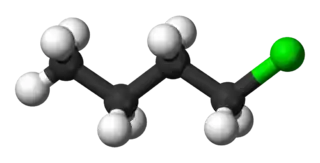
1-clorobutano
El 1-clorobutano, también llamado cloruro de butilo, es un compuesto orgánico de fórmula molecular C4H9Cl. Es un haloalcano lineal de cuatro carbonos con un átomo de cloro unido a uno de los carbonos terminales.[2][3][4]
Propiedades físicas y químicas
A temperatura ambiente, el 1-clorobutano es un líquido incoloro de olor desagradable, acre. Tiene su punto de ebullición a 78 °C mientras que su punto de fusión es -123 °C. Posee una densidad inferior a la del agua (ρ = 0,886 g/cm³) y en estado gaseoso es 3,2 veces más denso que el aire.[2] Su viscosidad a 20 °C es de 0,45 cP, inferior a la del agua pero mayor que la de la acetona.[5]
El valor del logaritmo de su coeficiente de reparto, logP = 2,64, indica que es más soluble en disolventes apolares —como el 1-octanol— que en disolventes polares. En agua es prácticamente insoluble, en proporción de 0,87 g/L.[2]
En cuanto a su reactividad, el 1-clorobutano es incompatible con agentes oxidantes fuertes así como con bases fuertes.[5] Reacciona con polvo de aluminio, oxígeno líquido, potasio y sodio.[6]
Síntesis
El 1-clorobutano se sintetiza por cloración térmica de butano sobre alúmina a 200 °C. Ello da como resultado la formación de 1-clorobutano y 2-clorobutano en parecidas proporciones, además de una pequeña cantidad de diclorobutano. Esta síntesis también es posible por vía fotoquímica a 15 - 20 °C, siendo la distribución de productos similar.[7]
Otra forma de obtener 1-clorobutano es por reacción de 1-butanol con ácido clorhídrico en presencia de cloruro de zinc anhidro.[8] A nivel industrial, esta síntesis se lleva a cabo en fase gas con flujo continuo a 130 - 170 °C y presión atmosférica. En vez de cloruro de zinc, puede emplearse una sal de fosfonio, en ambos casos sobre gel de sílice.[9] También puede utilizarse como catalizador una resina orgánica unida a una sal de fosfonio cuaternario.[10] Otra manera de convertir 1-butanol en 1-clorobutano implica el uso de dicloruro de dialquilselenio a 80 °C durante 7 horas, si bien el rendimiento es de solo el 34%.[11]
Asimismo, puede sintetizarse 1-clorobutano a partir del ácido pentanoico, por reacción de este con cloruro de litio combinado con acetato de plomo (IV), utilizando benceno como disolvente. El rendimiento llega al 92%.[12]
Usos
Se puede sintetizar 1-butanamina por reacción de 1-clorobutano con ftalimida de potasio usando N,N-dimetilformamida (DMF) como disolvente y posterior hidrólisis alcalina.[13] Asimismo, la reacción en fase vapor de 1-clorobutano con amoniaco sobre un catalizador de óxido de magnesio a 310 °C permite obtener tributilamina (48%) y dibutilamina (35%), además de 1-butanamina.[14] Análogamente, la alquilación de urea con este cloroalcano en hidróxido sódico acuoso produce tributilamina con un rendimiento del 77%.[15]
Se puede preparar valeronitrilo por cianuración de 1-clorobutano con cianuro sódico en polvo, empleando un catalizador de transferencia de fase PEG400, sin necesidad de disolvente. El rendimiento siguiendo este método es del 89%.[16]
El 1-clorobutano se emplea como agente «butilante» en síntesis orgánica, como por ejemplo en la fabricación de butilcelulosa,[6] polímero utilizado en cromatografía de proteínas hidrofóbicas. En este sentido, el n-butil-litio, ampliamente usado como iniciador de polimerización en la producción de elastómeros como polibutadieno o SBS, se sintetiza por reacción de 1-clorobutano con litio metálico:
Precauciones
El 1-clorobutano es un líquido inflamable cuyo punto de inflamabilidad es -12 °C. Sus vapores pueden formar mezclas explosivas con el aire cuando se calienta. Al arder desprende productos tóxicos como monóxido de carbono y ácido clorhídrico. Su temperatura de autoignición se alcanza a los 245 °C.[5]
Véase también
Los siguientes compuestos son isómeros del 1-clorobutano:
Referencias
- Número CAS
- 1-Chlorobutane (PubChem)
- 1-Chlorobutane (ChemSpider)
- «1-Chlorobutane (GESTIS)». Archivado desde el original el 10 de diciembre de 2019. Consultado el 10 de diciembre de 2019.
- 1-Chlorobutane. MSDS (Thermo-Fisher)
- 1-Chlorobutane (Chemical Book)
- Ullmann's Encyclopedia of Industrial Chemistry. 7. Wiley Interscience, Release 2009.
- Preparation of 1-chlorobutane (n-butyl chloride; 1-butyl chloride) (PrepChem)
- Tundo, P.; Selva, M. (2005). «Continuous-flow, gas phase synthesis of 1-chlorobutane (1-bromobutane) from 1-butanol and aqueous HCl (HBr) over silica-supported quaternary phosphonium salt». Green Chemistry 6. Consultado el 11 de diciembre de 2019.
- Process for preparing primary alkyl chlorides (1980). Parker, D.K. Patente EP0030516B1
- Shimizu, T. (2011). «Transformation of Alcohols into the Corresponding Halides». Science of Synthesis Knowledge Updates 1: 495. Consultado el 30 de noviembre de 2019.
- Margaretha, P. (2007). «35.1.1.3.3.1 Variation 1: Chlorodecarboxylation in the Presence of Lithium Chloride». Science of Synthesis 35: 51. Consultado el 13 de diciembre de 2019.
- McMurry, John (2004). «Aminas». Química Orgánica (sexta edición). Thompson. pp. 903-911. ISBN 970-686-354-0.
- Lawrence, S.A. (2009). «40.1.1.5.4.3.1 Method 1: Reaction of Ammonia with Alkyl Halides». Science of Synthesis 40: 523. Consultado el 10 de diciembre de 2019.
- Lawrence, S.A. (2009). «40.1.1.5.4.3.5 Method 5: Alkylation Reactions of Nitrogen-Containing Derivatives of Carbonic Acid». Science of Synthesis 40: 534. Consultado el 4 de diciembre de 2019.
- Cao, Y.; Chen, B.; Pei, B. (2001). «Cyanidation of halogen compounds and esters catalyzed by PEG400 without solvent». Synthetic Comm. 31 (14): 2203 - 2207.