Hormone thyroïdienne
Les hormones thyroïdiennes, c'est-à-dire la thyroxine (T4) la triiodothyronine (T3) et la diiodothyronine (T2), sont des hormones produites par les cellules folliculaires de la thyroïde à partir de la thyroglobuline et d'iodure. Il existe également la thyrocalcitonine, hormone produite par les cellules parafolliculaires de la thyroide et qui joue un rôle dans le métabolisme phospho-calcique. La thyrocalcitonine induit une hypocalcémie et une hypophosphoremie. Celles-ci sont produites majoritairement sous forme de T4. La T4 agit comme une prohormone, relativement peu active, qui est convertie en T3, plus active. La conversion de la T4 en T3 a lieu dans les cellules cibles, sous l'effet d'une enzyme, la thyroxine 5'-désiodase.
-Thyroxine_Structural_Formulae_V2.svg.png.webp)
-Triiodthyronine_Structural_Formulae_V2.svg.png.webp)
Les hormones thyroïdiennes sont essentielles à la croissance et au développement corrects, à la multiplication et à la différenciation de toutes les cellules de l'organisme, notamment dans le système nerveux central, le squelette et les bourgeons dentaires[1]. À divers degrés, elles régulent le métabolisme basal des protéines, des lipides et des glucides. Toutefois, c'est sur l'utilisation des composés riches en énergie que leur impact sur les cellules est le plus prononcé. Elles ont également un effet permissif sur l'action d'autres hormones et de neurotransmetteurs.
De nombreux stimuli physiologiques et pathologiques influent sur la synthèse des hormones thyroïdiennes. L'hyperthyroïdie est le syndrome clinique causé par un excès de thyroxine libre ou de triiodothyronine libre circulante, ou des deux. Une carence en iode provoque une augmentation de la taille de la thyroïde, d'où l'apparition d'un goitre, en réponse au ralentissement de la biosynthèse des hormones thyroïdiennes.
Production des hormones thyroïdiennes
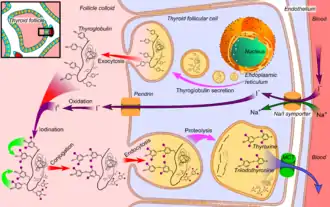
- la thyroglobuline est synthétisée par les ribosomes du réticulum endoplasmique rugueux et entre dans le lumen du follicule thyroïdien par exocytose
- le symport Na/I pompe activement des anions iodure I− depuis le sang à travers la membrane basale des cellules folliculaires pour les accumuler dans leur cytoplasme ; le mécanisme par lequel ces ions franchissent l'épithélium n'est pas connu avec précision
- les ions iodure passent ensuite dans la colloïde à travers la membrane apicale des cellules folliculaires à l'aide de la pendrine, qui agit comme un antiport Cl−/I−
- les ions iodure sont oxydés en diiode I2 par la thyroperoxydase
- le diiode réagit avec les résidus de tyrosine sur la thyroglobuline, qui en compte environ 120
- des résidus d'iodotyrosine adjacents sont condensés pour produire des iodothyronines, parmi lesquelles des hormones thyroïdiennes
- la thyroglobuline iodée est absorbée par les cellules folliculaires par endocytose
- les vésicules résultantes fusionnent avec des lysosomes pour libérer les acides aminés et les hormones thyroïdiennes par protéolyse de la thyroglobuline sous l'effet de peptidases
- la thyroxine (T4) et la triiodothyronine (T3) passent enfin dans le sang par des mécanismes qui demeurent largement inconnus.
Les hormones thyroïdiennes sont biosynthétisées dans la thyroïde. Cette biosynthèse est stimulée indirectement par l'hormone thyréotrope (TRH, de l'anglais : thyrotropin-releasing hormone), un tripeptide de structure (pyro)Glu–His–Pro–NH2 synthétisé par l'hypothalamus. La TRH induit la synthèse de la thyréostimuline (TSH, de l'anglais : thyroid-stimulating hormone) par l'anté-hypophyse, lobe antérieur de l'hypophyse. La TSH agit en augmentant l'expression du gène de la thyroperoxydase (TPO, de l'anglais : thyroid peroxidase).
La thyroïde est très vascularisée. Les cellules de la thyroïde sont organisées en follicules autour de vésicules thyroïdiennes qui contiennent une substance gélatineuse qu'on appelle généralement la colloïde. Ces cellules sont orientées, c’est-à-dire qu'elles possèdent un pôle apical du côté de la colloïde et un pôle basal du côté des vaisseaux sanguins. Le noyau des cellules folliculaires est relativement actif, la présence d'un réticulum endoplasmique rugueux, riche en ribosomes, démontre une forte activité de biosynthèse des protéines, et l'appareil de Golgi est lui-même très actif car on peut observer de nombreuses vésicules au pôle apical.
Les cellules folliculaires permettent l'échange de molécules entre le sang et la colloïde. Le sang fournit les acides aminés nécessaires à la synthèse, dans le réticulum de ces cellules, de la thyroglobuline (Tg), une protéine dimérique de 660 kDa qui contient environ 120 résidus de tyrosine. La thyroglobuline passe ensuite dans l'appareil de Golgi pour être internalisée dans les vésicules, lesquelles fusionnent avec la membrane apicale des cellules folliculaires en libérant la thyroglobuline dans la colloïde par exocytose.
L'iode absorbé par l'alimentation est présent dans l'organisme sous forme d'anions iodure I−, qui sont concentrés dans les cellules folliculaires à partir du sang à l'aide du symport Na/I (NIS), qui utilise le gradient électrochimique en cations sodium Na+ pour accumuler les ions I−. Ces derniers traversent ensuite la membrane apicale grâce à la pendrine, qui joue le rôle d'antiport Cl−/I−, pour rejoindre la colloïde, où ils sont oxydés par la thyroperoxydase (TPO) à l'aide de peroxyde d'hydrogène H2O2 pour former du diiode I2 susceptible de réagir directement avec les résidus de tyrosine de la thyroglobuline : ceux-ci peuvent être iodés une fois pour former des résidus de monoiodotyrosine (MIT), ou deux fois pour former des résidus de diiodotyrosine (DIT).
La condensation de deux résidus de DIT donne — outre un résidu d'alanine — un résidu de thyroxine (T4), tandis que la condensation d'un résidu de MIT sur un résidu de DIT donne un résidu de triiodothyronine (T3) ; la condensation d'un résidu de DIT sur un résidu de MIT donne en revanche un résidu de 3,3',5'-triiodothyronine (rT3 ou « T3 inverse »), qui est biologiquement inactive.
La thyréostimuline (TSH) se lie au récepteur de la TSH, un récepteur couplé à la protéine Gs, ce qui provoque l'endocytose de fragments de colloïde dans des vésicules qui fusionnent avec des lysosomes. Les hormones thyroïdiennes T4 et T3 sont libérées par digestion de la colloïde par des peptidases, à raison de seulement cinq ou six molécules d'hormone thyroïdienne libérées par molécule de thyroglobuline digérée, le ratio étant d'environ une molécule de T3 pour 20 molécules de T4.
Diffusion, désiodation de la T4 en T3 et mécanisme d'action
En raison de leur caractère lipophile, la T4 et la T3 sont transportées dans le sang en étant liées à des protéines telles que les globulines liant la thyroxine (TBG, des glycoprotéines qui fixent préférentiellement la T4), la transthyrétine (TTR, une autre glycoprotéine, qui ne transporte pratiquement que la T4) et des albumines sériques, qui ont une affinité relativement faible pour les T3 et T4 mais sont abondantes et donc contribuent significativement à leur diffusion dans l'organisme.
Les molécules de T4 et T3 présentes dans l'organisme sont généralement liées à une protéine transporteuse, seuls les 0,03 % libres de T4 et les 0,3 % libres de T3 étant biologiquement actives. Ce mode de transport a pour effet d'accroître la demi-vie des hormones thyroïdiennes dans le sang — environ 6,5 jours pour la T4 et 2,5 jours pour la T3 — et de réduire la vitesse à laquelle elles sont absorbées dans les tissus. C'est la raison pour laquelle la mesure de la concentration en hormones thyroïdiennes libres, désignées par T4L et T3L, revêt une grande importance clinique, tandis que la concentration totale, incluant les hormones liées aux protéines transporteuses, n'est pas significative.
Malgré leur nature lipophile qui devrait leur permettre de passer les membranes cellulaires, les hormones T3 et T4 ne diffusent pas passivement à travers la bicouche de phospholipides de la membrane plasmique des cellules cibles[2], et font appel pour cela à des transporteurs membranaires spécifiques.
Parmi les deux hormones thyroïdiennes, la prohormone T4 doit en fait être désiodée en T3 par une thyroxine 5'-désiodase dans les cellules cibles pour être pleinement active : la T3 est typiquement entre trois et cinq fois plus active que la T4, qui sert in fine essentiellement au transport de cette hormone dans le sang. Il existe deux isozymes de cette iodothyronine désiodase :
- le type 1 (D1), présent dans le foie, les reins, la thyroïde et, dans une moindre mesure, l'hypophyse, dont le rôle exact dans l'organisme n'est pas entièrement compris ;
- le type 2 (D2), présent dans l'hypophyse, le muscle squelettique, le cœur (artères coronaires), le système nerveux central et le tissu adipeux brun, responsable de l'essentiel de la formation de T3 dans la thyroïde, mais capable également de désioder la 3,3',5'-triiodothyronine, ou T3 inverse, en 3,3'-diiodothyronine, ou T2.
Pour mémoire, il existe également un troisième type d'iodothyronine désiodase, la thyroxine 5-désiodase (D3), qui convertit respectivement la T4 et la T3, qui sont biologiquement actives, en T3 inverse et en T2, biologiquement inactives, ce qui a pour effet d'inactiver globalement les hormones thyroïdiennes.
Une fois dans le cytoplasme, les hormones thyroïdiennes se lient aux récepteurs des hormones thyroïdiennes, qui sont des récepteurs nucléaires. Les récepteurs thyroïdiens se lient, sur l'ADN des cellules cibles, à des éléments de réponse des promoteurs de certains gènes dont ils régulent la transcription. Ces récepteurs thyroïdiens conditionnent la sensibilité relative des différents tissus aux hormones thyroïdiennes.
Effets biologiques
Les hormones thyroïdiennes agissent sur l'organisme pour augmenter le métabolisme de base, agir sur la biosynthèse des protéines et rendre le corps plus réceptif aux catécholamines (telles l'adrénaline, d'où l'intérêt des bêta-bloquants dans l'hyperthyroïdie). L'iode est un composant important dans leur synthèse.
Les hormones thyroïdiennes accélèrent le métabolisme de base et, par conséquent, accroissent la consommation de l'organisme en énergie et en oxygène. Elles agissent sur presque tous les tissus, hormis la rate. Elles accélèrent le fonctionnement de la pompe sodium-potassium et, d'une manière générale, raccourcissent la demi-vie des macromolécules endogènes en activant leur biosynthèse et leur dégradation.
Protéines
Les hormones thyroïdiennes stimulent la production de l'ARN polymérase I et II, et, par conséquent, augmentent l'activité de biosynthèse des protéines. Elles augmentent également la vitesse de dégradation des protéines, et, lorsqu'elles sont trop abondantes, la dégradation des protéines peut être plus rapide que leur biosynthèse ; dans ce cas, le corps peut tendre vers un équilibre ionique négatif.
Glucose
Les hormones thyroïdiennes potentialisent les effets des récepteurs adrénergiques β sur le métabolisme du glucose. Par conséquent, elles accélèrent la dégradation du glycogène et la biosynthèse du glucose par la néoglucogenèse[réf. nécessaire].
Lipides
Les hormones thyroïdiennes stimulent la dégradation du cholestérol et augmentent le nombre de récepteurs de LDL, ce qui accélère la lipolyse.
Cœur
Les hormones thyroïdiennes accélèrent le rythme cardiaque (Chronotrope positif - Tachycardie) et accroissent la force des systoles (Inotrope positif), augmentant ainsi le débit cardiaque à travers une augmentation du nombre de récepteurs adrénergiques β dans le myocarde et aussi de la sensibilité aux catécholamines. Il en résulte une augmentation de la pression artérielle systolique et une diminution de la pression artérielle diastolique.
Développement
Les hormones thyroïdiennes ont un effet profond sur le développement de l'embryon et les nourrissons. Elles affectent les poumons et influencent la croissance postnatale du système nerveux central. Elles stimulent la production de myéline, de neurotransmetteurs, et la croissance des axones. Elles sont également importantes dans la croissance linéaire des os.
Neurotransmetteurs
Les hormones thyroïdiennes peuvent accroître le taux de sérotonine dans le cerveau, en particulier au niveau du cortex cérébral, et inhiber les récepteurs 5-HT2, comme l'ont montré des études sur la réversibilité, sous l'effet de la T3, de comportements d'impuissance apprise chez des rats, et des études physiologiques de cerveaux de rats[pas clair] [3].
Usage médical des hormones thyroïdiennes
Les hormones thyroïdiennes sont prescrites dans les cas d'hypothyroïdie ou de thyroïdectomie (ablation chirurgicale de la glande thyroïdienne). Les hormones thyroïdiennes utilisées sont la T3 et la T4. L'hormone T3 est plus efficace que l'hormone T4 au niveau des récepteurs mais la T4 est transformée en T3 par les tissus périphériques et un traitement par la T4 permet d'avoir un taux normal de T3[4]. La demi-vie de la T3 n'est que de 24 heures et elle nécessiterait deux à trois prises quotidiennes, alors que la demi-vie de la T4 est de 6 à 8 jours et autorise une seule prise quotidienne, ce qui explique son utilisation préférentielle.
Le diagnostic du fonctionnement thyroïdien se fait en médecine nucléaire par injection d'iode 123 (isotope radioactif de l'iode) produit dans un cyclotron. Sa période radioactive est relativement faible puisqu'elle est de 13,21 h (c'est-à-dire 13 heures, 12 minutes et 36 secondes). Sa désintégration radioactive émet des rayons γ d'énergie caractéristique équivalent à 159 keV et 27 keV. La dose injectée pour le diagnostic ne dépasse pas les 10 mégabecquerels (MBq).
Histoire et découverte
La thyroxine (T4) a été isolée par l'Américain Edward Calvin Kendall en 1910 à partir de trois tonnes de thyroïde de porc, tandis que la triiodothyronine (T3) a été découverte en 1952 par le Français Jean Roche.
| Lévothyroxine (sodique) et/ou liothyronine (triiodothyronine) | |
| Informations générales | |
|---|---|
| Princeps |
Elthyrone - Merck (Belgique). Retiré du marché.
Euthyral - Merck (France)
Cynomel - Sanofi (France) |
| Identification | |
| Code ATC | H03AA |
Notes et références
- Pediatr Endocrinol Diabetes Metab. 2010;16(2):100-8. [Evaluation of mental development of children with congenital hypothyroidism detected in screening test--personal observations] [Article in Polish] Kik E, Noczyńska A. Klinika Endokrynologii i Diabetologii Wieku Rozwojowego Akademii Medycznej we Wrocławiu.
- (de) J. W. Dietrich, K. Brisseau et B. O. Boehm, « Resorption, Transport und Bioverfügbarkeit von Schilddrüsenhormonen », Endokrinologie, vol. 133, nos 31/32, , p. 1644-1648 (lire en ligne) DOI:10.1055/s-0028-1082780
- (en) P. Martin, D. Brochet, P. Soubrie et P. Simon, « Triidothyronine-induced reversal of learned helplessness in rats », Biological Psychiatry, vol. 20, no 9, , p. 1023-1025 (lire en ligne) DOI:10.1016/0006-3223(85)90202-1
- Jonklaas J, Davidson B, Bhagat S, Soldin SJ, Triiodothyronine levels in athyreotic individuals during levothyroxine therapy, JAMA, 2008;299:769-777
- Portail de la biologie
- Portail de la chimie
- Portail de la médecine