Cyanobacteria
Les Cyanobacteria, ou Cyanobactéries, sont un embranchement de bactéries (procaryotes) qui ne contient que la seule classe des Cyanophyceae. Ce sont des organismes procaryotes photosynthétiques improprement appelées « algues bleues », ou autrefois « algues bleu-vert ».
.JPG.webp)

| Empire | Prokaryota |
|---|---|
| Règne | Eubacteria |
| Sous-règne | Negibacteria |
- Eubactéries
- Protéobactéries
- groupe :
- Firmicutes
- groupe Bacillus / Clostridium
- Actinobactéries
- groupe :
- Firmicutes
- groupe :
- Bactéries vertes sulfureuses
- groupe :
- Flavobactéries
- Bactéroïdes
- groupe :
- Planctomycétales
- Bactéries vertes non sulfureuses
- Aquificales
- Thermotogales
On connaît plus de 7 500 espèces de cyanophycées (dont au moins 200 pouvant être libres, c'est-à-dire non symbiotiques et capables d'une vie indépendante), réparties dans plus de 150 genres[1].
Les cyanobactéries, malgré une éventuelle ressemblance superficielle et écologique, ne font partie d'aucun échellon taxinomique qu'on appelle communément « algues » ; en effet, elles ne sont pas des eukaryotes mais des prokaryotes, communément appellées bactéries unicellulaires ou coloniales. Ce sont le plus souvent des formes filamenteuses de consistance éventuellement gluante, dont le plus grand nombre est microscopique. Malgré leur nom vernaculaire, elles peuvent prendre diverses couleurs et sont rarement bleues. Ces couleurs viennent des pigments bleus (phycocyanines) et rouges (phycoérythrines) qui masquent la chlorophylle a et sont réunis dans les phycobilisomes, complexes collecteurs d'énergie lumineuse de l'appareil photosynthétique[2].
Les oxyphotobactéries réalisent la photosynthèse oxygénique et peuvent donc transformer l'énergie solaire en énergie chimique utilisable par la cellule en fixant le dioxyde de carbone (CO2) et en libérant du dioxygène (O2). Certaines d'entre elles peuvent dans certaines conditions fixer le diazote. Elles sont capables de consommer le carbone organique présent dans leur environnement.
La fixation du CO2 est attestée depuis au moins 3,7 milliards d'années[3],[4] mais on ne sait rien des organismes qui en sont à l'origine[5]. Les cyanobactéries et leurs ancêtres ont produit un bouleversement écologique majeur par leur dégagement de dioxygène dans l'atmosphère (elles sont responsables de la Grande Oxydation vers 2,45 milliards d'années) et par leur contribution au premier puits biologique de carbone et à une désacidification des océans, lorsqu'elles se sont organisées en colonies fixées (stromatolithes), capables de produire du calcaire.
Aujourd'hui, leurs populations croissantes, entre autres en France[6], favorisées par des déséquilibres trophiques ou écologiques (dont l'eutrophisation des eaux), posent divers problèmes : obstruction des systèmes de filtration, coloration et parfois dystrophisations des eaux ou anoxies, avec métabolites secondaires donnant un mauvais goût à l'eau (géosmine, 2-méthylisobornéol (en), p-cyclocitral…) et certains causant des toxicoses graves[7]. Une quarantaine d’espèces connues sécrètent ou contiennent des cyanotoxines qui sont généralement des neurotoxines pouvant causer la mort chez divers animaux, dont l'humain[8]. Ces toxines comptent parmi les plus puissants poisons naturels connus et n'ont pas d'antidote connu[9].
Les propriétés thérapeutiques des bains de boue seraient dues en majeure partie aux cyanobactéries. Certaines espèces comme la spiruline (Arthrospira platensis) sont utilisées comme complément alimentaire.
Description





Les cyanobactéries sont des organismes procaryotes mixotrophes ne présentant ni noyau véritable, ni plaste, ni reproduction sexuée.
Structure
Les cyanobactéries sont dépourvues de membrane nucléaire, de mitochondries, de réticulum endoplasmique et de flagelle. Au microscope électronique, on distingue deux zones différenciées, principalement par leur couleur :
- le chromoplasma (zone périphérique contenant les thylakoïdes, sortes de sacs écrasés contenant les organites photosynthétiques) qui, outre la photosynthèse, assure deux autres fonctions : la respiration, et la fixation de l'azote (chez certaines espèces) ;
- le centroplasma, situé au centre de la cellule, qui assure des fonctions semblables à celle d'un noyau et contient l'ADN, qui se présente généralement sous formes d'aiguilles.
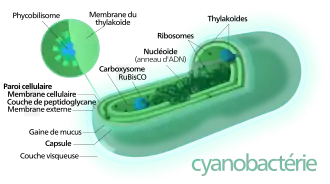
Pigments
Les cyanobactéries possèdent un certain nombre de pigments photosynthétiques qui leur confèrent leur caractère autotrophe phototrophe (capable de produire leur propre carbone à partir de molécules non organiques en utilisant l'énergie lumineuse). On a de la chlorophylle a (verte), des caroténoïdes (jaune-orange) et des phycobiliprotéines ou pigments accessoires tels que la phycocyanine, la phycoérythrine, la phycoérythrocyanine et l’allophycocyanine. La variabilité de pigments explique en partie la diversité de leurs couleurs (mais plutôt bleue dans près de 50 % des cas, d'où le préfixe cyanos dans leur nom). La moitié des cyanobactéries connues ont cependant une couleur extérieure autre (dorée, jaune, brun, rouge, orangée, vert émeraude, violet, ou bleu foncé presque noir). Ces bactéries sont en effet capables de modifier leur pigmentation en fonction de la qualité spectrale de la lumière, phénomène appelé adaptation chromatique complémentaire qui permet d'optimiser l'absorption lumineuse dans tout le spectre, ce qui rend ces bactéries compétitrices dans nombre de niches écologiques[10],[11],[12].
Ces pigments peuvent aussi avoir un rôle photoprotecteur (dissipation de l'énergie lumineuse lorsqu'elle est trop forte)[13].
Taille
La taille varie beaucoup selon les espèces ; certaines forment des filaments dépassant un mètre de long, unicellulaires, mais pouvant se subdiviser en fragments (dits hormogonies). D'autres espèces, moins communes forment des biofilms en plaques ou coussins, ou des colonies plus aléatoirement irrégulières. La plupart sont invisibles à l'œil nu hormis par la coloration qu'elles donnent parfois à l'eau ou au support qu'elles colonisent (elles font partie du micro- et nanoplancton). D'autres — récemment découvertes — sont invisibles au microscope optique traditionnel, et font partie du picoplancton[14].
C'est le cas des Prochlorophytes (ex. : Prochlorococcus marinus, très abondantes dans le picoplancton, plus petites que les cyanobactéries coccoïdes très présentes dans les eaux marines aux niveaux inférieurs de la zone euphotique où des densités de 105 cellules/ml sont mesurées[14]. La position taxinomique des Prochlorophytes a évolué et n'est pas encore clairement fixée[14]. Ces nanoalgues autotrophes (les plus petites connues) ne contiennent pas de chlorophylle a, mais de la divinyl-chlorophylle a et de la divinyl-chlorophylle b dont les maxima d’absorbance sont décalés de quelques nanomètres par rapport à ceux des chlorophylles correspondantes[14]. Leur croissance est très lente et leur durée de vie très longue.
Cyanobacteries et symbiose
Elles peuvent par symbiose plus ou moins complexes être les constituants algaux des lichens (gonidies) associés avec un champignon.
Des symbioses sont aussi possibles avec des éponges, amibes, protozoaires flagellés, d'autres cyanobactéries, mousses, hépatiques (dont elles peuvent aussi coloniser les cellules mortes)[15], plantes vasculaires (sous le rhizome de fougères, graminées, dans les nodosités de conifères du genre Cycas, Zamia, Dioon, à la base de feuilles d'Angiospermes, notamment dans les domaties[16]), oomycètes.
On en a trouvé se développant à l'intérieur de poils de mammifères (ours polaire dont le pelage prenait une teinte verdâtre dans les zoos), singe paresseux…
Lors des symbioses certaines perdent leur enveloppe et fonctionnent comme des chloroplastes sans rejet par l'hôte, et se dédoublant au rythme du dédoublement des cellules de l'hôte… Elles rendent à leur hôte le service de fixer l'azote (ex. : chez la fougère aquatique Azolla), produire de l'oxygène et certaines substances mucilagineuses et autres, utiles.
Chloroplastes et endosymbiose
Les chloroplastes des eucaryotes photosynthétiques (algues et plantes, qui sont des producteurs primaires) sont très probablement issus de cyanobactéries endosymbiotiques. L'Hypothèse de l'endosymbiose est soutenue par plusieurs similitudes, structurelles et génétiques.
- Les cyanobactéries ressemblent fortement aux chloroplastes des algues rouges.
- Des plastes issus d'une endosymbiose primaire qui contiennent de la chlorophylle a et b ont été retrouvés parmi les algues vertes et les plantes ainsi que des plastes qui contiennent de la chlorophylle a et des phycobiliprotéines parmi des algues rouges et des glaucophytes. Ces plastes ont probablement eu une origine commune.
- D'autres algues ont acquis leurs plastes à partir de ces formes par endosymbiose ou ingestion secondaire (pour la lignée verte : Euglénophytes et Chlorarachniophytes à partir d'une algue verte, et pour la lignée rouge : toutes les algues brunes au sens le plus large du terme — Hétérokontophytes, Cryptophytes, Dinophycées, Haptophytes, etc. — à partir d'une algue rouge).
Taxinomie
Les taxons appartenant à l'embranchement Cyanobacteria n'ont pas été validés par le Bacteriological Code (version de 1990), excepté[17] :
- les classes des Chroobacteria, Hormogoneae et Gloeobacteria ;
- les ordres des Chroococcales, Gloeobacterales, Nostocales, Oscillatoriales, Pleurocapsales et Stigonematales ;
- les familles des Prochloraceae et Prochlorotrichaceae ;
- les genres Halospirulina, Planktothricoides, Prochlorococcus, Prochloron, Prochlorothrix et Rubidibacter.
Les noms d'espèce Crinalium epipsammum De Winder et al. 1991, Microcystis aeruginosa Otsuka et al. 2001, Planktothrix mougeotii Suda et al. 2002 et Planktothrix pseudagardhii Suda et Watanabe 2002 sont postérieurs au Bacteriological Code (version de 1990)[17].
Le nombre de classes de l'embranchement des Cyanobacteria varie selon les références (et les dates de mise à jour). Liste non exhaustive de ces références :
| Référence | ICNB (1990 Revision) | ICNP (2008) | LPSN | NCBI | UniProt | ITIS |
| Classes en 2019 | 3[17] | 5[18] | 1[19]: <non nommée> | 8[20] | 8[21] | 1[22]: Cyanophyceae |
où :
- ICNB=International Code of Nomenclature of Bacteria (Bacteriological Code), qui est devenu le ICNP :
- ICNP=International Code of Nomenclature of Prokaryotes (Prokaryotic Code), 2008 Revision[23], publié par l'ICSP (International Committee on Systematics of Prokaryotes)[24]
- LPSN=List of Prokaryotic names with Standing in Nomenclature
- NCBI=National Center for Biotechnology Information
- UniProt=Universal Protein Resource
- ITIS=Integrated Taxonomic Information System
La taxinomie des cyanobactéries est en cours de révision, avec l'apparition de deux nouvelles classes (Melainabacteria et Sericytochromatia) regroupant au moins une partie des cyanobactéries provisoirement qualifiées d'incertae sedis.
Cependant, on peut faire un survol des systèmes les plus utilisés. Le système de Geitler[alpha 2], qui date de 1932, était basé sur la morphologie et les spécimens de collection et comptait trois ordres : Chroococcales, Chemesiphonales, et Hormogonales. Il incluait 1 300 espèces en 145 genres (Encyclopedia of Microbiology, Miselio Schaechter (rédacteur en chef), 3e éd. vol. 1 ; books.google).
Drouet, en 1981 (Beih. Nova Hedwiga 66 : 135-209), se fondant sur des spécimens d'herbier et la morphologie, simplifia le système précédent en incluant seulement 62 espèces en 24 genres, ce qui ne fut pas considéré comme approprié par les taxinomistes mais était apprécié des biochimistes et physiologistes à cause de son pragmatisme, et plusieurs noms de souches de laboratoire, comme Anacystis nidulans et Escherichia coli sont issues de son système.
Bourelly a fait une réévaluation du système geitlérien en 1985 dans son Les algues d'eau douce III, 2e éd., basée surtout sur la morphologie et les caractéristiques de reproduction.
La taxinomie la plus utilisée de nos jours[Quand ?] est celle de Rippka et ses collègues (J. Gen. Microbiol. 111: 1-61, 1979), qui inclut 5 ordres : Chroococcales, Pleurocapsales, Oscillatoriales, Nostocales, et Stigonematales. Elle se fonde sur la morphologie générale, l'ultrastructure, le mode de reproduction, la physiologie, la chimie, et parfois la génétique à partir de spécimens de collection et de culture.
La classification d'Anagnostidis et Komarek, fondée sur la morphologie générale, l'ultrastructure, le mode de reproduction et autres critères, et présentée dans une série d'articles datant de 1985 jusqu'à 1990 dans la revue Algology Studies et une autre série dans la revue Archives of Hydrobiology aussi de 1985 à 1990, comprenait 4 ordres : Chroococcales, Oscillatoriales, Nostocales, et Stigonematales. Les Pleurocapsales étaient fusionnés aux Chroococcales.
Des analyses moléculaires fondées sur l'ARNr 16S par Giovannoni et ses collègues en 1988 (Evolutionary relationships among Cyanobacteria and green chloroplasts, J. Bacteriol. 170 : 3584-92) et par Turner et ses collègues datant de 1989 (The relationships of a prochlorophyte Prochlorothrix hollandica to green chloroplasts, Nature 337 : 380-85) comprend 9 ordres (10 si on inclut les Prochlorales) répartis en 6 super-groupes de plus en plus exclusifs. Les ancêtres des super-groupes sont Gleobacter (Chroococcales 1), Pseudanabena (Chroococcales 2) (qui était la racine dans l'analyse de Giovannoni et collègues), Oscillatoriales 1, Prochlorales (Prochlorophytes), Synechococcus (Chroococcales 3), et Chroococcales 4 + Pleurocapsales. Le 6e super-groupe est composé d'Oscillatoriales 2 + (Nostocales + Stigonematales). Donc les Chroococcales et les Oscillatoriales sont polyphylétiques. Ces résultats correspondent au phénotype pour la plupart — par exemple, Gleobacter est probablement le genre le plus primitif, n'ayant pas de filaments, thylakoïdes, hormogonies, akinètes, ni hétérocystes, et se reproduisant par la fission binaire au lieu de la sporulation, et le groupe Nostocales + Stigonematales se démarquant surtout par la possession d'hétérocystes.
Découvertes
Jusqu'à récemment cet embranchement comportait l'unique classe des Cyanophyceae (Cyanophycées) ou Oxyphotobacteria (Oxyphotobactéries). Ces bactéries fixent par photosynthèse le carbone du dioxyde de carbone et libèrent du dioxygène.
- En 2013 un groupe de bactéries apparentées aux cyanobactéries connues mais non photosynthétiques a été découvert dans l'intestin de l'Homme et dans les eaux de surface. Il forme la classe des Melainabacteria (en), ou peut-être un nouvel embranchement[25].
- En 2017 un nouveau groupe a été découvert, apparenté aux précédents mais phylogénétiquement basal, également non photosynthétique. Il forme la classe des Sericytochromatia, ou peut-être un nouvel embranchement[26],[27].
Liste des ordres
Selon AlgaeBase (21 août 2022)[28] :
- Chroococcales Schaffner 1922
- Chroococcidiopsidales J.Komárek, J.Kastovsky, J.Mares & J.R.Johansen 2014
- Cyanophyceae ordo incertae sedis
- Gloeobacterales Cavalier-Smith 2002
- Gloeomargaritales D.Moreira et al. 2017
- Nostocales Borzì 1914
- Oscillatoriales Schaffner 1922
- Pleurocapsales Geitler 1925
- Pseudanabaenales unknown authority
- Spirulinales J.Komárek, J.Kastovsky, Mareš & J.R.Johansen 2014
- Spongiostromatales Gürich, 1907
- Synechococcales Hoffmann, Komárek & Kastovsky 2005
- Thermostichales Komárek & Strunecky 2020
Selon World Register of Marine Species (12 septembre 2017)[29].
Phylogénie de la photosynthèse
Les oxyphotobactéries possèdent deux photosystèmes (I et II), tous deux nécessaires à la photosynthèse oxygénique (photosynthèse s'accompagnant de la production d'oxygène libre) alors qu'aucune de ces deux machineries cellulaires n'est présente dans les deux autres classes. On en déduit logiquement que l'ancêtre commun aux trois classes de cyanobactéries n'était pas photosynthétique[30]. Les photosystèmes I et II sont présents dans d'autres bactéries photosynthétiques (mais anoxygéniques, c'est-à-dire sans production d'oxygène libre), mais jamais ensemble. Ils ont sans doute été acquis par les oxyphotobactéries par transfert horizontal de gènes en provenances de bactéries photosynthétiques préexistantes mais anoxygéniques[27].
Sur la base des théories d'horloge moléculaire, la séparation des deux classes des Melainabacteria et des Oxyphotobacteria daterait de 2,5 à 2,6 milliards d'années (la classe des Sericytochromatia se serait séparée antérieurement). La photosynthèse oxygénique daterait ainsi de la même époque voire serait plus tardive, donc serait nettement plus récente que ce que l'on a longtemps pensé[27].
Reproduction et aptitudes aux pullulations

Elle se fait par division végétative et par spores, soit unicellulaires (coccospores), soit sous forme de filaments de cyanobactéries (trichomes = hormogonies) ce qui constitue deux principales classes de cyanobactéries : les coccogonophycidées (formes solitaires ou coloniales) et les hormogonophycidées (formes coloniales filamenteuses). Quand la bactérie est symbiote d'une autre espèce, ses cellules se divisent au rythme des cellules de l'espèce-hôte. Les pullulations apparaissent souvent dans les eaux peu aérées ou à faible courant, mais il arrive qu'en été des rivières rapides soient touchées[31]. Les blooms de cyanobactéries peuvent fortement colorer l'eau. Ces efflorescences sont invisibles, ou ont l'apparence d'une mousse, d'écume ou de tapis couvrant la surface de l'eau (lacs étangs, bassins…). Selon les cas, les efflorescences ont une couleur bleue, vert clair, brun ou rouge. Elles donnent parfois l'impression que de la peinture flotte à la surface de l'eau[9]. C'est ainsi la pullulation de Trichodesmium (Oscillatoria) erythraeum qui est responsable de la coloration de la mer Rouge, en raison de son pigment rouge (la phycoérythrine[14]).
Les cyanobactéries qui vivent en colonies cohérentes (en trichomes formant des films, amas ou filaments) fixent l'azote de l'air via des cellules spécialisées dites hétérocystes qui fonctionnent indépendamment des autres cellules, en anaérobiose. Certaines font preuve d'une très bonne résistance au froid, au chaud et aux rayonnements ionisants ou ultraviolets ce qui leur permet notamment de vivre en zone polaire[32]. Quand les nitrates ou l'ammoniac manquent, une partie des cellules de ces cyanobactéries (10 % environ) épaississent leurs parois, excrètent leur pigment et synthétisent une enzyme (nitrogénase) qui fixe l'azote (stocké sous forme de glutamine qui peut être utilisée par d'autres cellules vivant elles en aérobie).
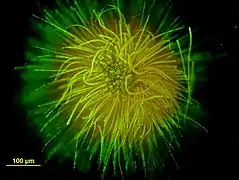 Colonie en forme de boule formée par une des espèces de Gloeotrichia (vue au microscope, avec coloration).
Colonie en forme de boule formée par une des espèces de Gloeotrichia (vue au microscope, avec coloration). Une colonie de cyanophycées du genre Anabaena (Nostocaceae).
Une colonie de cyanophycées du genre Anabaena (Nostocaceae). Une colonie de cyanophycées Lyngbya majuscula (Oscillatoriaceae).
Une colonie de cyanophycées Lyngbya majuscula (Oscillatoriaceae). Efflorescence de Blennothrix majus (Oscillatoriaceae).
Efflorescence de Blennothrix majus (Oscillatoriaceae)..jpg.webp) Une colonie de cyanophycées Symploca hydnoides? (Phormidiaceae).
Une colonie de cyanophycées Symploca hydnoides? (Phormidiaceae). Colonie de Leptolyngbya sp. (Pseudanabaenales).
Colonie de Leptolyngbya sp. (Pseudanabaenales).
Écologie des cyanobactéries

Les cyanobactéries sont les êtres vivants les plus anciens identifiés avec certitude avec les archées, puisqu'on en trouve déjà durant le précambrien (les formes les plus simples), jusqu'aux alentours de 3,8 milliards d'années[33], soit dans l'éon de l'Archéen. La présence de ces bactéries assez complexes laisse supposer l'existence antérieure de formes de vie plus simples (dont nous ne connaissons aucun fossile), repoussant la date d'apparition de la vie sur Terre. Par ailleurs, ces cyanobactéries anciennes ont généré des formations géologiques, les stromatolithes.
Grâce à leur activité, des roches carbonatées se sont formées en abondance en piégeant ainsi le gaz carbonique de l'atmosphère primitive, ce qui a pu nous fournir de nombreuses informations quant à la composition de l'atmosphère, donc sur les conditions de vie de l'époque. Elles sont à l'origine de la modification de l'atmosphère terrestre avec l'enrichissement en dioxygène, nécessaire au développement de la vie sur Terre en permettant l'apparition de la couche d'ozone protectrice, et du premier grand puits de carbone qui a diminué l'effet de serre, alors que la puissance moyenne reçue du Soleil augmentait.
Les cyanobactéries vivent presque partout, y compris dans des conditions extrêmes, des glaces polaires (On a trouvé des tapis bactériens de plusieurs centimètres d'épaisseur, sous plus de 5 m de glace permanente) aux sables des déserts. Elles survivent dans les lacs très chauds ou acides des cratères volcaniques comme dans les geysers. Elles croissent tant en eau douce que salée, sous forme planctonique (vivant dans la masse d'eau), ou sous forme benthique (organismes fixés à un substrat immergé). Elles se développent particulièrement bien dans certains milieux pollués par les activités humaines (eutrophisation, dystrophisation). Ces proliférations (blooms) forment par exemple des fleurs d'eau de couleur particulière qui apparaissent sur un plan d'eau en voie de pollution. On assiste à ces efflorescences algales quand l'eau contient de l'azote ou du phosphore en excès, conséquence par exemple d'une agriculture trop intensive ou d'une urbanisation épurant mal ses eaux. Pour cette raison, lorsqu'on détecte qu'une étendue d'eau est envahie par les cyanobactéries, il ne faut pas considérer l'efflorescence elle-même comme la pollution, mais plutôt comme une réaction naturelle à une pollution déjà présente.
Un autre paramètre important influençant l’apparition de fleurs d’eau est le débit du cours d’eau[34]. Un fort débit provoque un brassage continuel de la matière en suspension en plus d’empêcher la stratification des eaux. Ainsi, l’acquisition de nutriments par les cyanobactéries est peu probable et ils ne peuvent se positionner dans la colonne d’eau pour obtenir l’intensité lumineuse requise. C’est pourquoi les fleurs d’eau apparaissent dans les lacs et les rivières à faible débit, plutôt que dans les fleuves (avec quelques exceptions).
De plus, les cyanobactéries en cas de stress intense peuvent créer des spores résistantes (akinètes) protégées par une sorte de squelette minéral. Elles sont en outre reconnues pour n’avoir que très peu d’ennemis naturels et éliminent les espèces concurrentes, tout en échappant mieux que d'autres à la prédation. La principale source de contrôle des populations provient de la compétition entre espèces de cyanobactéries[1], et peut-être parfois de virus susceptibles de les infecter
Les cyanobactéries adoptent plusieurs stratégies de survie telle que la capacité d’emmagasiner le phosphore qui est l’élément nutritif limitant dans les cours d’eau[34]. De plus, certaines espèces possèdent un mécanisme de positionnement dans la colonne d’eau par l’intermédiaire de vésicules gazeuses. Ils sont donc en mesure de s’adapter aux conditions lumineuses variables en fonction de la période du jour[34]. Comme autres mécanismes d’adaptation on dénote la capacité de certaines espèces à utiliser des photons de longueurs d’onde différentes de ceux qui sont normalement utilisés, et qui pénètrent plus profondément dans l’eau[34].
Une question très importante au niveau de la fonction métabolique (rôle écologique) des cyanotoxines subsiste. Plusieurs suggèrent que la production de ces métabolites serait uniquement due à une réponse face à un stress provenant de l’environnement, alors que d’autres croient que l’expression des gènes qui génèrent ces toxines est constitutive et que la proportion synthétisée augmenterait avec la croissance de la souche en question et par conséquent, indirectement avec les facteurs environnementaux[35]. Comme autre hypothèse, on propose que ces molécules puissent servir de facteurs favorisant le mutualisme avec d’autres espèces, ou bien à l’inverse, ces toxines pourraient procurer un avantage sélectif sur des espèces compétitrices[34].
Activité
Certaines cyanobactéries sont aussi actives la nuit ou en l'absence de lumière, se transformant en quelque sorte en bactéries chimiohétérotrophes (en oxydant les sucres).
Certaines survivent aussi en anaérobiose (ex. : Oscillatoria limnetica) en photosynthétisant à partir du sulfure d'hydrogène au lieu de l'eau.
Certaines, sensibles à l'exposition prolongée aux UV, synthétisent des composés photoprotecteurs, les acides aminés analogues de la mycosporine[36].
Mobilité
Certaines cyanobactéries, bien que dépourvues de flagelles, de cils vibratiles sont mobiles (notamment chez les Nostocales). Quand elles sont soumises à des stress, elles peuvent alors produire des akinètes (cellules résistant à la déshydratation grâce à des parois épaissies).
On a observé des fragments de colonie s'en éloignant à une vitesse de 10 micromètres par seconde. Certaines colonies emprisonnent des bulles qui les font flotter et leur permettent d'être emportées par le courant. Certaines cyanobactéries sont parfois animées de mouvements saccadés.
La mobilité semble dépendre de trois types de phénomènes :
- capacité de lente « reptation » linéaire[37], Certaines cyanobactéries sont mobiles, glissant (Lien-vidéo[38]) ou pivotant, semble-t-il au moyen d'ondes de contraction ;
- par un autre mode de « nage » (« gliding motility » pour les anglophones), mal compris, non « phototactique »[39] qui n'implique pas de mouvement de flagelle. Il pourrait s'agir d'un phénomène d'extrusion différenciée de mucilage, permettant à la bactérie de se mouvoir autour de son axe (longitudinal) ;
- production (par certaines espèces) de vésicules gazeuses leur permettant de monter ou descendre dans la colonne d'eau, et de coloniser la surface de l'eau (au détriment d'autres espèces) quand les conditions (eaux calmes, chaleur…) leur sont favorables (c'est l'origine de certains blooms planctoniques).
Toxicité, écotoxicité
Les cyanobactéries sont abondantes dans le monde entier. De plus, les pullulations de cyanophycées dans des réservoirs superficiels d'eau potable sont de plus en plus fréquentes (en raison de déséquilibres écologiques encore mal compris, mais semblant impliquer l'eutrophisation des eaux de surface)[40].
50 % des efflorescences algales libèrent des endotoxines potentiellement dangereuses pour l'Homme et les animaux. L'essentiel des cyanotoxines produites s’accumulent dans les cellules.
Elles affectent principalement la peau et les muqueuses (dermatotoxines), le foie (hépatotoxines) et le système nerveux (neurotoxines, plus rares que les hépatotoxines). Les seuls décès humains dus à des toxines cyanobactériennes documentés et étayés par des preuves scientifiques ont été causés par l'exposition durant des dialyses. Il a été également documenté que des personnes infectées par l'eau de boisson et lors d'activités aquatiques récréatives ont dû subir des soins intensifs en milieu hospitalier[41].
Les personnes qui nagent dans des eaux contenant des toxines cyanobactériennes peuvent avoir des réactions allergiques telles que l'asthme, une irritation des yeux, des éruptions et des vésicules autour de la bouche et du nez[41].
L'ampleur de la production semble être corrélée avec la phase de croissance des cyanobactéries. Ensuite, en fin de période de sénescence, la cellule meurt et se lyse, libérant ses toxines dans son environnement. Ainsi, en début de bloom, on trouve très peu de toxines extracellulaires, alors que vers le déclin de ce bloom, le taux de toxines extracellulaires croît énormément[8].
Le classement de la toxicité aigüe des cyanotoxines, établi d’après les valeurs de DL50, place les anatoxines et les microcystines parmi les substances biologiques très toxiques[42], mais on a récemment constaté que certaines des toxines produites sont très stables, s'accumulent dans le cerveau et peuvent conduire à la mort par neurotoxicité après des décennies d'exposition chronique[43].
- Divers aspects possibles d'une efflorescence cyanobactérienne










Paléontologie et préhistoire
En 2017 des chercheurs se demandent si des cyanotoxines ne sont pas responsables de la mort de milliers de dinosaures et autres organismes durant l'époque tertiaire. Les « gisements » d’os fossiles fascinent par bien des aspects[44] ; en particulier, pourquoi tant d'animaux sont-ils morts à la fois au même endroit ? Les inondations, des catastrophes volcaniques, des coulées de boues ou des sécheresses dramatiques suivies de pluies diluviennes qui auraient rapidement enfoui les cadavres de grands et petits animaux, ou encore des bulles géantes de CO2 asphyxiant remontant d’un grand lac ne sont pas toujours crédibles.
Aussi Raymond Rogers se demande si de simples proliférations de certaines cyanobactéries auraient pu tuer ces animaux (et peut-être même les avoir attirés ?). Dans la formation géologique « Maevarano » au Nord-Ouest de Madagascar, 1 200 spécimens ont été trouvés dans une même couche sur une surface pas plus grande que le tiers d'un terrain de tennis ! Les gros et petits animaux y sont curieusement morts les uns contre les autres. Et ils semblent avoir été tués sans discrimination. Ceci évoque un poison aux effets paralysant ou mortel presque immédiats, capable de faire tomber des oiseaux du ciel… (de manière répétée puisque plusieurs lits d’os se superposent les uns aux autres)[44]. Certains animaux ont une posture arquée inhabituelle pour un animal mourant. Un dos arqué évoque les convulsions qu’on observe aujourd’hui lors de certains empoisonnements de vaches ayant bu de l’eau contaminée par certaines cyanobactéries. Des croûtes de carbonates inhabituelles y ont été trouvées, évoquant le reste d'un biofilm d’algues et/ou de bactéries encroutantes[44].
Le grand nombre d'oiseaux morts est également curieux. Des empoisonnements massifs sont connus en mer avec le phénomène de « zones mortes » : des centaines de restes de baleines et d'autres animaux marins se sont ainsi déposés devant l’actuel Chili, il y a 11 millions d'années, et un nombre croissant de zones marines mortes est actuellement observé depuis quelques décennies dans le monde. Wighart von Koenigswald, paléontologue à l'Université de Bonn (Allemagne) cité par la revue Science se demande si des cyanotoxines ne pourraient pas aussi expliquer le fameux gisement de Messel (des fosses datant de l’Éocène emplies de fossiles dont d'oiseaux et de chauves-souris)[44]. Des tortues en train de copuler et des juments pleines y ont été trouvées sur différents niveaux (ce qui implique que le phénomène s’est reproduit et dans ces cas en période de reproduction). Mais à Madagascar comme ailleurs la preuve directe d’algues ou de toxines manque encore. Rogers songe à tenter d’en retrouver des traces fossiles (chimiques ou via des biomarqueurs)[44].
Les principaux genres producteurs de toxines
Les principaux genres producteurs de toxines sont aujourd'hui Anabaena, Aphanizomenon, Cylindrospermopsis, Microcystis, Nodularia, Oscillatoria, Planktothrix[34],[35].
Cinétique environnementale et pathogénicité
Certaines de ces toxines sont relativement stables, ce qui pose la question d'une possible bioamplification dans la chaîne alimentaire, voire d'une contribution à causer ou aggraver des maladies neurodégénératives (syndromes de type Alzheimer et/ou Parkinsoniens)[45]. Dans les années 1960, un grand nombre de cas sporadiques de syndromes de ce type ont été observés sur l'île de Guam[40], avec une fréquence 100 fois plus élevée qu'ailleurs dans le monde. Les recherches faites sur l'île ont montré que ce syndrome était causé par un neurotoxique : un acide aminé non protéique ; le bêta-méthylamino-L-alanine (ou BMAA). Il a été ensuite démontré que ce BMAA provenait des graines de cycas (Cycas micronesica)[40]. Il a ensuite été démontré que c'est le même BMAA que celui qui est produit par les cyanobactéries symbiotiques trouvées en grande quantité dans des racines spécialisées des Cycas (dites « racines coralloïdes », formant des centaines de milliers de petits nodules accolés, abritant chacun une petite colonie de cyanobactéries)[40],[46]. Sous forme libre dans la nature, cette bactérie ne contient que 0,3 µg/g de BMAA, mais quand elle vit en symbiose avec son arbre (Cicas), elle en produit jusqu'à 120 fois plus (2 à 37 µg/g)[47]. Ce BMAA est transporté par la sève vers les branches, puis retrouvé particulièrement concentré dans les tissus reproducteurs de l'arbre (9 µg/g en moyenne dans la partie charnue du sarcotest et plus de 100 fois plus ; 1 161 µg/g en moy.) dans l'enveloppe périphérique de la graine)[47]. Ce BMAA est aussi trouvé sous forme bioassimilable dans le fruit et la graine[40], mais en petite quantité sous forme libre ; c'est sous forme liée à des protéines qu'il est surtout présent, jusqu'à une centaine de fois plus concentré, alors bioassimilable[47].
Des chercheurs avaient suggéré un lien entre ce BMAA et l'étrange syndrome de Guam, mais on leur a répondu qu'il faudrait manger des tonnes de farine ou de fruits de cet arbre pour accumuler la quantité de BMAA trouvée dans le cerveau des malades. Les recherches ont été interrompues durant une trentaine d'années, avant que d'autres chercheurs observent que plusieurs espèces d'animaux mangés par l'Homme se nourrissent couramment du fruit et de la graine de cet arbre : C'est le cas des roussettes (Pteropus mariannus), des cochons et des cervidés. On a alors rapidement montré qu'ils contribuent à une rapide bioamplification de cette toxine dans les chaînes alimentaires de l'Île de Guam ; jusqu'à l'Homme[47]).
Par exemple, les roussettes qui mangent de ces graines et fruits bioaccumulent à leur tour le BMAA (3 556 microg/g en moyenne). Elles sont elles-mêmes un gibier très prisé du peuple autochtone Chamorro qui les mange bouillies dans une crème de coco. Le BMAA est une toxine si stable qu'on l'a même retrouvé en grande quantité dans des spécimens de roussettes de Guam conservées dans les musées[48]. Selon les doses mesurées dans les musées, la consommation d'une seule de ces roussettes peut apporter une dose de BMAA équivalente à 174 kg à 1,014 tonnes de farine de cycas[48]. À cause des festins traditionnels de renards volants (autre nom de cette roussette), les Chamorros meurent bien plus nombreux que la moyenne des humains d'un syndrome[alpha 3] associant les symptômes d'une sclérose latérale amyotrophique et ceux d'une démence parkinsonnienne, constituant une maladie neurodégénérative, qui apparaît une trentaine d'années environ après le début de l'intoxication[43]. Ce BMAA lié à des protéines a effectivement aussi été retrouvé dans le cerveau des Guamiens morts de ces maladies dégénératives particulières (à des concentrations moyennes de 627 microg/g, 5 mM) alors qu'on ne l'a pas trouvé dans les cerveaux de cas témoins, ni dans le cerveau de patients morts de maladie de Huntington[40]. Ce fait a ravivé l'intérêt pour l'hypothèse que le BMAA pourrait être déclencheur possible d'autres maladies neurodégénératives, d'autant qu'il a aussi été trouvé (à des taux moyens de 95 microg/g, 0,8 mM) dans le cerveau d'individus nord-américains morts de maladie d'Alzheimer, ce qui renforce l'hypothèse d'un rôle étiologique possible du BMAA dans le cas de maladies neurodégénératives hors de l'Île de Guam[40],[47] et une étude encore contestée laisse penser que d'autres plantes ou animaux pourraient concentrer le BMAA[43].
Facteurs environnementaux ?
Dans les années 2000 on soupçonne qu'ils puissent jouer un rôle majeur dans le développement de maladies neurodégénératives, qui gagnent du terrain. Certaines souches de cyanobactéries sont potentiellement (et de manière avérée à Guam) source de BMAA environnemental susceptible d'être transporté dans les eaux potables, ou bioconcentré puis impliqué dans la maladie d'Alzheimer, la SLA (Sclérose Latérale Amyotrophique)[49] ou la maladie de Parkinson[50] chez des patients pouvant avoir une prédisposition génétique liée à une incapacité à prévenir l'accumulation de protéines liées au BMAA dans le cerveau est avancée par certains auteurs[40],[51], mais encore à confirmer (par exemple par traçage isotopique et/ou par des études épidémiologiques et écoépidémiologiques) solides.
Le BMAA, en tant qu'acide aminé non protéique, outre des effets toxiques sur les neurones moteurs, une action agoniste sur les récepteurs NMDA et AMPA et l'induction d'un stress oxydatif associé à un épuisement du glutathion, pourrait causer le mauvais repliement des protéines intraneuronales, ce qui est l'une des sources de la neurodégénérescence. S'il n'y a pas de modèle animal pour étudier une SLA induite par le BMAA, il existe maintenant des preuves substantielles pour soutenir un lien de causalité entre cette toxine bactérienne et la SLA[49]. Comme les pullulations de cyanophycées sont de plus en plus fréquentes en eau douce de surface, et que le dérèglement climatique devrait aggraver le phénomène[52], la confirmation d'un déclencheur environnemental bactérien pour la SLA ou d'autres maladies neurodégénératives, pourrait avoir d'énormes conséquences en matière de sécurité sanitaire[49].
En outre, d'autres maladies telles que le cancer du foie et les « maladies du foie non-alcoolique »[52] semblent également causées ou favorisées par les cyanotoxines. Ainsi, une étude récente (2015) a « révélé une association claire et significative entre la distribution spatiale des proliférations de cyanobactéries aux États-Unis, et le nombre de morts d'une maladie du foie non alcoolique » mais les auteurs ont souligné qu'ils ont montré une corrélation mais pas une causalité[52].
L’évaluation de la toxicité d’une efflorescence
Elle ne peut pas se faire par la seule reconnaissance des espèces en présence.
- En effet, une même cyanotoxine peut être synthétisée par plusieurs genres. Ainsi les deux genres Microcystis et Anabaena produisent des cyanotoxines de type microcystine[1].
- La présence d’un genre réputé produire des cyanotoxines ne signifie pas nécessairement que les toxines seront présentes, car ce ne sont pas toutes les espèces constituant le genre qui produiront des cyanotoxines[1]. Les espèces toxiques peuvent générer une souche qui possédera (et exprimera) ou non les gènes pour la production de toxines. Selon la diversité du matériel génétique des souches toxiques, celles-ci peuvent générer des cyanotoxines de toxicité variable[1].
- De plus, les études disponibles en 2005 laissaient penser que les proliférations de cyanobactéries ne sont pas prédictibles, et qu’il n’y a pas de relation entre la biomasse algale totale, la biomasse de cyanobactéries et la quantité de toxines produites.
- Les toxines ou leurs mécanismes d'action ne sont pas encore tous connus (exemple pour Coelosphaerium kuetzingianum).
- Des effets secondaires ou collatéraux sont à prendre en compte. Par exemple, les proliférations profondes peuvent causer des anoxies ou zones mortes, elles-mêmes sources d'autres toxines. Les proliférations de surface, en diminuant la pénétration de la lumière dans l'eau, nuisent également à d'autres groupes d'algues et de plantes et limitent les échanges gazeux entre l'atmosphère et l'eau (en outre elles consomment le dioxygène de l'eau) et peuvent ainsi conduire à une asphyxie (ou anoxie) des animaux aquatiques ou du milieu.
Depuis peu un nombre important d'oiseaux des Everglades meurt d'une maladie neurodégénérative mal comprise, dite Avian vacuolar myelinopathy ou AVM)[53]. Il semble que tous les oiseaux malades ont consommé une algue bleue localement présente sur les feuilles de plantes aquatiques. Des milliers d'oiseaux d'eaux (canards par exemple) deviennent léthargiques puis ne peuvent plus voler ni se nourrir ; ils font des proies plus faciles pour les rapaces qui peuvent bioaccumuler la toxine et en mourir[53]. Près de 200 aigles pêcheurs ont ainsi succombé à l'AVM. Les naturalistes craignent aussi que le Milan des marais (Rostrhamus sociabilis), déjà menacé en Floride y soit très exposé et vulnérable car son régime alimentaire est essentiellement constitué de gros escargots aquatiques qui consomment ces algues sur les feuilles de plantes aquatiques[53]. Les scientifiques se préparent à couper les plantes aquatiques proches de la surface dans les lacs contaminés par cette algue bleue[53].
Par ailleurs, certaines espèces de cyanobactéries du phytoplancton « normal » ou non toxiques, sont parfois cause d'un rendement exceptionnel en poissons, riz, canards… de certains étangs ou zones marines.
Relation avec certains gaz
Cyanobactéries et azote
Ces algues jouent un rôle important dans le cycle de l'azote, en étant capable de transformer l'azote atmosphérique en azote minéral type ammonium ou nitrates assimilables par les plantes, soit près de 100 millions de tonnes d'azote minéral par an[16]. En mourant, elles libèrent des sels nutritifs produits par la fixation de l'azote et augmentent ainsi le rendement agricole, tout particulièrement en rizicultures. On les utilise parfois ainsi comme engrais « vert » pour amener un apport d'azote directement assimilable par les plantes.
Cyanobactéries et méthane
On a montré (2002) qu'en présence de cyanophycées, la production de méthane diminue dans le sol des rizières[54].
Depuis quelques décennies, des chercheurs ont enregistré en mer des émissions de méthane apparemment « aberrantes », car semblant émerger d’eaux saturées en oxygène, là où les bactéries méthanogènes étaient supposées ne pas pouvoir vivre[55],[56],[57],[58]. Ceci a été observé dans des eaux froides (Arctique), tempérées ou subtropicales (sud de l’Atlantique-Nord)[59]. Le même constat a ensuite été fait en eau douce, dans la couche supérieure et bien oxygénée de surface de certains lacs (5-6 m) ; il survient alors en été (par exemple en 2011 sur le lac Stechlin en Allemagne[60]) ou sur le lac de Hallwil (Suisse ; là, l'eau des premiers mètres sous la surface était en juin-août sursaturée en méthane (300–400 nmol par litre), bien plus qu’en profondeur)[61].
En 2016-2017, plusieurs équipes ont commencé à identifier les microorganismes qui produisent ce méthane[62],[63],[64] (des Pseudomonas sp. ont été identifiées en 2017[63]) et/ou à étudier les voies biochimiques en jeu (le CH4 serait ici un sous-produit du métabolisme de la bactérie lorsqu’elle capte le phosphore dissous)[62],[65].
Lors de proliférations planctoniques de cyanophycées, ces émissions augmentent ; on s'est donc demandé si ces organismes (qu'on situe souvent à mi-chemin entre les algues et les bactéries) pouvaient, à la manière de bactéries méthanogènes produire du CH4[61]. Divers échantillons d'algues bleu-vert ont été cultivés in vitro (en incubateur stérile). Deux échantillons venaient de sols, cinq d'eau douce et six d'océan). Tous ces échantillons de cyanophycées (qu'elles soient unicellulaires ou filamenteuses) ont produit du méthane, en condition « sombre », mais aussi à la lumière (durant la photosynthèse[66]), ainsi que dans des environnements riches en oxygène et pauvres en oxygène (il a été vérifié qu’il n’y avait pas d’archées méthanogènes dans ces cultures). L’émission était plus faible en condition d’obscurité[61].
Après la parution de deux articles scientifiquement sceptiques sur une possible origine « oxique » de ce CH4, en 2016[67] et en 2019[68], ce travail a récemment (2020) confirmé que certaines cyanophycées courantes unicellulaires (Chroococcidiopsis sp., Synechococcus sp., Microcystis aeruginosa et Prochlorococcus sp.) ou filamenteuses (ex. : Anabaena sp., Scytonema hofmanni, Leptolyngbya sp. ou « croûte du désert », Phormidium persicinum, Trichodesmium erythraeum et Nodularia spumigena) produisent non seulement du CO2 et de l’oxygène, mais peuvent aussi des quantités très significatives de méthane[69],[70].
Ce méthane est produit dans les eaux marines ou dans les lacs (en été, durant leur période « stratifiée »). Il a été constaté dans des eaux eutrophes ou mésotrophes voire presque oligotrophes (c’est-à-dire très pauvres en nutriments) et dans les sols de zones humides. Ce « méthane oxique » est parfois dénommé « méthane paradoxal », car il est produit en présence d’oxygène et non pas en condition anoxique, condition qu’on pensait jusqu’alors impérative[71].
Il semble que les cyanophycées mobilisent deux mécanismes différents pour produire ce CH4, l'un agissant sous la lumière et l'autre dans l'obscurité, probablement dans les deux cas à partir de produits photosynthétiques fraîchement générés via la photosynthèse, dont le stock pourrait aussi être utilisé la nuit (la fermentation de composés ainsi stockés par les cyanobactéries avait déjà été décrit en 1997), produisant de l'acétate et de l'hydrogène, qui sont deux précurseurs connus de la formation de CH4 dit acétoclastique[72].
Selon les chercheurs de l'université de Swansea, la quantité émise est probablement corrélée à la taille du lac et « pourrait représenter plus de la moitié des émissions de méthane de surface pour les lacs de plus d'un kilomètre carré »[61].
Typiquement, dans la colonne d'eau, la teneur en méthane est plus importante près du fond et près des rives (surtout s’ils sont riches en matière organique fermentescible) ; elle est faible près de la surface (car le CH4 passe dans l'air à ce niveau-là) et elle est la plus élevée dans la thermocline (sous la couche de mélange plus oxygénée). L’épaisseur et la position de la thermocline varient selon la saison, la météo (vent notamment) et les caractéristiques géomorphologues et physicochimiques du lac. Une partie du méthane trouvé en surface remonte du fond (bullage ou diffusion) et une partie est produit près de la surface (interface eau-air)[61]. Le GIEC disposait des variations des teneurs globales. On commence maintenant à mieux évaluer la modulation biologique et les puits et sources de méthane ; une provenance nouvelle (la couche de mélange de surface, source de méthane oxique) est intégrée dans les modèles du cycle mondial du méthane[61].
Le flux varie selon les saisons et les milieux, mais il est — au moins localement — très significatif[73] ; dans le lac Cromwell (Canada) il représentait 20 % de l'émission totale de surface (le reste provenant de sources anoxiques)[74].
En eaux mésotrophes et tempérées, ce CH4 peut représenter la majorité (> 50 %) du méthane total émis en surface pour les lacs de plus de 1 km2[61] (ex. : au dessus du lac de Hallwil en Suisse, il représentait 63 à 83% des émissions de surface[75]). En extrapolant les données modélisées d’émissions lacustres oxiques à l’échelle planétaire, la production de méthane oxique pourrait représenter jusqu'à 66 % des émissions de méthane des lacs du monde[61]. À la différence du méthane produit dans le sédiment, celui ci est synthétisé près de la surface où il passe rapidement dans l’air, sans avoir le temps d'être dissous dans l'eau ni d'être éventuellement consommé par des bactéries méthanotrophes.
Les modèles locorégionaux du cycle mondial du méthane doivent donc désormais intégrer cet apport « supplémentaire » à l’atmosphère, à savoir celui des eaux « oxiques » (c’est-à-dire oxygénées)[61]. La chaîne biochimique qui conduit à la production de ce CH4 est encore mal comprise, et on ignore encore à quelle échelle ce phénomène existe dans le monde ou comment il évoluera dans le contexte du dérèglement climatique, de l’eutrophisation ou acidification des eaux, du cycle du phosphore… Ces données pourraient peut-être permettre de mieux comprendre la variabilité de certaines émissions lacustres de méthane[76],[77],[78],[79] et par exemple pourquoi de 2014 à 2017 le taux de méthane atmosphérique a connu une si forte hausse[80].
Récemment, parmi des bactéries courantes, une cyanobactérie filamenteuse typique de la croûte du désert (Leptolyngbya sp.) et des cyanobactéries endolithiques Chroococcidiopsis se sont aussi montrées capables de produire du CH4, de jour comme de nuit[81], confirmant que des cyanophycées peuvent produire du méthane à partir de sols oxiques ou de roches poreuses, ce qui était jusqu'alors considéré comme impossible[66].
Cyanobactéries et eaux douces
Exemple du Québec
Au Québec, en 3 ans de 2001 à 2004, sur 6 stations de pompage d'eau potable, Anabaena flosaquae, Coelosphaerium kuetzingianum ont assez fréquemment été détectées, ainsi qu'une dizaine d'autres souches. Le plus grand nombre d'espèces potentiellement toxiques était sur les sites de Plessisville, Saint-Hyacinthe et Farnham. Dans un tiers des cas environ, la présence d'une ou plusieurs espèces de cyanobactéries était associée à une concentration détectable de cyanotoxine[82]. Sachant que ces espèces sont caractérisées par des blooms planctoniques, sans mesures régulières et très rapprochées, on n'est jamais certain de mesurer les maxima. La rivière Bécancour, la rivière Yamaska et la baie Missisquoi qui servent de réservoir d'eau potable, en contenaient[83] à des taux « souvent supérieurs au seuil d’alerte proposé par Bartram et al. (1999) pour l’approvisionnement en eau potable, soit 2000 cellules/ml ». Les cyanotoxines n'étaient cependant que rarement détectées au robinet, ou à faibles valeurs[84] grâce à un bon traitement de l'eau ; les stations de potabilisation réussissant à éliminer les cyanobactéries sans faire éclater leurs cellules, c'est-à-dire sans libérer les cyanotoxines intracellulaires dans l'eau ou en les filtrant sur le charbon de bois activé.
Au Québec, près de la moitié des prélèvements d'eau potable proviennent d'eaux de surface (lacs, fleuves et rivières) sensibles aux pollutions, par les cyanobactéries notamment. En 2007, 160 lacs ont été touchés et 7 fermés totalement. Le gouvernement québécois a élaboré un plan d'envergure pour diminuer la pollution des eaux : marais filtrants, dragage des sédiments et plantes captant les phosphates sont à l'essai. D'autres expériences tentent d'éliminer les « fleurs d'eau » (cyanobactéries). En été 2009, seront ainsi testés des ultrasons dont la longueur d'onde devrait être fatale uniquement aux cyanobactéries.
En aquarium
En aquariophilie, un surdéveloppement de certaines cyanobactéries « filamenteuses » et/ou « encroûtantes » signale un problème de qualité de l'eau ; elles apparaissent souvent après un manque d'entretien ou un déséquilibre en nutriments (les matières organiques en décomposition favorisent leur développement). Leur résistance et leur mode de reproduction les rendent difficiles à éliminer par les moyens de nettoyage habituels de l'aquariophile et quelques fragments suffisent à reformer un épais biofilm.
Or leur présence est indésirable en aquarium car d'une part elles peuvent y former un tapis étouffant les plantes, empêchant leur activité chlorophyllienne normale puis les tuant (leur mort contribuant à polluer l'eau) ; d'autre part le sable recouvert par un tapis d'algues n'est plus drainé et oxygéné, devenant impropre à toute vie microbienne aérobie. Certaines espèces peuvent sécréter des cyanotoxines ; enfin, les cyanobactéries fixant l'azote, elles concurrencent les « bonnes bactéries » de l'aquarium (Nitrobacter et Nitrosomonas), ce qui déséquilibre à long terme l'écosystème en place.
Solutions : Agir sur un des facteurs n'apporte souvent aucun résultat. Les nitrates, même peu présents, peuvent être compensés par la fixation de l'azote. Il est recommandé de nettoyer l'aquarium et son filtre avant des changements d'eau importants, en veillant à un éclairage approprié, et en évitant temporairement l'apport de CO2. Une période d'une semaine dans le noir total, combiné à un bon nettoyage du bac et à une oxygénation de l'aquarium pourrait parfois suffire à les éradiquer. En derniers recours, des antibiotiques (érythromycine à raison de 200 mg pour 100 litres) sont efficaces, mais tueront aussi les bonnes bactéries (déséquilibre écologique), en risquant de créer des souches résistantes. Les poissons peuvent être transférés dans un autre aquarium le temps du traitement pour notamment leur éviter un pic d'ammoniac ou de nitrites, avant de filtrer sur charbon actif puis ré-ensemencer l'aquarium en bonnes bactéries, une fois le traitement terminé.
Dans le cas d'un aquarium récifal, sa prolifération provoquera une nécrose des coraux. Il faudra comprendre la cause du déséquilibre afin de limiter sa propagation. En journée des longueurs d’ondes comprises entre 560 à 620 nanomètres et entre 665 et 680 nanomètres favorisera son développement. Réduire la durée d'éclairage et modifier les longueurs d'ondes réduiront ainsi son développement.

Dans les réservoirs d'irrigation et d'eau potable…
L'eau de réservoirs alimentés par des fleuves ou de l'eau pluviale peut être contaminée par des cyanobactéries toxiques. C'est de plus en plus fréquent depuis les années 1970. On y trouvera par exemple (hémisphère nord) :
- Anabaena flosaquae ;
- Anabaena planctonica ;
- Anabaena solitaria ;
- Anabaena spiroides ;
- Anabaena sp. ;
- Aphanizomenon flosaquae ;
- Coelosphaerium kuetzingianum ;
- Coelosphaerium naegilianum ;
- Gomphosphaeria aponica ;
- Gomphosphaeria lacustris ;
- Microcystis flosaquae ;
- Microcystis sp. ;
- Oscillatoria aghardii ;
- Planktothrix rubescens.
.
Cyanobactéries et sécurité sanitaire
Risques sanitaires

Il est recommandé de ne pas irriguer de cultures, ni abreuver des animaux avec une eau touchée par une efflorescence de cyanophycées[9] et de signaler toute mauvaise odeur émise par une eau destinée à la potabilisation. Souvent, la première alerte est donnée après qu'un chien est tombé malade ou est mort après avoir nagé ou bu dans de l'eau touchée par une efflorescence de Microcystis aeruginosa, Anabaena circinalis, Anabaena flos-aquae, Aphanizomenon flos-aquae, Cylindrospermopsis raciborskii (espèces les plus souvent en cause aux États-Unis)[9]…
Les enfants sont plus à risque que les adultes victimes de ces toxines, car plus légers et en absorbant proportionnellement plus que les adultes[9].
Les coquillages filtreurs ou certains poissons peuvent concentrer ces toxines et être sources d'intoxications alimentaires, éventuellement mortelles (ex. : Ciguaterra)[85].
Causes de la pullulation
Au niveau de l'eau, les causes suspectées sont une teneur trop élevée en matière organique, en nitrates et/ou phosphates. Dans un aquarium, l'éclairage peut être en cause (trop, pas assez ou source inappropriée). Le temps d'éclairage devrait être compris entre 10 et 12 heures par jour. Des contaminations externes par introduction d'algues peuvent être en cause. Par précaution, sur les sites extérieurs contaminés, les activités nautiques autres que baignade ou plongée sont parfois autorisées à condition qu'un lavage/rinçage soigneux du matériel suive l'activité, pour ne pas contaminer d'autres sites.
Pistes de recherches
Elle porte ou pourrait porter sur une meilleure surveillance environnementale (réseaux de bouées de mesures automatiques en temps réel), sur l'identification des espèces et de leurs caractéristiques génétiques (ce qui implique l'entretien de collections de souches de référence et la mise en place d'une normalisation et standardisation des protocoles et modes de dosages (comptage de cellules, colonies et/ou filaments avec identification des classes, genre et/ou espèce) et des dosages de toxines (microcystines, mais aussi toxines autres que la MC-LR et que les microsystines, dont la cylindrospermopsine et les saxitoxines), des modèles visant à prévoir les efflorescences et leur durée ainsi que les risques associés, une meilleure connaissance de l'écophysiologie des cyanobactéries et de la biosynthèse des toxines, de leur devenir dans l'environnement (filtreurs, poissons, sédiments…) et d'éventuels moyens de les inhiber (avec évaluation de l'efficacité des traitements à moyen et long terme). Les effets sur la santé d'une exposition longue à de faibles doses ne semblent pas avoir été étudiés.
Règlementation
Dans la plupart des pays, des normes existent avec des teneurs et seuils de tolérance limite pour les toxines.
En France, une circulaire[86] porte sur les eaux récréatives.
Un décret[87] porte sur les eaux de boisson et concerne les eaux destinées à la consommation humaine (hors eaux minérales naturelles) imposant de ne pas dépasser 1 μg/L de microcystine LR (soit la recommandation de l'OMS en 1998).
Toute prolifération phytoplanctonique impose une recherche de microcystine dans les eaux brutes. L'AFSSA/AFSSE ont produit des avis sur les risques induits par les cyanobactéries.
Galerie
_Rivulariees%252C_Calothrix_confervicola_Ag.jpeg.webp) Calothrix confervicola (Rivulariaceae).
Calothrix confervicola (Rivulariaceae). Scytonema crispum (Scytonemataceae).
Scytonema crispum (Scytonemataceae). Stigonema sp. (Stigonemataceae).
Stigonema sp. (Stigonemataceae).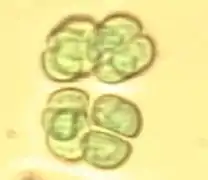 Chroococcus limneticus (Chroococcaceae).
Chroococcus limneticus (Chroococcaceae).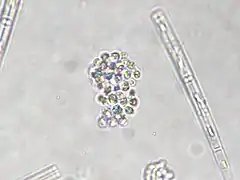 Gonphosphaeria sp. (Gomphosphaeriaceae).
Gonphosphaeria sp. (Gomphosphaeriaceae). Hyella caespitosa (Hydrococcaceae).
Hyella caespitosa (Hydrococcaceae).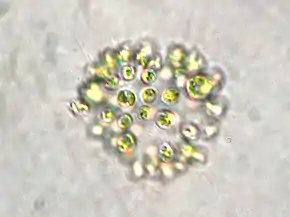 Microcystis aeruginosa (Microcystaceae).
Microcystis aeruginosa (Microcystaceae).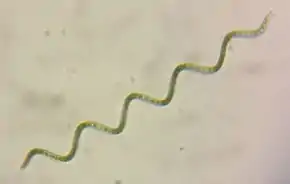
 Spirulina sp. au microscope (Pseudanabaenaceae).
Spirulina sp. au microscope (Pseudanabaenaceae). Merismopedia sp. (Merismopediaceae).
Merismopedia sp. (Merismopediaceae).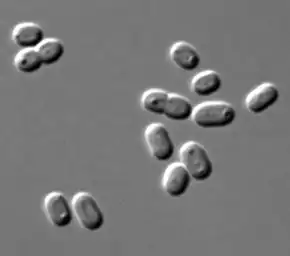 Synechococcus sp. (Synechococcaceae).
Synechococcus sp. (Synechococcaceae).
Source
- Les Fleurs d'eau de cyanobactéries, revue de littérature (Laurion et al. 2007)
Notes et références
Notes
- S'il s'agissait de dépôts atmosphériques dus à la pollution, leur localisation serait plus continue et ces dépôts seraient partiellement lessivés par les eaux de ruissellement.
- Lothar Geitler (1899–1990) était un botaniste autrichien, spécialiste des diatomées et des algues. Le genre Geitlerinema (de) est nommé en son honneur.
- Syndrome dit « Syndrome de Guam » ou AL-SPDC pour Amyotrophic lateral sclerosis/parkinsonism-dementia complex, aussi dit « Syndrome de Guam »
Références
- World Health Organisation (WHO), Toxic cyanobacteria in Water : A guide to their public health consequences, monitoring and management, 1re edition, 1999.
- Claude Payri, « Les algues en Polynésie Française », sur com.univ-mrs.fr.
- (en) Nicola Davis, « Oldest fossils on Earth discovered in 3.7bn-year-old Greenland rocks », sur The Guardian, (consulté le ).
- (en) Allen P. Nutman, Vickie C. Bennett, Clark R. L. Friend, Martin J. Van Kranendonk et Allan R. Chivas, « Rapid emergence of life shown by discovery of 3,700-million-year-old microbial structures », Nature, vol. 537, no 7621, , p. 535-538 (DOI 10.1038/nature19355).
- William F. Martin et al., 2016, Physiology, phylogeny, and LUCA
- Martine Valo « Après les algues vertes, "les algues bleues : un problème d'environnement majeur" », Le Monde, du .
- (en) Centers for Disease Control and Prevention, « Facts about cyanobacteria and cyanobacterial harmful algal blooms », sur ncf-net.org.
- C. Svrcek, D. W. Smith, Cyanobacteria toxins and the current state of knowledge on water treatment options: a review, J. Environ. Eng. Sci. 3 : 155-184, 2004.
- NCF (2009), Facts about cyanobacteria and cyanobacterial harmful algal blooms by the Centers for Disease Control and Prevention (CDC) (From www.cdc.gov/hab/cyanobacteria/facts.htm)
- (en) Donald A. Bryant, « Phycoerythrocyanin and Phycoerythrin: Properties and Occurrence in Cyanobacteria », Journal of Genral Microbiology, vol. 128, no 4, , p. 835-844 (DOI 10.1099/00221287-128-4-835)
- (en) Samsonoff, W. A. and R. MacColl (2001). "Biliproteins and phycobilisomes from cyanobacteria and red algae at the extremes of habitat." Arch Microbiol 176(6): 400-405
- Tandeau de Marsac, N. (1983). "Phycobilisomes and complementary chromatic adaptation in cyanobacteria". Bull de L'Inst Pasteur 81: 201-254.
- (en) D. Kirilovsky, C.A. Kerfeld The orange carotenoid protein: a blue-green light photoactive protein Photochem. Photobiol. Sci., 12 (2013), pp. 1135-1143.
- Projet Référentiel Plancton en baie de Calvi : II. Diversité de l'écosystème planctonique de la Baie de Calvi., mai 2007, consulté le 2010/11/01 (voir p. 8/27).
- Bjørn Solheim and Matthias Zielke (2003), Associations Between Cyanobacteria and Mosses ; Cyanobacteria in Symbiosis, Pages 137-152 (1re page de l'article (en anglais))
- René Pérez, Ces algues qui nous entourent, Editions Quae, (lire en ligne), p. 21
- (en) « Classification of Cyanobacteria », sur www.bacterio.net, (consulté le )
- (en) « Taxonomy of the phylum Cyanobacteria Woese et al. 1985 emend. McNeill et al. 2006 non Cyanobact », sur www.namesforlife.com (consulté le )
- (en) « Classification of domains and phyla - Hierarchical classification of prokaryotes (bacteria) », sur www.bacterio.net, (consulté le )
- (en) « Taxonomy browser (Cyanobacteria) », sur www.ncbi.nlm.nih.gov (consulté le )
- (en) « Cyanobacteria », sur www.uniprot.org (consulté le )
- (en) « ITIS Standard Report Page: Cyanobacteria », sur www.itis.gov (consulté le )
- (en) « International Code of Nomenclature of Prokaryotes | Microbiology Society », sur www.microbiologyresearch.org, (consulté le )
- (en) « Publications », sur www.the-icsp.org (consulté le )
- (en) Sara C Di Rienzi, Itai Sharon, Kelly C. Wrighton, Omry Koren et al., « The human gut and groundwater harbor non-photosynthetic bacteria belonging to a new candidate phylum sibling to Cyanobacteria », eLife, (DOI 10.7554/eLife.01102).
- (en) Robert E. Blankenship, « How Cyanobacteria went green », Science, vol. 355, no 6332, , p. 1372-1373 (DOI 10.1126/science.aam9365).
- (en) Rochelle M. Soo, James Hemp, Donovan H. Parks, Woodward W. Fischer et Philip Hugenholtz, « On the origins of oxygenic photosynthesis and aerobic respiration in Cyanobacteria », Science, vol. 355, no 6332, , p. 1436-1440 (DOI 10.1126/science.aal3794).
- Guiry, M.D. & Guiry, G.M. AlgaeBase. World-wide electronic publication, National University of Ireland, Galway. https://www.algaebase.org, consulté le 21 août 2022
- World Register of Marine Species, consulté le 12 septembre 2017
- Martin Tiano, « Comment les cyanobactéries ont commencé à respirer », Pour la science, no 476, , p. 14.
- Jean-Henri Hecq et Anne Goffart ; Jean-François Humbert, INRA, journée scientifique sur les cyanobactéries du 6/6/2005
- Antonio Quesada, Warwick F. Vincent, David R. S. Lean, Community and pigment structure of Arctic cyanobacterial assemblages: the occurrence and distribution of UV-absorbing compounds ; FEMS Microbiology Ecology, volume 28, numéro 4, avril 1999, pages 315-323 (résumé)
- (en) S.A. Kulasooriya, « Cyanobacteria : Pioneers of Planet Earth », Ceylon Journal of Science, vol. 40, no 2, , p. 71-88
- Agence française de sécurité sanitaire de l’environnement et du travail (AFSSET), Évaluation des risques liés à la présence de cyanobactéries et de leurs toxines dans les eaux destinées à l’alimentation, à la baignade l’eau de baignade et aux autres activités récréatives, juillet 2006.
- Ministère de la santé et des services sociaux et Santé Canada, Risque à la santé publique découlant de la présence de cyanobactéries et de microcystines dans trois bassins versants du Sud-ouest québécois tributaire du fleuve Saint-Laurent, décembre 2001.
- (en) Aharon Oren, Nina Gunde-Cimerman, « Mycosporines and mycosporine-like amino acids: UV protectants or multipurpose secondary metabolites? », FEMS Microbiology Letters, vol. 269, no 1, , p. 1–10 (DOI 10.1111/j.1574-6968.2007.00650.x)
- R. W. Castenholz ; 1982 ; The biology of cyanobacteria voir Chapitre : Motility and taxes pages 413 à 439 ; Editeur : N. G. Carr & B. A. Whitton|publisher=University of California Press, Berkeley et Los Angeles ; (ISBN 0-520-04717-6)
- Vidéo présentant une cyanobactérie en filament, en mouvement devant un brin d'algue (Algae magni), dans un échantillon d'eau de marais salant (Heron's Head Park)
- J. B. Waterbury, J. M. Willey, D. G. Franks, F. W. Valois & S. W. Watson; 1985 ; A cyanobacterium capable of swimming motility ; Science ; volume 30, pages 74–76 ; doi:10.1126/science.230.4721.74 (Résumé )
- Bradley WG, Mash DC., Beyond Guam: the cyanobacteria/BMAA hypothesis of the cause of ALS and other neurodegenerative diseases. ; Amyotroph Lateral Scler. 2009; 10 Suppl 2:7-20. (résumé)
- « OMS | Maladies liées à l'eau », sur WHO (consulté le )
- Synthèse de la journée scientifique sur les cyanobactéries du 6/6/2005, consulté 2009 02 01
- Karamyan VT, Speth RC., Animal models of BMAA neurotoxicity: a critical review ; Life Sci. 2008 Jan 30;82(5-6):233-46. Epub 2007 Dec 7. (résumé)
- Gramling C (2017) Did tiny algae fell mighty dinosaurs? Science Paléontologiedoi: 10.1126 / science.aap8161|29 aout 2017
- Papapetropoulos S, Is there a role for naturally occurring cyanobacterial toxins in neurodegeneration? The beta-N-methylamino-L-alanine (BMAA) paradigm; Neurochem Int. 2007 Jun;50(7-8):998-1003. Epub 2007 Jan 14. (Résumé)
- Photos de l'arbre, des nodules, des fruits mangés par une roussette
- Cox PA, Banack SA, Murch SJ., Biomagnification of cyanobacterial neurotoxins and neurodegenerative disease among the Chamorro people of Guam. Proc Natl Acad Sci U S A. 2003 Nov 11; 100(23):13380-3. (Résumé)
- Banack SA, Cox PA., Biomagnification of cycad neurotoxins in flying foxes: implications for ALS-PDC in Guam, Neurology. 2003 Aug 12;61(3):387-9 (résumé)
- Banack SA, Caller TA, Stommel EW., The cyanobacteria derived toxin Beta-N-methylamino-L-alanine and amyotrophic lateral sclerosis ; Toxins (Basel). 2010 Dec;2(12):2837-50. Epub 2010 Dec 20 (Résumé)
- Salama M, Arias-Carrión O., Natural toxins implicated in the development of Parkinson's disease; Ther Adv Neurol Disord. 2011 Nov; 4(6):361-73.
- Ince PG, Codd GA., Return of the cycad hypothesis - does the amyotrophic lateral sclerosis/parkinsonism dementia complex (ALS/PDC) of Guam have new implications for global health ? Neuropathol Appl Neurobiol. 2005 Aug; 31(4):345-53 ([Résumé])
- Commission européenne (2015) Link found between ‘algal blooms’ and liver disease, d'après Zhang, F., Lee, J., Liang, S. and Shum, C. (2015). Cyanobacteria blooms and non-alcoholic liver disease: evidence from a county level ecological study in the United States. Environmental Health 14(1). DOI: 10.1186/s12940-015-0026-7 ; "Science for Environment Policy": European Commission DG Environment News Alert Service, edited by SCU, The University of the West of England, Bristol.
- ‘Mad bird’ disease threatens endangered Florida fowl ; SciencMag, 19 mai 2016
- Prasanna, R., Kumar, V., Kumar, S., Yadav, A. K., Tripathi, U., Singh, A. K., … & Sethunathan, N. (2002) Methane production in rice soil is inhibited by cyanobacteria. Microbiological research, 157(1), 1-6.
- Karl D.M. et al. (2008) Aerobic production of methane in the sea. Nat. Geosci. 1, 473–478
- Damm E et al. (2010) Methane production in aerobic oligotrophic surface water in the central Arctic Ocean. Biogeosciences 7, 1099–1108.
- Grossart, H.-P., Frindte, K., Dziallas, C., Eckert, W. & Tang, K. W. (2011) Microbial methane production in oxygenated water column of an oligotrophic lake. Proc. Natl Acad. Sci. USA 108, 19657–19661.
- Tang, K. W., McGinnis, D. F., Frindte, K., Brüchert, V. & Grossart, H.-P. (2014) Paradox reconsidered: methane oversaturation in well-oxygenated lake waters. Limnol. Oceanogr. 59, 275–284
- Scranton, M. I. & Brewer, P. G. Occurrence of methane in the near-surface waters of the western subtropical North-Atlantic. Deep Sea Res. 24, 127–138 (1977).
- Delyth Purchase (2019) Study shows lake methane emissions should prompt rethink on climate change ; 4 décembre ; Swansea University
- Günthel, M., Donis, D., Kirillin, G., Ionescu, D., Bizic, M., McGinnis, D. F., … & Tang, K. W. (2019) Contribution of oxic methane production to surface methane emission in lakes and its global importance. Nature communications, 10(1), 1-10. URL= https://www.nature.com/articles/s41467-019-13320-0 (CC-BY-SA 4.0)
- Yao, M., Henny, C. & Maresca, J. A. (2016) Freshwater bacteria release methane as a by-product of phosphorus acquisition. Appl. Environ. Microbiol. 82, 6994–7003.
- Wang, Q., Dore, J. E. & McDermott, T. R. (2017) Methylphosphonate metabolism by Pseudomonas sp. populations contributes to the methane oversaturation paradox in an oxic freshwater lake. Environ. Microbiol. 19, 2366–2378.
- Bizic-Ionescu, M., Ionescu D., Günthel, M., Tang, K. W. & Grossart H.-P. Oxic Methane Cycling: New Evidence for Methane Formation in Oxic Lake Water. in Biogenesis of Hydrocarbons (eds. Stams, A. & Sousa, D.) 379–400 (Springer, Cham, 2018).
- Carini, P., White, A. E., Campbell, E. O. & Giovannoni, S. J. (2014) Methane production by phosphate-starved SAR11 chemoheterotrophic marine bacteria. Nat. Commun. 5, 4346
- Bižić, M., Klintzsch, T., Ionescu, D., Hindiyeh, M. Y., Guenthel, M., Muro-Pastor, A. M., … & Grossart, H. P. (2019) Cyanobacteria, the most ancient and abundant photoautotrophs on Earth produce the greenhouse gas methane during photosynthesis. bioRxiv, 398958.|URL= https://www.biorxiv.org/content/biorxiv/early/2019/06/21/398958.full.pdf
- Fernandez, J. E., Peeters, F. & Hofmann, H. (2016) On the methane paradox: transport from shallow water zones rather than in situ methanogenesis is the major source of CH4 in the open surface water of lakes. J. Geophys. Res. Biogeosci. 121, 2717–2726.
- Peeters, F., Fernandez, J. E. & Hofmann, H. (2019) Sediment fluxes rather than oxic methanogenesis explain diffusive CH4 emissions from lakes and reservoirs. Sci. Rep. 9, 243.
- Bob Yirka (2010) et al. REPORT : Blue-green algae found to produce greenhouse gas methane, Phys.org, 16 janvier
- Hartmann, J. F., Gunthel, M., Klintzsch, T., Kirillin, G., Grossart, H. P., Keppler, F., & Isenbeck-Schröter, M. (2020) High Spatio-Temporal Dynamics of Methane Production and Emission in Oxic Surface Water. Environmental Science & Technology. Résumé : https://pubs.acs.org/doi/abs/10.1021/acs.est.9b03182
- Tang, K. W., McGinnis, D. F., Ionescu, D. & Grossart, H-P(2016) Methane production in oxic lake waters potentially increases aquatic methane flux to air. Environ. Sci. Technol. Lett. 3, 227–233.
- Stal L.J & Moezelaar R (1997) Fermentation in Cyanobacteria. FEMS Microbiol. Rev. 21, 179– 211.
- Donis D et al. (2017) Full-scale evaluation of methane production under oxic conditions in a mesotrophic lake. Nat. Commun. 8, 1661.
- Bogard, M. J. et al. (2014) Oxic water column methanogenesis as a major component of aquatic CH4 fluxes. Nat. Commun. 5, 5350
- Donis, D. et al. Full-scale evaluation of methane production under oxic conditions in a mesotrophic lake. Nat. Commun. 8, 1661 (2017).
- Sabrekov A.F & al. (2017) Variability in methane emission from West Sibiria’s shallow boreal lakes on a regional scale and its environmental controls. Biogeosciences 14, 3715–3742
- Natchimuthu S & al. (2016) Spatio-temporal variability of lake CH4 fluxes and its influence on annual whole lake emission estimates. Limnol. Oceanogr. 61, S13–S26
- Xiao Q & al. (2017) Spatial variation of methane emission in a large shallow eutrophic lake in subtropical climate. J. Geophys. Res. Biogeosci. 122, 1597–1614.
- Wik, M., Thornton, B. F., Bastviken, D., Uhlbäck, J. & Crill P.M (2016) Biased sampling of methane release from northern lakes: a problem for extrapolation. Geophys. Res. Lett. 43, 1256–1262
- Nisbet E.G & al. (2019) Very strong atmospheric methane growth in the 4 years 2014‐2017: implications for the Paris Agreement. Glob. Biogeochem. Cycles 33, 318–342 URL= https://agupubs.onlinelibrary.wiley.com/doi/pdf/10.1029/2018GB006009
- F. Garcia-Pichel, J. Belnap, S. Neuer, F. Schanz (2003) Estimates of global cyanobacterial biomass and its distribution. Arch. Hydrobiol. Suppl. Algol. Stud. 109, 213–227 , cités par 2019>Bižić & al (2019)
- Source, page 37
- aux prises d’eau des stations, c'est-à-dire dans le bas de la colonne d’eau.
- 30 à 50 fois moins que le maximum acceptable de 1,5 μg/l pour Santé Canada (2002) pour la microcystine-LR.
- CDC, Harmful Algal Blooms (HABs), page mise à jour 2012-07-24, consultée 2012-10-08
- Circulaire DGS/SD7a/n°2002/335 du 07/06/02.
- Décret n° 2001-1220 du 20 décembre 2001.
Voir aussi
Bibliographie
- (en) Jef Huisman, Hans C.P. Matthijs, Petra M. Visser, Harmful Cyanobacteria, Springer (résumé, plan)
- (en) Nathan Back et al. (2008), Cyanobacterial Harmful Algal Blooms ; Advances in experimental medicine and biology ; H. Kenneth Hudnell Editor ; PDF, 24 p. ; DOI:10.1007/ 978-0-387-75865-7, sur le site de l'EPA
- (en) Paul V.J. (2008), Global warming and cyanobacterial harmful algal blooms. In: Hudnell H.K. (eds) Cyanobacterial Harmful Algal Blooms: State of the Science and Research Needs. Advances in Experimental Medicine and Biology, vol 619, 950 p . Springer, New York, NY.
- (en) Paerl H et al. (2011), Controlling harmful cyanobacterial bloom in a world experiencing anthropogenic and climatic-induced change. Science of the total environment. 409: 1739-1745
- (en) Huismen J et al. (2005),Population dynamics of harmful cynobactéria: Factors affecting species composition,p.143-176, dans J.Huisman,H.C.P.Matthijs et P.M.Visser (eds.).Harmful cyanobacteria,Aquatic ecology series,vol.3,Springer,Dordrecht.
Filmographie
- (fr) Documentaire traitant des problèmes qui touchent les lacs du Québec, dont les cyanobactéries, et de solutions (site officiel du documentaire québécois)
Articles connexes
Liens externes
- « Des micro-algues au pétrole bleu », ParisTech Review, décembre 2011
- (fr) Rapport sur l’évaluation des risques liés à la présence de cyanobactéries et de leurs toxines dans les eaux destinées à l’alimentation, à la baignade et autres activités récréatives (Afssa et Afsset, juillet 2006)
- Étude des cyanobactéries Synechococcus et Prochlorococcus : Groupe Plancton, Station Biologique de Roscoff (en anglais, mais contient aussi des informations en français)
- "La cyanobactérie dans un aquarium récifal": article sur les méthodes naturelles pour lutter contre les cyanobacteries à destination des aquariophiles.
- (en) Current approaches to cyanotoxin risk assessment, risk management and regulations in different countries
Références taxinomiques
- (en) Référence World Register of Marine Species : taxon Cyanobacteria Stanier ex Cavalier-Smith, 2002 (+ liste classes + liste ordres)
- (fr+en) Référence ITIS : Cyanobacteria Cavalier-Smith, 2002
- (en) Référence uBio : Cyanobacteria (ex Stanier 1974) Cavalier-Smith 2002
- (en) Référence Paleobiology Database : Cyanobacteria
- (en) Référence Tree of Life Web Project : Cyanobacteria
- (en) Référence Catalogue of Life : Cyanobacteria Cavalier-Smith, 2002 (consulté le )
- (en) Référence NCBI : Cyanobacteria (taxons inclus)
- Portail de la microbiologie
- Portail de la botanique
- Portail de l’aquariophilie
- Portail origine et évolution du vivant
- Portail de la phycologie
- Portail de la biologie marine