Nicotinamide adénine dinucléotide
Le nicotinamide adénine dinucléotide (NAD) est une coenzyme présente dans toutes les cellules vivantes. Il s'agit d'un dinucléotide, dans la mesure où la molécule est constituée d'un premier nucléotide, dont la base nucléique est l'adénine, uni à un second nucléotide, dont la base est le nicotinamide. Le NAD existe sous une forme oxydée, notée NAD+, et une forme réduite, notée NADH.
Pour les articles homonymes, voir NAD.
| Nicotinamide adénine dinucléotide | |
 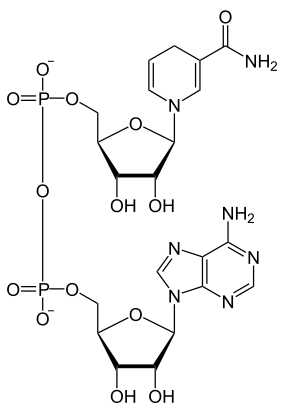 Structure du NAD+ (à gauche) et du NADH (à droite) |
|
| Identification | |
|---|---|
| Nom UICPA | adénosine 5’-{3-[1-(3-carbamoylpyridinio)-1,4-anhydro-D-ribitol-5-yl] dihydrogen diphosphate} |
| Synonymes |
NAD+, coenzyme I, DPN+ |
| No CAS | |
| No ECHA | 100.000.169 |
| No CE | 200-184-4 |
| No RTECS | UU3450000 |
| DrugBank | DB01907 |
| PubChem | 5892 |
| ChEBI | 15846 |
| SMILES | |
| InChI | |
| Apparence | solide |
| Propriétés chimiques | |
| Formule | C21H27N7O14P2 [Isomères] |
| Masse molaire[1] | 663,425 1 ± 0,024 3 g/mol C 38,02 %, H 4,1 %, N 14,78 %, O 33,76 %, P 9,34 %, |
| Écotoxicologie | |
| DL50 | 4 333 mg kg−1 (souris, i.p.)[2] |
| Unités du SI et CNTP, sauf indication contraire. | |
Le NAD intervient dans le métabolisme comme transporteur d'électrons dans les réactions d'oxydoréduction, le NAD+ comme oxydant et le NADH comme réducteur. Le NAD intervient également dans quelques autres processus cellulaires, notamment certaines modifications post-traductionnelles — ADP-ribosylation — des protéines nouvellement synthétisées. En raison de l'importance de ces fonctions cellulaires, les enzymes impliquées dans le métabolisme du NAD font l'objet de diverses recherches pharmaceutiques.
Le NAD peut être synthétisé in vivo à partir du tryptophane et de l'aspartate, deux acides aminés protéinogènes, ainsi que de la vitamine B3 (niacine). Des composés semblables sont libérés par des réactions qui dégradent la structure du NAD, mais ces composés sont généralement récupérés par des voies dites de sauvetage, qui les recyclent sous leur forme active. Une fraction du NAD est également convertie en nicotinamide adénine dinucléotide phosphate (NADP), une coenzyme dont la biochimie est très proche de celle du NAD mais dont le rôle métabolique est sensiblement différent.
Le signe + de la graphie NAD+ représente la charge électrique formelle de l'hétéroatome d'azote du nicotinamide, qui disparait dans le NADH, mais le NAD+ est en réalité un anion de charge -1 à pH physiologique, tandis que le NADH est un dianion, de charge -2.
Propriétés
Chimie

Comme tous les dinucléotides, le nicotinamide adénine dinucléotide est constitué de deux nucléosides unis par un groupe diphosphate. Chacun de nucléosides contient un résidu de ribose, l'un étant lié à un résidu d'adénine sur l'atome de carbone en position 1’, tandis que l'autre est lié, sur la position équivalente de l'autre nucléotide, à un résidu de nicotinamide. Ce dernier peut prendre deux orientations différentes, ce qui donne deux diastéréoisomères ; seul le diastéréoisomère à nicotinamide β est présent dans les systèmes biologiques. Les deux nucléotides sont unis par un pont diphosphate entre leurs atomes de carbone en position 5’[3].
Le NAD intervient dans les réactions d'oxydoréduction comme accepteur d'électrons (NAD+, oxydant) ou donneur d'électrons (NADH, réducteur)[4] :
- RH2 + NAD+ NADH + H+ + R.
Deux électrons sont transférés au NAD+, mais avec un seul proton, de sorte que l'autre proton est libéré sous forme d'ion H+. Plus précisément, un électron est transféré à l'hétéroatome d'azote du cycle pyridine, dont la charge électrique passe de +1 à 0, tandis qu'un atome d'hydrogène est transféré sur l'atome de carbone en position 4, à l'opposé de l'atome d'azote dans le cycle pyridine. Le potentiel standard du couple rédox NAD+/NADH vaut –0,32 V, ce qui en fait un réducteur fort[5]. Cette réaction est aisément réversible, de sorte que le coenzyme peut continuellement osciller entre les états oxydé et réduit au gré des oxydations et réductions auxquelles elle participe, sans être dégradée[3].
Physique

Le nicotinamide adénine dinucléotide oxydé et réduit se présente sous la forme de poudres blanches à grains amorphes, hygroscopique et très soluble dans l'eau. Il est stable sous forme solide s'il est conservé à sec à l'abri de la lumière. Les solutions de NAD+ sont incolores et demeurent stables pendant à peu près une semaine à 4 °C et pH neutre, mais se décomposent rapidement à pH acide ou basique ; en se décomposant, il forme des composés qui agissent comme inhibiteurs d'enzymes dont ils sont coenzymes[6].
Le NAD+ et le NADH sont tous les deux très absorbants dans l'ultraviolet du fait de la présence d'adénine dans la molécule. Le pic d'absorption du NAD+ s'observe à une longueur d'onde de 259 nm, avec une absorptivité molaire de 16 900 M−1·cm−1. Le NADH absorbe l'ultraviolet à plus grande longueur d'onde, avec un second pic d'absorption à 339 nm pour une absorptivité de 6 220 M−1·cm−1. Cette différence entre les spectres d'absorption du NAD+ et du NADH offre un moyen simple de mesurer la conversion de l'un en l'autre lors des dosages enzymatiques (en) en mesurant l'absorption à 340 nm à l'aide d'un spectrophotomètre.
Le NAD+ et le NADH diffèrent également du point de vue de leur fluorescence : le NADH en solution présente un pic d'émission à 460 nm avec une durée de vie à l'état excité de 0,4 ns tandis que le NAD+ ne présente pas de fluorescence[7]. Les caractéristiques du signal de fluorescence varient lorsque le NADH se lie aux protéines, de sorte que ces variations peuvent être mises à profit pour mesurer les constantes de dissociation, déterminantes dans l'étude de la cinétique enzymatique[7],[8]. Ces variations sont également étudiées par microscopie à fluorescence afin de mesurer les changements d'état rédox des cellules vivantes[9].
Concentration cellulaire des formes oxydée et réduite du NAD — et du NADP
La quantité totale de NAD+ et de NADH dans le foie de souris est d'environ 1 µmol·g-1 de matière humide, ce qui représente environ dix fois la concentration en NADP+ et NADPH dans les mêmes cellules[10]. La concentration réelle de NAD+ dans le cytosol de ces cellules est plus difficile à mesurer, les estimations avoisinant 0,3 mmol·L-1 pour les cellules animales[11],[12] et 0,1 à 0,2 mmol/L chez la levure[13]. Cependant, plus de 80 % de la fluorescence du NADH des mitochondries provient de formes liées à des protéines, de sorte que la concentration des formes libres en solution est bien plus faible[14].
Les données relatives aux autres compartiments cellulaires sont limitées, cependant la concentration de NAD+ dans les mitochondries est semblable à celle du cytosol[12]. Le NAD+ y est importé par un transporteur membranaire spécifique car cette coenzyme ne peut diffuser à travers la bicouche lipidique des membranes[15].
L'équilibre entre les formes réduite et oxydée du NAD est appelé ratio [NAD+]/[NADH]. Ce ratio est indicateur important de l'état rédox de la cellule, qui reflète à la fois l'activité métabolique de la cellule et sa bonne santé[16]. Les effets du ratio [NAD+]/[NADH] sont complexes, dans la mesure où il contrôle l'activité de plusieurs enzymes clés, dont la glycéraldéhyde-3-phosphate déshydrogénase et la pyruvate déshydrogénase. Dans les tissus sains de mammifères, ce ratio entre espèces libres dans le cytoplasmes vaut typiquement 700, ce qui favorise les réactions d'oxydation[17],[18]. Le ratio de [NAD+]/[NADH] total est bien plus faible, les estimations chez les mammifères étant de l'ordre de 3 à 10[19]. À l'opposé, le ratio des espèces libres [NADP+]/[NADPH] est généralement de l'ordre 0,005, de sorte que c'est la forme réduite NADPH de cette coenzyme qui est largement prédominante[20]. Ces différences sont essentielles pour comprendre le rôle fondamentalement différent du NAD et NADP dans le métabolisme.
Biosynthèse
La biosynthèse du NAD+ est réalisée à travers deux voies métaboliques : par une voie de novo à partir de précurseurs élémentaires, ou par une voie de sauvetage à partir de produits de dégradation, tels que le nicotinamide.
Synthèse de novo

La plupart des êtres vivants produisent le NAD+ à partir de précurseurs élémentaires[4]. Le détail des réactions dépend des organismes, mais ils ont en commun de passer par l'acide quinoléique (QA) à partir d'un acide aminé, en l'occurrence le tryptophane (Trp) chez les animaux et certaines bactéries, ou l'aspartate (Asp) chez les plantes et d'autres bactéries[21],[22]. L'acide quinolinique est converti en acide nicotinique mononucléotide (NaMN) par transfert sur du phosphoribose, puis l'ensemble est transféré sur une unité adénylate pour former l'acide nicotinique adénine dinucléotide (NaAD), et le résidu d'acide nicotinique est finalement aminé en nicotinamide pour former le NAD.
Une partie du NAD+ peut ensuite être phosphorylé en NADP+ par la NAD+ kinase[23]. La plupart des êtres vivants utilisent l'ATP comme donneur de groupe phosphate, mais certaines bactéries telles Mycobacterium tuberculosis et certaines archées telles que l'hyperthermophile Pyrococcus horikoshii (en) utilisent le polyphosphate inorganique comme donneur de phosphoryle[24],[25].
Voies de sauvetage
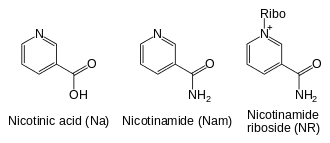
Outre l'assemblage de novo à partir de précurseurs tels que des acides aminés, les cellules disposent de voies métaboliques de sauvetage des composés à base de pyridine, telles que la voie de sauvetage des nucléotides. Les trois précurseurs vitaminiques utilisés par ces voies de sauvetage sont l'acide nicotinique (NA), le nicotinamide (Nam) et le N-ribosylnicotinamide (NR)[4]. Ces composés peuvent être obtenus dans l'alimentation et sont désignés collectivement vitamine B3 ou niacine ; ils peuvent également se former dans les cellules par dégradation du NAD+ cellulaire. Certaines des enzymes intervenant dans ces voies de sauvetage sont concentrées dans le noyau de la cellule, ce qui permet de compenser l'utilisation intensive de cette coenzyme dans cet organite[26]. Certaines publications font état de l'absorption directe par les cellules de mammifère du NAD+ de leur milieu extracellulaire[27].
Chez l'homme, les réactions de sauvetage sont essentielles bien que la voie de novo soit également présente. Une carence en vitamine B3 provoque la pellagre, une maladie survenant notamment en contexte de malnutrition[28]. Les besoins cellulaires élevés en NAD proviennent de la consommation continuelle de cette coenzyme au cours de réactions telles que les modifications post-traductionnelles, dans la mesure où son utilisation dans les réactions d'oxydoréduction n'altère pas sa concentration cellulaire[4].
Les voies de sauvetage utilisées chez les microorganismes sont différentes de celles des mammifères[29]. Certains pathogènes, tels que la levure Candida glabrata et la bactérie Haemophilus influenzae sont incapables de produire leur NAD mais possèdent des voies de sauvetage et sont par conséquent dépendantes de la disponibilité de ces précurseurs[30],[31]. La bactérie intracellulaire Chlamydia trachomatis est quant à elle totalement dépourvue de gène en rapport avec la biosynthèse ou le sauvetage du NAD et du NADP, ce qui fait qu'elle doit acquérir ces coenzymes de son hôte[32].
Fonctions biochimiques
Le nicotinamide adénine dinucléotide assure plusieurs fonctions biochimiques dans le métabolisme des cellules. Il intervient comme coenzyme dans les réactions d'oxydoréduction, comme donneur de groupes ADP-ribose dans les réactions d'ADP-ribosylation, comme précurseur du messager secondaire ADP-ribose cyclique, ainsi que comme substrat des ADN ligases bactériennes et des sirtuines, ces dernières utilisant le NAD+ pour la désacétylation des histones. De surcroît, le NAD+ peut être libéré des cellules spontanément et par des mécanismes régulés[33], ce qui lui confère également des fonctions extracellulaires[34].
Interaction avec les oxydoréductases

Le rôle principal du NAD+ est celui de transporteur d'électrons d'une molécule à une autre. Les réactions de ce type sont catalysées par un grand groupe d'enzymes appelées oxydoréductases. Lorsqu'il se lie à une protéine, le NAD+ et le NADH se glissent généralement dans un type de structure appelé pli Rossmann[36], du nom du scientifique qui, le premier, identifia la récurrence de ce motif structurel dans les protéines qui se lient à des nucléotides[37]. Ce motif contient au moins trois feuillets β parallèles reliés par deux hélices α qui alternent selon la séquence β–α–β–α–β. Cette structure conduit à un groupe de feuillets β flanqué par deux hélices α d'un même côté. Dans la mesure où chaque pli Rossmann se lie à un nucléotide, les domaines qui se lient au NAD+ contiennent deux plis Rossmann appariés[37]. Cette structure n'est cependant pas universelle pour toutes les enzymes à NAD, certaines bactéries possédant pas exemple des enzymes impliquées dans le métabolisme des acides aminés qui se lient au NAD+ mais sont dépourvus de pli Rossmann[38].
Lorsqu'il se lie au site actif d'une oxydoréductase, le cycle du nicotinamide est positionné de telle sorte qu'il peut accepter l'équivalent d'un anion hydrure H− de l'autre substrat. Selon l'enzyme considérée, le donneur d'hydrure se trouve devant ou derrière le plan du cycle du nicotinamide tel que représenté ci-dessous, ce qui définit deux classes d'oxydoréductases : celles de classe A transfèrent l'anion hydrure depuis l'avant du plan, tandis que celle de classe B le transfèrent depuis l'arrière du plan.
 (en) Les oxydoréductases de classe A transfèrent l'anion hydrure du substrat depuis l'avant du plan du cycle du nicotinamide, tandis que celle de classe B le transfèrent depuis l'arrière de ce plan.
(en) Les oxydoréductases de classe A transfèrent l'anion hydrure du substrat depuis l'avant du plan du cycle du nicotinamide, tandis que celle de classe B le transfèrent depuis l'arrière de ce plan.
L'atome C4 étant prochiral, cette propriété peut être mise à profit dans l'étude de la cinétique de l'enzyme afin d'obtenir des informations sur le mécanisme réactionnel de la catalyse qu'elle réalise : on procède en présentant à l'enzyme un substrat enrichi en deutérium afin de réduire le NAD+ avec du deutérium plutôt qu'avec de l'hydrogène, ce qui permet de déterminer lequel des deux stéréoisomères de NADH est produit[39].
Bien que les protéines se lient au NAD+ et au NADP+ de manière semblable, les enzymes présentent presque toujours une très grande sélectivité pour l'une ou l'autre de ces coenzymes[40]. Cette spécificité rend compte du rôle métabolique distinct de ces deux coenzymes et provient de jeux de résidus d'acides aminés différents entre les sites de liaison de ces deux types d'enzymes. Ainsi, une liaison ionique se forme dans le site actif des enzymes à NADP entre le groupe phosphate supplémentaire du NADP+ et un résidu d'acide aminé basique, tandis que les enzymes à NAD possèdent à cet endroit un résidu de charge électrique opposée, c'est-à-dire négative, ce qui réduit considérablement l'affinité de leur site pour le NADP+. Il existe cependant des exceptions à cette règle générale, et certaines enzymes telles que l'aldose réductase, la glucose-6-phosphate déshydrogénase et la 5,10-méthylènetétrahydrofolate réductase peuvent utiliser les deux coenzymes chez certaines espèces[41].
Fonctions dans la respiration cellulaire
Les réactions d'oxydoréduction catalysées par les oxydoréductases sont critiques à tous les niveaux du métabolisme, mais l'un des aspects particulièrement vitaux du couple rédox NAD+/NADH a trait à son rôle dans l'oxydation des nutriments dans le cadre de la respiration cellulaire. L'énergie métabolique est contenue dans les électrons à haut potentiel de transfert qui réduisent le NAD+ en NADH, par exemple lors de la dégradation des acides gras par β-oxydation et du glucose par glycolyse puis oxydation par le cycle de Krebs de l'acétyl-CoA produite au cours de ces voies métaboliques. Chez les eucaryotes, le NADH produit dans le cytoplasme est importé dans les mitochondries à l'aide de « navettes » mitochondriales, comme la navette malate-aspartate[42] ; il existe, chez les plantes, des navettes semblables également pour les chloroplastes[43]. Le NADH mitochondrial, quant à lui, est oxydé à travers la chaîne respiratoire jusqu'à transférer ses électrons à un accepteur final, qui est par exemple l'oxygène O2 chez les organismes aérobies : il se forme dans ce cas de l'eau H2O. L'énergie libérée par ces oxydations est récupérée sous forme d'un gradient électrochimique généré à travers la membrane mitochondriale interne par les pompes à protons de la chaîne respiratoire sous la forme d'un gradient de concentration de protons dont la dissipation permet à l'ATP synthase de phosphoryler l'ADP en ATP ; ce processus est appelé phosphorylation oxydative[44].
Étant donné que les formes oxydée et réduite du nicotinamide adénine dinucléotide interviennent dans cet ensemble de réactions, la cellule maintient une concentration significative en NAD+ et en NADH, avec un ratio [NAD+]/[NADH] >> 1 en accord avec le rôle essentiellement oxydant de cette coenzyme. A contrario, le NADP intervient essentiellement comme réducteur dans les biosynthèses, telles que la photosynthèse et la biosynthèse des acides gras, de sorte que le ratio [NADP+]/[NADPH] << 1.
Bien que le NAD soit une coenzyme essentiellement catabolique sous forme oxydée NAD+, il intervient également dans certaines voies anaboliques, telles que la néoglucogenèse[45]. Ce besoin en NADH pour l'anabolisme pose un problème aux procaryotes qui se nourrissent de nutriments qui ne libèrent que de petites quantités d'énergie. Par exemple, les bactéries nitrifiantes telles que Nitrobacter oxydent le nitrite NO2− en nitrate NO3−, ce qui libère suffisamment d'énergie pour pomper des protons et produire de l'ATP, mais pas assez pour produire du NADH directement[46]. Ces bactéries sont par conséquent contraintes d'utiliser une nitrite réductase pour produire le complément d'énergie nécessaire à la production de NADH en remontant partiellement la chaîne respiratoire à contre-sens[47].
Fonctions non rédox


Le nicotinamide adénine dinucléotide est également consommé lors de réactions de transfert d'unités ADP-ribose. En effet, les ADP-ribosyltransférases sont des enzymes qui assurent ce type de transfert à des protéines nouvellement synthétisées, dans le cadre de modifications post-traductionnelles appelées ADP-ribosylation[48]. L'ADP-ribosylation consiste aussi bien en un transfert d'un unique groupe ADP-ribosyle à une protéine, c'est-à-dire une mono(ADP-riobylation), ou en un transfert de nombreuses unités ADP-ribosyle en longues chaînes ramifiées, c'est-à-dire une poly(ADP-ribosylation)[49]. La mono(ADP-ribosylation) a été identifiée pour la première fois sur un groupe de toxines bactériennes, notamment la toxine cholérique, mais elle intervient également dans le cadre d'une signalisation cellulaire normale[50],[51]. La poly(ADP-ribosylation), quant-à-elle, est réalisée par des poly(ADP-ribose) polymérases[49],[52]. Les structures poly(ADP)-ribose interviennent dans la régulation de plusieurs processus cellulaires et sont particulièrement importantes dans le noyau par exemple dans la réparation de l'ADN et la maintenance des télomères[52]. Outre ces fonctions intracellulaires, il existe également des ADP-ribosyltransférases extracellulaires, dont le rôle demeure cependant encore obscur[53]. Le NAD+ peut également être ajouté à un ARN cellulaire comme modification de l'extrémité 5’[54].
Le NAD intervient également dans la signalisation cellulaire comme précurseur de l'ADP-ribose cyclique, produit à partir du NAD+ par des ADP-ribosyle cyclases (EC ) dans le cadre d'un mécanisme par messager secondaire[55]. Il agit en particulier sur le métabolisme du calcium en induisant la libération du calcium à partir de ses points de stockage intracellulaires[56] en se liant à une classe de canaux calciques appelée récepteurs de la ryanodine qui sont situés dans la membrane d'organites tels que le réticulum endoplasmique[57].
Le NAD+ est également consommé par des sirtuines, comme la Sir2[58], qui sont des histone désacétylases NAD-dépendantes. Ces enzymes agissent en transférant des groupes acétyle sur la partie ADP-ribose du NAD+ depuis leur protéine substrat, ce qui clive la coenzyme en libérant du nicotinamide et de l’O-acétyl-ADP-ribose. Les siruines semblent impliquées essentiellement dans la régulation de la transcription à travers la désacétylation des histones et la modification de la structure du nucléosome[59]. L'étude de l'activité de ces enzymes est particulièrement intéressante compte tenu de leur importance dans la régulation du vieillissement (sénescence)[60]. Les sirtuines sont également capables de désacétyler d'autres protéines que les histones.
Les ADN ligases bactériennes sont d'autres enzymes dépendantes du NAD. Elles utilisent en effet l'un des nucléotides constituant le NAD, en l'occurrence l'AMP, qu'elles transfèrent au phosphate de l'extrémité 5’ de l'un des brins d'ADN. Cet intermédiaire est ensuite attaqué par l'hydroxyle 3’ de l'autre brin d'ADN, ce qui donne une nouvelle liaison phosphodiester[61]. Ce mécanisme diffère de celui utilisé par les eucaryotes, chez lesquels c'est l'ATP qui est utilisé comme donneur d'unité AMP pour former l'intermédiaire ADN-AMP[62].
Fonctions extracellulaires
Le NAD intervient également comme molécule de signalisation cellulaire impliquée dans la communication intercellulaire[34],[63],[64]. Du NAD+ est libéré par des neurones dans les vaisseaux sanguins[33], la vessie[33],[65], le gros intestin[66],[67], de cellules neurosécrétrices[68] et dans le cerveau au niveau des synaptosomes (en)[69], et pourrait agir comme neurotransmetteur des nerfs vers des cellules effectrices des muscles lisses[66],[67]. Des recherches complémentaires sont encore nécessaires pour comprendre les mécanismes sous-jacents à ces fonctions extracellulaires du NAD et leur importance pour la santé et les maladies humaines.
Pharmacologie et utilisation médicale
Les enzymes qui produisent et qui utilisent le NAD+ et le NADH sont importantes à la fois en pharmacologie et du point de vue de la recherche de nouveaux traitements[70]. La conception de médicaments nouveaux et leur développement utilise le NAD de trois façons différentes : directement comme cible de médicaments, en concevant des inhibiteurs ou des activateurs agissant sur les enzymes qui utilisent le NAD, et enfin en inhibant la biosynthèse du NAD[71].
Le NAD lui-même n'est utilisé comme traitement d'aucune maladie, mais a cependant été étudié pour son application éventuelle dans le traitement de maladies neurodégénératives telles que la maladie d'Alzheimer et la maladie de Parkinson[4]. La preuve des bienfaits du NAD contre les maladies neurodégénératives est en discussion. Certaines études sur les souris ont donné des résultats prometteurs[72] et des essais cliniques chez l'homme ont montré un effet sur la maladie de Parkinson[73], sur la fatigue chronique[74], sur la dépression[75], sur la maladie d'Alzheimer[76] mais les résultats concernant la maladie de Parkinson sont discutés[77].
Le NAD est également la cible directe de l'isoniazide, un médicament utilisé dans le traitement de la tuberculose, infection à Mycobacterium tuberculosis. L'isoniazide est un promédicament activé par une peroxydase une fois dans la cellule bactérienne pour donner un radical libre[78]. C'est ce radical qui réagit avec le NADH, produisant des adduits qui agissent comme inhibiteurs très puissants de l'énoyl-ACP réductase[79] et de la dihydrofolate réductase[80]. Une expérience conduite dans le cadre de recherches contre les effets du vieillissement (sénescence) a montré que la communication intracellulaire entre le noyau et les mitochondrie s'est améliorée chez la souris après absorption d'un supplément de NAD pendant une semaine[81].
Il est possible de concevoir des inhibiteurs fondés sur le NAD qui sont spécifiques à une enzyme précise, et ce bien qu'un grand nombre d'oxydoréductases utilisent le NAD comme coenzymes et se lient à lui avec une structure tridimensionnelle hautement conservée[82]. C'est par exemple le cas des molécules à base d'acide mycophénolique et de tiazofurine, qui inhibent l'IMP déshydrogénase au niveau du site de liaison au NAD+ ; cette enzyme étant important pour le métabolisme des purines, ces composés peuvent être à la base de médicaments anticancéreux, antiviraux et immunosuppresseurs[82],[83]. D'autres médicaments agissent non pas comme inhibiteurs mais comme activateurs d'enzymes intervenant dans le métabolisme du NAD. Les sirtuines sont particulièrement intéressantes à cet égard compte tenu du fait que l'activation de ces enzymes de désacétylation accroît la durée de vie des organismes[84]. Des composés tels que le resvératrol accroissent l'activité de ces enzymes, ce qui laisse entrevoir la possibilité de les utiliser pour retarder les effets du vieillissement à la fois d'organismes modèles vertébrés[85] et invertébrés[86],[87]. La nicotinamidase, qui convertit le nicotinamide en acide nicotinique, fait également l'objet de recherches pharmaceutiques car cette enzyme, absente chez l'homme, est présente chez la levure et les bactéries[29].
En bactériologie, un supplément en NAD, appelé parfois facteur V, dans le milieu de culture peut être utilisé avec certaines bactéries fastidieuses.
Histoire
Le NAD+ a été découvert en 1906 par les biochimistes britanniques Arthur Harden et William John Young (en)[88]. Ils observèrent le fait qu'ajouter des extraits de levure bouillis et filtrés à des extraits de levure non bouillis accélérait significativement leur vitesse de fermentation. Ils appelèrent coferment la substance inconnue à l'origine de ce phénomène. À la suite d'un processus long et délicat de purification de ces extraits de levure, ils obtinrent un facteur thermostable dont la nature nucléotidique fut établie par le biochimiste suédois Hans von Euler-Chelpin[89]. Le rôle de cette coenzyme dans les transferts d'ions hydrure fut établi en 1936 par l'Allemand Otto Heinrich Warburg, qui identifia également le résidu de nicotinamide comme étant le site de la réaction d'oxydoréduction[90].
Les précurseurs vitaminiques du NAD+ ont commencé à être identifiés en 1938 lorsque de Conrad Elvehjem (en) a montré que la nicotinamide présente dans le foie possède une action « anti langue noire » chez le chien affligé d'un syndrome apparenté à la pellagre[91], puis qu'il démontra que la niacine intervient dans la biosynthèse du NAD+, alors appelée « coenzyme I »[92]. Au début des années 1940, Arthur Kornberg identifia la première enzyme de la biosynthèse du NAD+[93]. Puis les biochimistes américains Morris Friedkin et Albert L. Lehninger (en) établirent en 1949 que le NADH assure l'intégration entre des voies métaboliques telles que le cycle de Krebs et la production d'ATP par la phosphorylation oxydative[94]. Les différents métabolites[95] et enzymes[96] intervenant dans la biosynthèse du NAD+ furent établis en 1958 par Jack Preiss et Philip Handler, raison pour laquelle la voie de sauvetage à partir de l'acide nicotinique est appelée voie de Preiss-Handler. La voie de la nicotinamide riboside kinase a quant à elle été découverte en 2004 par Charles Brenner (en) et al.[97].
Les fonctions non rédox du NAD+ et du NADP+ sont de découverte plus récente[3]. La première d'entre elles à avoir été identifiée est l'utilisation du NAD+ comme donneur de groupe ADP-ribosedans les réactions d'ADP-ribosylation, observée au début des années 1960[98]. Le métabolisme du NAD+ est resté un domaine d'intenses recherches jusqu'au XXIe siècle, avec un regain d'intérêt à la suite de la découverte des sirtuines en 2000[99].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Nicotinamide adénine dinucléotide », sur ChemIDplus, consulté le 16 août 2009
- (en) Nadine Pollak, Christian Dölle et Mathias Ziegler, « The power to reduce: pyridine nucleotides – small molecules with a multitude of functions », Biochemical Journal, vol. 402, no 2, , p. 205-218 (PMID 17295611, PMCID 1798440, DOI 10.1042/BJ20061638, lire en ligne)
- (en) Peter Belenky, Katrina L. Bogan et Charles Brenner, « NAD+ metabolism in health and disease », Trends in Biochemical Sciences, vol. 32, no 1, , p. 12-19 (PMID 17161604, DOI 10.1016/j.tibs.2006.11.006, lire en ligne)
- (en) G. Unden et J. Bongaerts, « Alternative respiratory pathways of Escherichia coli: energetics and transcriptional regulation in response to electron acceptors », Biochimica et Biophysica Acta (BBA) - Bioenergetics, vol. 1320, no 3, , p. 217-234 (PMID 9230919, DOI 10.1016/S0005-2728(97)00034-0, lire en ligne)
- (en) Jean-Francois Biellmann, Claude Lapinte, Erich Haid et Guenter Weimann, « Structure of lactate dehydrogenase inhibitor generated from coenzyme », Biochemistry, vol. 18, no 7, , p. 1212-1217 (PMID 218616, DOI 10.1021/bi00574a015, lire en ligne)
- (en) J. R. Lakowicz, H. Szmacinski, K. Nowaczyk et M. L. Johnson, « Fluorescence lifetime imaging of free and protein-bound NADH », Proceedings of the National Academy of Sciences of the United States of America, vol. 89, no 4, , p. 1271-1275 (PMID 1741380, PMCID 48431, DOI 10.1073/pnas.89.4.1271, lire en ligne)
- (en) David M. Jameson, Vickey Thomas et DeMing Zhou, « Time-resolved fluorescence studies on NADH bound to mitochondrial malate dehydrogenase », Biochimica et Biophysica Acta (BBA) - Protein Structure and Molecular Enzymology, vol. 994, no 2, , p. 187-190 (PMID 2910350, DOI 10.1016/0167-4838(89)90159-3, lire en ligne)
- (en) Marina R. Kasimova, Jurgita Grigiene, Klaas Krab, Peter H. Hagedorn, Henrik Flyvbjerg, Peter E. Andersen et Ian M. Møller, « The Free NADH Concentration Is Kept Constant in Plant Mitochondria under Different Metabolic Conditions », The Plant Cell, vol. 18, no 3, , p. 688-698 (PMID 16461578, PMCID 1383643, DOI 10.1105/tpc.105.039354, lire en ligne)
- (en) Paul D. Reiss, Peter F. Zuurendonk et Richard L. Veech, « Measurement of tissue purine, pyrimidine, and other nucleotides by radial compression high-performance liquid chromatography », Analytical Biochemistry, vol. 140, no 1, , p. 162-171 (PMID 6486402, DOI 10.1016/0003-2697(84)90148-9, lire en ligne)
- (en) Kazuo Yamada, Nobumasa Hara, Tomoko Shibata, Harumi Osago et Mikako Tsuchiya, « The simultaneous measurement of nicotinamide adenine dinucleotide and related compounds by liquid chromatography/electrospray ionization tandem mass spectrometry », Analytical Biochemistry, vol. 352, no 2, , p. 282-285 (PMID 16574057, DOI 10.1016/j.ab.2006.02.017, lire en ligne)
- (en) Hongying Yang, Tianle Yang, Joseph A. Baur, Evelyn Perez, Takashi Matsui, Juan J. Carmona, Dudley W. Lamming, Nadja C. Souza-Pinto, Vilhelm A. Bohr, Anthony Rosenzweig, Rafael de Cabo, Anthony A. Sauve et David A. Sinclair, « Nutrient-Sensitive Mitochondrial NAD+ Levels Dictate Cell Survival », Cell, vol. 130, no 6, , p. 1095-1107 (PMID 17889652, PMCID 3366687, DOI 10.1016/j.cell.2007.07.035, lire en ligne)
- (en) Peter Belenky, Frances G. Racette, Katrina L. Bogan, Julie M. McClure, Jeffrey S. Smith et Charles Brenner, « Nicotinamide Riboside Promotes Sir2 Silencing and Extends Lifespan via Nrk and Urh1/Pnp1/Meu1 Pathways to NAD+ », Cell, vol. 129, no 3, , p. 473-484 (PMID 17482543, DOI 10.1016/j.cell.2007.03.024, lire en ligne)
- (en) Ksenia Blinova, Stefanie Carroll, Salil Bose, Aleksandr V. Smirnov, John J. Harvey, Jay R. Knutson et Robert S. Balaban, « Distribution of Mitochondrial NADH Fluorescence Lifetimes: Steady-State Kinetics of Matrix NADH Interactions », Biochemistry, vol. 44, no 7, , p. 2585-2594 (PMID 15709771, DOI 10.1021/bi0485124, lire en ligne)
- (en) Simona Todisco, Gennaro Agrimi, Alessandra Castegna et Ferdinando Palmieri, « Identification of the mitochondrial NAD+ transporter in Saccharomyces cerevisiae », Journal of Biological Chemistry, vol. 281, no 3, , p. 1524-1531 (PMID 16291748, DOI 10.1074/jbc.M510425200, lire en ligne)
- (en) Freya Q. Schafer et Garry R. BuettnerRedox environment of the cell as viewed through the redox state of the glutathione disulfide/glutathione couple, « Redox environment of the cell as viewed through the redox state of the glutathione disulfide/glutathione couple », Free Radical Biology and Medicine, vol. 30, no 11, , p. 1191-1212 (PMID 11368918, DOI 10.1016/S0891-5849(01)00480-4, lire en ligne)
- (en) D. H. Williamson, P. Lund et H. A. Krebs, « The redox state of free nicotinamide-adenine dinucleotide in the cytoplasm and mitochondria of rat liver », Biochemical Journal, vol. 103, no 2, , p. 514-527 (PMID 4291787, PMCID 1270436, DOI 10.1042/bj1030514, lire en ligne)
- (en) Qinghong Zhang, David W. Piston et Richard H. Goodman, « Regulation of Corepressor Function by Nuclear NADH », Science, vol. 295, no 5561, , p. 1895-1897 (PMID 11847309, DOI 10.1126/science.1069300, lire en ligne)
- (en) Su-Ju Lin et Leonard Guarente, « Nicotinamide adenine dinucleotide, a metabolic regulator of transcription, longevity and disease », Current Opinion in Cell Biology, vol. 15, no 2, , p. 241-246 (PMID 12648681, DOI 10.1016/S0955-0674(03)00006-1, lire en ligne)
- (en) R. L. Veech, L. V. Eggleston et H. A. Krebs, « The redox state of free nicotinamide–adenine dinucleotide phosphate in the cytoplasm of rat liver », Biochemical Journal, vol. 115, no 4, , p. 609-619 (PMID 4391039, PMCID 1185185, DOI 10.1042/bj1150609a, lire en ligne)
- (en) Akira Katoh, Kazuya Uenohara, Mitsuru Akita et Takashi Hashimoto, « Early Steps in the Biosynthesis of NAD in Arabidopsis Start with Aspartate and Occur in the Plastid », Plant Physiology, vol. 141, no 3, , p. 851-857 (PMID 16698895, PMCID 1489895, DOI 10.1104/pp.106.081091, lire en ligne)
- (en) John W. Foster et Albert G. Moat, « Nicotinamide adenine dinucleotide biosynthesis and pyridine nucleotide cycle metabolism in microbial systems », Microbiological Reviews, vol. 44, no 1, , p. 83-105 (PMID 6997723, PMCID 373235, lire en ligne)
- (en) G. Magni, G. Orsomando et N. Raffaelli, « Structural and functional properties of NAD kinase, a key enzyme in NADP biosynthesis », Mini Reviews in Medicinal Chemistry, vol. 6, no 7, , p. 739-746 (PMID 16842123, DOI 10.2174/138955706777698688)
- (en) Nadia Raffaelli, Lucia Finaurini, Francesca Mazzola, Lisa Pucci, Leonardo Sorci, Adolfo Amici et Giulio Magni, « Characterization of Mycobacterium tuberculosis NAD Kinase: Functional Analysis of the Full-Length Enzyme by Site-Directed Mutagenesis », Biochemistry, vol. 43, no 23, , p. 7610-7617 (PMID 15182203, DOI 10.1021/bi049650w, lire en ligne)
- (en) Haruhiko Sakuraba, Ryushi Kawakami et Toshihisa Ohshima, « First Archaeal Inorganic Polyphosphate/ATP-Dependent NAD Kinase, from Hyperthermophilic Archaeon Pyrococcus horikoshii: Cloning, Expression, and Characterization », Applied and Environmental Microbiology, vol. 71, no 8, , p. 4352-4358 (PMID 16085824, PMCID 1183369, DOI 10.1128/AEM.71.8.4352-4358.2005, lire en ligne)
- (en) Rozalyn M. Anderson, Kevin J. Bitterman, Jason G. Wood, Oliver Medvedik, Haim Cohen, Stephen S. Lin, Jill K. Manchester, Jeffrey I. Gordon and David A. Sinclair, « Manipulation of a Nuclear NAD+ Salvage Pathway Delays Aging without Altering Steady-state NAD+ Levels », Journal of Biological Chemistry, vol. 277, no 21, , p. 18881-18890 (PMID 11884393, DOI 10.1074/jbc.M111773200, lire en ligne)
- (en) Richard A. Billington, Cristina Travelli, Emanuela Ercolano, Ubaldina Galli, Cintia Blasi Roman, Ambra A. Grolla, Pier Luigi Canonico, Fabrizio Condorelli et Armando A. Genazzani, « Characterization of NAD Uptake in Mammalian Cells », Journal of Biological Chemistry, vol. 283, no 10, , p. 6367-6374 (PMID 18180302, DOI 10.1074/jbc.M706204200, lire en ligne)
- (en) L. M. Henderson, « Niacin », Annual Review of Nutrition, vol. 3, , p. 289-307 (PMID 6357238, DOI 10.1146/annurev.nu.03.070183.001445, lire en ligne)
- (en) Anthony Rongvaux, Fabienne Andris, Frédéric Van Gool et Oberdan Leo, « Reconstructing eukaryotic NAD metabolism », BioEssays, vol. 25, no 7, , p. 683-690 (PMID 12815723, DOI 10.1002/bies.10297, lire en ligne)
- (en) Biao Ma, Shih-Jung Pan, Margaret L. Zupancic et Brendan P. Cormack, « Assimilation of NAD+ precursors in Candida glabrata », Molecular Microbiology, vol. 66, no 1, , p. 14-25 (PMID 17725566, DOI 10.1111/j.1365-2958.2007.05886.x, lire en ligne)
- (en) Joachim Reidl, Stefan Schlör, Anita Kraiß, Joachim Schmidt-Brauns, Gabriele Kemmer et Elizabeth Soleva, « NADP and NAD utilization in Haemophilus influenzae », Molecular Microbiology, vol. 35, no 6, , p. 1573-1581 (PMID 10760156, DOI 10.1046/j.1365-2958.2000.01829.x, lire en ligne)
- (en) Svetlana Y. Gerdes, Michael D. Scholle, Mark D'Souza, Axel Bernal, Mark V. Baev, Michael Farrell, Oleg V. Kurnasov, Matthew D. Daugherty, Faika Mseeh, Boris M. Polanuyer, John W. Campbell, Shubha Anantha, Konstantin Y. Shatalin, Shamim A. K. Chowdhury, Michael Y. Fonstein et Andrei L. Osterman, « From Genetic Footprinting to Antimicrobial Drug Targets: Examples in Cofactor Biosynthetic Pathways », Journal of bacteriology, vol. 184, no 16, , p. 4555-4572 (PMID 12142426, PMCID 135229, DOI 10.1128/JB.184.16.4555-4572.2002, lire en ligne)
- (en) Lisa M. Smyth, Janette Bobalova, Michael G. Mendoza, Christy Lew et Violeta N. Mutafova-Yambolieva, « Release of β-Nicotinamide Adenine Dinucleotide upon Stimulation of Postganglionic Nerve Terminals in Blood Vessels and Urinary Bladder », Journal of Biological Chemistry, vol. 279, no 47, , p. 48893-48903 (PMID 15364945, DOI 10.1074/jbc.M407266200, www.jbc.org/content/279/47/48893.full.pdf)
- (en) Richard A Billington, Santina Bruzzone, Antonio De Flora, Armando A Genazzani, Friedrich Koch-Nolte, Mathias Ziegler et Elena Zocchi, « Emerging functions of extracellular pyridine nucleotides », Molecular Medicine, vol. 12, nos 11-12, , p. 324-327 (PMID 17380199, PMCID 1829198, DOI 10.2119/2006-00075.Billington, lire en ligne)
- (en) William J. Cook, Olga Senkovich, Agustin Hernandez, Haley Speed et Debasish Chattopadhyay, « Biochemical and structural characterization of Cryptosporidium parvum Lactate dehydrogenase », International Journal of Biological Macromolecules, vol. 74, , p. 608-619 (PMID 25542170, DOI 10.1016/j.ijbiomac.2014.12.019, lire en ligne)
- (en) Arthur M. Lesk, « NAD-binding domains of dehydrogenases », Current Opinion in Structural Biology, vol. 5, no 6, , p. 775-783 (PMID 8749365, DOI 10.1016/0959-440X(95)80010-7, lire en ligne)
- (en) S. T. Rao et Michael G. Rossmann, « Comparison of super-secondary structures in proteins », Journal of Molecular Biology, vol. 76, no 2, , p. 241-256 (PMID 4737475, DOI 10.1016/0022-2836(73)90388-4, lire en ligne)
- (en) Masaru Goto, Hisashi Muramatsu, Hisaaki Mihara, Tatsuo Kurihara, Nobuyoshi Esaki, Rie Omi, Ikuko Miyahara et Ken Hirotsu, « Crystal Structures of Δ1-Piperideine-2-carboxylate/Δ1-Pyrroline-2-carboxylate Reductase Belonging to a New Family of NAD(P)H-dependent Oxidoreductases: CONFORMATIONAL CHANGE, SUBSTRATE RECOGNITION, AND STEREOCHEMISTRY OF THE REACTION », Journal of Biological Chemistry, vol. 280, no 49, , p. 40875-40884 (PMID 16192274, DOI 10.1074/jbc.M507399200, www.jbc.org/content/280/49/40875.full.pdf)
- (en) C. R. Bellamacina, « The nicotinamide dinucleotide binding motif: a comparison of nucleotide binding proteins », The FASEB Journal, vol. 10, no 11, , p. 1257-1269 (PMID 8836039, lire en ligne)
- (en) Oliviero Carugo et Patrick Argos, « NADP-Dependent enzymes. I: Conserved stereochemistry of cofactor binding », Proteins, vol. 28, no 1, , p. 10-28 (PMID 9144787, DOI 10.1002/(SICI)1097-0134(199705)28:1<10::AID-PROT2>3.0.CO;2-N, lire en ligne)
- (en) Tim J. Vickers, Giuseppe Orsomando, Rocío Díaz de la Garza, David A. Scott, Song O. Kang, Andrew D. Hanson et Stephen M. Beverley, « Biochemical and Genetic Analysis of Methylenetetrahydrofolate Reductase in Leishmania Metabolism and Virulence », Journal of Biological Chemistry, vol. 281, no 50, , p. 38150-38158 (PMID 17032644, DOI 10.1074/jbc.M608387200, lire en ligne)
- (en) Barbara M. Bakker, Karin M. Overkamp, Antonius J.A. van Maris, Peter Kötter, Marijke A.H. Luttik, Johannes P. van Dijken et Jack T. Pronk, « Stoichiometry and compartmentation of NADH metabolism in Saccharomyces cerevisiae », FEMS Microbiology Reviews, vol. 25, no 1, , p. 15-37 (PMID 11152939, DOI 10.1111/j.1574-6976.2001.tb00570.x, lire en ligne)
- (en) Dieter Heineke, Burgi Riens, Heike Grosse, Petra Hoferichter, Ute Peter, Ulf-Ingo Flügge et Hans Walter Heldt, « Redox Transfer across the Inner Chloroplast Envelope Membrane », Plant Physiology, vol. 95, no 4, , p. 1131-1137 (PMID 16668101, PMCID 1077662, DOI 10.1104/pp.95.4.1131, lire en ligne)
- (en) P. R. Rich, « The molecular machinery of Keilin's respiratory chain », Biochemical Society Transactions, vol. 31, no 6, , p. 1095-1105 (PMID 14641005, DOI 10.1042/bst0311095, lire en ligne)
- (en) F. D. Sistare et R. C. Haynes, Jr, « The interaction between the cytosolic pyridine nucleotide redox potential and gluconeogenesis from lactate/pyruvate in isolated rat hepatocytes. Implications for investigations of hormone action », Journal of Biological Chemistry, vol. 260, no 23, , p. 12748-12753 (PMID 4044607, lire en ligne)
- (en) A. Freitag et E. Bock, « Energy conservation in Nitrobacter », FEMS Microbiology Letters, vol. 66, nos 1-3, , p. 157-162 (DOI 10.1111/j.1574-6968.1990.tb03989.x, lire en ligne)
- (en) Shawn R. Starkenburg, Patrick S. G. Chain, Luis A. Sayavedra-Soto, Loren Hauser, Miriam L. Land, Frank W. Larimer, Stephanie A. Malfatti, Martin G. Klotz, Peter J. Bottomley, Daniel J. Arp et William J. Hickey, « Genome Sequence of the Chemolithoautotrophic Nitrite-Oxidizing Bacterium Nitrobacter winogradskyi Nb-255 », Applied and Environmental Microbiology, vol. 72, no 3, , p. 2050-2063 (PMID 16517654, PMCID 1393235, DOI 10.1128/AEM.72.3.2050-2063.2006, lire en ligne)
- (en) Mathias Ziegler, « New functions of a long-known molecule. Emerging roles of NAD in cellular signaling », The FEBS Journal, vol. 267, no 6, , p. 1550-1564 (PMID 10712584, DOI 10.1046/j.1432-1327.2000.01187.x, lire en ligne)
- (en) J. Diefenbach et A. Bürkle, « Poly-ADP-ribosylation in health and disease. Introduction to poly(ADP-ribose) metabolism », Cellular and Molecular Life Sciences CMLS, vol. 62, nos 7-8, , p. 721-730 (PMID 15868397, DOI 10.1007/s00018-004-4503-3, lire en ligne)
- (en) Felicitas Berger, María Ramírez-Hernández et Mathias Ziegler, « The new life of a centenarian: signalling functions of NAD(P) », Trends in Biochemical Sciences, vol. 29, no 3, , p. 111-118 (PMID 15003268, DOI 10.1016/j.tibs.2004.01.007, lire en ligne)
- (en) Daniela Corda et Maria Di Girolamo, « Functional aspects of protein mono‐ADP‐ribosylation », The EMBO Journal, vol. 22, no 9, , p. 1953-1958 (PMID 12727863, PMCID 156081, DOI 10.1093/emboj/cdg209, lire en ligne)
- (en) Alexander Bürkle, « Poly(ADP-ribose). The most elaborate metabolite of NAD+ », The FEBS Journal, vol. 272, no 18, , p. 4576-4589 (PMID 16156780, DOI 10.1111/j.1742-4658.2005.04864.x, lire en ligne)
- (en) Michel Seman, Sahil Adriouch, Friedrich Haag et Friedrich Koch-Nolte, « Ecto-ADP-ribosyltransferases (ARTs): emerging actors in cell communication and signaling », Current Medicinal Chemistry, vol. 11, no 7, , p. 857-872 (PMID 15078170, DOI 10.2174/0929867043455611, lire en ligne)
- (en) Y. Grace Chen, Walter E. Kowtoniuk, Isha Agarwal, Yinghua Shen et David R. Liu, « LC/MS analysis of cellular RNA reveals NAD-linked RNA », Nature Chemical Biology, vol. 5, no 12, , p. 879-881 (PMID 19820715, PMCID 2842606, DOI 10.1038/nchembio.235, lire en ligne)
- (en) Andreas H. Guse, « Biochemistry, Biology, and Pharmacology of Cyclic Adenosine Diphosphoribose (cADPR) », Current Medicinal Chemistry, vol. 11, no 7, , p. 847-855 (PMID 15078169, DOI 10.2174/0929867043455602, lire en ligne)
- (en) Andreas H. Guse, « Regulation of Calcium Signaling by the Second Messenger Cyclic Adenosine Diphosphoribose (cADPR) », Current Molecular Medicine, vol. 4, no 3, , p. 239-248 (PMID 15101682, DOI 10.2174/1566524043360771, lire en ligne)
- (en) Andreas H. Guse, « Second messenger function and the structure–activity relationship of cyclic adenosine diphosphoribose (cADPR) », The FEBS Journal, vol. 272, no 18, , p. 4590-4597 (PMID 16156781, DOI 10.1111/j.1742-4658.2005.04863.x, lire en ligne)
- (en) Brian J. North et Eric Verdin, « Sirtuins: Sir2-related NAD-dependent protein deacetylases », Genome Biology, vol. 5, no 5, , p. 224 (PMID 15128440, PMCID 416462, DOI 10.1186/gb-2004-5-5-224, lire en ligne)
- (en) Gil Blander et Leonard Guarente, « The Sir2 Family of Protein Deacetylases », Annual Review of Biochemistry, vol. 73, , p. 417-435 (PMID 15189148, DOI 10.1146/annurev.biochem.73.011303.073651, lire en ligne)
- (en) Johannes Trapp, « The Role of NAD+ Dependent Histone Deacetylases (sirtuins) in Ageing », Current Drug Targets, vol. 7, no 11, novembre, p. 2006 (PMID 17100594, DOI 10.2174/1389450110607011553, lire en ligne)
- (en) Adam Wilkinson, Jonathan Day et Richard Bowater, « Bacterial DNA ligases », Molecular Microbiology, vol. 40, no 6, , p. 1241-1248 (PMID 11442824, DOI 10.1046/j.1365-2958.2001.02479.x, lire en ligne)
- (en) Primo Schär, Gernot Herrmann, Graham Daly et Tomas Lindahl, « A newly identified DNA ligase of Saccharomyces cerevisiae involved in RAD52-independent repair of DNA double-strand breaks », Genes & Development, vol. 11, no 15, , p. 1912-1924 (PMID 9271115, PMCID 316416, DOI 10.1101/gad.11.15.1912, lire en ligne)
- (en) Mathias Ziegler et Marc Niere, « NAD+ surfaces again », Biochemical Journal, vol. 382, no Pt 3, , e5-6 (PMID 15352307, PMCID 1133982, DOI 10.1042/BJ20041217, lire en ligne)
- (en) Friedrich Koch-Nolte, Stefan Fischer, Friedrich Haag et Matthias Ziegler, « Compartmentation of NAD+-dependent signalling », The FEBS Letters, vol. 585, no 11, , p. 1651-1656 (PMID 21443875, DOI 10.1016/j.febslet.2011.03.045, lire en ligne)
- (en) Leanne T. Breen, Lisa M. Smyth, Ilia A. Yamboliev et Violeta N. Mutafova-Yambolieva, « β-NAD is a novel nucleotide released on stimulation of nerve terminals in human urinary bladder detrusor muscle », American Journal of Physiology, vol. 290, no 2, , F486-F495 (PMID 16189287, DOI 10.1152/ajprenal.00314.2005, lire en ligne)
- (en) Violeta N. Mutafova-Yambolieva, Sung Jin Hwang, Xuemei Hao, Hui Chen, Michael X. Zhu, Jackie D. Wood, Sean M. Ward et Kenton M. Sanders, « β-Nicotinamide adenine dinucleotide is an inhibitory neurotransmitter in visceral smooth muscle », Proceedings of the National Academy of Sciences of the United States of America, vol. 104, no 41, , p. 16359-16364 (PMID 17913880, PMCID 2042211, DOI 10.1073/pnas.0705510104, lire en ligne)
- (en) Sung Jin Hwang, Leonie Durnin, Laura Dwyer, Poong-Lyul Rhee, Sean M. Ward, Sang Don Koh, Kenton M. Sanders et Violeta N. Mutafova–Yambolieva, « β-Nicotinamide Adenine Dinucleotide Is an Enteric Inhibitory Neurotransmitter in Human and Nonhuman Primate Colons », Gastroenterology, vol. 140, no 2, , p. 608-617 (PMID 20875415, PMCID 3031738, DOI 10.1053/j.gastro.2010.09.039, lire en ligne)
- (en) Ilia A. Yamboliev, Lisa M. Smyth, Leonie Durnin, Yanping Dai et Violeta N. Mutafova-Yambolieva, « Storage and secretion of β-NAD, ATP and dopamine in NGF-differentiated rat pheochromocytoma PC12 cells », European Journal of Neuroscience, vol. 30, no 5, , p. 756-768 (PMID 19712094, PMCID 2774892, DOI 10.1111/j.1460-9568.2009.06869.x, lire en ligne)
- (en) Leonie Durnin, Yanping Dai, Isamu Aiba, C. William Shuttleworth, Ilia A. Yamboliev et Violeta N. Mutafova-Yambolieva, « Release, neuronal effects and removal of extracellular β-nicotinamide adenine dinucleotide (β-NAD+) in the rat brain », European Journal of Neuroscience, vol. 35, no 3, , p. 423-435 (PMID 22276961, PMCID 3270379, DOI 10.1111/j.1460-9568.2011.07957.x, lire en ligne)
- (en) Anthony A. Sauve, « NAD+ and Vitamin B3: From Metabolism to Therapies », The Journal of Pharmacology and Experimental Therapeutics, vol. 324, no 3, , p. 883-893 (PMID 18165311, DOI 10.1124/jpet.107.120758, jpet.aspetjournals.org/content/324/3/883.full.pdf+html)
- (en) Javed A. Khan, Farhad Forouhara, Xiao Tao et Liang Tong, « Nicotinamide adenine dinucleotide metabolism as an attractive target for drug discovery », Expert Opinion on Therapeutic Targets, vol. 11, no 5, , p. 695-705 (PMID 17465726, DOI 10.1517/14728222.11.5.695, lire en ligne)
- (en) Shinjiro Kaneko, Jing Wang, Marie Kaneko, Glenn Yiu, Joanna M. Hurrell, Tanuja Chitnis, Samia J. Khoury et Zhigang He, « Protecting axonal degeneration by increasing nicotinamide adenine dinucleotide levels in experimental autoimmune encephalomyelitis models », Journal of Neuroscience, vol. 26, no 38, , p. 9794-804 (PMID 16988050, DOI 10.1523/JNEUROSCI.2116-06.2006, lire en ligne)
- (en) G.j.d. Birkmayer et W. Birkmayer, « Stimulation of endogenous L-dopa biosynthesis — a new principle for the therapy of Parkinson's disease. The clinical effect of nicotinamide adenine dinucleotide (NADH) and nicotinamide adenine dinucleotidephosphate (NADPH) », Acta Neurologica Scandinavica, vol. 80, , p. 183–187 (ISSN 1600-0404, DOI 10.1111/j.1600-0404.1989.tb01800.x, lire en ligne, consulté le )
- « Therapeutic effects of oral NADH on the symptoms of patients with chronic fatigue syndrome », Annals of Allergy, Asthma & Immunology, vol. 82, no 2, , p. 185–191 (ISSN 1081-1206, DOI 10.1016/S1081-1206(10)62595-1, lire en ligne, consulté le )
- « Prof. George Birkmayer NADH », sur birkmayer-nadh.com (consulté le )
- V. Demarin, Sarkanji S. Podobnik, D. Storga-Tomic et G. Kay, « Treatment of Alzheimer's disease with stabilized oral nicotinamide adenine dinucleotide: a randomized, double-blind study », Drugs Under Experimental and Clinical Research, vol. 30, no 1, , p. 27–33 (ISSN 0378-6501, PMID 15134388, lire en ligne, consulté le )
- (en) Russell H. Swerdlow, « Is NADH Effective in the Treatment of Parkinson’s Disease? », Drugs & Aging, vol. 13, no 4, , p. 263-268 (PMID 9805207, DOI 10.2165/00002512-199813040-00002, lire en ligne)
- (en) Graham S. Timmins et Vojo Deretic, « Mechanisms of action of isoniazid », Molecular Microbiology, vol. 62, no 5, , p. 1220-1227 (PMID 17074073, DOI 10.1111/j.1365-2958.2006.05467.x, lire en ligne)
- (en) Richa Rawa, Adrian Whitty et Peter J. Tonge, « The isoniazid-NAD adduct is a slow, tight-binding inhibitor of InhA, the Mycobacterium tuberculosis enoyl reductase: Adduct affinity and drug resistance », Proceedings of the National Academy of Sciences of the United States of America, vol. 100, no 24, , p. 13881-13886 (PMID 14623976, PMCID 283515, DOI 10.1073/pnas.2235848100, lire en ligne)
- (en) Argyrides Argyrou, Matthew W. Vetting, Bola Aladegbami et John S. Blanchard, « Mycobacterium tuberculosis dihydrofolate reductase is a target for isoniazid », Nature Structural & Molecular Biology, vol. 13, no 5, , p. 408-413 (PMID 16648861, DOI 10.1038/nsmb1089, lire en ligne)
- (en) Ana P. Gomes, Nathan L. Price, Alvin J.Y. Ling, Javid J. Moslehi, Magdalene K. Montgomery, Luis Rajman, James P. White, João S. Teodoro, Christiane D. Wrann, Basil P. Hubbard, Evi M. Mercken, Carlos M. Palmeira, Rafael de Cabo, Anabela P. Rolo, Nigel Turner, Eric L. Bell et David A. Sinclair, « Declining NAD+ Induces a Pseudohypoxic State Disrupting Nuclear-Mitochondrial Communication during Aging », Cell, vol. 155, no 7, , p. 1624-1638 (PMID 24360282, DOI 10.1016/j.cell.2013.11.037, lire en ligne)
- (en) Krzysztof W. Pankiewicz, Steven E. Patterson, Paul L. Black, Hiremagalur N. Jayaram, Dipesh Risal, Barry M. Goldstein, Lieven J. Stuyver et Raymond F. Schinazi, « Cofactor Mimics as Selective Inhibitors of NAD-dependent Inosine Monophospate Dehydrogenase (IMPDH) - the Major Therapeutic Target », Current Medicinal Chemistry, vol. 11, no 7, , p. 887-900 (PMID 15083807, DOI 10.2174/0929867043455648, lire en ligne)
- (en) P. Franchetti et M. Grifantini, « Nucleoside and non-nucleoside IMP dehydrogenase inhibitors as antitumor and antiviral agents », Current Medicinal Chemistry, vol. 6, no 7, , p. 599-614 (PMID 10390603)
- (en) Eun-Joo Kim et Soo-Jong Um, « SIRT1: roles in aging and cancer », BMB Reports, vol. 41, no 11, , p. 751-756 (PMID 19017485, DOI 10.5483/BMBRep.2008.41.11.751, lire en ligne)
- (en) Dario R. Valenzano, Eva Terzibasi, Tyrone Genade, Antonino Cattaneo, Luciano Domenici et Alessandro Cellerino, « Resveratrol Prolongs Lifespan and Retards the Onset of Age-Related Markers in a Short-Lived Vertebrate », Current Biology, vol. 16, no 3, , p. 296–300 (PMID 16461283, DOI 10.1016/j.cub.2005.12.038, lire en ligne)
- (en) Konrad T. Howitz, Kevin J. Bitterman, Haim Y. Cohen, Dudley W. Lamming, Siva Lavu, Jason G. Wood, Robert E. Zipkin, Phuong Chung, Anne Kisielewski, Li-Li Zhang, Brandy Scherer et David A. Sinclair, « Small molecule activators of sirtuins extend Saccharomyces cerevisiae lifespan », Nature, vol. 425, no 6954, , p. 686-689 (PMID 12939617, DOI 10.1038/nature01960, Bibcode 2003Natur.425..191H, lire en ligne)
- (en) Jason G. Wood, Blanka Rogina, Siva Lavu, Konrad Howitz, Stephen L. Helfand, Marc Tatar et David Sinclair, « Sirtuin activators mimic caloric restriction and delay ageing in metazoans », Nature, vol. 430, no 7000, , p. 686-689 (PMID 15254550, DOI 10.1038/nature02789, Bibcode 2004Natur.430..686W, lire en ligne)
- (en) Arthur Harden et William John Young, « The Alcoholic Ferment of Yeast-Juice. Part II.--The Conferment of Yeast-Juice », Proceedings of the Royal Society B, vol. 78, no 526, , p. 369-375 (DOI 10.1098/rspb.1906.0070, JSTOR 80144, Bibcode 1906RSPSB..78..369H, lire en ligne)
- (en) Hans von Euler, « Fermentation of sugars and fermentatives enzymes », sur site Nobelprize.org, (consulté le ).
- (de) Otto Warburg et Walter Christian, « Pyridin, der wasserstoffübertragende Bestandteil von Gärungsfermenten », Helvetica Chimica Acta, vol. 19, no 1, , E79-E88 (DOI 10.1002/hlca.193601901199, lire en ligne)
- (en) C. A. Elvehjem, R. J. Madden, F. M. Strong et D. W. Woolley, « The isolation and identification of the anti-black tongue factor », Nutrition Reviews, vol. 32, no 2, , p. 48-50 (PMID 4274128, lire en ligne)
- (en) A. E. Axelrod, Robert J. Madden et C. A. Elvehjem, « The Effect of a Nitocinic Acid Deficiency upon the Coenzyme I Content of Animal Tissues », Journal of Biological Chemistry, vol. 131, , p. 85-93 (lire en ligne)
- (en) Arthur Kornberg, « The participation of inorganic pyrophosphate in the reversible enzymatic synthesis of diphosphopyridine nucleotide », Journal of Biological Chemistry, vol. 176, , p. 1475-1476 (PMID 18098602, lire en ligne)
- (en) Morris Friedkin et Albert L. Lehninger, « Esterification of inorganic phosphate coupled to electron transport between dihydrodiphosphopyridine nucleotide and oxygen », Journal of Biological Chemistry, vol. 178, , p. 611-623 (PMID 18116985, lire en ligne)
- (en) Jack Preiss et Philip Handler, « Biosynthesis of diphosphopyridine nucleotide. I. Identification of intermediates », Journal of Biological Chemistry, vol. 233, , p. 488-492 (PMID 13563526, lire en ligne)
- (en) Jack Preiss et Philip Handler, « Biosynthesis of diphosphopyridine nucleotide. II. Enzymatic aspects », Journal of Biological Chemistry, vol. 233, , p. 493-500 (PMID 13563527, lire en ligne)
- (en) Pawel Bieganowski et Charles Brenner, « Discoveries of nicotinamide riboside as a nutrient and conserved NRK genes establish a Preiss-Handler independent route to NAD+ in fungi and humans », Cell, vol. 117, no 4, , p. 495-502 (PMID 15137942, DOI 10.1016/S0092-8674(04)00416-7, lire en ligne)
- (en) P. Chambon, J. D. Weill et P. Mandel, « Nicotinamide mononucleotide activation of new DNA-dependent polyadenylic acid synthesizing nuclear enzyme », Biochemical and Biophysical Research Communications, vol. 11, , p. 39-43 (PMID 14019961, DOI 10.1016/0006-291X(63)90024-X, lire en ligne)
- (en) Shin-ichiro Imai, Christopher M. Armstrong, Matt Kaeberlein et Leonard Guarente, « Transcriptional silencing and longevity protein Sir2 is an NAD-dependent histone deacetylase », Letters to Nature, vol. 403, no 6771, , p. 795-800 (PMID 10693811, DOI 10.1038/35001622, lire en ligne)
Voir aussi
- Nicotinamide adénine dinucléotide phosphate
- Liste d'abréviations de biologie cellulaire et moléculaire
- Portail de la biochimie
- Portail de la chimie