اكتشاف وتطوير مثبطات التيوبيولين
مثبطات التيوبيولين هي نوع من مثبطات التفتل تُستخدم كأدوية علاج كيميائي تتداخل بشكل مباشر مع نظام التيوبيولين، على عكس أدوية العلاج الكيميائي التي تعمل على الحمض النووي. تلعب الأنيبيات الدقيقة دورًا مهمًا في الخلايا حقيقية النواة. اكتسبت ألفا-تيوبيولين وبيتا-تيوبيولين (Alpha- و beta-tubulin)، والتي هي المكونات الرئيسية للأنيبيات الدقيقة، اهتمامًا كبيرًا بسبب وظيفتها وخصائصها الفيزيائية الحيوية وأصبحت موضوع دراسة مكثفة في الآونة الآخيرة، خاصةً فيما يتعلق بدراسات السرطان. يمكن أن تؤثر إضافة ربيطات التيبيولين على استقرار الأنيبيات الدقيقة ووظيفتها، بما في ذلك الانقسام الفتيلي وحركة الخلية ونقل العضيات داخل الخلايا. أثارت الجزيئات التي ترتبط بالتيبيولين اهتمامًا كبيرًا بعد إدخال التاكسانات في علم الأورام السريري والاستخدام العام لقلويات العناقية. تمنع هذه المركبات الانقسام الخلوي عن طريق الارتباط ببروتين التوبولين في المغزل الانقسامي ومنع البلمرة أو إزالة البلمرة في الأنيبيات الدقيقة.[1][2] ولذلك فإن مثبطات التيوبيولين قد تكون فعالة في علاج السرطان عن طريق إيقاف نموه وتطوره. تقتل مثبطات التيوبيولين الخلايا السرطانية عن طريق تثبيط ديناميكيات الأنيبيات الدقيقة اللازمة لفصل الحمض النووي وبالتالي منع وتثبيط انقسام الخلايا السرطانية.[3][4][5][6] تتم مشاركة آلية العمل هذه أيضًا مع عامل كيميائي طبيعي آخر يسمى الكولشيسين.
التاريخ
أول مركب كيميائي معروف يرتبط بالتيوبيولين هو الكولشيسين، وقد تم عزله من زعفران الخريف، المُسمى اللحلاح الخريفي، ولكن لم يتم استخدامه لعلاج السرطان آنذاك. كانت أول الأدوية المضادة للسرطان المعتمدة للاستخدام السريري هي القلويات العناقية، فينبلاستين وفينكريستين في الستينيات. تم عزلهم من مستخلصات أوراق نبات Catharanthus roseus (Vinca rosea) في جامعة ويسترن أونتاريو عام 1958.[7] ينتمي العقار الأول إلى التاكسانات والباكليتاكسيل، المكتشفة في مقتطفات من لحاء شجرة الطقسوس، تاكسوس بريفيفوليا، في عام 1967 من قبل مونرو وول ومانسوخ واني، ولكن نشاط تثبيط التيوبيولين لم يكن معروفًا حتى عام 1979. أشجار الطقسوس هي مصدر فقير لنشاط هذه العوامل مما حدّ من تطور التاكسانات لأكثر من 20 عامًا حتى اِكتُشفت طريقة الاصطناع. في ديسمبر 1992 تمت الموافقة على باكليتاكسيل لاستخدامه في العلاج الكيميائي.[8]
التيوبيولين ونظام الأنيبيات الدقيقة
الوظيفة
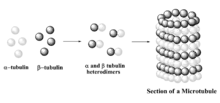
الأنيبيات الدقيقة هي المكونات الرئيسية للهيكل الخلوي للخلايا حقيقية النواة ولها دور مهم في الوظائف الخلوية المختلفة مثل الهجرة داخل الخلايا والنقل، والحفاظ على شكل الخلية، والقطبية، وتأشير الخلية والانقسام.[9] تلعب هذه الأنيبيات دورًا في منتهى الأهمية في عملية انقسام الخلايا من خلال المشاركة في حركة الكروموسومات وربطها خلال مراحل مختلفة من الانقسام. لذلك، تعتبر ديناميكيات الأنيبيات الدقيقة هدفًا مهمًا لتطوير الأدوية المضادة للسرطان.[10]
آلية العمل
العوامل التي تعمل كمثبطات للتوبيولين، تعمل أيضًا كمثبطات لانقسام الخلايا (مثبطات التفتل). تتواجد الأنيبيات الدقيقة في حالة ديناميكية مستمرة من النمو والتّقصر عن طريق الارتباط القابل للانعكاس والتفكك لمغاير α / β-tubulin في كلا الطرفين. يعد هذا السلوك الديناميكي والتحكم الناتج في طول الأنيبيب الدقيق أمرًا حيويًا للتشغيل السليم للمغزل التفتلي في الانقسام، أي انقسام الخلايا.
تشارك الأنيبيات الدقيقة في مراحل مختلفة من دورة الخلية. أثناء المرحلة الأولى من دورة الخلية والتي تُسمى الطور التمهيدي، تبدأ الأنيبيات الدقيقة اللازمة لانقسام الخلية في التكون والنمو باتجاه الكروموسومات التي تشكلت حديثًا وتشكل حزمة من الأنيبيات الدقيقة تسمى بالمغزل التفتلي. خلال مرحلة طليعة الطور الاستوائي والطور الاستوائي، يربط هذا المغزل نفسه بالكروموسومات عند نقطة معينة تسمى الحيز الحركي ويخضع لعدة فترات نمو وتقصر في ضبط مع ذبذبات الكروموسومات ذهابًا وإيابًا. في طور الصعود أيضًا، تحافظ الأنيبيات الدقيقة المتصلة بالكروموسومات على عملية تقصير وإطالة منظمة بعناية. وبالتالي فإن وجود دواء يمكنه كبت ديناميكيات الأنابيب الدقيقة كافٍ لمنع دورة الخلية بالكامل ويؤدي إلى موت الخلايا عن طريق الاستماتة.
وهكذا تعمل مثبطات التيوبيولين بالتدخل في ديناميكيات الأنيبيات الدقيقة، أي النمو (البلمرة) والتقصر (إزالة البلمرة). تعمل فئة واحدة من المثبطات عن طريق تثبيط بلمرة التيوبيولين لتشكيل الأنيبيات الدقيقة وتسمى مثبطات البلمرة مثل نظائر الكولشيسين والقلويات العناقية. هذا النوع من المثبطات يقلل من كتلة البوليمر المايكروتيوبل في الخلايا عند التركيز العالي وتعمل كعوامل مزعزعة لاستقرار الأنيبيات. تعمل الفئة الأخرى من المثبطات عن طريق تثبيط إزالة بلمرة التوبولين المبلمر وتزيد من كتلة بوليمر الأنيبيات الدقيقة في الخلايا. تعمل كعوامل مثبتة للأنيييات وتسمى مثبطات إزالة البلمرة مثل نظائر باكليتاكسيل.[9] يبدو أن هذه الفئات الثلاث من الأدوية تعمل بآلية مختلفة قليلاً.
تعمل نظائر الكولشيسين على منع انقسام الخلايا عن طريق تعطيل الأنيبيات الدقيقة. تم الإبلاغ عن أن الوحدة الفرعية β للتوبيولين (بيتا تيوبيولين) تتدخل في ارتباط الكولشيسين بالبروتين المعني. يرتبط الكولشيسين بالتوبيولين القابل للذوبان لتشكيل مركب يُسمى معقد كولشيسين-توبيولين. يخضع هذا المركب جنبًا إلى جنب مع التيوبيولينات الطبيعية للبلمرة لتشكيل الأنيبيات الدقيقة.
أدوية ربط التيوبيولين
اكتسبت الجزيئات القادرة على الارتباط بالتيوبولين اهتمامًا كبيرًا بين العوامل السامة للخلايا نظرًا لنجاحها في علم الأورام السريري. وهي تختلف عن الأدوية الأخرى المضادة للسرطان في طريقة عملها لأنها تستهدف الجهاز المغزلي وليس الحمض النووي (الدنا). تم تصنيف عقاقير ربط التيوبيولين على أساس طريقة عملها وموقع الارتباط.[11][12][13] يوجد نوعان أساسيان لهذة العقاقير:
I. مثبطات إزالة بلمرة التيوبيولين
باكليتاكسيل، تشمل باكليتاكسيل، إيبوثيلون، دوسيتاكسيل، ديسكديرموليد، إلخ.
II. مثبطات بلمرة التيوبيولين
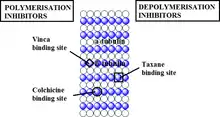
- موقع ارتباط أدوية مختلفة على بروتين التيوبيولين.
 تاكسول مرتبط ببروتين التيوبيولين.
تاكسول مرتبط ببروتين التيوبيولين. فينبلاستين مرتبط ببروتين التيوبيولين.
فينبلاستين مرتبط ببروتين التيوبيولين.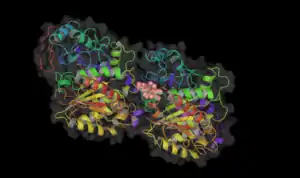 كلولشيسين مرتبط ببروتين التيوبيولين.
كلولشيسين مرتبط ببروتين التيوبيولين.
| فئات مثبطات التيوبيولين | نطاق الارتباط | الأدوية ذات الصلة أو النظائر. | الاستخدامات العلاجية | مرحلة التطوير السريري |
|---|---|---|---|---|
| مثبطات البلمرة | نطاق العناقية. | فينبلاستين | مرض هودجكن، سرطان الخلايا الجنسية الخصيوي. | في الاستخدام السريري 22 تجربة مركبة قيد التنفيذ |
| فينكريستين | اللوكيميا والأورام اللمفاوية. | في الاستخدام السريري 108 تجربة مركبة قيد التنفيذ | ||
| فينورلبين | الأورام الصلبة والأورام اللمفاوية وسرطان الرئة. | في الاستخدام السريري 29 تجربة سريرية من المرحلة الأولى إلى الثالثة قيد التنفيذ (فردية ومجتمعة) | ||
| فينفلونين | المثانة، سرطان الرئة ذو الخلايا غير الصغيرة، سرطان الثدي. | المرحلة الثالثة | ||
| كريتوفيسين 52 | الأورام الصلبة. | انتهت المرحلة الثالثة | ||
| هاليكوندرين | - | المرحلة الاولى | ||
| دولاستاتين | عامل محتمل يستهدف الأوعية الدموية. | المرحلة الاولى؛ اكتملت المرحلة الثانية | ||
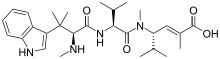
| هيميسترلينز | - | المرحلة الاولى | ||
| نطاق الكولشيسين. | كولشيسين | الأمراض غير الورمية (النقرس، حمى البحر الأبيض المتوسط العائلية ) | تمت الموافقة عليها في عام 2009 من قبل FDA بموجب مبادرة الأدوية غير المعتمدة | |
| كومبريتستاتين | عامل محتمل يستهدف الأوعية الدموية. | المرحلة الاولى | ||
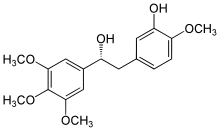
| 2-ميثوكسيستراديول | - | المرحلة الاولى | ||
| E7010 | الأورام الصلبة. | المرحلة الأولى والثانية | ||
| مثبطات إزالة البلمرة | نطاق التاكسين. | باكليتاكسيل (تاكسول) | أورام المبيض والثدي والرئة وساركوما كابوزي. تجارب مع العديد من الأورام الأخرى | في الاستخدام السريري 207 تجارب المرحلة الأولى والثالثة في الولايات المتحدة ؛ TL00139 في تجارب المرحلة الأولى |
| دوسيتاكسيل (تاكسوتير) | أورام البروستاتا والدماغ والرئة | 8 تجارب في الولايات المتحدة (المراحل الأولى والثالثة) | ||
| إيبوثيلون | الأورام المقاومة للباكليتاكسيل. | المراحل من الأول إلى الثالث | ||
| ديسوديرموليد | - | المرحلة الاولى |
| مثبطات التيوبيولين | |||
|---|---|---|---|
| نظاق العناقية. |  |
 |
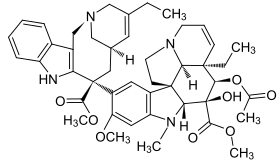 |
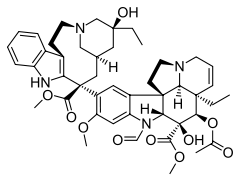
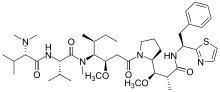
| فينبلاستين | فينكريستين | فينورلبين | |
 |
 |
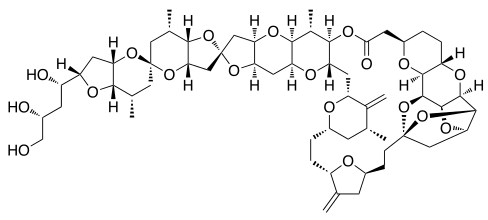 | |
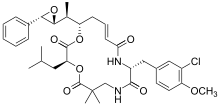
| فينفلونين | كريبتوفيسين 52 | هاليكوندرين ب | |
 |
 |
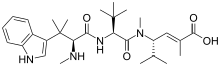 | |
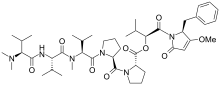
| دولاستاتين 10 | دولاستاتين 15 | هيميسترلين أ | |
 | |||
| هيميسترلين ب | |||
| نطاق الكولشيسين. |  |
 |
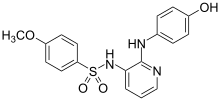 |
| كولشيسين | كومبريتاستاتين | E7010 | |
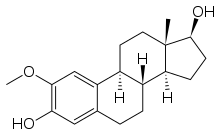 | |||
| 2-ميثوكسيستراديول | |||
| نظاق التاكسين. | 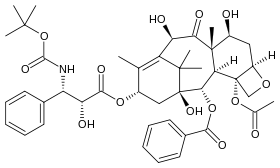 |
 |
-Epothilone_A.svg.png.webp) |
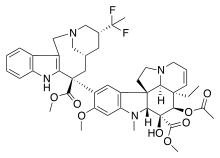
| دوسيتاكسيل | باكليتاكسيل | إيبوثيلون أ | |
-Epothilone_B.svg.png.webp) |
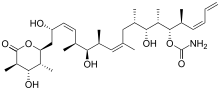 | ||
| Epothilone ب | ديسوديرموليد | ||
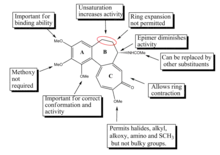
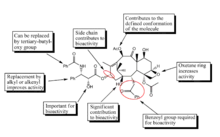
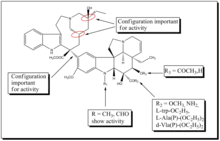
المحدودية
الآثار الجانبية
اعتلال الأعصاب المحيطية الناجم عن العلاج الكيميائي، تنميل أو مذل متدرج ودائم، وخز دائم، ألم شديد، وحساسية مفرطة للبرد، تبدأ في اليدين والقدمين وأحيانًا تشمل الذراعين والساقين.[14]
يمكن أن تشمل الآثار الجانبية الأخرى ما يلي:غثيان، تقيؤ، إسهال، إمساك، تغلف معوي شللي، احتباس بولي، بالإضافة إلى:[بحاجة لمصدر]
- كبت نقي العظم
- التهاب الفم ( تقرح في الشفتين واللسان وتجويف الفم).
- تفاعلات فرط الحساسية - احمرار ، تفاعلات جلدية موضعية، طفح جلدي مع أو بدون حكة، ضيق في الصدر، آلام الظهر، ضيق التنفس، حمى دوائية، أو قشعريرة حادة (النفضان).
- التأثيرات العضلية الهيكلية - ألم مفصلي و / أو ألم عضلي.
- ضعف شديد.
- انخفاض ضغط الدم.
- داء الثعلبة.
- السمية العصبية.
تعد مقاومة الأدوية المتعددة أيضاً من أهم وأعقد الصعوبات التي تتعلق بالعلاج المضاد للسرطان.
انظر أيضًا
المراجع
- Kaur, Ramandeep؛ Kaur, Gurneet؛ Gill, Rupinder Kaur؛ Soni, Richard؛ Bariwal, Jitender (24 نوفمبر 2014)، "Recent developments in tubulin polymerization inhibitors: An overview"، European Journal of Medicinal Chemistry (باللغة الإنجليزية)، 87: 89–124، doi:10.1016/j.ejmech.2014.09.051، ISSN 0223-5234، مؤرشف من الأصل في 16 أغسطس 2020.
- "Tubulin Polymerization Inhibitor Screenings"، مؤرشف من الأصل في 22 سبتمبر 2017.
- "Tubulin: Mystery of Vital Cell Protein Solved After 30 Years"، www2.lbl.gov، مؤرشف من الأصل في 03 أغسطس 2020، اطلع عليه بتاريخ 18 أغسطس 2020.
- "What is Tubulin?"، News-Medical.net (باللغة الإنجليزية)، 06 فبراير 2020، مؤرشف من الأصل في 18 أغسطس 2020، اطلع عليه بتاريخ 18 أغسطس 2020.
- Gunning, Peter W.؛ Ghoshdastider, Umesh؛ Whitaker, Shane؛ Popp, David؛ Robinson, Robert C. (01 يونيو 2015)، "The evolution of compositionally and functionally distinct actin filaments"، Journal of Cell Science (باللغة الإنجليزية)، 128 (11): 2009–2019، doi:10.1242/jcs.165563، ISSN 0021-9533، PMID 25788699، مؤرشف من الأصل في 07 فبراير 2020.
- Binarová, Pavla؛ Tuszynski, Jack (22 أكتوبر 2019)، "Tubulin: Structure, Functions and Roles in Disease"، Cells، 8 (10)، doi:10.3390/cells8101294، ISSN 2073-4409، PMID 31652491، مؤرشف من الأصل في 18 أغسطس 2020.
- Jordan, M. A. (31 ديسمبر 2001)، "Mechanism of Action of Antitumor Drugs that Interact with Microtubules and Tubulin"، Current Medicinal Chemistry - Anti-Cancer Agents (باللغة الإنجليزية)، مؤرشف من الأصل في 4 يونيو 2018، اطلع عليه بتاريخ 16 أغسطس 2020.
- Gordaliza, M. (01 ديسمبر 2007)، "Natural products as leads to anticancer drugs"، Clinical and Translational Oncology (باللغة الإنجليزية)، 9 (12): 767–776، doi:10.1007/s12094-007-0138-9، ISSN 1699-3055، مؤرشف من الأصل في 6 يناير 2021.
- Perez, Edith A. (01 أغسطس 2009)، "Microtubule inhibitors: Differentiating tubulin-inhibiting agents based on mechanisms of action, clinical activity, and resistance"، Molecular Cancer Therapeutics (باللغة الإنجليزية)، 8 (8): 2086–2095، doi:10.1158/1535-7163.MCT-09-0366، ISSN 1535-7163، PMID 19671735، مؤرشف من الأصل في 6 ديسمبر 2019.
- Jordan, M. A. (31 ديسمبر 2001)، "Mechanism of Action of Antitumor Drugs that Interact with Microtubules and Tubulin"، Current Medicinal Chemistry - Anti-Cancer Agents (باللغة الإنجليزية)، مؤرشف من الأصل في 4 يونيو 2018، اطلع عليه بتاريخ 20 أغسطس 2020.
- Iskander, Mohd N. Islam and Magdy N. (30 نوفمبر 2004)، "Microtubulin Binding Sites as Target for Developing Anticancer Agents"، Mini-Reviews in Medicinal Chemistry (باللغة الإنجليزية)، مؤرشف من الأصل في 8 يونيو 2018، اطلع عليه بتاريخ 22 أغسطس 2020.
- Hamel, Ernest (01 مارس 1996)، "Antimitotic natural products and their interactions with tubulin"، doi:10.1002/(sici)1098-1128(199603)16:23.3.co;2-i، مؤرشف من الأصل في 22 أغسطس 2020.
{{استشهاد بدورية محكمة}}: Cite journal requires|journal=(مساعدة) - Kingston, David G. I. (2009-3)، "Tubulin-Interactive Natural Products as Anticancer Agents"، Journal of natural products، 72 (3): 507–515، doi:10.1021/np800568j، ISSN 0163-3864، PMID 19125622، مؤرشف من الأصل في 22 أغسطس 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - "NCI Cancer Bulletin for February 23, 2010 - National Cancer Institute"، web.archive.org، 11 ديسمبر 2011، مؤرشف من الأصل في 23 أغسطس 2020، اطلع عليه بتاريخ 23 أغسطس 2020.
- بوابة الكيمياء
- بوابة صيدلة
- بوابة طب